
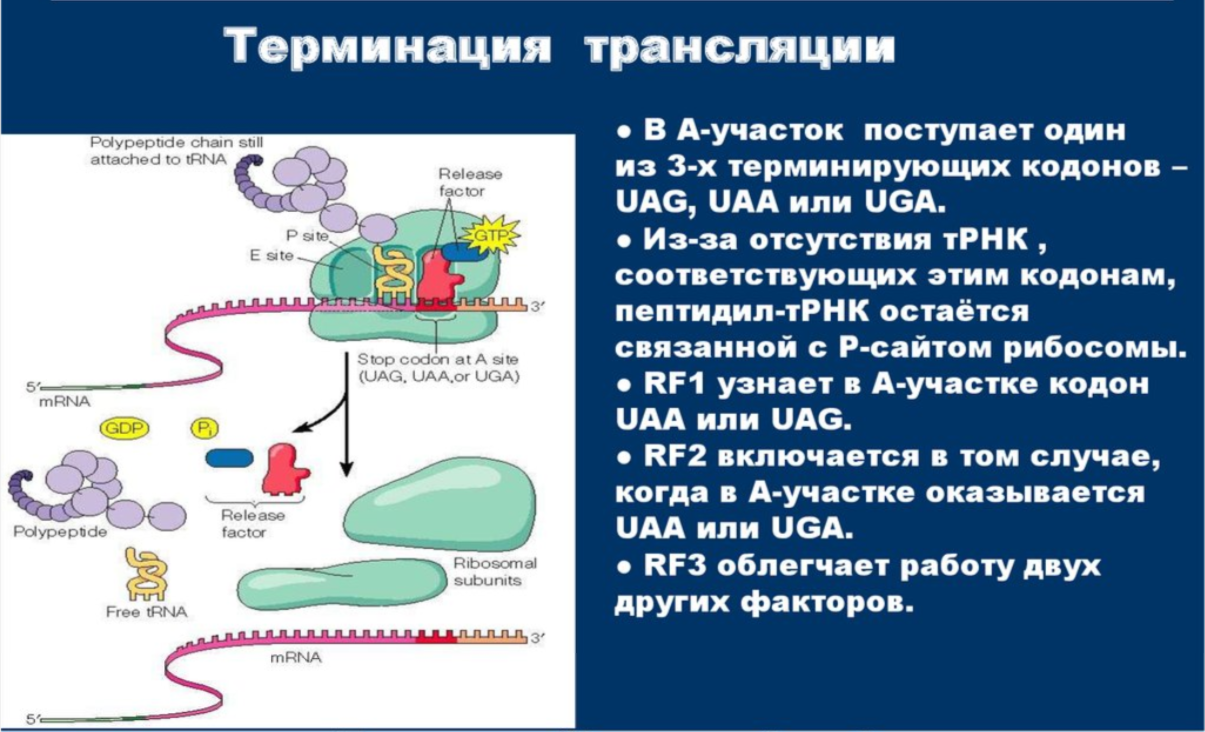
Терминация трансляции
Терминация трансляции – это процесс завершение синтеза п/п цепи и освобождение ее из связи с последней тРНК и рибосомой. Сигналом о завершении трансляции является один из трех бессмысленных кодонов: UAA, UAG, UGA. Помимо терминирующих кодонов в терминации трансляции участвуют три белковых фактора – RF-1, RF-2, RF-3.
Основные стадии терминации:
1). Узнавание терминирующего кодона.
Рибосома должна находиться в посттранслоцированном состоянии. ТТ начинается с того, что в А-сайт поступает один из терминирующих кодонов. Поскольку этим кодонам не соответствует какая-либо аа-тРНК, с этим участком связывается один из факторов терминации – RF-1 или RF-2. Эта реакция стимулируется фактором RF-3.
2). Гидролиз сложноэфирной связи между С-концом пептидила и ССА-концом донорной тРНК.
Эта реакция осуществляется ПТЦ рибосомы. Факторы терминации делают его способным переносить пептидил на Н2О, вследствие чего пептидил отделяется от рибосомы, но мРНК и деацилированная тРНК продолжают на ней удерживаться. На этом процесс терминации трансляции заканчивается, и все последующие стадии необходимы только для подготовки рибосомы к следующей трансляции.
3). Освобождение рибосомы из комплекса с мРНК и тРНК.
Фактор ERF, фактор элонгации EF-G и GTP. Механизм неизвестен.
4). Диссоциация рибосомы 70S
Эта
стадия протекает с участием IF-3, который
специфически взаимодействуя с 30S,
способствует ее отделению от 50S.

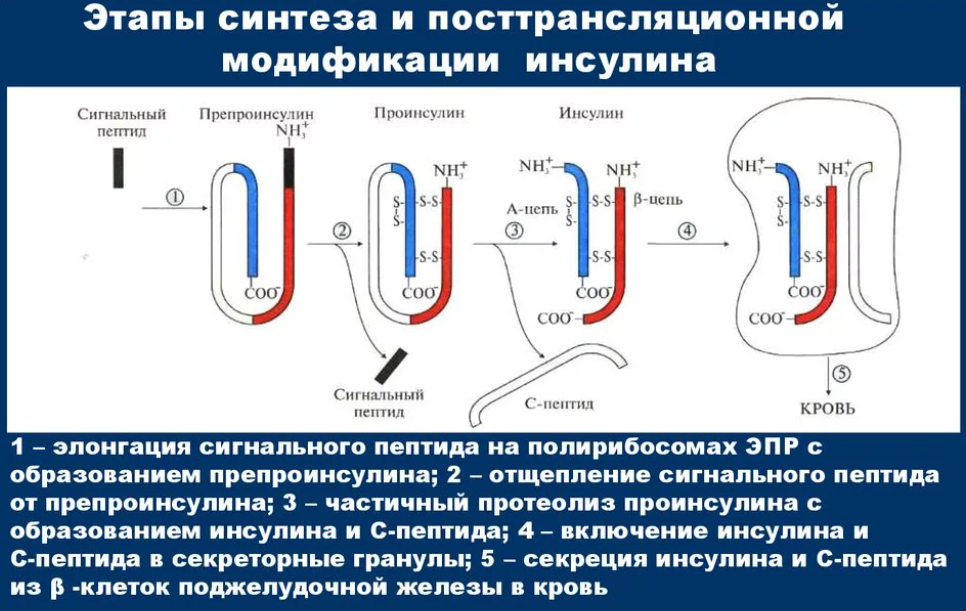
Ограниченный протеолиз на примере препроинсулина.
Фолдинг полипептидной цепи, роль шаперонов в этом процессе.

1. Классификации шаперонов (Ш)
В соответствии с молекулярной массой все шапероны можно разделить на 6 основных групп:
высокомолекулярные, с молекулярной массой от 100 до 110 кД;
Ш-90 - с молекулярной массой от 83 до 90 кД;
Ш-70 - с молекулярной массой от 66 до 78 кД;
Ш-60;
Ш-40;
низкомолекулярные шапероны с молекулярной массой от 15 до 30 кД.
Среди шаперонов различают: конститутивные белки (высокий базальный синтез которых не зависит от стрессовых воздействий на клетки организма), и индуцибельные, синтез которых в нормальных условиях идёт слабо, но при стрессовых воздействиях на клетку резко увеличивается. Индуцибельные шапероны относят к "белкам теплового шока", быстрый синтез которых отмечают практически во всех клетках, которые подвергаются любым стрессовым воздействиям. Название "белки теплового шока" возникло в результате того, что впервые эти белки были обнаружены в клетках, которые подвергались воздействию высокой температуры.
2. Роль шаперонов в фолдинге белков
При синтезе белков N-концевая область полипептида синтезируется раньше, чем С-концевая область. Для формирования конформации белка нужна его полная аминокислотная последовательность. Поэтому в период синтеза белка на рибосоме защиту реакционно-способных радикалов (особенно гидрофобных) осуществляют Ш-70.
Ш-70 - высококонсервативный класс белков, который присутствует во всех отделах клетки: цитоплазме, ядре, ЭР, митохондриях. В области карбоксильного конца единственной полипептидной цепи шаперонов есть участок, образованный радикалами аминокислот в форме бороздки. Он способен взаимодействовать с участками белковых молекул и развёрнутых полипептидных цепей длиной в 7-9 аминокислот, обогащённых гидрофобными радикалами. В синтезирующейся полипептидной цепи такие участки встречают примерно через каждые 16 аминокислот.
Фолдинг многих высокомолекулярных белков, имеющих сложную конформацию (например, доменное строение), осуществляется в специальном пространстве, сформированном Ш-60. Ш-60 функционируют в виде олигомернoго комплекса, состоящего из 14 субъединиц (рис. 1-23).
Ш-60 образуют 2 кольца, каждое из которых состоит из 7 субъединиц, соединённых друг с другом. Субъединица Ш-60 состоит из 3 доменов: апикального (верхушечного), промежуточного и экваториального. Верхушечный домен имеет ряд гидрофобных остатков, обращённых в полость кольца, сформированного субъединицами. Экваториальный домен имеет участок связывания с АТФ и обладает АТФ-азной активностью, т.е. способен гидролизовать АТФ до АДФ и Н3РО4.
Шапероновый комплекс имеет высокое сродство к белкам, на поверхности которых есть элементы, характерные для несвёрнутых молекул (прежде всего участки, обогащённые гидрофобными радикалами). Попадая в полость шаперонового комплекса, белок связывается с гидрофобными радикалами апикальных участков Ш-60. В специфической среде этой полости, в изоляции от других молекул клетки происходит перебор возможных конформации белка, пока не будет найдена единственная, энергетически наиболее выгодная конформация.
Высвобождение белка со сформированной нативной конформацией сопровождается гидролизом АТФ в экваториальном домене. Если белок не приобрёл нативной конформации, то он вступает в повторную связь с шапероновым комплексом. Такой шаперонзависимый фолдинг белков требует затрат большого количества энергии.
Таким образом, синтез и фолдинг белков протекают при участии разных групп шаперонов, препятствующих нежелательным взаимодействиям белков с другими молекулами клетки и сопровождающих их до окончательного формирования нативной структуры . Они предотвращают взаимодействие новосинтезированных белков друг с другом, изолируют гидрофобные участки белков от цитоплазмы, способствуют переходу вторичной структуры в третичную.
Шапероны также участвуют в защите клеточных белков от денатурирующих воздействий (температуры, гипоксии, инфекции, рН, тяжелых металлов). Их количество возрастает при повышении температуры, поэтому их также называют белками теплового шока.
Регуляция биосинтеза белка на уровне транскрипции у прокариот. Регуляция экспрессии генов у прокариот осуществляется в основном на уровне транскрипции. Возможно, это связано с тем, что прокариотические мРНК имеют короткий «срок жизни» — всего несколько минут. Конститутивные и индуцибельные белки (ферменты). В большинстве случаев прокариоты используют негативную регуляцию с помощью ген-специфичных репрессоров, которые связываются с промоторами структурных генов. Все белки прокариот (в т.ч. и ферменты) можно разделить на конститутивные и регулируемого синтеза.
Конститутивные белки синтезируются постоянно в любых условиях. Их количество не изменяется в процессе жизнедеятельности клетки или при изменении условий окружающей среды. Клетка «считает», что эти ферменты будут нужны ей всегда, поэтому кодирующие их гены постоянно экспрессируются («включены»). Пример: ферменты, метаболизирующие глюкозу.
Клетка затрачивает значительные ресурсы на синтез белков, поэтому ей не выгодно синтезировать белок, если в данный момент он ей не нужен. Обеспечить экономию позволяет наличие белков регулируемого синтеза. Клетка может изменять скорость их синтеза и концентрацию (иногда в тысячи раз) в соответствии со своими нуждами. Таким образом, синтезируются только те белки (ферменты), которые необходимы клетке в данных условиях. Белки регулируемого синтеза можно разделить на две группы: 1.В случае индуцибельных белков регуляция направлена на «включение» синтеза ранее не требовавшегося фермента, когда в нем возникла необходимость. «Включение» синтеза белка называется индукцией, а «включающее» синтез химическое вещество — индуктором (или депрессором). Индуктор реагирует с репрессором, инактивируя его. Как правило, индуцибельными являются ферменты катаболических путей (сбраживание сахаров, распад аминокислот и др.).
2.В случае репрессируемых белков цель регуляции — прекращение (репрессия) их синтеза. Обычно репрессируемыми являются ферменты анаболизма (синтеза аминокислот, азотистых оснований и т.д.). Регуляция экспрессии генов путем индукции на примере Lac-оперона.
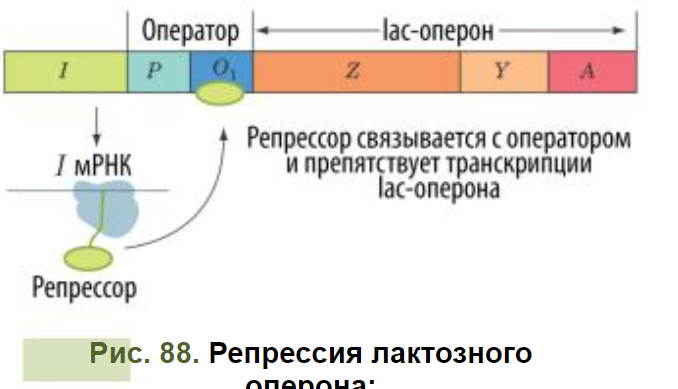
Оперон может находиться в двух состояниях: активном (включён) и неактивном (выключен). В норме (при отсутствии лактозы в среде) лактозный оперон неактивен (выключен): промотор оперона блокирован lac- репрессором — этот белок препятствует транскрипции, поскольку не даёт РНК-полимеразе возможности корректно начать её (связаться с промотором полимераза всё-таки может, как было показано в последние годы) (см. Рис. 88)
лактоза
в среде отсутствует, репрессор активен,
транскрипция lac-оперона выключена
Как только лактоза появляется в среде, она попадает в клетку и связывается с lac-репрессором. Это меняет его конформацию, он становится неактивен, утрачивает своё сродство к промотору и отщепляется. Lac-оперон включается и на нём начинается транскрипция, а затем происходит трансляция мРНК на белок (см. Рис. 89 ).
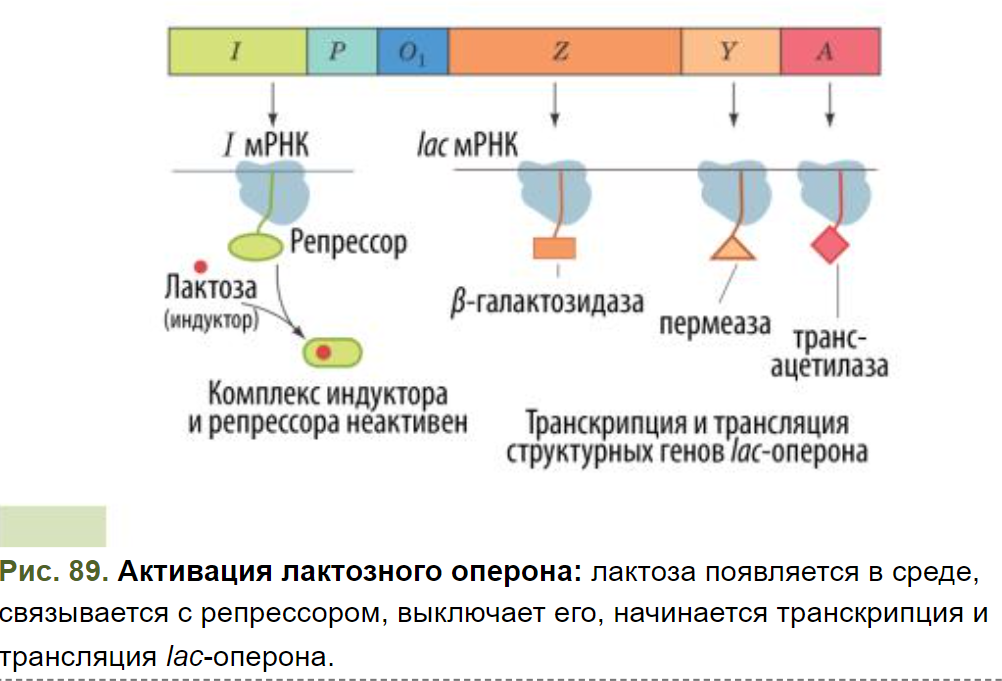
Синтезированные ферменты помогают клетке «усвоить» лактозу:
1.Галактозидпермеаза служит мембранным переносчиком лактозы в клетку (ускоряет её перенос в разы);
2.β-Галактозидаза расщепляет лактозу до глюкозы и галактозы, которые затем включаются в гликолиз.
3.Тиогалактозид-трансацетилаза переносит ацетильную группу с аце- тил-КоА на β-галактозиды. Её функция в контексте lac-оперона ещё недостаточно изучена. Есть гипотеза, что этот фермент обезвреживает неметаболизируемые пиранозиды, ацетилируя их.
В этом механизме регуляции — индукции — лактоза является индуктором, в отсутствии неё репрессор выключает транскрипцию на опероне. Такую регуляцию называют негативной.
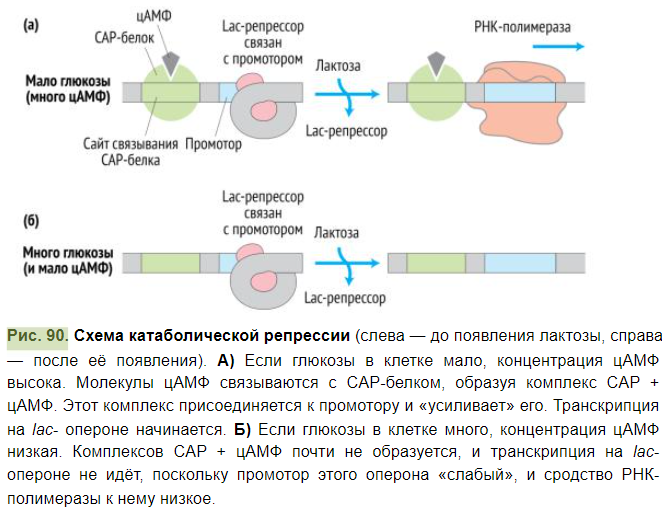
Помимо индукции, у кишечной палочки существует механизм позитивной регуляции — катаболическая репрессия (см. Рис. 90 ▼). Клетки кишечной палочки E.coli способны усваивать как глюкозу, так и лактозу. Возможны два случая:
1.В среде есть глюкоза и лактоза. 2.В среде есть только лактоза.
1. Теория оперона
Гены белков, функции которых в метаболических процессах тесно связаны, часто в геноме группируются вместе в структурные единицы (опероны). Согласно теории Жакоба и Моно, оперонами называют участки молекулы ДНК, которые содержат информацию о группе функционально взаимосвязанных структурных белков, и регуляторную зону, контролирующую транскрипцию этих генов. Структурные гены оперона экспрессируются согласованно, либо все они транскрибируются, и тогда оперон активен, либо ни один из генов не "прочитывается", и тогда оперон неактивен. Когда оперон активен и все его гены транскрибируются, то синтезируется полицистронная мРНК, служащая матрицей для синтеза всех белков этого оперона. Транскрипция структурных генов зависит от способности РНК-полимеразы присоединяться к промотору, расположенному на 5'-конце оперона перед структурными генами.
Связывание РНК-полимеразы с промотором зависит от присутствия белка-репрессора на смежном с промотором участке, который называют "оператор". Белок-репрессор синтезируется в клетке с постоянной скоростью и имеет сродство к операторному участку. Структурно участки промотора и оператора частично перекрываются, поэтому присоединение белка-репрессора к оператору создаёт стерическое препятствие для присоединения РНК-полимеразы.
Большинство механизмов регуляции синтеза белков направлено на изменение скорости связывания РНК-полимеразы с промотором, влияя таким образом на этап инициации транскрипции. Гены, осуществляющие синтез регуляторных белков, могут быть удалены от оперона, транскрипцию которого они контролируют.
