
книги2 / монография 5
.pdfтранзиторную боль в груди, очень хорошо. Они могут быть отпущены домой после прихода в себя после седации. Мягкую пищу могут принимать в этот же день поздно. Симптомы улучшения возникают постепенно и обычно пик наступает на 1-3 день, хотя у случайных пациентов может быть и позже. После одного сеанса лечения ботулиническим токсином П избавление от симптомов отмечено у почти 80% пациентов. После 6 месяцев 50% лиц могут быть в ремиссии, в то время как другие могут нуждаться в повторных инъекциях или в другом методе лечения, таких как баллонная дилатация или оперативная миотомия. Хирурги сообщают, что миотомия по Геллеру, из-за фиброза в мышечном слое НПС, будет труднее у пациентов, которые подвергались повторным инъекциям ботулинического токсина А (Dughera L. et al, 2005). В тоже время ботулинический токсина А широко демонстрирует наиболее эффективное лечение у пожилых пациентов с сопутствующими заболеваниями, у которых дилатация или операция имеет высокий риск. Симптомы у пожилых исчезают, по крайней мере, после одной инъекции до 1-2 лет.
Исторически, пневматическая дилатация была первой попыткой лечения при ахалазии пищевода и была описана в 1674 году Thomas Willis. Пневматическая дилатация НПС у пациентов с ахалазией преследует цель разрыва мышечных волокон. Бужи или стандартный баллон для дилатации обычно не эффективен, но пневматическая дилатация с ригидным и большого размера баллоном, установленным через НПС, является эффективной и недорогой, хотя детали процедуры в различных учреждениях варьируют. Нет согласия относительно деталей баллонной дилатации. Стационарно или амбулаторно, под седацией или нет, вид дилататора, изначальный размер баллона, давление, скорость, длительность, количество дилатаций за один сеанс эндоскопии и время повторной дилатации отличаются от центра к цен-
тру (Kadakia S.C., Wong R.K., 1993; Wong R.K., 2005; Zerbib F. et al, 2006).
Выполнение пневматической дилатации под эндоскопической визуализацией – хорошая альтернатива процедуре под рентгеном. Серьезные осложнения после пневматической дилатации редкие. Наиболее серьезное осложнение – перфорация пищевода, которая возникает со средней частотой около 2,5% (Novais P.A., Lemme E.M., 2010). ГЭР – наиболее частое хроническое осложнение после дилатации НПС по поводу ахалазии. По сравнению с инъекцией ботулинического токсина А, после баллонной дилатации результаты лучше и необходимость в дальнейшем лечении была меньше (Patti M.G. et al, 2003).
Советы и нюансы.
•Диета и процедура употребления пищи должны быть приспособлены. Меньше, чаще, много раз в день. Жидкая пища, разумеется, проходит пищевод с меньшим сопротивлением.
•Пациента необходимо инструктировать принимать пищу мелкими кусочками, долго жевать и медленно глотать. Запивать пищу жидкостями.
•Употреблять пищу в строго вертикальном положении и находится после этого в вертикальном положении некоторое время (по крайней мере, 2
21
часа) для освобождения пищевода. Выпрямление спины, поднятие рук выше головы и удержание их могут увеличивать внутрипищеводное давление и улучшать очищение пищевода.
•Лечение пациентов с ахалазией и проблемами с питанием очень похоже на то, что у пациентов с дисфагией из-за неврологического заболевания или рака пищевода. Оральное кормление имеет соответствующее психосоциальное значение для пациентов и их семей и должно продолжаться, когда это возможно. У некоторых пациентов пероральное потребление часто не является адекватным даже при отсутствии значительных трудностей при глотании. При легкой и умеренной ахалазии питание, как правило, нарушается слабо, и если семья побуждает пациента следовать диетическим изменениям, то редко происходит потеря веса и недоедание.
•Диета при дисфагии должна быть очень индивидуализирована, включая изменение текстуры пищи или вязкости жидкости. Пища может быть нарезана, измельчена или очищена, а жидкости могут быть загустевшими.
Если пациент не может, есть или пить, или потреблять достаточное количество пищи, или риск легочной аспирации высок, необходимо обеспечить питание через зонд. Если есть возможность хирургической миотомии, энтеральное питание через назальный зонд для кормления будет адекватным
вкачестве временной меры, учитывая, что пациент, страдающий от недоедания, всегда подвергается серьезному риску послеоперационных осложнений. В очень редких и отобранных случаях ахалазии конечной стадии, при которой возможна дальнейшая операция или пневматическое расширение, введение пищи через чрескожную гастростому, а не хирургическую гастростомию, было бы выбором. Чрескожное проведение зонда в желудок эффективно и обычно приемлемо для пациентов и их лиц, осуществляющих уход. Долгосрочные осложнения включают закупорку зонда и инфекцию раны. У некоторых пациентов, которых кормят через желудочный зонд, может возникнуть легочная аспирация, и для этих случаев предлагается рутинное питание через тощую кишку.
Пациенты с диффузным спазмом пищевода испытывают загрудинную схваткообразную боль, которая может напоминать инфаркт миокарда. Диффузный спазм пищевода представляет тяжелую степень дисмоторики, которая может вызывать симптомы дисфагии (Рисунок 8). Дисфагия обычно возникает как для плотной пищи, так и для жидкостей. Боль в груди, которая может симулировать сердечную боль, может быть вызвана глотанием, но может также не быть связана с глотанием. При ЭГДС слизистая оболочка пищевода выглядит нормальной, но множественные сокращения вызывают деформацию просвета, обуславливая картину «штопора» в нижней трети пищевода (Рисунок 9).
22

А |
Б |
Рисунок 8. А - схема диффузного спазма пищевода. Б - рентгеноскопия пищевода с барием.
Рисунок 9. Винтообразный просвет пищевода при диффузном спазме пищевода.
ГЭРБ обычно не вызывает дисфагию, так что должны быть исследованы другие причины. Регургитация содержимого желудка может вызвать ощущение давления за мечевидным отростком. Тяжелое заболевание может привести к образованию стриктуры. Пептические стриктуры обычно представлены с дисфагией к плотной пище. В запущенных случаях может возникнуть дисфагия к жидкостям. Симптомы обычно развиваются медленно, а степень потери веса, которая видна у пациентов со злокачественными стриктурами, отмечается не часто. Симптомы изжоги и регургитации могут улучшиться, так как стриктура является барьером для рефлюкса. Пептические стриктуры обычно имеют гладкую поверхность слизистой оболочки (Рисунок 10). Наличие любой нерегулярности должно настораживать в отношении возможной злокачественности.
23

Рисунок 10. Пептическая стриктура пищевода.
Рак гортани или глотки часто ассоциируется с одинофагией. Пациенты испытывают одностороннюю боль в глотке при глотании, радирующую в ухо или угол челюсти с этой стороны.
Рак пищевода сопровождается очень смутными симптомами и обычно диагностируется в поздней стадии, что сопровождается плохой частотой выживаемости. Главный симптом – дисфагия для плотной пищи больше, чем для жидкости (Рисунок 11). По сравнению с воспалительными стриктурами, злокачественные стриктуры имеют тенденцию быстро прогрессировать, часто приводя к дисфагии для жидкостей в течение нескольких месяцев от начала симптомов. Быстро прогрессирующая дисфагия требует ранней эндоскопии.
А |
Б |
В |
Рисунок 11. А - схема рака пищевода. Б - рентгенография с барием. В - эндоскопическая картина.
Эозинофильный эзофагит. До недавнего времени причина периодического или прогрессирующего затруднения проглатывания плотной пищи считалась механическая проблема, такая как стриктура или рак, в то время как моторные расстройства, такие как ахалазия или диффузный спазм были причинами дисфагии для плотной пищи и жидкости. Но сейчас мы осведом-
24
лены об относительно новой болезни, эозинофильном эзофагите, как причины дисфагии как у взрослых, так и у детей. Наличие избытка эозинофилов в пищеводе было впервые описано в 1977 году у 51-летнего мужчины с дисфагией, болью в груди с анамнезом тяжелой астмы и значительной эозинофи-
лией (Dobbins J.W. et al, 1977). В 1983 году Matzinger M.A. и Daneman A. до-
ложили похожий случай у подростка. У обоих пациентов большое количество эозинофилов было также отмечено в дуоденум, предполагающее, что такие данные являются частью синдрома системной гиперэозинофилии. Увеличение количества эозинофилов в ЖКТ описано при многих заболеваниях, включая БК, расстройства соединительной ткани, злокачественность, различные инфекции и реакции медикаментозной гиперчувствительности. Однако только в 1993 году эозинофильный эзофагит, как отчетливая клиническая сущность состоящая из изолированной эозинофилии (обычно более 15 эозинофилов в большом поле зрения) у пациентов с дисфагией, был описан Attwood S.Е. с соавторами. Сейчас эпидемиологические исследования предполагают, что эозинофильный эзофагит может быть так частый, как ВЗК. В исследовании детей г. Цинциннати (США) частота была оценена как 10 на 100 000 детей в год, а количество было оценено как 43 на 100 000. Интересно, что 95% случаев было диагностировано после 2000 года (Noel R.J., 2000).
За последние несколько лет, так как возрос интерес к этому заболеванию, число доложенных случаев постоянно увеличивается. Увеличение частично связано с осведомленностью об этом состоянии среди врачей и, следовательно, большим количеством взятых биопсий. Однако частота эозинофильного эзофагита увеличилась в 10 раз между 1989 и 2003 годами, что предполагает и истинный рост этого заболевания (Traumann A., Simon H.U., 2005). Частота эозинофильного эзофагит идет параллельно астме, экземе, аллергическим ринитам и другим атопическим заболеваниям.
Патологические механизмы эозинофильного эзофагита неизвестны. Рефлюкс кислоты не причинный фактор у большинства пациентов. Однако рефлюкс может играть вторичную роль, так как некоторые пациенты не отмечают симптоматического и не имеют эндоскопического и гистологического разрешения эозинофильного эзофагита после лечения ИПП (Ngo P. et al, 2004). Исследования у детей предполагают, что пищевой аллерген – главный действующий фактор для эозинофильного эзофагита. У детей строгая элементная диета приводит к полному разрешению симптомов и значительному снижению эозинофилов в пищеводе. Однако симптомы имеют тенденцию рецидивировать как только пациенты возвращается к обычно диете. Неясно, эффективна ли модифицированная диета у взрослых.
Диагностика эозинофильного эзофагита – гистологическая, с «выраженной» эозинофилией в биоптатах слизистой оболочки пищевода, обычно, 15 или более эозинофилов в большом поле зрения. В то время как нормальный пищевод почти не содержит эозинофилов (Dellon Е.S. et al, 2007), а в
25
биоптатах пациентов с ГЭРБ, обычно, менее 10 в большом поле зрения, а эозинофилы ограничены дистальным пищеводом (Furuta G.T. et al, 2007).
Однако современный системный обзор литературы обнаружил 10 различных гистологических определений эозинофильного эзофагита, от более 5 до более 30 эозинофилов и более, чем в трети статей не содержалось каких либо специфических диагностических критериев. Не согласия относительно большого поля зрения (колебания от 0,12 до 0,44 мм2), что приводит к вариабельности в описании плотности эозинофилов (Parftt J.R. et al, 2007).
Современное консенсусное определение эозинофильного эзофагита следующее:
1)клинические симптомы дисфункции пищевода (к примеру, дисфагия, ущемление пищи);
2)по крайней мере, 15 эозинофилов в большом поле зрения; и
3)нет ответа на высокие дозы ИПП или нормальные результаты при рН мониторинге дистального пищевода. Другие признаки, такие как гиперплазия базальной зоны, отек и удлинение сосочков собственной пластинки слизистой видны в большей протяженности у пациентов с эозинофильным эзофагитом, чем у пациентов с ГЭРБ (Arora A.S. et al, 2003).
Более чем 90% взрослых с эозинофильным эзофагитом представлены с периодическими затруднениями в глотании плотной пищи, в то время как ущемление пищи возникает у более, чем 60%. Изжога только у четверти пациентов. Некардиальная боль в груди, рвота и абдоминальна боль также встречаются, но менее часто. До 80% пациентов с эозинофильным эзофагитом имеют в анамнезе атопические заболевания, такие как астма, аллергический ринит или аллергия к пище и медикаменты. От одной трети до половины пациентов имеют периферическую эозинофилию и до 55% имеют повышенные уровни иммуноглобулина E (IgE) (Sgouros S.N. et al, 2003). У детей симптомы варьируют с возрастом и включают проблемы с питанием, рвоту, абдоминальную боль и дисфагию. Кроме этого дети с эозинофильным эзофагитом имеют высокую частоту атопических симптомов и периферическую эозинофилию, чем взрослые (Liacouras C.A. et al, 2005).
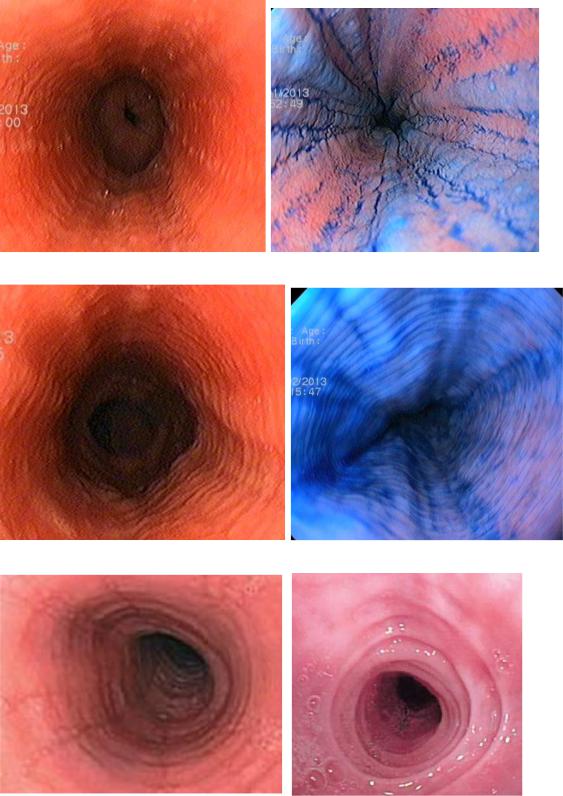
Эндоскопические признаки эозинофильного эзофагита характерные. демонстрируется хрупкость слизистой оболочки («папиросная бумага»), непреходящие кольца слизистой оболочки («трахеизация», «кошачий пищевод»), преходящие кольца слизистой оболочки, вертикальные морщины слизистой оболочки («санный путь»), белые крапинки (эозинофильные микроабсцессы и суженный калибр пищевода (Рисунок 12). Многие такие признаки, как преходящие кольца, вертикальные морщины могут быть пропущены (от 9% до 32% пациентов с симптомами, предполагающими эозинофильный эзофагит, по заключениям эндоскопии имели нормальный пищевод).
26
А |
Б |
В |
Г |
Д |
Е |
Рисунок 12. А - белые крапинка, вертикальные морщины и преходящие кольца слизистой. В - метиленовый синий улучшает визуализацию вертикальных морщин при их едва заметном проявлении. В - преходящие кольца слизистой оболочки. Г - исследования с метиленовым синим. Д - кольцевидный пищевод, вертикальные морщины, сужение просвета. Е -
непреходящие множественные кольца слизистой оболочки пищевода.
27
Хотя моторные нарушения у пациентов с эозинофильным эзофагитом частые, включающие по данным манометрии некоординированные сокращения и неэффективную перистальтику, манометрия не рекомендуется как ди-
агностический тест (Sgouros S.N. et al, 2003).
Рентгенологически, при исследовании с барием, эозинофильный эзофагит может проявиться серией концентрических колец, стриктурами различной длины с кольцами внутри стриктур (Zimmerman S.L. et al, 2005). Такие данные поддерживают теорию, что воспаление может привести к подслизистому фиброзу, сужению и устойчивым симпомам. Кроме этого в современных исследованиях обнаружено повышенное отложение коллагена в биопсийных образцах (Chehade M. et al, 2007), что предполагает повышенный потенциал для фиброза. Считают, что рентгенологическое исследование наиболее успешное до ЭГДС для определения наличия стриктуры, что будет показанием для эндоскопической дилатации (Attwood S.Е. et al, 2003).
От 50% до 80% пациентов с эозинофильным эзофагитом имеют сочетанные атопические заболевания, такие как атопический дерматит, экзема, аллергические риниты или астма, с большей частотой у детей, чем у взрослых. У таких пациентов тест на аллергию могут предсказать ответ на лечение. Следовательно, все пациенты с эозинофильным эзофагитом должны быть обследованы аллергологом. Определение числа эозинофилов в периферической крови до и после лечения является разумным, так как повышенное количество эозинофилов снижается после лечения. Таким же образом, многие пациенты с эозинофильными эзофагитами имеют повышенные уровни IgE сыворотки, которые предполагают сопутствующее атопическое заболевание. Следовательно, общие уровни IgE также должны быть определены до
ипосле лечения. Рекомендуется определение IgE против специфических аэроаллергенов, но тестирование IgE против специфических пищевых антигенов не доказало пользы. Таким же образом могут быть использованы кожные тесты для аэроаллергенов, но не для аллергенов пищи. По настоящее время кожные тесты при эозинофильном эзофагите имеют ограниченное, но многообещающее значение (Kato M. et al, 1998).
Хотя дисфагия персистирует, количество эозинофилов в биоптатах пищевода со временем значительно снижается. Предполагается, что интенсивная эозинофильная инфильтрация видна только вначале болезни, переходя в фиброз и реконструкцию, похожие как при астме и других хронических атопический заболеваниях. В отличие от ПБ, предзлокачественном осложнении длительной ГЭРБ, при длительном наблюдении у пациентов с эозинофильным эзофагитом нет повышенного риска рака пищевода (Straumann A. et al, 2003).
Строгая элиминационная диета приводит к полному разрешению симптомов и гистологии эозинофильного эзофагита у детей. Наиболее логичным
илегким подходом кажется устранение аллергена. Основной проблемой данной тактики является крайняя сложность точного выявления пищевого аллергена, ответственного за заболевание. Кроме того, у ряда пациентов на-
28
блюдается аллергия не на один, а на несколько пищевых продуктов. Кожные пробы с различными аллергенами могут помочь в выявлении агента, вызвавшего эозинофильный эзофагит, но далеко не всегда. Строгая элиминационная, основанная на аминокислотах, диета не очень приятна. Часто приходится налаживать питание через назогастральный зонд, а заболевание имеет тенденцию возвращаться, когда прервана диета (Kelly K.J. et al, 1995).
В случае невозможности выявления специфического антигена наиболее рациональным является исключение шести аллергогенных групп продуктов: белок коровьего молока, соя, яйца, пшеница, рыба, орехи. Купирование симптоматики в течение 7–10 дней и разрешение эозинофильной инфильтрации при повторной биопсии через 4–6 недель позволяет аккуратно расширять диету по одному виду продуктов 1 раз в неделю (существуют специальные перечни продуктов, согласно их потенциальной аллергогенности) под пристальным контролем симптоматики. При возникновении симптомов необходимо исключить последний вид принятой пищи. Если после исключения «опасной шестерки» симптомы или эозинофильная инфильтрация сохраняются, необходимо применить элиминационную, основанную на аминокислотах, диету с ее последующим расширением по ранее изложенной схеме (Kagalwalla A.F. et al, 2006).
При недостаточной эффективности лечебного питания в виде монотерапии и невозможности или безрезультатности применения элементных диет в комплексном лечении пациентов с пищевой аллергией необходимо назначение медикаментозных препаратов.
Проглатывание топического кортикостероида флутиказона пропионата
– основа терапии для детей и взрослых. На фоне его приема в возрастной дозе (по 44 мкг у детей в возрасте 2-4 лет, по 110 мкг – 5-10 лет, по 220 мкг – в возрасте старше 11 лет 2 раза в сутки) в течение 8 недель отмечается достижение клинической (к концу первой недели приема) и морфологической ремиссии (существенно уменьшается степень эозинофильной инфильтрации). В одном исследовании 21 взрослый пациент с эозинофильным эзофагитом получил 6-недельный курс проглатывания флутиказона 220 мкг/глоток аэрозоля от 2 до 4 глотков дважды в день. Симптомы полностью разрешились у всех пациентов за, по крайней мере, 4 месяца и не было пациентов, нуждающихся в эндоскопической дилатации (Arora A.S. et al, 2003). В другом исследовании 19 пациентов, пролеченных флутиказоном 4 недели, показали значительное улучшение как симптоматически, так и гистологически. Однако после 3 месяцев 14 (17%) имели рецидив симптомов, указывая на хрони- чески-рецидивирующую природу этого заболевания (Remedios M. et al, 2006). Только в исследовании у детей Konikoff M.R. с соавторами (2006) показали, что 3-месячный курс флутиказона вызывает ремиссию, определенную как менее чем 1 эозинофил в большом поле зрения, у 50% пациентов, по сравнению с 9% у группе плацебо. Проглатывание дымка флутиказона хорошо переносится, хотя описаны случаи кандидоза пищевода, который наблюдался при применении флутиказона в дозе 220 мкг 2 раза в день
29
(Remedios M. et al, 2006). Топические кортикостероиды с успехом применяются и при других эозинофильных поражениях пищевого канала у детей с первых месяцев жизни. В частности, отмечена положительная динамика на фоне приема будесонида при некоторых формах аллергического энтероколита и проктоколита.
Суппрессия кислоты все еще имеет неясную роль в лечении эозинофильного эзофагита. Как отмечено выше, заболевание определено как наличие или персистенция эозинофилии пищевода после максимального лечения или исключения рефлюкса кислоты. У большинства пациентов терапия ИПП была без успеха, но современные рекомендации предполагают, что такие лекарства разумны как сочетанная терапия у пациентов, которые также имеют симптомы ГЭРБ (Kato M. et al, 1998).
Для пациентов, у которых не наступило улучшение с флутиказоном, показаны другие препараты. Системные кортикостероиды с успехом применяются у взрослых и детей с синдромом гиперэозинофилии, а также у пациентов с рефрактерным эозинофильным эзофагитом, однако побочные эффекты ограничивают рутинное и длительное применение. Препаратами первого выбора являются пероральные формы кромогликата натрия, достаточно эффективные при IgE- и не-IgE-опосредованных формах пищевой аллергии, резистентных к диетическим мероприятиям. Накоплен достаточный опыт применения кромогликата натрия, в частности – его пероральной формы (налкром), в лечении больных пищевой аллергией детей. В ряде случаев при тяжелых и рефрактерных формах пищевой аллергии возникает необходимость назначения системных кортикостероидов и даже иммуносупрессантов по жизненным показаниям. Liacouras С.А с соавторами (2005) применил метилпреднизолон в дозе 1,5 мг/кг в два приема в течение 4 недель. После лечения у 19 из 20 пациентов отмечено значительное клиническое и гистологическое улучшение. Однако у 9 больных симптомы появились вновь при сроках наблюдения до одного года.
Следующей группой препаратов, эффективных при пищевой аллергии, являются Н1-антагонисты, обладающие способностью стабилизировать мембраны тучных клеток (кетотифен). Существенная положительная динамика часто отмечается при приеме препарата в возрастной дозировке курсом от 3 недель до 4–6 месяцев как при кожных формах аллергии, так и при ряде эозинофильных поражений пищевого канала (эозинофильный гастроэнтерит, эозинофильный колит, некоторые формы эозинофильного проктита). В настоящее время активно изучается применение антицитокиновых и антилейкотриеновых препаратов при некоторых формах эозинофильного поражения органов пищеварения, в том числе и при ЭЭ. В частности, в западных странах активно изучается эффективность ингибитора экспрессии рецептора лейкотриена (cys-LT1) – препарата монтелукаст (Montelukast). Он блокирует действие лейкотриена D4, который является специфическим эозинофильным хемоаттрактантом. Показана эффективность монтелукаста как при эозинофильном эзофагите, так и при эозинофильном энтероколите. Другим активно
30
