
книги2 / монография 4
.pdfСпецифичность и избирательность катализа
Катализ – явление специфическое, поэтому каталитическую активность катализатора можно оценивать только по отношению к конкретной реакции, хотя ряд катализаторов проявляют активность и более общую. В целом состав и химическое строение катализаторов очень разнообразно. Катализатор может быть индивидуальным веществом (металлы, активированный уголь), соединением (оксид, соль и т.д.), соединением белковой природы (например, ферменты).
Механизмы катализа
Конкретных механизмов катализа очень много, в качестве примеров перечислим несколько основных.
«Переносный» катализ. В этом случае катализатором осуществляется перенос атома, молекулы, электрона, фрагмента. Например, реакция
2SO2 + O2 → 2SO3
Практически не протекает в отсутствие катализатора. Напротив, присутствие катализатора (сульфованадата) на поверхности носителя при 450-550оС в виде жидкой пленки позволяет осуществить процесс в две стадии:
SO2 + V2O5 1 SO3 + V2O4
V2O4 + ½ O2 2 V2O5
Механизм гомогенных реакций
Во всех процессах, рассмотренных выше, роль катализаторов сводится к снижению энергии активации (Еа) и, следовательно, к ускорению реакций.
Рассмотрим пример бимолекулярной реакции, идущей в отсутствие катализатора по схеме:
А+ В → АВ* → Продукты
Вприсутствии катализатора К, который принимает участие в образовании активного комплекса, первая стадия ‒ образование промежуточного соединения ‒ идет по схеме:
А+ В + К К1 АВК*
К2
Учитывая теорию активированного комплекса, следует принять, что существует равновесие между исходными веществами и активированным
61
комплексом. Скорость процесса в целом определяется скоростью распада активированного комплекса в направлении образования продуктов реакции и регенерации катализатора:
АВК* К2 К + Продукты Во всех этих процессах, как и в рассмотренных выше, роль
катализатора сводится к снижению Еа и, следовательно, к ускорению реакции. Кроме того, участие катализатора в процессе приводит к усложнению кинетического закона протекания реакции и появлению новых кинетических уравнений.
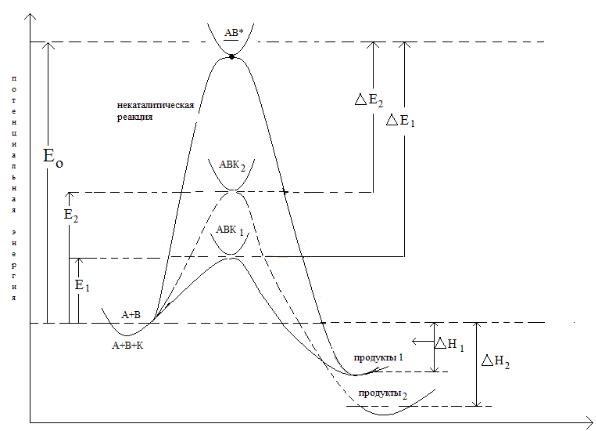
Энергетическая диаграмма протекания каталитической реакции
На рис. 2.7 показаны пути протекания реакции по некаталитическому и каталитическому механизмам. Согласно этой схеме, разница в энергиях активации есть ни что иное, как энтальпия образования активного комплекса, в состав которого входит катализатор из активного комплекса, состоящего только из исходных веществ.
Рис. 2.7. Координата реакции
На рисунке видно, что реакция превращения исходных веществ в продукт реакции проходит путь через энергетический барьер с образованием активированного комплекса. Процесс превращения
62
исходных веществ в продукты реакции в присутствии катализатора проходит путь с более низким энергетическим барьером и показывает, что катализатор снижает уровень энергетического барьера и реакция протекает быстрее.
2.8. Ферментативный катализ
Ферменты – это «возбудители жизни»
академик И.П. Павлов
Ферменты – это биологические катализаторы. Ферментативный или биологический катализ неразрывно связан с жизнедеятельностью организмов растительного и животного происхождения и человека. Многие жизненно важные химические реакции, протекающие в клетке (их около десяти тысяч), управляются ферментами.
Ферментативные реакции подчиняются общим законам катализа, но, вследствие сложности состава и строения ферментов, образуют специфическую и весьма обширную область каталитических реакций.
Биологические катализаторы, ускоряющие каталитические реакции в живых системах, называют в отечественной литературе ферментами, в англоязычной – энзимами.
О ферментах много говорят и пишут: «всемогущие» и «чудодейственные», «молекулярные машины организма» - эти эпитеты пестрят на страницах научно-популярных книг и журналов.
Чтобы показать, как работают ферменты, в чем причина их чрезвычайно высокой каталитической активности и что может нам дать познание природы их деятельности, дать подробные ответы на такие вопросы не помогут объемистые книги. Потому что наука пока не в состоянии подробно ответить и объяснить такие вопросы. С другой стороны, в учебных программах для студентов младших курсов не ставятся такие вопросы.
Каталитические свойства и активность биологических катализаторов-ферментов, зависимость их от различных условий в значительной степени отличаются (по составу и строению, активности, специфичности, ускорению реакций, влиянию рН среды и температуры) от каталитических свойств неорганических катализаторов.
Состав и строение. По сравнению с неорганическими катализаторами ферменты имеют значительно более сложный состав и строение. Прежде всего, ферменты имеют белковую природу, чем и обусловлена очень высокая специфичность и чувствительность к температуре.
В состав активных центров многих ферментов входят различные металлы (металлоферменты): Zn, Mo, Co и др.
63
Специфичность, избирательность и активность ферментов
При обсуждении ферментативного катализа возникает два главных вопроса: 1) почему ферменты так избирательны и ускоряют химические превращения молекулы только определенной структуры (которая нам тоже известна); 2) каким образом фермент снижает энергетический барьер, т.е. выбирает энергетически более выгодный путь, благодаря чему реакции могут протекать при обычной температуре.
В отличие от химических катализаторов ферменты обладают значительно большей специфичностью: каждый из них действует лишь на строго определенную реакцию или группы реакций и даже на определенную химическую связь.
Строгая специфичность и избирательность, высокая скорость – главные признаки ферментативного катализа. Ни один из созданных руками человека катализаторов (за исключением, пожалуй, 2- оксипиридина) не может сравниться по силе и избирательности воздействия на органические молекулы.
Причины столь высокой специфичности ферментов еще до конца не изучены. Существует ряд теорий, дающих объяснение механизму действий ферментов. Например, модель «ключ-замок» и др., о них будет сказано в следующем разделе.
Учение без размышления бесполезно, но и размышление без учения опасно.
Конфуций
Активность ферментов
По своей активности биологические катализаторы-ферменты в тысячи и миллионы раз превосходят активность химических катализаторов. Даже один из лучших неорганических катализаторов атомная платина уступает, например, ферменту каталазе по своей активности в расчете на один активный центр в тысячи раз. О скорости ферментативных реакций можно судить по следующему примеру, 1 моль фермента сахаразы способен расщепить в 1 секунду 1000 моль сахарозы.
Присутствие ферментов в ничтожно малых количествах способно расщеплять огромное количество реагирующих веществ. Например, 1 г кристаллического пепсина расщепляет 50 кг коагулированного яичного белка. Фермент пероксидаза, который ускоряет окисление субстрата за счет пероксида водорода, проявляет свою активность при разбавлении 1 вес.ч. фермента в 500 000 вес. ч. воды.
64
Влияние рН. В отличие от неорганических катализаторов, активность ферментов сильно зависит от рН среды, причем для каждого фермента существует свой интервал значений рН, внутри которого активность максимальная.
Таблица 2.1. Оптимальные значения рН, при которых фермент проявляет максимальную каталитическую активность по отношению к субстрату
Фермент |
Субстрат |
рН |
Пепсин |
яичный белок |
1,5 |
Пепсин |
Казеин |
1,8 |
Пепсин |
Гемоглобин |
2,2 |
Фосфатаза крови (кислая) |
Глицеринфосфат |
4,5-5,0 |
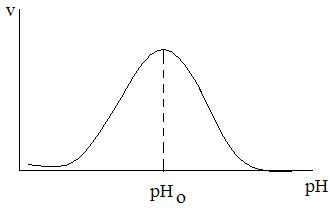
Если построить зависимость скорости от рН среды, то получится характерная колоколообразная кривая с максимумом при определенном рН (рис. 2.8.). Чем вызвано такое поведение ферментов? Полагают, в частности, что это связано с процессами ионизации активных центров ферментов под влиянием Н3О+ и ОН- водной среды. Эта идея соответствует известным в органической химии фактам резкого изменения реакционной способности функциональных групп при изменении их ионного состояния. Протонирование аминогруппы делает её нереакционноспособной по отношению к электрофильным центрам другой молекулы, а протонирование карбонильного кислорода, напротив, увеличивает реакционную способность карбонильного углерода по отношению к нуклеофильным агентам. Можно полагать, что нечто подобное происходит и при ферментативном катализе при изменении кислотности среды.
Рис. 2.8. Колоколообразная зависимость наблюдаемой скорости ферментативных реакций от рН среды
Влияние температуры. Учитывая белковую природу ферментов – они очень чувствительны к изменению температуры, особенно к её повышению. Влияние температуры на скорость ферментативной реакции
65
имеет сложный характер, связанный прежде всего, с проблемой термолабильности фермента поскольку положение максимума рН среды существенно зависит от температуры. Кроме того, при повышении температуры происходит изменение третичной структуры фермента, изменяющее геометрические параметры активного центра.
Ферменты «работают» в значительно более узком интервале температур. Температурный оптимум большинства растительных ферментов составляет 40-60°С, для животных ферментов 40-50°С. Если температура превысит эти пределы, активность фермента очень быстро падает, а при 70-80оС происходит их необратимое разрушение, обусловленное денатурацией белка. Лишь очень немногие ферменты способны в определенных условиях выдерживать нагревание до 100°С без потери активности. Например, оптимум температуры для α-амилазы достигает 100°С, в то время как для люциферазы находится при 25-30°С.
Таким образом, если скорость химических процессов обычно увеличивается с ростом температуры и это увеличение практически ничем не лимитируется, биологические процессы имеют свои температурные границы, за которыми наступает резкое уменьшение их скорости и даже полное прекращение – смерть.
Металлоферменты. Одна из наиболее важных функций большинства биометаллов в организме – это участие (в составе ферментов)
вкатализе многих жизненно необходимых реакций.
Всостав ферментов, катализирующих гидролитические реакции, входят ионы металлов: Са2+, Mg2+, Zn2+, Mn2+ и др. Ферменты,
катализирующие редокспроцессы, могут содержать железо, медь, молибден, кобальт и др. Последняя группа ферментов более многочисленна и более важная для жизненных процессов.
Наиболее простой гидролитический процесс, катализируемый металлоферментами этой группы – процесс превращения СО2 в гидрокарбонат-ион (или обратный процесс):
СО2 + ОН- ↔ НСО3- Эта реакция протекает и без катализатора, однако в условиях
нормального прохождения жизненных процессов требуется её ускорение. Ускорение этой реакции достигается в результате катализа её цинксодержащим ферментом – карбоангидразой, которая важна для дыхания.
Ион цинка в карбоангидразе может быть замещен на ионы кобальта, марганца, никеля, меди, ртути, свинца, железа, бериллия, магния и кальция. При замене цинка на кобальт фермент не только сохраняет свою активность, но она даже повышается. При замене цинка на никель и марганец активность фермента снижается, а в остальных случаях каталитическая активность исчезает.
66
Для данного металлофермента характерно наличие ряда ингибиторов анионного типа, резко дезактивирующих его: CN-, CNO-, S2O42-, молекулы сульфонамидов.
Еще один пример одного из наиболее изученных металлоферментов
– карбоксипептидаза, которая содержит цинк, участвует в катализе гидролитических процессов. При замене цинка на кобальт активность этого фермента повышается, а при замене на никель марганец и железо активность его уменьшается. При замене же цинка на кадмий, ртуть, медь, свинец или родий активность металлофермента исчезает. Подобное может происходить при недостатке одних металлов и избытке других в организме.
Синтез ферментов. Практически все реакции в биохимических системах являются каталитическими и набор ферментов, очевидно, так же необходим для жизни, как и все известные её химические носители.
Но откуда же берутся ферменты и почему они оказываются настроенными именно на те реакции, которые требуются клетке?
Подбор даже одного катализатора в технике – дело очень трудное, приходиться производить сотни опытов в поисках избирательно и достаточно активного катализатора. Организм же с необыкновенной щедростью вовлекает в биохимические реакции десятки ферментов, а в случае необходимости, как доказано, может синтезировать и такие, которые в норме у него отсутствуют.
Синтез ферментов – это прежде всего синтез белков, потому что все ферменты имеют белковую природу. Синтез белка идет на РНК, а строение РНК определяется в свою очередь ДНК. Отсюда вывод, что для синтеза данного фермента нужна определенная ДНК. Не вся огромная молекула ДНК требуется для создания соответствующей данному белку РНК, а только её часть.
Ингибирование ферментативных реакций
На каталитическую активность ферментов могут влиять различные факторы, а, следовательно, и на скорость ферментативных реакций.
Мы рассмотрели, что в роли активаторов могут выступать: рН среды, температура, концентрация субстратов, присутствие катионов металлов и др. вещества. Ингибирование могут вызывать различные факторы.
Наука выигрывает, когда её крылья раскованы фантазией.
М. Фарадей
Никакие рассуждения не в состоянии указать человеку путь, которого он не хочет видеть.
Р. Роллан
67
Фемтохимия и структурная кинетика
Можно надеяться, что у читателей вызовет интерес совершенно новые направления в химии – фемтохимия и структурная кинетика.
До 1990-х годов все экспериментальные исследования кинетики элементарных реакций сводились к регистрации временной зависимости концентраций реагентов или продуктов. Между тем молекулярная система проходит довольно сложный путь от исходного к конечному состоянию через последовательность промежуточных структур - переходное состояние, где старые связи уже «почти» разорваны, а новые связи уже «почти» возникли. В этом смысле понятия «активированный комплекс», т.е. атомная конфигурация, соответствующая седловой точке на ППЭ (поверхность потенциальной энергии) «переходное состояние» не вполне тождественны, хотя довольно часто их используют как синонимы. Переходное состояние, где невозможно четко выделить ни исходную, ни конечную конфигурацию атомов, имеет очень небольшую пространственновременную область существования: на расстоянии порядка 0,1 нм (1 Å) оно «живет» не более 10-13 с, т.е. периода одного колебания. Эти оценки следуют из того факта, что скорость движения атомов в молекулах составляет ≈ 103 м∙с-1 (1013 Å∙с-1), а увеличение длины химической связи на 0,1 нм соответствует её полному разрыву. Вполне понятно, что вплоть до конца XX века те спектральные методы, которые имелись в распоряжении исследователей и давали временное разрешение не лучше 10 -13с, не позволяли изучать динамику реакционной системы в переходном состоянии. Лишь с развитием лазерной техники в 19701990 годы научились создавать достаточно мощные импульсы электромагнитного излучения длительностью 10-102 фемтосекунд (1 фс = 10-15 с), что дало возможность непосредственно регистрировать изменения межъядерных расстояний за время пребывания молекулярной системы в переходном состоянии 100 фс с шагом порядка 0,01 нм (0,1 Å).
Таким образом, возникли совершенно новые направления в экспериментальной и теоретической химии, которые получили название фемтохимии, а также структурная кинетика - исследование эволюции молекулярных структур в реальном масштабе времени. В 1999 г. за фундаментальные экспериментальные и теоретические работы
вобласти фемтохимии А. Зевейл был удостоен Нобелевской премии.
Вкачестве примера эффективного использования фемтосекундной спектроскопии для установления механизма элементарных реакций приведем результаты, полученные в начале 1990-х годов при исследовании мономолекулярной реакции раскрытия кольца циклобутана с образованием двух молекул этилена
68
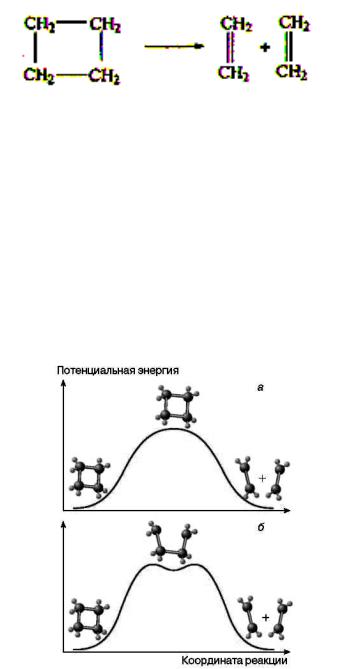
Эта реакция может протекать по двум альтернативным механизмам: одностадийному синхронному с одновременным разрывом двух σ-связей в молекуле циклобутана и образованием двух π-связей в молекулах этилена, либо по двухстадийному с промежуточным образованием бирадикала тетраметилена ∙СН2 – CH2 – CH2 – CH2∙. Ранее выполненные экспериментальные исследования и теоретические расчеты не позволяли определить, какой из этих двух механизмов реализуется в действительности. Детальное исследование кинетики образования и гибели бирадикалов методами фемтохимии с масс-спектральным детектированием образующихся продуктов позволило вполне однозначно решить указанную проблему: процесс раскрытия цикла идет по последовательному механизму.
Рис.2.9. Потенциальные кривые для превращения циклобутана:
а - одновременный разрыв двух связей; б – образование промежуточного соединения
Происходит постадийный разрыв, и существует относительно устойчивое промежуточное состояние (б). Опытами был доказан второй путь и измерено время жизни промежуточного состояния ~ 700 фс.
Таким методом можно исследовать переходное состояние, следить за разрывом и образованием связи. Показано, что можно исследовать процессы, происходящие на поверхности, в растворах, полимерах и биологических системах.
Приведенный пример показывает, что в фемтосекундном эксперименте можно получить информацию о свойствах и динамике
69
молекулярной системы в переходном состоянии, которое в течение более чем полувека было «вещью в себе», ускользающей от непосредственного наблюдения за моделью. Кроме того, использование мощных лазерных импульсов фемтосекундной длительности открывает новые возможности, позволяющие контролировать внутримолекулярные процессы и управлять самим ходом химической реакции не на стадии её термического или фотохимического инициирования, а путем целенаправленного воздействия на переходное состояние.
Образование есть то, что остается, когда всё выученное забыто.
М. Лауэ
М. Лауэ – немецкий физик, первооткрыватель дифракции рентгеновских лучей на кристаллах – метод рентгеноструктурного анализа.
Лауреат Нобелевской премии по физике (1914 г.). Альберт Эйнштейн охарактеризовал открытие Макса Лауэ как одно из самых красивых в физике. Это открытие позволило
увидеть молекулу буквально собственными глазами.
Вопросы и задания для самостоятельной работы
1.Химическая кинетика и скорость реакций являются важными понятиями и широко используются в разных химических дисциплинах и науках. Дайте объяснения этим понятиям.
2.Скорость реакций имеет большое практическое значение. Какими методами можно определить скорость реакций? Приведите объяснение, примеры.
3.Объясните и покажите графически, как можно определить среднюю и мгновенную скорости реакций.
4.Приведите примеры реакций разного типа: простые и сложные, гомогенные и гетерогенные, последовательные и параллельные, сопряженные, обратимые и необратимые.
5.Приведите примеры такого типа реакции как: фитохимические реакции, цепные, радиационно-химические реакции, в чем их суть?
6.Перечислите факторы, влияющие на скорость химических реакций. Покажите это на примерах.
7.Скорость реакций зависит от природы веществ, дисперсности и концентрации реагирующих веществ. Приведите объяснения.
8.Сформулируйте закон действующих масс (ЗДМ), важнейший закон химической кинетики, приведите его математическое выражение и применение для гомогенных и гетерогенных реакций.
9.Важной величиной в законе действующих масс является «константа скорости», что она характеризует, от чего она зависит и от чего не зависит, её размерность.
70
