
книги2 / монография 4
.pdf
Глава 23
р-Элементы VA-группы (ns²np³)
Изучив содержание главы 23, студент должен:
знать
строение внешних электронных оболочек атомов элементов VA группы в основном невозбужденном и возбужденном состоянии;
закономерности изменения основных параметров и свойств атомов элементов VA группы;
характер химических связей атомов элементов VA группы с другими элементами, ковалентность связи, степени окисления и координационные числа в соединениях, гибридизация атомных орбиталей и пространственное строение молекул;
азот, нахождение в природе, биологическую роль азота, его получение, физические и химические свойства и применение;
соединения азота с отрицательными степенями окисления (нитриды, амиды, гидразин, гидроксиламин, азиды), их получение, химические свойства и применение;
аммиак, строение молекулы, получение, физические и химические свойства, применение, ион аммония и его соли;
соединения азота с положительными степенями окисления (оксиды, кислота азотистая и азотная, соли), строение молекул, получение, физические и химические свойства, применение;
окислительно-восстановительные свойства азотной кислоты разной концентрации и с металлами разной активности, «царская водка»;
термическое разложение нитратов с разной активностью металлов;
фосфор, нахождение в природе, получение, строение молекулы, физические и химические свойства, применение;
фосфиды, галиды, фосфин;
кислородные соединения фосфора (оксиды, кислоты, соли), строение их молекул, получение, физические и химические свойства, применение;
элементы подгруппы мышьяка, их характеристика, нахождение в природе, получение, физические и химические свойства, применение;
соединения подгруппы мышьяка: с водородом, серой, галогенами, кислородом (оксиды, кислоты, соли), их получение, свойства и применения;
биологическую роль p-элементов VA группы и применение их соединений в медицине и фармации;
определение микроколичеств мышьяка в биологическом материале по методу Марша;
уметь
составлять уравнения химических реакций, характеризующих получение, химические свойства элементов VA группы и их соединений;
владеть
способами написания реакций получения простых веществ VA группы и их соединений;
навыками работы с химическими реактивами и оборудованием.
В VA-группу элементов периодической системы Д.И.Менделеева входят: азот - N, фосфор - P, мышьяк - As, сурьма - Sb, висмут - Bi. Атомы
421
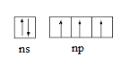
этих элементов имеют электронную конфигурацию внешнего энергетического уровня ns²np³ и относятся к р-элементам.
Эти элементы: неметаллы – органогены азот и фосвор, примесные токсичные элементы мышьяк, сурьма и висмут.
23.1. Общая характеристика элементов VА-группы
На внешнем электронном уровне все 5 рассматриваемых элементов имеют 5 электронов: 2 электрона на заполненной s-орбитали и 3 электрона наполовину заполенном р-подуровне (правило Хунда). Все эти электроны являются валентыми.
Повышенное число валентых электронов (5) по сравнению с предыдущей группой (IVА) усиливает тенднцию к присоединению электронов (усиление электроотрицательных свойств), то есть к дополнению внешнего энергетического уровня до октета (8). Однако эта способность присоединять электроны проявляется пока слабее чем у элементов: (VIА группы: кислород - полоний; VIIА-группы (фтор - астат). Так, электроотрицательность элементов VА-группы (азот – висмут) меньше, чем у р-элементов VIА-группы и VIIA-группы), и наоборот ОЭО в ряду азот-висмут (VА) больше, чем у р-элементов IVА-группы (углерод – свинец).
Тенденция же отдавать электроны проявляется в обратном напрвлении:
|
N |
P |
As |
Sb |
Bi |
ОЭО |
3,1 |
2,2 |
2,1 |
1,8 |
1,7 |
Азот сильно электроотрицательный элемент, и занимает 3-е место в ряду электроотрицательности после фтора и кислорода.
Свойста р- элементов VА-группы периодически резко изменяются с увеличением порядкового номера в той же последоватедьности, которая наблюдалась ранее в рассмотренных главных подгрппах.
Основные параметры и сведения об элементах VА-группы приведены ниже в таблице 23.1.
422
Таблица 23.1. Основные параметры и сведения элементов VА группы
Параметр |
N |
P |
As |
Sb |
Bi |
|
Валентные электроны |
2s²2p³ |
3s²3p³ |
4s²4p³ |
5s²5p³ |
6s²6p³ |
|
Ковалентный атомный радиус |
0,070 |
0,110 |
0,121 |
0,141 |
0,152 |
|
атома, нм |
||||||
|
|
|
|
|
||
Энергия ионизации |
14,53 |
10,484 |
9,81 |
8,639 |
7,287 |
|
Э°→Э , эВ |
||||||
|
|
|
|
|
||
Сродство к электрону |
7 |
72,0 |
78 |
101 |
91,3 |
|
Э + е→Э , кДж/моль |
||||||
|
|
|
|
|
||
Относительная |
3,1 |
2,2 |
2,1 |
1,8 |
1,7 |
|
электроотрицательность |
||||||
|
|
|
|
|
||
Содержание в земной коре, % |
0,02 |
0,08 |
5· 10 |
2· 10 |
4,8 ·10 |
|
(масс) |
||||||
|
|
|
|
|
||
В почвах, % |
0,1 |
0,08 |
4· 10 |
? |
2· 10 |
|
В Мировом океане, % |
10 |
5 ·10 |
1,5· 10 |
≈3· 10 |
2 ·10 |
|
В растениях, % |
0,3 |
0,07 |
10 - 10 |
? |
2 · 10 |
|
В живых организмах, % |
3,1 |
0,95 |
10 - 10 |
? |
2· 10 |
|
В организме человека, % |
3,0 |
1,1 |
≈ 2·10 |
10 |
10 |
|
Общая масса в организме |
2100 |
780 |
18· 10 ³ |
≈10 ³ |
≈10 ³ |
|
человека (на 70 кг), г |
||||||
|
|
|
|
|
||
Суточное потребление (на 70 |
7-16 |
(0,9-1,9) |
≈4·10 |
≈3·10 |
≈1·10 |
|
кг), г |
||||||
|
|
|
|
|
В главной подгруппе VА-группы сверху вниз резко изменяются основные параметры и свойства атомов, увеличивается число энергетических уровней, возрастают радиусы атомов, вследствие этого связь валентных электронов с ядром ослабевает и неметаллические свойства атомов элементов уменьшаются, а металлические свойства усиливаются. Так атомы азота и фосфора представляют собой неметаллические элементы, следующий атом мышьяк имеет промежуточный характер – амфотерный.
У сурьмы и висмута преобладают металлические свойства. Способность образовывать катионы в соединениях проявляется у
сурьмы и висмута.
Закономерные изменения химических свойств от азота к фосфору и висмуту выражается в постепенном ослаблении силы кислот и усилении признаков металлического характера.
Азот и фосфор образуют типичные кислоты, сурьма и висмут дают высшие оксиды, в которых кислотный характер выражен очень слабо.
Степени окисления характерные для элементов VА-группы: (-3), (0), (+3), (+5).
Характер химических связей с другими элементами. В
соответствии с электронными валентными конфигурациями, характером и природой элементов VА-группы их электроотрицательностью и сродством к электрону, с которыми они соединяются, могут образовываться соединения двух типов: ионные и ковалентные.
423
Вследствие большой электроотрицательности азота и фосфора, в большинстве образующихся соединений с ковалентной связью, только мышьяк, сурьма и висмут, проявляют возрастающую тенденцию к отдаче электронов (образованию соединений катионного характера).
Азот с активными металлами образует нитриды типа Li N. Однако ионных соединений подобных Na P очень мало.
Однако отдача электронов также трудна, вследствие высоких ионизационных потенциалов. Ионы с зарядом +5 не существуют, но 3-х валентные As, Sb, Bi могут образовывать катионные (ионные) соединения,
подобные BiF , Sb (SO ) , Bi(NO ) .
Некоторые наиболее важные тенденции проявляются:
оксидами, изменяющими свой характер от кислотного у азота – фосфора до основного у висмута;
галогенидами, обладающими возрастающим ионным характером.
Азот и фосфор с водородом и кислородом образуют только ковалентные соединения.
Ковалентность элементов в соединениях. Наличие у атомов р-
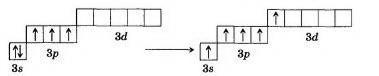
элементов VА-группы 3-х неспаренных электронов в нормальном невозбужденном состоянии обусловливает ковалентность равную 3 (ЭН , ЭГ ), то есть образуются 3 ковалентные связи с другими элементами.
При возбуждении атомов один из двух s- электронов у всех элементов, кроме азота, может перейти на d-подуровень внешнего уровня, тогда все электроны становятся неспаренными и их ковалентность становится равной 5 (ЭХ ).
Соединения такого ионного типа для азота неизвестны. В атоме азота возбуждение невозможно, так как нет d-подуровня и чтобы распарить электроны с s²-орбитали и перевести на третий энергетический уровень требуется затрата большой энергии, которая не может быть компенсирована той энергией образования химических связей азота с другими атомами.
Поэтому азот в отличие от других элементов пятой группы, не образует соединений с ковалентностью равной 5. Азот не является 5–ти ковалентным и в своих наиболее типичных соединениях, как, например, азотная кислота, азотный ангидрид и др.
Атомы азота при переходе в возбужденное состояние могут увеличивать число неспаренных электронов максимум до 4-х, при потере одного электрона, тогда электронная конфигурация становится s¹p³ - азот
424
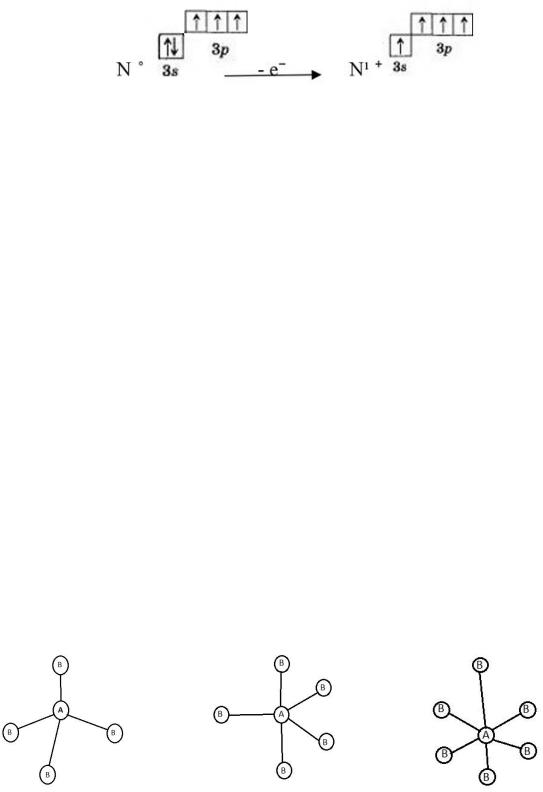
становится 4-х ковалентным. Итак, максимальная ковалентность азота равна только 4.
3-х ковалентен |
4-х ковалентен |
4-х ковалентное состояние азота может быть достигнуто и за счет донорно-акцепторного механизма как, например, в NH Cl и других соединениях.
Для фосфора и высших аналогов максимальная ковалентность равна 6, так как эти элементы могут быть акцепторами электронов за счёт d- орбиталей.
Гибридизация и пространственная конфигурация молекул и ионов VA группы.
Гибридизация орбиталей характерна для атома азота и мало характерна для высших аналогов (из-за большого размера орбиталей последних).
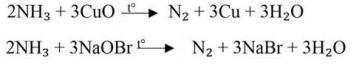
Для Э(III) имеет место sp³-гибридизация и соответственно тетраидрическое или пирамидальное расположение связей, это показано ниже.
Для Э(V) возможны три типа гибридизации: sp³, sp², sp.
При этом атом азота может находиться в состоянии sp³, sp², sp – гибридизации.
Для фосфора наиболее характерно sp³-гибридное состояние. Поскольку при переходе от N к Bi участие s-орбиталей в sp³ -
гибридизации уменьшается и усиливается участие в гибридизации d- орбиталей.
sp³гибридизация |
sp³d-гибридизация |
sp³d²-гибридизация |
Строение: тетраэдрическое, |
Строение: |
Строение: октаэдрическое |
Э О , ЭО ³ ,(NH , PO ³ ) |
бипирамидальное |
расположение связей |
|
ЭХ (АВ ) |
АВ , ЭХ , PF- |
|
425 |
|
Таким образом возможны следующие гибридизации атомов элементов VA группы:
I - sp, sp², sp³ II - sp³, sp³d,
III - sp³, sp³d, sp³d², очень характерна sp³d² -гибридизация Кординационные числа. При образовании комплексных соединений
характерны для N-4, P, As, Sb, Bi- 6.
Способность образовывать кратные связи хорошо проявляется у азота, что отличает его от других элементов подгруппы (P, As, Sb, Bi). Для азота характерна 2-х-атомная молекула с кратной связью :N≡N:. Азот также образует тройные связи с углеродом (-C≡N), в то время как P, As, Sb образуют тетраэдрические молекулы P , As , Sb .
23.2. Азот и его соединения
Азот (Nitrogenium) от греческого - это безжизненный. Открыт в 1772 Д. Рутерфордом.
Нахождение в природе. Основная масса азота находится в природе в свободном состоянии. Свободный азот является главной составной частью воздуха, который содержит ~78% объема азота.
В земной коре азот находится в виде соединений: нитратов и других соединений. Самыми важными (промышленное значение) является: NaNO - чилийская селитра и KNO индийская селитра.
Кроме того, азот входит в виде сложных органических соединений в составе всех живых организмов (белков и др.).
Атомы и ионы азота обнаружены в газовых туманностях и солнечной системе. На Уране и Нептуне он находится в виде NH .
Биологическая роль и круговорот азота. Наша цивилизация не могла бы существовать без соединений, содержащих азот. Этот элемент входит в состав полимеров, лекарств, красителей и множества других веществ без которых мы сегодня не можем обойтись. Но главное, азот входит в состав белков – незаменимого компонента человеческой пищи. Азот находится во всех живых организмах в виде многочисленных органических соединений: белков, нуклеиновых кислот, некоторых витаминов и гормонов, алкалоидов, гемоглобина крови, хлорофилла и др. Без белка нет жизни, а также азот является обязательной составной частью белка, то понятно какую роль играет этот элемент в живой природе. «Жизнь есть форма существования белковых тел…» - Ф. Энгельс. Животные и высшие растения не могут усваивать азот прямо из воздуха. Такой способностью обладают только некоторые микроорганизмы (азотобактерии, находящиеся в гумусе почвы). Некоторые из этих бактерий живут в симбиозе с бобовидными растениями (люцерна, клевер) и способствуют усвоению и накоплению в почве связанного азота.
426
Небольшое количество азотистой и азотной кислот содержит дождевая вода (они образуются из N и O в воздухе при действии электрических разрядов).
Высшие растения извлекают азот из почвы в виде NH (соли NH ) и нитратов и переводят их в сложные органические соединения. Вместе с пищей соединения азота из растений передаются животным.
Связанный азот из организмов животных и растений возвращается в почву после гибели и гниения последних.
Таким образом в природе совершается непрерывный круговорот
азота.
Несмотря на замкнутость азотного цикла для получения высоких урожаев необходимо вносить в почву дополнительно удобрения, содержащие азот.
Без азота не могут синтезироваться белковые вещества, а без белковых веществ не может строиться и протоплазма живой клетки
Ни одной растительной клетки или клетки животного организма и человека не существует без азотного вещества.
Характерно, что растения и животные потребляют не свободный, а связанный азот, находящийся в почве в форме азотистых и аммиачных солей. Функции перевода свободного азота в связанный выполняют азотофиксирующие бактерии (клубеньковые бактерии).
Азот не только носитель жизни, он широко применяется в химической технологии.
Исследования, проведенные Институтом элементарных органических соединений АН СССР, показали, что в биологических системах азот образует комплексные соединения с ионами металлов, входящих в состав ферментов и белков, ускоряющих химическое взаимодействие в клетках. Установлено, например, что если в почве отсутствует молибден, то процесс фиксации атомарного азота микроорганизмами полностью прекращается.
Получение свободного азота. В промышленности азот получают фракционной перегонкой жидкого воздуха (постепенным испарением), отделением кислорода (-183°С) и других составных частей воздуха.
Азот кипит при -195,8°С.
В лабораторных условиях его получают из азотсодержащих соединений разными способами:
термическим разложением соединений, например, нитритов:
NH NO → N + 2H O
окислением аммиака: 4NH + 3O → 2N + 6H O
427
(при пропускании NH через накалённый CuO)
(реакция идет количественно и применяется для определения азота в соединениях, солях NH и др. веществах).
Строение молекулы азота. Молекула азота состоит из двух атомов N ( N≡N), : N≡N:, связанныхсвязанные тройной связью:
одна σ связь и две п-связи. Молекула неполярная, исключительно прочная, энергия диссоциации 940 кДж/моль.
Даже при температуре 3000°С на атомы разлагается 0,01% 4000°С _________________ 0,075% 5000°С _________________ 2,9%
В разных источниках выход атомов азота немного различается в процентах.
Физические свойства азота – бесцветный газ, без запаха и очень мало растворим в воде, немного легче воздуха. В жидком состоянии азот – подвижный, как вода жидкость. Твёрдый азот – белоснежные большие кристаллы, его получают или охлаждением жидкого азота, или быстрым испарением жидкого азота.
Химические свойства азота. Вследствие большой прочности молекулы азот химически малоактивен. В обычных условиях (при нормальной температуре) азот непосредственно взаимодействует лишь с литием:
N + 6Li = 2Li N
Так было раньше, а сейчас получены соединения азота с переходными элементами: Ti, Va и другими, особенно с Mo, W.
При нагревании в присутствии катализаторов, электроразряда и ионизирующих излучений азот становится более химически активным; типичными реакциями являются:
N (г) + 3H (г) = 2NH (г)
N (г) + O (г) = 2NO(г)
N (г) + 3Mg(тв) = Mg N (тв)
Окислительная способность нейтрального атома азота значительно меньше, чем кислорода и значительно больше, чем углерода.
Нейтральный атом азота – очень слабый окислитель, поэтому восстановительная способность азота в состоянии N³ - значительно больше, чем кислорода в состоянии O² и меньше, чем углерода в состоянии C .
Азот не поддерживает горения.
Животные, помещённые в атмосферу азота, быстро погибают, не вследствие ядовитости азота, а из-за отсутствия кислорода.
Азот находит широкое применение для получения NH , для заполнения электрических ламп, для создания нейтральной среды некоторых химических реакций и для других целей.
428
Соединения азота
Нитриды – соединения азота с металлами. При высоких температурах азот окисляет многие металлы и неметаллы, образуя нитриды:
3Mg + N = Mg N (Na N, AlN, Si N , P N , S N , Cl N) 3H + N = 2NH
Нитриды активных металлов имеют кристаллическую структуру (ионные соединения, почти): Na N, Mg N . Они химически довольно активны, например легко разлагаются водой:
Na N + 3HOH = 3NaOH + NH
Нитриды тяжёлых металлов (d – элементы обладают большой твёрдостью, химически и термически очень стойки, обладают металлическим блеском и электропроводностью).
Нитриды галогенов – эндотермические соединения. В свободном состоянии выделен жидкий Cl N (∆H°обр = 229 кДж/ моль), легко разлагается со взрывом. По химической природе – это кислотные соединения:
Cl N + 3H O = 3HClO + NH
Из ковалентных нитридов наибольшее практическое применение имеет нитрид водорода – аммиак.
Аммиак. Азот образует с водородом несколько соединений:
1)Аммиак – NH
2)Гидразин – N H
3)Гидроксиламин – NH OH
4)Азотистоводородная кислота – HN
Важнейшим из них является аммиак, остальные можно рассматривать как его производные.
Получение аммиака. В лаборатории NH получают:
нагреванием солей аммония со щелочами;
2NH Cl + Ca(OH) = CaCl + 2NH +2H O
термическим разложением солей аммония;
NH Cl → NH +HCl
гидролизом ионных нитридов;
Mg N +6HOH = 3Mg(OH) + 2NH
Впромышленности NH получают синтезом из простых веществ: N + 3H ↔ 2NH + 92кДж/моль
Всоответсвии с принципом Ле Шателье процесс проводят при повышенном давлении, 150-1000 атм., катализатор железо и температура 400-500°С (хотя реакция экзотермическая, поэтому необходимо “разогреть” молекулы, расшатать в них прочные ковалентные связи).
429
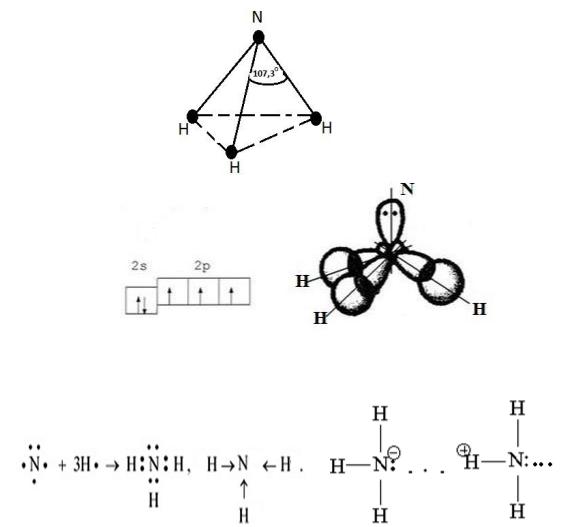
Строение молекулы NH . Молекула NH имеет форму тригональной пирамиды, в вершине которой находится атом азота, а в вершинах оснований – атомы водорода.
Вследствие sp³-гибридизации атом азота содержит несвязывающее двухэлектронное облако, отчётливо ориентированное в пространстве. Поэтому молекула NH – резко выраженный донор электронной пары и обладает высокой полярностью (μ = 1,46 Д).
Неподелённая электронная пара и полярность связи Н→N обуславливают донорно-акцепторные свойства атома азота и способность образовывать ассоциаты за счёт водородных связей.
Поэтому температура плавления (-77,75 °С) и кипения (-33 - 35°С) аммиака довольно низкая, он легко сжижается и имеет высокую теплоту испарения и его применяют в холодильных машинах.
Физические свойства аммиака. Аммиак - бесцветный газ с характерным резким запахом, хорошо растворим в воде (1 объём при комнатной температуре растворяет 700 объёмов аммиака с образованием гидроксида NH OH (нашатырный спирт)).
Обычный медицинский нашатырный спирт содержит 10% NH , концентрированный – 25% NH . Аммиак легко сжижается.
430
