
книги2 / монография 4
.pdf
Н2О, NH и другими веществами; известен комплексный ион [BF4] , для них характерны реакции присоединения.
Галиды бора (кроме BF) разлагаются:
ВГ3 + 3НОН = В(ОН)3 + 3НГ Тригалиды бора – сильные акцепторы электронной пары.
Наиболее важным из галидов бора является трифторид - ВF . ВF является одним из самых активных акцепторов – сильная кислота
Льюиса □ВF, он легко соединяется с Н О, эфирами, спиртами, аминами, образуя продукты присоединения:
HF + BF = HF→ ВF3→H[BF4]
H[BF4] – комплексная фтороборная или борофтористоводородная кислота устойчива только в растворе, причём её кислотные свойства выражены гораздо сильные, чем у НF. Соли борофтористоводородной кислоты – фторобораты, хорошо растворимы в воде К[BF4], кроме
Rb[BF4], Cs[BF4].
Кислородные соединения бора В2О3 и В(ОН)3. В2О3 - оксид бора(III), борный ангидрид, в природе в свободном виде не встречается.
Получают обезвоживанием (прокаливанием) Н3ВО:
При горении бора в атмосфере кислорода:
4B + 3O2→ 2B2O3
Свойства – бесцветная, стекловидная, гигроскопичная масса, хорошо растворимая в воде с образованием борной кислоты:
В О +3Н О → 2Н ВО В2О3 в кислотах не растворяется, растворяется в щелочах:
2В2О3 + 2NaOH = Na2B4O7 + H2O
В2О3 + 2NaOH = 2NaBO2 + H2O
Борная (ортоборная кислота) Н3ВО3, В(ОН)3. Встречается в природе и может быть получена:
При гидролизе галогенидов (было показано); Растворении В О в воде (было показано);
При взаимодействии тетрабората натрия с сильными кислотами:
Na2B4O7 + 2НCl + 5H2O = 4H3BO3 + 2NaCl
H3BO3 - белые кристаллы или блестящие чешуйки мало растворимы в холодной воде, лучше в горячей.
При нагревании H3BO3 (постепенно) последовательно отщепляется вода по схеме:
391
Ортоборная кислота H BO очень слабая (слабее угольной), даже в
первой ступени диссоциации её мала и соли легко гидролизуются:
H3BO3 + Н2О = [В(ОН)4] + Н+ К = 7,3·10 ¹°
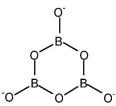
Известны несколько так называемых полиборных кислот, соответствующие различным степеням гидратации борного ангидрида
(nB O·H O):
Н2В4О7 (или 2В2О3Н2О) – тетраборная кислота 2НВО2 (или В2О3Н2О) – метаборная кислота 2Н3ВО3 (или В2О33Н2О) – ортоборная кислота
Из этих кислот в свободном виде выделена только H3BO , остальные известны только в виде солей.
Все полиборные кислоты и их соли имеют полимерную структуру. Соли ортоборной кислоты – бораты щелочных металлов хорошо
растворимы в воде, все остальные труднорастворимы.
Водные растворы имеют сильнощелочную среду вследствие гидролиза.
Бораты большей частью являются солями не H3BO3, а тетраборной, метаборной и других кислот, например:
При взаимодействии H3BO3 с NaOH образуются не ортобораты, а тетраили метабораты (то есть кислоты менее гидратированные).
4H3BO3 + 2NaOH= Na2B4O7 + 7H2O
H3ВО3 + NaOH = NaBO2 + 2H2O (избыток щёлочи)
Бура – является важнейшим в практике боратом, Na B O ·10H O – бесцветные кристаллы, выветриваются на воздухе, мало растворимы в воде.
Водные растворы сильно гидролизуются по аниону (реакция среды щелочная):
Na2B4O7 + 7H2O = 4Н3ВО3 + 2NaOH B4O7² + 7HOH = 4H3BO3 + 2OH
(подкисление сильно увеличивает гидролиз (равновесие смещается в сторону прямой реакции за счёт связывания ОН).
Метабораты –((HBO ) , Na B O ) щелочных металлов LiBO , NaBO и KBO твердые вещества, тримерны, имеют плоское циклическое строение:
Растворы солей некоторых (многих) металлов в расплавленной буре имеют характерную окраску. Это используется в качественном анализе при качественном анализе металлов. Реакцию проводят в ушке платиновой
392
проволочки, причем получается окрашенная капля борного стекла («перл буры»).
Структура боратов. Многие бораты встречаются в природе обычно в гидратированной форме. Безводные гидраты можно получить сплавлением H BO c оксидами металлов, а гидратированные бораты кристаллизируются из водных растворов: Na B O ·10H O, KB O ·4H O, которые являются циклическими или линейными полимерами, образованными связыванием частиц ВО и ВО или обоими вместе с обобщением атомов кислорода.
Примеры безводных анионов боратов представлены ниже:
Циклический анион |
Бесконечная цепь (BO2)n-n |
метаборат (BO2)33- |
|
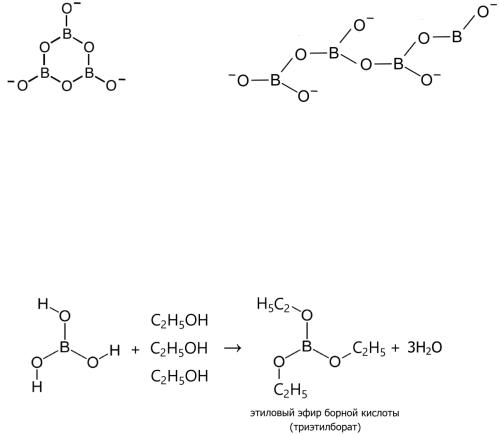
Эфиры борной кислоты
Образуются при взаимодействии Н ВО со спиртами, например СН ОН или С Н ОН с отщеплением Н О в присутствии концентрированной Н SO .
Этиловый эфир борной кислоты (триэтилборат)
Эфиры борной кислоты окрашивают пламя в интенсивный зелёный цвет. Это используется для качественного определения борной кислоты и боратов. Для этого вещества нагревают с Н SO и спиртом и поджигают спирт.
21.3. Алюминий и его соединения
Нахождение в природе. По распространенности на земле занимает 4-е место (после О, Н, Si), причем на его долю приходится около 5,5% от общего числа атомов земной коры. Состоит из одного стабильного изотопа Al, основная масса сосредоточена в алюмосиликатах. К важнейшим соединениям Al относят: бокситы Al2О3·nH2O, содержащие 32-60%
393
глинозёма Al2О3, корундAl2О3 - устойчивая кристаллическая модификация глинозёма: глина, основной состав которой (соответствует каолину),
отвечает формуле Al2О3·2SiO2·2H2O, криолит Na3[AlF6], нефелин (Na, K)2O·Al2O3·2SiO2, алунит K2SO4, Al2(SO4)·2Al2O3·6H2O.
Получение– электролизом Al2O3.
Физические свойства - алюминий серовато-белый, легкий металл, тягуч (способен вытягиваться в тонкую проволоку), ковок (прокатывается в тонкие листы). Теплопроводность хорошая, но меньше Сu вдвое, электропроводность около 60% электропроводности Cu. Относится к легким металлам, плотность его 2,7 г/см³.
Химические свойства. При обычных условиях чистый алюминий обладает высокой химической активностью. На воздухе, вследствие образования чрезвычайно тонкой прочной плёнки оксида или гидроксида, он очень стоек к коррозии. В отличие от бора алюминий проявляет амфотерные свойства.
Чистый или амальгамированный алюминий (покрытый ртутью):
легко окисляется в Al O ;
превращается в AlCl и др;
При нагревании соединяется с серой t Al2S3
азотом t AlN углеродом t Al4C3
В ряду напряжений металлов алюминий стоит далеко левее от Н, но не вытесняет его из воды, так как образуется плотная защитная оксидная плёнка. Однако амальгамированный алюминий энергично взаимодействие с Н О выделяя водород.
2Al+6 H O = 2Al(OH) +3H ↑
Алюминий при обычных условиях растворяется в разбавленных минеральных кислотах (кроме Н S и органических кислотах)
2Al + 6HCl = 2AlCl + 3H
при нагревании растворяется в HNO любой
Al + 4HNO = Al(NO ) + NO + 2H O
На холоду концентрированные HNO , Н SO пассивируют алюминий
Алюминий растворяется в щелочах с выделением Н ↑ В разбавленных щелочах образуются метаалюминаты
NaAlO ·2H O
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
В концентрированных щелочах образуются ортоалюминаты
Na [Al(OH) ] или Na AlO ·3H O
394
Алюминий с другими металлами образует сплавы-дюралюминаты,
силумины и др.
Применение. Алюминий находит самое широкое применение и в этом плане занимает одно из первых мест среди других металлов. В основном в виде различных сплавов: дюралюмина (Аl – 94%, Cu, Mg, Mn, Fe, Si), силумина (Al – 84% + Si 10-14% и 0,1% Na).
Алюминий является сильнейшим восстановителем и применяется в металлургии для восстановления металлов из руд при нагревании (алюмотермия).
2Al + Fe O t Al O + 2Fe.
Алюминиевая фольга (толщиной 0,005 мм) применяется в пищевой и фармацевтической промышленности для упаковки продуктов и лекарственных препаратов.
Применения: в авиа-, авто-, судо- и приборостроении в производстве посуды и других целей.
Соединения алюминия. Для алюминия, как и для бора характерна степень окисления(+3), координационные числа 4 и 6.
Гидрид ( AlH)n полимерное вещество, также как ВН, соединение с дефицитом электронов.
Гидрид алюминия реагирует с основными гидридами и образует аланаты LiH + AlH3 = Li[AlH4] они являются хорошими восстановителями.
Оксид и гидроксид Al: Al2O3 и Al(OH)3. Al2O3 известен в виде нескольких модификаций глинозем-аморфное вещество. Кристаллическая форма образует минерал в природе корунд, очень прочное вещество по твердости уступает лишь алмазу. Применяется в виде абразивного материала в виде корундовых кругов и наждака.
Кристаллическая модификация Al2O3 химически очень стойка, не взаимодействует с Н2О и кислотами. Щелочами разрушается лишь при длительном нагревании.
Оксид алюминия – аморфное вещество, в воде не растворяется, проявляет амфотерные свойства , основные свойства выражены сильнее чем кислотные:
Al2O3 + 6NaOH + 3H2O 2Na3[Al(OH)6]
Al2O3 + 2NaOH 2NaAlO2 + H2O
Al(OH) - полимерное соединение Al(OH) ·Н О. Получают косвенным путем из солей.
AlCl + 3 NaOH = Al(OH) + 3NaCl
Свойства – студнеобразный белый осадок, практически нерастворим в воде, но легко растворяется в кислотах и сильных щелочах. Амфотерные свойства, но основные и особенно кислотные свойства выражены довольно слабо.
395
Кдис. по основному типу = 1 · 10
Кдис. по кислотному типу = 4 · 10 ¹
НАlO - метаалюминиевая кислота, соли – метаалюминаты H AlO - ортоалюминиевая кислота, соли – ортоалюминаты. Al(OH) + 3HCl = AlCl + 3 H O
Al(OH) + NaOH = Na[Al(OH) ]
Алюминаты (орто- и мета) в них алюминий проявляет себя как кислотообразующий элемент, образуя гидроксокомплексы: [Al(OH)4] ;
[Al(OH)5]² ; [Al(OH)6]³.
Алюминаты наиболее активных металлов в воде хорошо растворимы и сильно подвергаются гидролизу и устойчивы лишь при избытке щелочи.
Соли алюминия сильных кислот многие хорошо растворимы в воде, но сильно подвергаются гидролизу, поэтому показывают кислую реакцию. Многие из них разлагаются водой, например:
Al2S3 + 6HOH ↔ 2Al(OH)3↓ + 3 H2S↑
AlCl3 + 2HOH ↔ Al(OH)2Cl + 2HCl Al2(SO4)3 + 2HOH ↔ 2Al(OH)SO4 + H2SO NaAlO2 + 2HOH ↔ Al(OH)3 + OH+ Na+ AlO2 + 2HOH ↔ Al(OH)3 + OH [Al(OH)4] +HOH↔ [Al(OH)3H2O] + OH
Гидраты солей (кристаллогидраты). Из кислых растворов выделяются кристаллогидраты соответствующих солей алюминия:
AlСl · 6H O; Al(NO ) · 9 H O; Al (SO ) ·18 H O
Квасцы: KAl(SO ) . 12H O; NH Al(SO ) · 12H O принадлежат к классу двойных или смешанных солей K SO · Al (SO ) · 12H O.
При нагревании они легко теряют Н О и полностью обезвоживаются (жженые квасцы).
Квасцы обладают вяжущим вкусом. Применяются при крашении тканей, в медицине как вяжущее, подсушивающее и дезинфицирующее средство (на слизистые оболочки, кожу и др.), при дублении кож.
Галогениды (галиды Al). Можно получить прямым взаимодействием простых веществ.
Al +3Гал → AlГал
2Al + 6HГал → 2AlГал3 + 3H↑
За исключением они растворимы в воде и весьма реакционноспособны, бесцветные кристаллические вещества. Летучи и уже при обычных условиях AlCl3; AlBr3; AlI3 дымят во влажном воздухе (вследствие гидролиза).
Галлиды Al с галоидными солями ряда одновалентных металлов образуют комплексные соединения типа Ме[AlF6] и Me[AlF4].
В парообразном состоянии, в расплавах и в некоторых органических растворителях AlCl , AlBr и AlI находятся в виде димерных молекул
Al Гал .
396
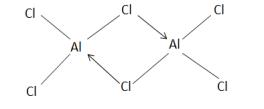
Простая молекула AlГал существует только при высокой температуре, например Al Cl , диссоциирует на AlCl только при 700˚С. Содержит два «мостиковые» атома галогена:
Криолит AlF + 3NaF = Na [AlF ]
Другие соединения:
Al S - алюминия сульфид получают прямым синтезом при нагревании. В водных растворах не может быть получен, так как нацело гидролизуется:
2Al³ + 3S² + 6H O ↔ 2Al(OH) ↓ + 3H S↑
Al C - карбид алюминия получают прямым синтезом при высокой температуре. Он мгновенно реагирует с водой, образуя метан:
Al C +12HOH = 4Al(OH) + 3CH
LiAlH - литийалюминийгидрид – аланат лития.
21.4. Биологическая роль р-элементов IIIA-группы. Применение их соединений в медицине и фармации
Бор. Бор относится к примесным микроэлементам, его массовая доля в организме человека составляет 10-5%. Бор концентрируется главным образом в легких (0,34мг), щитовидной железе (0,30мг), селезенке (0,21 мг), печени, мозге (0,22мг), почках, сердечной мышце (0,21мг). Биологическое действие бора еще недостаточно изучено. Известно, что бор входит в состав зубов и костей, очевидно, в виде труднорастворимых солей борной кислоты с катионами металлов.
Избыток бора вреден для организма человека. Имеются данные, что большой избыток бора угнетает амилазы. Протеиназы уменьшают активность адреналина. Предполагается, что снижение активности адреналина, являющегося производным полифенола, связано с его взаимодействием с триборной кислотой.
Давно известно, что бор необходим высшим растениям, однако данные о его биологической роли противоречивы.
Исследования, проведенные в последние годы, показали, что бор является необходимым элементом для некоторых животных. Установлено, что бор участвует в углеводно-фосфатном обмене, взаимодействует с рядом активных соединений (углеводами, ферментами, витаминами, гормонами). Вместе с тем употребление пищевых продуктов с большим содержанием бора нарушает в организме обмен углеводов и белков, что
397
приводит к возникновению эндемических кишечных заболеваний – энтеритов.
Алюминий. По содержанию в организме человека (10-5%) алюминий относится к примесным микроэлементам. Алюминий концентрируется главным образом в сыворотке крови, легких, печени, костях, ногтях, волосах, входит в структуру нервных оболочек мозга человека.
Суточное потребление алюминия человеком составляет 47 мг. Алюминий влияет на развитие эпителиальной и соединительной ткани, на регенерацию костных тканей, на обмен фосфора.
Алюминий оказывает воздействие на ферментативные процессы. В большинстве случаев катионAl3+ замещает ионы Э2+ – активаторы ферментов Е, например ионы Mg2+, Ca2+:
Э2+E + Al3+ Э2+ + Al3+Е
Такая взаимозаменяемость возможна вследствие сходства ряда свойств ионов Al3+ и Mg2+, Ca2+. Например, ионы Al3+ и Mg2+ имеют
близкие радиусы, одинаковые координационные числа – 6. Ионы Al3+ и Ca2+имеют близкие энергии ионизации (ΔЕи=12,2кДж/моль), одинаковые координационные числа – 6.
Избыток алюминия в организме человека тормозит синтез гемоглобина, так как благодаря довольно высокой комплексообразующей способности алюминий блокирует активные центры ферментов, участвующие в кроветворении. Имеются данные, что алюминий может катализировать реакцию трансаминирования (перенос NH2-группы).
Галлий. Галлий – это примесный микроэлемент (содержание в организме человека 10-6-10-5%). Биологическая роль галлия в живых организмах почти не выяснена.
Индий. В настоящее время биологическое действие индия неизвестно. Не имеются достоверные сведения о его наличии в живых организмах. Учитывая близость атомного строения и физико-химических свойств индия и таллия, можно прогнозировать сходство их биологического действия. Очевидно, индий, как и алюминий, попадая в организм, должен накапливаться в костной и других тканях в виде малорастворимого фосфата. Соединения индия в медицине не применяются.
Таллий. Таллий относится к весьма токсичным элементам. Ион Tl+ склонен, подобно Ag+, образовывать прочные соединения с серосодержащими лигандами:
Tl+ + R-SH R-S-Tl + H+
Вследствие этого он очень токсичен, так как подавляет активность ферментов, содержащих тиогруппы – SH. Даже весьма незначительные количества соединений Tl+ при попадании в организм вызывают выпадение волос.
398
Вследствие близости радиусов К+ и Tl+, они обладают сходными свойствами и способны замещать друг друга в ферментах. Ионы К+ и Tl+ являются синергистами. Этим объясняется тот факт, что ферменты пируваткиназа и диолгидраза активируются не только ионами К+, но и ионами Tl+ (ион Tl+ замещает ион К+ в каталитическом центре ферментов).
Синергизм таллия и калия проявляется и в том, что подобно ионам К+, ионы Tl+ накапливаются в эритроцитах.
В качестве противоядия при отравлении ионами Tl+ используют серосодержащий лиганд – аминокислоту цистин HS-CH2CH(NH2)COOH.
Необходимо отметить, что биологическая роль р-элементов IIIA группы изучена очень мало. В настоящее время известно, что бор и галлий взаимодействуют в растениях с ингибиторами их развития – полифенолами, уменьшая токсичность последних. Установлено также несомненная роль алюминия в построении эпителиальной и соединительной тканей, а кроме того, его участие в качестве как активатора, так и ингибитора. Свойством ингибировать многие серосодержащие ферменты обладает ион Tl+.
Биологическая активность р-элементов IIIA группы связана, главным образом, с их способностью к образованию комплексных соединений с кислородсодержащими лигандами и нерастворимыми фосфатами.
Применение соединений р-элементов IIIА-группы в медицине
Бура Na2B4O7∙10 Н2О используется как антисептическое средство. Борная кислота Н3ВО3 применяется как антисептическое средство в мазях, в глазных и ушных каплях и т. д. Некоторые соединения бора используются для нейтронной терапии раковых опухолей. Гидроксид алюминия Al(OH)3 может использоваться при повышенной кислотности желудка. Квасцы алюминиевые KAl(SO4)2∙12H2O («жженые квасцы») применяются для полосканий, промываний и примочек при воспалениях слизистых оболочек и кожи.
399
Вопросы и задания для самостоятельной работы
1.В ПСЭ содержится 30 р-элементов и находятся они в 6-ти группах главных подгруппах и в 6-ти периодах. Укажите на каких энергетических подуровнях находятся валентные электроны. Как изменяются радиусы атомов и ионов р-элементов и общие закономерности и свойства в группах и периодах. Покажите на примерах.
2.Как влияют на свойства р-элементов новые энергетические уровни и подуровни, которые усиливают экранирование зарядов ядер атомов на предшествующие электроны? Приведите объяснения.
3.IIIА группу главную подгруппу составляют элементы, которые имеют электронную валентную конфигурацию (ns2np1). Какую валентность, степень окисления, координационные числа они проявляют в соединениях? Покажите на примерах.
4.Укажите как изменяются основные параметры и свойства атомов элементов IIIА группы (радиусы атомов и ионов, энергия ионизации, электроотрицательность, ковалентность атомов в соединениях). Приведите примеры.
5.Покажите характерные состояния (sp2 и sp3) гибридизации АО у бора и алюминия, а также электронодефицитность, свойства бора и алюминия.
6.Охарактеризуйте нахождение бора и алюминия в природе, способы их получения. Физические и химические свойства простых веществ и применение.
7.Бороводороды и бориды, галиды бора и алюминия, их состав, строение, получение и свойства. Приведите соответствующие примеры и реакции.
8.Оксиды и гидроксиды бора и алюминия, их состав, получение и химические свойства. Кислоты бора (борная, метаборная, их соли), бораты и эфиры борной кислоты, бура, кристаллогидраты и квасцы алюминия. Приведите химические реакции, характеризующие указанные процессы и свойства веществ, применение.
9.Охарактеризуйте биологическую роль атомов элементов III A группы и применение их соединений в медицине и фармации.
10.Составьте уравнения реакции следующих превращений:
а) B2O3 → B → Mg3B2 → H2B6 → B2O3 → H3BO3 → Na2B4O7 → H3BO3 б) Al3+ → Al2O3 → Al → [Al(OH)4]- → Al3+ → Al(OH)2+ → [Al(OH)6]3-
11. Напишите уравнения протолитических реакций гидролиза следующих
солей:
AlI3; Na3[Al(OH)6]; Na2B4O7. Укажите реакцию среды, какая из указанных солей сильнее подвергается гидролизу?
12. Закончите уравнения ОВР:
а) B2H6 + KMnO4 + H2SO3 → H3BO3 → … б) Al + K2Cr2O7 + H2SO4 → …
13.Металлический алюминий растворили в растворе HCl и получили 200 мл раствора с молярной концентрацией в нем соли алюминия равной 0,1 моль/л. К этому раствору добавили щелочь до полного растворения выпавшего в начале осадка. Определить количество образовавшейся комплексной соли и массу алюминия.
14.Определите массу буры (Na2B4O7 ∙ 10H2O) и массу воды, которую надо взять для приготовления 100 г 5%-ного антисептического раствора.
15.Определите массу алюмокалиевых квасцов, которые применяются в медицине для наружного промывания, необходимую для приготовления 5%-ного раствора.
400
