
книги2 / монография 4
.pdf
горячем концентрированном растворе KOH образуется соль железной кислоты-феррат:
2Fe(OH)3 + 10KOH + 3Br2 = 2K2FeO4 + 6KBr + 8H2O
Ферраты являются очень сильными окислителями, даже сильнее KMnO4. Например, NH3 окисленная до свободного N2:
2K2FeO4 + 2NH4OH = 2Fe(OH)3 + N2 + 4KOH.
Таким образом, из рассмотренного материала вытекает, что почти все простые соединения Co и Ni являются производными 2-х валентных элементов Э(II), они наиболее устойчивы. Соединения железа почти одинаково устойчивы и 2-х и 3-х валентного состояния. Так как элементы семейства железа проявляют переменные с.о., то в реакциях они часто выступают в роли окислителей и восстановителей.
Комплексные соединения. Элементы Fe, Co, Ni образуют множество комплексов, где координационное число в основном равно 6. Примеры некоторых комплексов были уже приведены, добавим к этому реактив Чугаева (диметилглиоксим), который применяют для количественного осаждения Ni2 +:
|
|
|
|
H |
|
|
|
|
|
|
|
|
O |
O |
|
|
|
||
|
|
H3C |
|
|
|
|
CH3 |
||
H3C |
N OH |
N |
N |
||||||
2 |
|
+ Ni2++ 2NH3 |
|
Ni |
|
|
|
|
+ 2NH4+ |
|
|
|
|
|
|
||||
H3C |
N OH |
H C |
N |
N |
CH |
3 |
|
||
|
|
|
|
|
|||||
|
|
3 |
|
|
|
|
|
|
|
|
|
|
O |
O |
красный |
||||
|
|
|
|
H |
|
|
|||
|
|
|
|
|
|
|
|
|
|
В результате реакции образуется розовый осадок. В образовавшемся соединении никельдиметилглиоксима кроме обычных связей имеются донорно-акцепторные и водородные связи.
18.3. Биологическая роль элементов семейства железа и применение их соединений в медицине
Из 3-х металлов Fe, Co, Ni VIII B группы железо и кобальт являются важнейшими биогенными элементами и относятся к металлам жизни.
В организме человека содержится 5 грамм железа. Большая часть его находится в гемоглобине крови (около 70%). Железо входит так же в состав ряда ферментов, каталазы, пероксидазы, цитохромоксидазы – главных катализаторов окислительно-восстановительных процессов.
Содержание железа в растениях в 2 раза больше, чем в животных организмах, многие растения (бессмертник, итальянская марена, синюха, сушеница топяная и др.) накапливают его в значительных количествах.
351
Хотя содержание железа в земной коре велико, но существует проблема усвоения этого элемента. У людей и высших животных наблюдается дефицит железа и проявляется в анемиях.
Железо поступает в организм в основном с растительной пищей и мясом, а также с питьевой водой. Пищевые продукты животного происхождения усваиваются лучше, самое большое усвоение из мяса млекопитающихговядины, меньше из мяса домашней птицы или рыбы, и меньше всего из печени, молока и хлебных злаков, к продуктам, в которых содержится большое количество железа с высокой биодоступностью, т.е. способностью всасываться, относятся коровья печень и почки, яйца, рыба. Железо плохо выделяется из ростков пшеницы, масла бобовых, шпината, чечевицы, и зелени, свеклы – пищевых продуктов с высоким содержанием фитатов. Напротив, хорошее выделение железа происходит из моркови, картофеля, плодов свеклы, тыквы, брокколи, помидоров, цветной капусты, овощей, которые содержат существенные количества яблочной, лимонной или аскорбиновой кислоты. Наиболее богаты железом также: сушеные белые грибы, персики, абрикосы, зелень петрушки, яблоки, айва, толокно, устрицы, овсяная крупа, какао, горох, листовая зелень, пивные дрожжи, инжир и изюм. Медицинские препараты железа примерно на 90 процентов уходят из организма в неизменном виде.
Порог токсичности железа для человека составляет 200 мг/сутки. Летальная доза для человека: 7-35 г. Летальным исходом для ребенка
может стать прием сульфата железа в дозе 3 г и выше. Основные проявления дефицита железа:
-Развитие железодефицитных анемий;
-Головные боли и головокружения, слабость, утомляемость, непереносимость холода, снижение памяти и концентрации внимания;
-Замедленное умственное и физическое развитие у детей;
-Учащенное сердцебиение при незначительной нагрузке;
-Ломкость и деформация ногтей;
-Извращение вкуса;
-Угнетение иммунитета;
-Повышение общей заболеваемости, утомляемости;
-Увеличение риска опухолевых заболеваний;
-У пациентов обычно наступает улучшение, как только начата терапия железом.
Снова вернемся к гемоглобину – это один из самых важных комплексных соединений, без которых не могут жить теплокровные животные и человек. Гемоглобин – это сложное комплексное соединение, которое создала природа, где комплексообразователем является железо(II) встроенное в гетероциклическую порфириновую структуру. Это сложный по составу белок, содержащий небелковую (простетическую) группу – гем,
на долю которой приходится около 4% массы гемоглобина.
352
Простетическая группа представляет собой бионеорганический комплекс железа(II) с органическим веществом - порфирином. Эта группа и носит название гем (греч.гема-кровь).
Физиологическая функция гемоглобина заключается в способности обратимо связывать кислород и переносить его от легких к тканям. Если гемоглобин условно обозначить Hb·Fe2+, то реакцию обратимого
присоединения кислорода можно записать так: [Hb·Fe2+] + O2 ↔ [Hb·Fe2+·O2]
дезоксигемоглобин оксигемоглобин Гемоглобин, присоединивший кислород, называется
оксигемоглобином, а без кислорода - дезоксигемоглобином.
Гемоглобин взаимодействует также с оксидом углерода CO (монооксид), который в быту называется - угарный газ. При этом образуется
макроциклический комплекс с железом - карбонилгемоглобин:
[Hb·Fe2+] + CO = [HbFe2+∙ CO]
Константа устойчивости комплекса с угарным газом приблизительно в 200 раз прочнее, чем комплекса гемоглобина с кислородом. И гемоглобин блокируется, теряет способность присоединять кислород, нарушается перенос кислорода от легких к тканям и вызывает отравление организма, и, если не оказывать помощи, то может наступить летальный исход.
Группа ферментов, катализирующих реакции окисления пероксида водорода, называются каталазами и пероксидазами. Они имеют в своей структуре гем, в центре которого находится железо Fe3+. Механизм действия каталазы до конца не ясен, но доказано, что Fe3+ не восстанавливается. Каталаза ускоряет разложение H2O2, который образуется в реакциях метаболизма:
H2O2+ H2O2 каталаза 2H2O + O2
одна молекула является окислителем, другаявосстановителем. Реакция идет с большой скоростью, одна молекула каталазы может разложить 44000 молекул H2O2 за секунду.
Кобальт – жизненно важный и необходимый для человека и животных микроэлемент. Его роль трудно переоценить: он участвует в обмене жирных кислот, фолиевой кислоты, углеводородном, белковом и минеральном обмене, но главная его функцияучастие в синтезе витамина B12, в процессах кроветворения и образования гемоглобина. По составу витамин B12 – это сложное бионеорганическое комплексное соединение по строению похоже на гемоглобин. Комплексообразователем является кобальт, который встроен в структуру порфириновой системы, как железо в гемоглобине. Витамин B12 участвует в синтезе гемоглобина. При недостатке кобальта в организме возникает злокачественное малокровие (уменьшается число эритроцитов, снижается гемоглобин в крови). Развитие этой болезни ведет к смерти. В 1964 г. английскому
353
исследователю Дороти Кроуфут-Ходжкин присуждена Нобелевская премия по химии за открытие витамина B12, он содержит 4% кобальта. Витамин B12 участвует в синтезе гемоглобина, появлению красных кровяных телец. Многие растения, особенно лекарственные накапливают кобальт в сверхдозах – кубышка желтая, сушеница топяная, черемуха и шиповник. В среднем потребность в кобальте в сутки в организм 20-30 мкг, при поступлении менее 10 мкг кобальта проявляется дефицит:
-общая слабость, утомляемость, снижение памяти, анемия;
-аритмия;
-замедленное развитие, и др.
Поступивший в организм кобальт в первую очередь концентрируется в костном мозге, поджелудочной железе, печени, селезенке, почках и сердце. Накопление витамина B12 происходит в печени. Главный источник витамина B12 – животные продукты, особенно печень и почки. Недостаток витамина B12 наблюдается только у абсолютных вегетарианцев. Авитаминоз B12 вызывает пернициозную анемию, долгое время считавшуюся неизлечимой.
Соединения кобальта, применяемые в медицинской практике. К
ним относятся: цианокобаламин (витамин B12), при анемии, нервных заболеваниях. Коамид в комплексе кобальта с никотиновой кислотой при анемии и др., хлорид кобальта(II) – CoCl2 – в виде 20%-го раствора при гипертонии; радиоактивные препараты Co-для лучевой терапии, анемии. Изотоп кобальта применяется для лечения злокачественных опухолей.
Кобальт влияет на углеводный обмен, минеральный, белковый и жировой обмен, очень важная его роль – участие в процессе кроветворения
– синтезе гемоглобина.
Никель по сравнении с железом и кобальтом играет более скромную роль в организме. Его биологические функции изучены мало. Полагают, что он оказывает влияние на действие многих ферментов, усиливает синтез аминокислот, содержащих серу. Благоприятно влияет никель совместно с Fe на образование гемоглобина крови. Положительно действует Ni совместно с кобальтом на синтез гемоглобина. Растения, которые сильно накапливают никель: белладонна, пустырник, термопсис, можжевельник, лист березы, ягоды черемухи и др. Первые результаты, доказавшие биологическую роль никеля, были получены в 1974 г., фермент уреаза содержит никель и катализирует гидролиз мочевины на аммиак и СО2.
18.4.Семейство платины
Ксемейству платины относят 6 d-элементы VIII В группы: рутений Ru, родий Rh, палладий Pd, осмий Os, иридий Ir и платина Pt.
В природе они рассеяны и встречаются редко.
354
В периодической системе элементов Д.И. Менделеева платиновые металлы расположены в пятом и шестом периодах. У всех платиновых металлов при заполнении (n-1) d-подуровня происходит спаривание d- электронов. Это упрочняет и делает его более стабильным.
Платиновые металлы шестого периода вследствие лантаноидного сжатия имеют практически одинаковые орбитальные радиусы, которые очень мало отличаются от радиусов платиновых металлов пятого периода. Это обусловливает близость физических и химических свойств всех шести металлов.
Относительно небольшие радиусы атомов и большая стабильность d- подуровня определяют низкую химическую активность платиновых металлов. В электрохимическом ряду напряжений все платиновые металлы стоят после водорода. Значение электроотрицательности этих металлов изменяется в пределах 2,20 - 2,28, почти не отличаются между собой. Это объясняет тот факт, что соединения платиновых металлов (оксиды, гидроксиды) проявляют амфотерность, например, платина (IV) гидроксид растворятся в кислотах и в щелочах:
Pt(OH) + 2NaOH = Na2[Pt(OH) ]
Pt(OH) + 6HCl = H [PtCl ] + 4H O
Элементы семейства платины относят к тяжелым металлам. Осмий самый тяжелый из металлов. Металлы этой группы отличаются высокими температурами плавления и кипения, что указывает о большой энергии связи в кристаллических решетках металлов.
Все платиновые металлы проявляют низкую химическую активность. В обычных условиях не взаимодействуют даже с сильными окислителями (O , Cl , F ) и только при высоких температурах в мелкораздробленном состоянии металлы взаимодействуют с кислородом.
Проявляют в соединениях различные степени окисления. Для соединений платиновых металлов характерны следующие степени окисления: рутений +3, + 4, +8; родий +3; палладий +2, +4; осмий +4, +6, +8; иридий +3, +4; платина +2, +4. При сплавлении с сильным окислителем, например, натрия гипохлоритом, металлы окисляются:
М + 3NaClO + 2NaOH = Na MO + 3NaCl + H O
Платина и палладий активнее других металлов этой группы. Так, палладий довольно легко реагирует с концентрированной HNO и с горячей концентрированной H SO . Металлы Pt и Pd окисляются смесью HNO и HCl («царская водка»), образуя комплексные соединения.
3Pt + 4HNO + 18HCl = 3H [PtCl ] + 4NO + 8H O
Рутений реагирует с этой смесью незначительно и очень слабо взаимодействует родий и иридий. При сплавлении в атмосфере воздуха идет реакция окисления с образованием платинатов:
Pt + O + 2NaOH = Na PtO + H O
355
Эта реакция показывает, что сплавление со щелочами в платиновой посуде проводить нельзя.
Платиновые металлы, как и другие d-элементы образуют различные комплексные соединения, в которых координационное число металлов, как правило, равно 4 и 6. Наиболее известны комплексы платины, причем у платины (II) координационное число 4, а у платины (IV) – к.ч. 6, также платина образует устойчивые аммиакаты:
PtCl + 4NH = [Pt(NH ) ]Cl
PtCl + 6NH = [Pt(NH ) ]Cl
Известны и другие хлоридные и цианидные комплексы:
PtCl + 2NaCl = Na [PtCl ]
PtCl2 + 4KCN = K [Pt(CN) ] + 2KCl
При определенных условиях могут быть получены и нейтральные комплексы со смешанными лигандами типа [Pt(NH ) Cl ] и [Pt(NH ) Cl ].
Надо отметить, что получение платиновых металлов обходится очень дорого (валютные металлы) в связи с трудностями отделения их друг от друга и малой распространённостью в земной коре. Несмотря на малую доступность и дороговизну эти металлы имеют разнообразное применение в технике, а также для изготовления кислотно- и жаропрочной заводской аппаратуры, лабораторной и химической посуды, в качестве катализаторов и др.
Они имеют блестящий, серовато-белый цвет, большинство из них обладают способностью поглощать некоторые газы, например водород. Так 1 объём палладия поглощает 936 объёмов водорода (H ).
Соединения платиновых металлов.
Соединения Э(II) характерны для платины и палладия.
PdO – чёрный порошок получают при температуре 600-700°С в кислороде.
Соли Pd² - кристаллические, хорошо растворимые вещества. PdCl очень легко восстанавливаются в растворе до металла некоторыми газообразными восстановителями, например (CO) при обычной температуре:
PdCl2 + H2O + CO = CO2 + 2HCl + Pd
Соли Pd(II) в водных растворах сильно подвергаются гидролизу. Комплексные соединения Pd и Pt многочисленны и разнообразны.
Соединения типа Э(IV) - характерны для всех платиновых металлов, особенно для Pt.
У простых соединений Pt (IV) кислотные свойства преобладают. Pt(OH)4 - амфотерное соединение:
Pt(OH)4 + 2KOH = K2[Pt(OH)6] Pt(OH)4 + 6HCl = H2[PtCl6] + 4H2O
356
H [PtCl ]·6H O - платинахлористоводородная кислота может быть получена при действии платины в насыщенном хлорном HCl:
Pt + 2Cl2 + 2HCl= H2[PtCl6]
выделяется в виде кристаллогидратов H [PtCl ]·6H O – коричневокрасные кристаллы, это 2-х основная сильная кислота, хорошо растворимая в воде, спирте, эфире.
Соединение типа Э(VI) наиболее характерны для осмия и рутения. Оба металла при сплавлении их со щелочами в присутствии окислителей образуют соли кислот: осмиевой - осмонаты и рутениевой – рутенаты:
Э + 3KNO3 + 2KOH = K2ЭO4 + 3KNO2 + H2O
K2OsO4 и K2RuO4 они неустойчивы и разлагаются до RuO2 - восстановление и OsO4 - окисление.
Соединения типа Э(VIII) известны только для Os и Ru.
OsO - бледно-жёлтое вещество и RuO4 - золотисто-жёлтые, летучие, очень ядовитые, обладают сильными окислительными свойствами.
Для осмия известен также октафторид OsF – лимонно-жёлтые кристаллы, обладает окислительными свойствами.
Соединения осмия (VIII) легко восстанавливаются органическими соединениями с выделением чёрного оксида и поэтому растворы OsO применяются в гистологии для окраски микроскопических препаратов (например срезов).
18.5. Биологическая роль элементов семейства платины и их применение в медицине
Известно, что существенной роли, как микроэлементы в организмах, они не играют. Это можно объяснить инертной природой самих металлов и их большой массой. По этой причине нет оснований обсуждать необходимость этих элементов для живых организмов и их биологическую роль.
Однако, как было отмечено (КС), надо дополнить, что многочисленные исследования показали, что цис-изомер дихлордиамминплатины (II) оказывает лечебное действие при раковых заболеваниях. Действие [Pt(NH3)2Cl2] основано на том, что в комплексе происходит последовательное замещение хлорид-ионов хелатирующими лигандами. Такими лигандами являются аминокислые остатки в белках. Координация идёт за счёт взаимодействия металла с азотом лиганда. После замещения хлорид-ионов создаются условия для замещения и групп NH , в результате платина образует четыре связи с новыми лигандами. Это свойство цис-изомеров [Pt(NH3)2Cl2] позволяет образовывать устойчивый комплекс с молекулой ДНК.
357
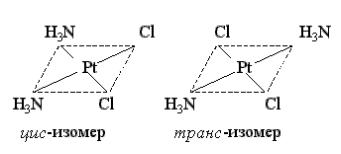
Таким образом, [Pt(NH3)2Cl2] ингибирует синтез ДНК. Интересно отметить, что трансизомер [Pt(NH3)2Cl2] токсичен, но противоопухолевым действием не обладает.
1)Цис-дихлородиамминплатина (II) [Pt(NH3)2Cl2]
2)Транс-дихлородиамминплатина (II) [Pt(NH3)2Cl2]
Наряду с цис-дихлородиамминплатиной (II) противоопухолевой активностью обладают и другие комплексы, содержащие в качестве лигандов амины и хлорид-ионы платины (IV) [Pt(NH3)2Cl4].
Вопросы и задания для самостоятельной работы
1.В побочной подгруппе VIII B группы ПСЭ находятся девять d-элементов, они сгруппированы в три триады и два семейства, приведите их состав, валентные электронные конфигурации атомов элементов, их степень окисления и координационные числа в соединениях.
2.В семействе железа (Fe, Co, Ni) число валентных электронов разное, основные параметры атомов элементов изменяются, однако свойства простых веществ в данном семействе различаются очень мало, почему? Предложите ответы на этот вопрос.
3.Металлы семейства железа находят широкое и разное применение. Приведите примеры получения этих металлов из природных соединений. Объясните, когда при выплавке железа получается чугун, мягкая сталь, ковкое железо, и как получается химически чистые железо, кобальт и никель?
4.Охарактеризуйте химические свойства железа, кобальта и никеля по
отношению к: O2, S, галогенам, P, As, C; разбавленной HCl и концентрированным HNO3 и H2SO4. Приведите примеры соответствующих реакций и укажите условия.
5.Объясните, что такое коррозия железа, какие есть способы её устранения. Приведите способы борьбы с коррозией.
6.Карбонилы и комплексные соединения семейства железа. Приведите примеры
иреакции их получения, а также применение.
7.Оксиды железа, кобальта и никеля в разных степенях окисления, их формулы, получение, химические свойства. Напишите соответствующие реакции.
8.Гидроксиды металлов семейства железа в разных степенях окисления, их получение, химические свойства. Напишите соответствующие реакции.
9.Приведите примеры солей металлов семейства железа разного состава и степени окисления, разной природы, напишите протолитические реакции их гидролиза
иукажите pH водной среды.
10.Напишите реакции получения цианидных комплексов железа (II) и железа (III), запишите значения их констант нестойкости и их численные выражения.
11.Запишите формулы оксида железа (VI) и железной кислоты, получение и свойства ферратов.
358
12.Охарактеризуйте биологическую роль железа, кобальта, никеля и применение их соединений в медицине и фармации.
13.Запишите формулы ферритов и ферратов, чем они отличаются по химическому составу и свойствам?
14.К семейству платины относят шесть d-элементов VIII B группы. Дайте общую характеристику элементов семейства платины, укажите сходство и различия с элементами семейства железа.
15.Оцените биологическую роль элементов семейства платины и применение их
вмедицине (цис- и транс-платиновый комплекс)
16.Составьте уравнения реакций следующих превращений:
Fe →Fe2+→ Fe3+ → FeO2- →Fe3+ →[Fe(OH)6]3-
17. Закончите уравнения ОВР:
а) Fe2O3 + Br2 + NaOH →...
б) K2FeO4 + NH3 + H2O → N2+ ...
в) K4[Fe(CN)6] + KΜnO4 + H2O →...
18.К 0,1 М раствору феррата натрия влили избыточное количество подкисленного водного раствора иодида натрия. К полученному раствору добавили по каплям 0,5 М раствор NaOH до полного выпадения образующегося осадка массой 2,136 г. Определить объём раствора феррата натрия.
19.Подберите реагенты и составьте уравнения следующих превращений:
FeSO4→FeCl3→FeCl2→Fe(OH)2.
359

Глава 19
d-Элементы IB-группы (n-1)d10ns1
Изучив содержание главы 19, студент должен:
знать
электронное строение атомов элементов IB группы;
распределение валентных электронов на энергетических уровнях;
степени окисления атомов элементов в соединениях и координационные числа;
закономерности изменения основных параметров и свойств атомов элементов IB группы;
нахождение в природе, получение, физические и химические свойства простых веществ и применение важнейших соединений меди, серебра, золота (оксиды, гидроксиды, соли), галогениды, комплексные соединения;
биологическую роль и применение в медицине и фармации;
уметь
составлять уравнения реакций, характеризующие свойства элементов IB группы;
владеть
навыками проведения химических реакций;
навыками работы с химическими реагентами при проведении реакций и обосновании полученных результатов.
19.1. Общая характеристика элементов подгруппы меди
Медь (Cu) – металл жизни, серебро (Ag) – биогенный металл, золото
(Au) – примесный металл. d-элементы ӀВ-группы (n-1)d10ns1
Атом меди в основном состоянии имеет электронную конфигурацию 4s13d10, в возбуждённом – 4s13d94р1; атом серебра является полным электронным аналогом меди: строение атома в возбужденном состоянии 5s14d95р1; атом золота в отличие от атомов меди и серебра имеет заполненный электронами 4f-подуровень: 6s14f145d10.
В атомах элементов меди (n-1)d-состоянии должны находиться по 9 электронов, но вследствие более устойчивой d10-конфигурации, энергетически более выгодным является переход одного электрона из s- подуровня («проскок») на d-подуровень. Поэтому Cu, Ag, Au в s-состоянии внешнего уровня имеют по одному электрону, а в предвнешнем d- подуровне по 10 электронов.
Таблица 19.1. Основные параметры и сведения элементов IB группы
Параметр |
|
Cu |
Ag |
Au |
Валентные электроны |
|
4s13d10 |
5s14d10 |
6s14f145d10 |
Металлический атомный радиус, нм |
|
0,128 |
0,144 |
0,144 |
Энергия ионизации Эо Э*, эВ |
|
7,724 |
7,574 |
9,22 |
Относительная электроотрицательность |
|
0,520 |
0,799 |
1,83 |
|
360 |
|
|
|
