
книги2 / монография 4
.pdf
Глава 16
d –Элементы VIB-группы
Изучив содержание главы 16, студент должен:
знать
электронное строение атомов элементов VIB группы;
особенности распределения валентных электронов на энергетических уровнях
ипочему у хрома и молибдена имеет место «проскок» электронов;
степени окисления атомов элементов и координационные числа в соединениях подгруппы хрома;
периодичность изменения основных параметров и свойств атомов элементов VIB группы и отличие их от таковых у элементов главной подгруппы;
нахождение в природе элементов подгруппы хрома, получение, физические и химические свойства простых веществ и применение;
окислительно-восстановительные свойства соединений подгруппы хрома;
особенности оксидов и гидроксидов хрома;
хромовые кислоты, соли, их строение, получение, свойства и применение;
краткие сведения о молибдене и вольфраме;
биологическую роль и применение в медицине и фармации;
уметь
составлять химические уравнения реакций при проведении эксперимента с веществами подгруппы хрома;
владеть
навыками проведения химических реакций и обосновывать их результаты.
16.1. Общая характеристика d-элементов подгруппы хрома
Хром Сr, молибден Mo, вольфрам W – элементы VIВ-группы
(n-1)d ns².
Такая структура валентных электронов (n-1)d ns2 на энергетических уровнях характеризует эти элементы как металлы, способные отдавать электроны с наружного и предвнешнего уровня, проявляя максимальную с.о. +6. У хрома и молибдена наблюдается проскок одного s-электрона на d-подуровень. Хром, молибден и вольфрам могут проявлять с.о. +1, +2, +3, +4, +5, +6; наиболее устойчивые соединения с с.о. (+3, +6).
Соединения этих металлов в с.о.(+3) – амфотерны, в высшей с.о. проявляют кислотный характер.
Координационные числа для этих металлов наиболее характерны 6,4.
Характер связи с другими элементами. В соединениях с низшей валетностью возникает ионная связь(CrCl3), в высших валентных
321
состояниях связь ковалентная. Ниже приведены характеристики указанных металлов (табл. 16.1).
Таблица 16.1. Основные параметры и сведения элементов VIB группы
|
Cr |
Mo |
W |
Валентные электроны |
3d54s1 |
4d55s1 |
5d46s2 |
Металлический атомный радиус, нм |
0,125 |
0,136 |
0,137 |
Энергия ионизации Эо Э+, эВ |
6,67 |
7,10 |
7,98 |
Относительная электроотрицательность |
1,66 |
2,16 |
2,36 |
Содержание в земной коре, % (мас) |
0,019 |
3•10-4 |
1•10-4 |
в почвах, % |
2•10-6 |
1•10-7 |
9•10-7 |
в Мировом океане, % |
5•10-4 |
2•10-5 |
? |
в растениях, % |
1•10-5 |
10-6-10-5 |
? |
в животных организмах, % |
10-6-10-3 |
10-7-10-4 |
? |
в организме человека, % |
1,66 |
2,16 |
2,36 |
Общая масса в организме человека (на 70 |
6•10-3 |
9•10-3 |
? |
кг), г |
|
|
|
Суточная потребность на (70 кг), г |
0,05 |
0,1-0,3 |
? |
Вопрос в таблице означает отсутствие надежных данных.
Из приведенных характеристик видно, что в ряду Cr – Mo - W у d- элементов изменяется мало атомный радиус, энергия ионизации, относительная электроотрицательность (особенно Mo-W), следовательно и металлическая активность изменяется мало, поэтому по свойствам эти элементы близки между собой, например:
|
Cr |
Mo |
W |
Плотность, г/см³ |
7,2 |
10,2 |
19,3 |
Температура плавления, ˚C |
1890 |
2620 |
3380 |
Температура кипения, ˚C |
3390 |
4800 |
5900 |
Электропроводность |
7,1 |
20,2 |
19,3 |
Вольфрам является самым тугоплавким из метеллов.Технический хром является одним из твердых металлов, а чистый хром пластичен.
Сходство и отличие от основной (главной) подгруппы
1.Элементы обоих подгрупп проявляют общую высшую с.о. (+6) и в этом состоянии являются сильными окислителями.
2.Общим является и то, что триоксиды (ЭО ) образуют соли с основными оксидами и щелочами.
Отличие
1.Элементы подгруппы хрома все металлы, а в главной подгруппе есть и неметаллы.
2.Для элементов VI группы характерны кислоты типа H ЭO , но в ряду Cr – Mo – W их сила закономерно уменьшается, тогда как в главной подгруппе H SeO не слабее H SO
322
3.Для S – Se - Te образуются водородные соединения ЭH , элементы подгруппы Cr их не имеют.
16.2. Химия элементов и соединений подгруппы хрома
Нахождение в природе. Металлы подгруппы хрома относятся к довольно распространенным элементам в земной коре и встречаются исключительно в виде соединений, например хром в виде FeO·Cr O или Fe(CrO ) - хромистый железняк.
Получение: выплавкой из руд и дальнейшим восстановлением, например методом алюмотермии Cr O + 2Al → Al O + 2Cr, а также электролизом растворов солей и др.
Физические свойства. Cr, Mo, W- парамагнитные металлы, проявляют характерные свойства (металлический блеск, электропроводны, тугоплавки, образуют различные сплавы, очень твердые например хром режет стекло) и т.д.
Химические свойства. С химической точки зрения металлы подгруппы хрома имеют пониженную химическую активность:
они устойчивы на воздухе (у них образуется прочная оксидная пленка), не реагируют с водой;
при нагревании взаимодействуют с О , галогенами, S, N , P, C, Si
идр.
в ряду Cr – Mo – W химическая активность уменьшается. Так, Cr при обычной температуре вытесняет водород из разбавленных кислот (НГал) и H SO;
под действием концентрированной HNO и H SO , хром пассивируется (образуется прочная оксидная пленка). При нагревании указанные металлы растворяются в концентрированной HNO и H SO
Применение. Металлы Cr – Mo – W находят широкое применение как в свободном виде, так и в виде сплавов. Хром в качестве покрытия других металлов для защиты от коррозии «Хромирование».
Соединения. Мо и W широко используются в производстве легированных сталей, в качестве катализаторов и др.
Для элементов подгруппы хрома известны соединения, отвечающие различным валентным состояниям. Наибольшее значение и применение находят производные шестивалентных элементов Ме(VI) и 3-х валентные хрома (они наиболее устойчивые).
Соединения Cr(II), Mo и W(II, III, IV, V) – неустойчивые легко окисляются (являются восстановителями).
323
Триоксиды: CrO , MoO , WO являются ангидридами кислот, под действием расплавов щелочей превращаются в хроматы, молибдаты, вольфраматы.
Соединения Cr(II). Большинство соединений 2-х валентного Cr неустойчивы и легко окисляются.
Водные растворы солей Cr(II) получают без доступа воздуха при растворении
Cr + 2HCl = CrCl + H ↑
полученное соединение нестойкое и реакция идет дальше
2CrCl + 2HCl → 2CrCl +H ↑
CrO, Cr(OH) проявляют слабо основные свойства, в воде не растворяются.
Cr(OH) можно получить по реакции:
CrCl + 2NaOH = Cr(OH) + 2NaCl (в отсутствие О ).
Известны комплексные соединения Cr(II): [Cr(NH ) ]Cl , K [Cr(CN) ]·3H O и др.
Соединения Cr(III). Для Cr(III) состояние является наиболее устойчивым и важным. Известно много устойчивых простых и комплексных соединений Cr(III). Соединения Cr(III) токсичны для человека и животных, но благоприятствуют росту растений.
Cr O , Cr(OH) - проявляют амфотерный характер. Cr O получают окислением Cr при нагревании, или термическом разложением гидроксидов, хроматов и дихроматов:
2Cr(OH) = Cr O + 3H O
(NH ) Cr O = N + 4H O + Cr O
Cr(OH) не растворяется в воде, выделяется при действии щелочей на соли хрома в виде синевато-серого осадка:
CrCl + 3NaOH = Cr(OH) ↓ + 3HCl
Cr(OH) проявляет амфотерные свойства, подобно гидроксиду алюминия, взаимодействует с кислотами с образованием соли Cr(III), а со щелочами с образованием хромитов:
Cr(OH) + 3HCl = CrCl + 3H O
Cr(OH) + NaOH = Na[Cr(OH) ]
Метаили ортохромиты являются солями соответствующих кислот: HCrO (метахромистая) и H CrO (ортохромистая), образуются при сплавлении оксида Cr(III) со щелочами или содой:
Cr O + 2NaOH = 2NaCrO + H O
Cr O + 6NaOH = 2Na CrO + 3H O
Если реакция взаимодействия Cr(OH) идет в избытке концентрированной щелочи, то образуется гексагидроксохроматы(III) – хромиты:
Cr(OH) + 3NaOH = Na [Cr(OH) ]
324
Если водный раствор щелочи разбавлен, то образуется тетрагидроксохроматы(III) - соли хромистой кислоты:
Cr(OH) + NaOH = Na[Cr(OH) ]
Получающиеся хромиты придают раствору изумрудно-зеленую окраску.
При сплавлении со щелочами образуется метаили ортохромиты (соли метаили ортохромистых кислот HCrO , H CrO ).
Cr(OH) при действии сильных окислителей (H O , хлорная или бромная вода и др.) в щелочной среде превращаются в хроматы, например:
2Na [Cr(OH) ] + 3Br + 4NaOH = 2Na CrO + 6NaBr + 8H O
При растворении Cr(OH) в кислотах получаются соответствующие соли Cr³ . Ионы Cr(III) склонны к образованию различных комплексов. Водные растворы солей хрома обычно имеют сине-фиолетовую окраску (вследствие гидратации иона [Cr(H O) ]³ . При нагревании таких растворов их цвет меняется вследствие образования изомерных гидратов:
[Cr(H O) ]Cl ↔ [Cr(H O) Cl]Cl ·H O ↔ [Cr(H O) Cl ]Cl· 2H O
фиолетовый светло-зелёный желто-зеленый Неодинаковое распределение молекул воды между внутренней и
внешней сферой в комплексах называется гидратной изомерией. Гидролиз. По склонности к гидролизу и образованию двойных солей
типа квасцов соединения Cr(III) похожи на соли Al: Cr³ + 2HOH ↔Cr(OH) + 2H
Или более точно [Cr(HOH) ]³ + HOH↔[Cr(OH)(HOH) ]² + H O
Таким образом, для растворенной части Cr(OH) одновременно имеют место следующие равновесия:
Cr³ + 3OH ↔Cr(OH) = H CrO ↔ HCrO + H O ↔ H + CrO + H O
При добавлении кислоты (H ) эти равновесия смещаются влево, при добавлении щелочей (ОН ) – вправо.
Сама по себе электролитическая диссоциация по кислотному и основному направлению невелика. Поэтому соли Cr(III) подвергаются в водном растворе сильно гидролизу.
Хромовые квасцы – это двойные соли Cr(III) и калия: KCr(SO ) ·12H O или эти соли сине-фиолетовые кристаллы обладают дубящем, вяжущим действием, применяются при дублении кож и в текстильном производстве.
Комплексные соединения. Известно очень много комплексных соединений Cr(III): аммиачные, аквакомплексы, гидроксокомплексы,
цианидные и др., к.ч. 6,4: [Cr(NH ) ]Cl , K [Cr(OH) ], [Cr(H O) ]³ , [Cr(Cl) ]³, K [Cr(CN) ] и др.
Соли большинства Cr³ - кристаллогидраты.
Окисление Cr³ → Cr происходит под действием сильных окислителей в щелочной среде (уже были примеры).
325
Соединения Cr(VI). Известны многочисленные соединения 6- валентного Cr в высшей с.о. Cr в них находится, в основном, в составе анионов CrO ² и Cr O ² .
Соединения 6-валентного Cr получают окислением металлического хрома или соединений 2-х и 3-валентного хрома. Они окрашены в желтый, оранжевый, красный или коричневые цвета и обладают окислительными свойствами.
Наиболее устойчивы соединения Cr(VI) – это хроматы и бихроматы (дихроматы), самые неустойчивые пероксохроматы и галогениды.
Важнейшими соединениями Cr(VI) являются CrO и соли хромовой и двухромовой кислот H CrO , H Cr O .
CrO - триоксид хрома, хромовый ангидрид темно-красное кристаллическое вещество, очень легко растворяется в воде, ядовит и является очень сильным окислителем.
Получается действием концентрированной H SO (как водоотнимающее вещество) на дихроматы или хроматы калия или натрия:
K Cr O + H SO = K SO + H O + 2CrO
При растворении CrO в воде имеют место равновесия:
2 CrO + 2H O = 2H CrO ↔H Cr O + H O
2H CrO ↔H Cr O + H O
CrO очень сильный окислитель, со многими веществами реагирует наподобие взрыва, сильно действует на органические вещества. Широко применяется для хромирования ванн, в медицине как разъедающее средство. Разбавленные растворы его используются для фиксации микроскопических препаратов.
Хромовые кислоты (H CrO , H Cr O ). При растворении в воде CrO образуются две кислоты хромовая (H CrO ) и дихромовая (H Cr O ), которые существуют только в водных растворах и при попытке их выделить из раствора распадаются на хромовый ангидрид CrO и воду, но соли их достаточно устойчивы. Соли хромовой кислоты хроматы, двухромовой – дихроматы.
Почти все хроматы имеют желтую окраску. Большинство хроматов 2-х валентных металлов нерастворимы в воде, например PbCrO , BaCrO , легко растворимы (Na CrO , K CrO ).
Большинство дихроматов имеют красно-оранжевую окраску растворимость их больше, чем соответствующих хроматов.
Хроматы и дихроматы при изменении реакции среды легко переходят друг в друга:
В кислой среде устойчивы бихроматы (их растворы имеют кислую среду, вследствие гидролиза, а хроматы переходят в бихроматы):
2K CrO + H SO = K Cr O + K SO + H O
2CrO ² + 2H = Cr O7² + H O
326
В щелочной среде устойчивы хроматы, а бихроматы переходят в хроматы:
K Cr O + 2KOH = 2K CrO + H O
Cr O ² + 2OH = 2CrO ² + H O
Таким образом, при изменении реакции среды (добавлении кислоты или щёлочи происходит изменение окраски растворов, вследствие превращения хроматов в бихроматы или наоборот).
Хроматы и бихроматы – сильные окислители и широко применяются в практике в качестве окислителей и как отбеливающее средство.
Окисление хроматами и бихроматами производится обычно в кислой среде и сопровождается резким изменением окраски (Cr → Cr³ ).
Окислительные свойства соединений Сr(VI) наиболее сильно проявляются в кислой среде, а восстановительные свойства – в щелочной среде.
Примеры:
K Cr O + 3H S + 4H SO = Cr (SO ) +3S↓ + K SO + 4H O
Бихроматы (K Cr O ) или CrO в концентрированной Н SO являются очень сильными окислителями под названием «хромовая смесь» используется для мытья (обезжиривания) лабораторной посуды.
Хроматы и бихроматы широко используются в разных химиях, прежде всего, как окислители, в качественном и количественном анализе аналитической химии, в том числе при анализе лекарственных средств в фармацевтической химии. Хромовые кислоты и их соли очень ядовиты.
Получение. Хроматы получают в щелочных растворах окислением Cr(III) с помощью сильных окислителей Cl , Br , I , NaOCl, KMnO , PbO и др.
Хлористый хромил (СrO Cl ) – красно-бурая жидкость, это хлорангидрид, с водой взаимодействует по уравнению:
CrO Cl +2HOH = H CrO +2HCl
Получение:
1) взаимодействием CrO с газообразным HCl:
CrO + 2HCl = CrO Cl + H O
2) K Cr O + 4KCl + 3H SO (конц) = 2CrO Cl + 3K SO + 3H O
Свойства: со щелочами образует хроматы
CrO Cl + 4NaOH = Na CrO + 2NaCl + 2H2O
Пероксид хрома – CrO известна только в растворах и в форме продуктов присоединения.
Образование CrO происходит с синим окрашиванием, которое получается при действии Н О на подкисленные растворы хроматов. В воде не растворяется. В свободном состоянии не существует, при распаде CrO в соли Cr(III) синяя окраска раствора постепенно сменяется на зелёную. Однако, если сразу подкисленный раствор встряхнуть с эфиром,
327
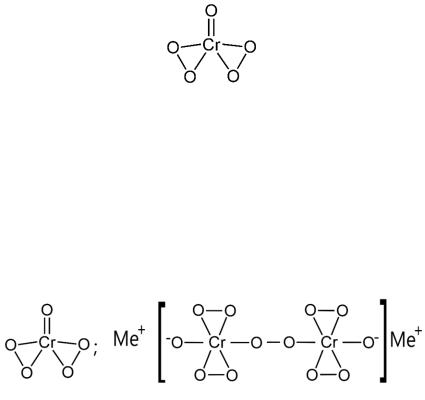
то пероксид хрома CrO переходит в эфирный слой и сохраняется там длительное время.
Структуру CrO можно представить в следующем виде:
Пероксид хрома содержит в своём составе две пероксидные группы (-О-О-) за счёт которых проявляет окислительные свойства.
Пероксохромовые кислоты или надхромовые кислоты, и их соли образуются при взаимодействии H O с подкисленными растворами хромовых и двухромовых солей.
Они отвечают составу HCrO (или H Cr O ) и H Cr O и их соли –
MeCrO , (Me CrO ).
Их структуру можно представить:
Синий пероксид |
Синие пероксохроматы (VI) |
Вводном растворе пероксохроматы неустойчивы.
Вщелочном растворе они распадаются, дают хроматы, в кислом растворе переходят в соединения Cr(III).
Металлы (Mo, W) являются полными электронными аналогами Cr, во многом имеют схожую с ним характеристику, но их соединения малочисленны и в практике встречаются мало.
Например: их оксиды MoO и WO похожи на CrO являются кислотными, мало растворимы в воде, легко растворяются в щелочах с образованием солей молибденовой кислоты (H MoO ) и вольфрамовой (H WO ), они являются окислителями, но более слабые, чем хромовые кислоты и их соли.
328
16.3.Биологическая роль
иприменение в медицине и фармации элементов и соединений подгруппы хрома
ВпобочнуюVIB подгруппу периодической системы входят 3 биогенных элемента, жизненно необходимые, незаменимые «металлы жизни» хром и молибден, а также вольфрам, который не играет (пока) большой роли в процессах жизнедеятельности и относится к потенциально токсичным элементам.
Суточная потребность организма взрослого человека (в мг) составляет: хрома 0,05 – 0,15, молибдена 0,1 – 0,3.
Ворганизмах и тканях человека хром концентрируется больше в волосах, ногтях, меньше в гипофизе, надпочечниках, поджелудочной железе, лёгких, скелетных мышцах.
Хром участвует в деятельности ферментов (например, пепсина). При недостатке хрома замедляется рост животных, сокращается их жизнь, нарушается углеводный обмен, заболевают глаза. Предполагают, что нарушение обмена хрома может привести к диабету. Установлено, что исключение хрома из рациона животных вызывает у них нарушение усвоения глюкозы – концентрация её в крови и моче повышается (симптомы сахарного диабета, причём содержание инсулина в крови остаётся нормальным). Доставка же 3-х валентного хрома в пищу животных быстро снижало концентрацию глюкозы в крови. Обследование больных сахарным диабетом показало, что часть таких больных нуждается
в3-х валентном хроме, которого не хватало в организме, и человек усваивает глюкозу хуже, чем в норме, даже после введения инсулина. Добавка же хрома в пищу в течение длительного времени нормализовало обмен глюкозы. Считается, что соединения 3-х валентного хрома является для организма безопасным. Соединения 6-валентного хрома является токсичными для человека и быстро превращаются в 3-х валентную форму. При острых отравлениях хромом необходимо срочное применение антибиотиков.
По оценкам специалистов примерно половина населения Земли испытывает дефицит хрома, потому что соединения Cr(III), даже растворимые, плохо всасываются, другая причина – рафинирование пищевых продуктов. В зерне хром содержится в основном в оболочке и зародышах, мука, особенно пшеничная высших сортов, практически лишена хрома. Дефицит хрома особенно чувствуют люди старшего возраста, поскольку хром является одним из немногих микроэлементов, содержание которых в организме с возрастом уменьшается (за исключением лёгких).
При обнаружении в организме дефицита хрома наблюдается:
329
нарушение мышечной координации, тремор конечностей;
невралгии, снижение чувствительности конечностей;
увеличение риска развития атеросклероза, ишемической болезни
сердца;
нарушение репродуктивной функции у мужчин.
При дефиците хрома в организме рекомендуется приём хромосодержащих препаратов, например пиколината.
В случае избыточного содержания хрома у человека возможны следующие негативные проявления:
аллергии, дерматиты, экземы;
невротические расстройства;
увеличение вероятности онкологических заболеваний.
Mo (молибден). В отличие от хрома и вольфрама Mo обладает рядом уникальных свойств – он стал металлом жизни.
Ворганизме взрослого человека Mo ≈ 10 мг (примерно 50% в скелете, 20% - в печени).
Долгое время роль Mo была не выяснена. Первые данные о биологической роли Mo были получены в 1930 г, было установлено, что этот микроэлемент имеет существенное значение для роста азотосодержащих бактерий. В 1936 г. стало ясно, что он необходим для всех азотосодержащих организмов и встречается во всех растительных и животных тканях. В 1939 г. была установлена потребность для высших растений, а в 1953 г. – и для животных, когда обнаружили, что фермент ксантиноксидаза является молибденсодержащим металферментом и регулирует в организме азотистый обмен ( пуриновый обмен). В результате окисления пуринов образуется мочевая кислота. Если в пище мало Mo, то фермента ксантиноксидазы образуется недостаточно и нарушается пуриновый обмен. Если Mo больше, то обмен тоже нарушается – исхудание, заболевание суставов. Ксантиноксидаза ускоряет азотистый – пуриновый обмен в организме, в результате окисления образуется мочевая кислота. Если этой кислоты слишком много, то почки не успевают выводить её их организма, тогда в суставах и мышечных сухожилиях скапливаются нерастворимые соли мочевой кислоты. Появление боли в суставах – один из признаков заболевания – подагры.
Известно большое число различных растений, в которых накапливается большое количество Mo, из них – мята перечная, крапива двудомная, пижма, хвощ полевой, донник и др.
Ворганизм млекопитающих и человека Mo поступает в основном с
пищей.
Содержание Mo в крови человека зависит от индивидуальных особенностей и географического проживания.
Уровень содержания Mo в тканях с возрастом существенно не изменяется.
330
