
книги2 / монография 4
.pdf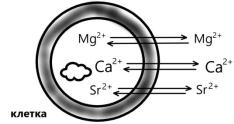
способы получения гидридов, кроме BeH2, MgH2, сводятся к нагреванию соответствующего металла в атмосфере водорода: Ca + H2 = CaH2.
Гидриды – белые кристаллические вещества, имеющие ионную кристаллическую решетку. Они представляют собой типичные соли, являются сильными восстановителями, окисляются кислородом, в воде подвергаются гидролизу:
CaH2 + 2HOH = 2H2 + Ca(OH)2
BaH2 + O2 = Ba(OH)2
Из всех гидридов применение находит CaH2 для получения водорода с целью наполнения воздушных шаров в полевых условиях.
Нитриды (Э3N2) образуются при нагревании в атмосфере азота металлов IIА группы. Это бесцветные тугоплавкие вещества, легко гидролизуются водой:
Э3N2 + 6HOH = 3Э(OH)2 + 2NH3
Карбиды – соединения металлов с углеродом: BeC2, MgC2, CaC2. Они разлагаются водой и кислотами.
Комплексные соединения. Щелочноземельным металлам не свойственно комплексообразование, но известны некоторые соли, в которых координационные числа чаще всего 4 и 6, а у Са даже 8:
[Be(NH3)4]Cl2, [Mg(NH3)6]Cl2, [Ca(H2O)6]Cl2, [Ca(NH3)8]Cl2 и т.д.
Склонность к образованию комплексных соединений падает с увеличением размера атома-комплексообразователя, то есть от Ве к Ва.
14.3. Биологическая роль s-элементов IIA –группы и применение их в медицине
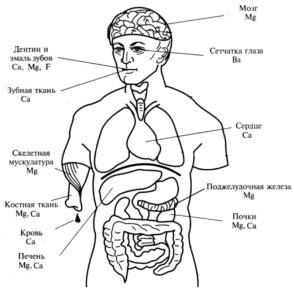
Наиболее важными среди элементов IIА-группы для живых организмов являются макроэлементы магний и кальций, и микроэлементы стронций и барий. Магний входит в состав многих ферментативных систем, а кальций является главным компонентом костной ткани. Стронций оказывает влияние на процессы в костной ткани, а барий, очевидно, играет определенную роль в функционировании органов зрения. Если о биологической роли магния и кальция многое известно, то влияние микроэлементов стронция, бария и радия на живые организмы изучено очень мало. В живых организмах эти элементы находятся в степени окисления (+2).
311
В обычных условиях бериллий образует не простые, а комплексные ионы. В ряду Be+ - Mg2+ - Са2+- Sr2+ - Ва2+ прочность комплексов с
кислородсодержащими и другими лигандами уменьшается. Способность иона Ве2+ образовывать более прочные комплексы по сравнению с ионом Mg2+ с кислородсодержащими лигандами, фторидами и другими, присутствующими в живых организмах, обусловливает токсическое действие этого катиона. Например, ион бериллия подавляет активность многих ферментов, активируемых ионом Mg в результате замещения ионов магния в его комплексах с ферментами, нуклеиновыми кислотами и другими биолигандами, содержащими фосфатные группы.
Магний и бериллий являются антагонистами, т. е. добавление одного элемента приводит к вытеснению другого. Именно поэтому при отравлении солями бериллия вводят избыток солей магния. Вследствие токсичности соединения бериллия в медицинской практике в качестве лекарственных средств не применяются. Комплексные соединения магния играют огромную роль в жизнедеятельности растительных и животных организмов.
Рис. 14.1 Топография s-элементов IIA-группы в организме человека
Так, например, ион Mg2+ является комплексообразователем в пигменте зеленых растений – хлорофилле - бионеорганическом соединении, играющем важную роль в процессе фотосинтеза.
Во внутриклеточной жидкости в которой содержится АТФ (аденозинтрифосфат ) и АДФ (аденозиндифосфат), которые содержат в качестве комплексообразователя ионы Mg2+ . Во многих ферментативных реакциях, в которых АТФ выполняет функцию донора фосфатной группы, активной формой АТФ является комплекс МgАТФ2-. Необходимо отметить, что от концентрации ионов Mg2+ зависит устойчивость рибосом.
312
Ион Mg2+ образует шестикоординационные соединения регулярной структуры в отличие от большого по размеру иона Са2+.
Кальций проявляет координационные числа 6, 7 или 8 и образует несимметричные комплексы. Возможным следствием является различная биологическая роль этих элементов в живых организмах. Способность ионов Са2+ образовывать комплексные соединения различного строения позволяет им легко «приспосабливаться» к окружающим их донорным атомам биолигандов и служить мостиками между лигандами. Очевидно, именно поэтому ион Са2+ гораздо эффективнее по сравнению с ионом магния вступает в качестве мостика между двумя лигандами во внеклеточном пространстве.
Интересно отметить, что ион Са2+ обычно бывает антагонистом иона Mg2+ в биохимических процессах. Впрочем, в этом нет ничего удивительного, поскольку физико-химические характеристики этих элементов существенно различаются (ΔЕ ионизации, различные координационные числа и т.д.). Так, ионы Са2+ подавляют активность многих ферментов, активируемых ионами Mg2+, например, аденозинтрифосфатазу.
Антагонизм ионов кальция и магния проявляется и в том, что в отличие от магния ион кальция является внеклеточным катионом. При длительном поступлении в организм избыточных количеств солей магния наблюдается усиленное выделение кальция из костной ткани и некоторых белков.
Синергизм ионов магния и кальция наблюдают в активации некоторых ферментов, однако в большинстве случаев ион Mg2+ является активатором внутриклеточных ферментов, а ион кальция - внеклеточных.
Так как кальций по физико-химическим характеристикам (радиус ионов, энергия ионизации, координационные числа) близок к стронцию и барию, то, как правило, ионы этих элементов являются синергистами иона кальция. Сходство в размерах ионов кальция и стронция приводит к наличию постоянной примеси стронция в организме.
При избытке ионов Sr2+ возникает эндемическая уровская болезнь. Это заболевание было обнаружено у населения, проживающего у реки Уровы в Восточной Сибири. Характерными особенностями болезни являются размягчение и искривление костей. Анализ почвы этой местности показал повышенное содержание в ней стронция. Вследствие этого в костной ткани происходило вытеснение ионов кальция ионами стронция, который не способен выполнять функции ионов Са2+.. Результатом этого процесса является возникновение стронциевого рахита.
Токсичны и соли бария. Механизм действия этих солей заключается в том, что ионы Ва2+, имея одинаковый радиус с ионом К+, конкурируют с ним в биохимических процессах. В результате такой взаимозамещаемости
313
возникает гипокалиемия. Ионы бария могут проникать и в костные ткани, вызывая эндемические заболевания (например, болезнь па-пинг).
Среди соединений элементов IIА-группы в качестве лекарственного средства применяют в медицине магний оксид MgO в качестве антацидного средства при повышенной кислотности желудочного сока:
MgO(т) + 2НCl (жел. сок) = MgCl2 (р) + Н2О (ж)
Магний оксид имеет преимущество перед натрий водородкарбонатом NaНСОз, так как при взаимодействии MgO с кислотой желудочного сока не происходит выделение углерода диоксида. Поэтому при действии магния оксида не наблюдается гиперсекреции. Образующийся при реакции магний хлорид, переходя в кишечник, оказывает легкий послабляющий эффект (осмотическое действие).
Смесь магний оксида MgO (85%) и магний пероксида MgО2 (15%) является препаратом, известным под названием «магний перекись». Этот препарат применяют при желудочно-кишечных расстройствах. Эффект частично связан с антацидным действием MgO, а частично - с бактерицидным действием образующегося водородпероксида Н2О2 при растворении препарата в кислом содержимом желудка:
MgO2 (т) + 2НСl (жел. сок) = Н2О2 (р) + MgCl2 (р)
Вопросы и задания для самостоятельной работы
1.Бериллий первый элемент IIА группы находится во втором периоде и по своим свойствам во многом отличается от остальных щелочноземельных металлов. Охарактеризуйте эти особенности и с чем они связаны? Обоснуйте ответы и приведите соответствующие примеры и химические реакции.
2.Бериллий и магний занимают несколько особое положение от остальных четырех элементов IIA группы. Приведите объяснения и конкретные примеры.
3.Охарактеризуйте физические и химические свойства щелочноземельных металлов в сопоставлении их с щелочными металлами. Приведите примеры и соответствующие реакции.
4. Расположите гидроксиды атомов элементов IIА группы по растворимости и усилению основных свойств и дайте объяснение этим закономерностям.
5.Приведите примеры и способы устранения временной и постоянной жесткости
воды.
6.Охарактеризуйте биологическую роль элементов IIА группы и применение соединений в медицине и фармации.
7.Соли BaSO4 и BaCO3 - это белые нерастворимые порошки. С помощью каких веществ можно различить эти вещества: а) соляная кислота; б) Na2SO4; в) K2CO3; г) NH4Cl; д) серная кислота?
8.Определите массу катионов кальция, поступающих в организм при приеме внутрь ложки раствора (10 мл), содержащего 5 г гексагидрата хлорида кальция
CaCl2∙6H2O в 100 мл.
314

Глава 15
d-Элементы (d-блок). Общая характеристика
Изучив содержание главы 15, студент должен:
знать
общую характеристику и положение d-элементов в ПСЭ Д.И. Менделеева в побочных подгруппах (I-VIII группах);
что при распределении валентных электронов на атомных орбиталях могут быть «проскоки» (провалы) электронов с одного подуровня на другой;
d-элементы обладают рядом сходных свойств в группах и периодах, где основные параметры атомов элементов изменяются незначительно по сравнению с s- и p-элементами;
большинство d-элементов проявляют слабую химическую активность;
d-элементы обладают выраженной способностью образовывать комплексные соединения с неорганическими и органическими лигандами;
d-элементы в живых организмах находятся в малых количествах и выполняют важную биологическую роль (микроэлементы);
как правило d-элементы в живых организмах находятся в низших с.о.;
d-элементы обладают способностью образовывать, как правило, координационные соединения, что очень важно для живых организмов;
в фармацевтических лабораториях, фабриках, заводах производятся многие лекарственные средства, содержащие d-элементы;
уметь
составлять уравнения химических реакций получения d-элементов и характеризовать их свойства и производных соединений;
владеть
навыками выбирать необходимые способы и реакции получения d-элементов с учетом их химической активности и проводить изучение химических свойств соединений в определенных лабораторных условиях.
К d-элементам относятся элементы побочных подгрупп (их 8) периодической системы Д.И. Менделеева.
У d-элементов в последнюю очередь в атомах заполняются электронами d-подуровни предвнешних энергетических уровней. У них общая валентная электронная конфигурация отвечает формуле (n-1)dmns2 или ns2(n-1)d1-10, которую можно представить следующим образом:
В периодической системе элементов (ПСЭ) находится 33 d-элемента (это больше, чем s-элементов и больше, чем р-элементов), и d-элементы находятся в больших периодах.
315
Если s-элементы и р-элементы в ПСЭ составляют главные подгруппы – самые длинные, где s-элементы составляют первую главную подгруппу (щелочные металлы, кроме водорода) – самые активные металлы, вторую группу – тоже активные s-металлы (кроме бериллия). То р-элементы в ПСЭ составляют главные подгруппы от IIIА–VIIIА групп, элементы разной природы: неметаллы, металлы, амфотерные металлы.
Надо отметить, что в указанных группах валентные электроны находятся на внешних энергетических уровнях и у них высшая валентность элементов соответствует номеру группы в ПСЭ.
В соответствии с порядком заполнения электронами орбиталей атомов все элементы ПСЭ разделены на соответствующие семейства или блоки: s, p, d, f. Какой валентный подуровень заполняется электронами в атоме в последнюю очередь, к такому блоку относятся элементы. Такой подход подчеркивает сходства элементов по семействам, их близость в закономерностях изменения их физико-химических свойств.
d-элементы называют ещё переходными или переходными металлами, потому что все они обладают свойствами характерными для металлов. Эти элементы называют и d-сериями или вставными декадами (по 10 элементов), которые как бы вставлены между s- и р-элементами одного периода.
Большие периоды можно рассматривать, как малые периоды, в которых включены вставочные декады (семейства) из 10 d-элементов.
15.1. Особенности d-элементов
Переходные элементы обладают некоторыми особенностями по сравнению с элементами главных подгрупп. Особенности переходных элементов определяются, прежде всего, электронным строением их атомов. На внешнем электронном уровне все они (d-элементы), как правило, содержат два s-электрона (ns2), у некоторых d-элементов содержится один s-электрон, за счет «провала» (проскока) одного s- электрона (из ns2) на d-подуровень предвнешнего уровня (n-1), вследствие близости энергии s- и d-подуровней.
Значения энергии ионизации (отрыв электрона) атомов d-элементов невысокие, что указывает на сравнительно слабую связь внешних электронов с ядром; поэтому переходные элементы в образуемых ими соединениях имеют положительную степень окисления, проявляя сходство с металлами главных подгрупп.
Кроме сходства металлов главных подгрупп (s- и p-элементы) и побочных подгрупп (d-металлы) между ними есть существенные различия. Например, вследствие незаполненности валентного d-подуровня внешнего уровня электронами, d-орбитали этого предпоследнего энергетического
316
валентного уровня могут участвовать в образовании химических связей с другими атомами, что и обуславливает переменную валентность.
Почти все элементы главных подгрупп IV–VII групп ПСЭ представляют собой неметаллы, а вот элементы побочных подгрупп (d- элементы) все металлы.
d-Элементы расположены в больших периодах непосредственно после s-элементов, а затем после d-элементов следуют р-элементы внешнего уровня. Поэтому при обсуждении свойств d-элементов следует сравнивать их свойства с s- и р-элементами, рассматривая длинные (большие) периоды целиком.
У свободных атомов электроны d-подуровня никогда не являются внешними электронами. Они заполняются электронами лишь после заполнения s-подуровня внешнего уровня, а затем заполняются электронами d-подуровни предвнешнего уровня ns2(n-1)d1-10.
Важным свойством d-элементов является переменная валентность и разнообразие степени окисления. Эта особенность связана, главным образом, с незавершенностью предвнешнего d-электронного уровня (кроме элементов IВ и IIВгрупп).
Впериодах с увеличением заряда ядра наблюдается уменьшение устойчивости соединений d-элементов в высших степенях окисления. Параллельно возрастают окислительно-восстановительные свойства этих соединений. Наибольшая окислительная способность наблюдается у феррат-ионов, перманганат-ионов.
С увеличением устойчивости соединений в группах d-элементов сверху вниз одновременно уменьшаются их окислительные свойства.
Необходимо отметить высокие комплексообразующие способности d-элементов, которые обычно значительно больше, чем у s- и р-элементов. Это объясняется возможностями d-элементов быть как донорами, так и акцепторами электронов, участвующих в образовании координационных соединений.
Более 1/3 всех микроэлементов в организме составляют d-элементы.
Ворганизме они существуют в виде комплексных соединений или гидратированных ионов. Поэтому можно говорить, что «свободные» ионы металлов в организмах не существуют: это либо их гидраты, либо продукты гидролиза, или комплексные частицы.
Вбиохимических реакциях d-элементы наиболее часто проявляют себя как металлы-комплексообразователи. Лигандами выступают биологически активные вещества, аминокислоты, белки, нуклеиновые кислоты и др.
Однотипность внешних электронных структур атомов обуславливает общность очень многих свойства переходных элементов (d-элементы):
317
в свободном состоянии это типичные металлы, их плотно упакованные кристаллические решетки имеют, как правило, большие плотности (малые атомные объемы);
они плавятся при высокой температуре и характеризуются высокими значениями теплот испарения. Практически все они (кроме ртути) твердые, прочные, обладают высокой тепло- и электропроводностью. Только скандий, иттрий, титан относятся к тяжелым металлам;
все они образуют сплавы между собой и с другими металлами;
атомы переходных элементов (за немногим исключением Zn, Cd)
проявляет переменную валентность;
у переходных элементов сильно выражена способность к образованию комплексных соединений;
большинство соединений переходных элементов окрашены;
наличие частично заполненных электронных оболочек электронами обуславливает способность переходных элементов образовывать
соединения с парамагнитными свойствами;
их максимально возможная степень окисления, за некоторым исключением, равна номеру группы. К исключениям относятся d-
элементы 1-ой группы и большинство d-элементов 8-ой группы;
Так Cu, Ag, Au (d-элементы 1-ой группы) могут проявлять степень окисления (+1), но и (+2, +3).
Из элементов VIII группы только Ru и Os проявляют высшую степень окисления (+8), у всех остальных она меньше. RuO4, OsO4, OsF8.
Химические свойства соединений d-элементов могут изменяться от основных к амфотерным до кислотных, например:
Mn(OH)2 – основной; Mn(OH)4 – амфотерный; H2MnO4, HMnO4 –
кислоты.
Они не дают ковалентных и ионных гидридов, а образуют гидриды внедрения (то же самое происходит и с карбидами, нитридами, боридами).
Наряду с отмеченной общностью в свойствах переходных элементов можно указать на некоторые их различия:
атомные и ионные радиусы d-элементов в периодах слева направо уменьшаются медленно, а потенциалы ионизации увеличиваются;
атомные и ионные радиусы в группах сверху вниз увеличиваются, но
в меньшей мере по сравнению с s- и р-элементами.
Свойства переходных элементов изменяются не в строгом соответствии с изменением атомного номера, как это имеет место в главных подгруппах.
318
Если в пределах одного периода у элементов главных подгрупп, то есть у s- и р-элементов с возрастанием их порядкового номера возрастает количество электронов на внешнем электронном слое, что приводит к довольно быстрому (резкому) переходу от типичных металлов к типичным неметаллам. То у переходных элементов такое не происходит, у них с возрастанием порядкового номера не происходит существенного изменения структуры внешнего электронного слоя (так как происходит застройка электронами предвнешнего уровня), поэтому химические свойства этих элементов изменяются в периоде, хотя и закономерно, но гораздо менее резко и заметно на свойствах, чем у элементов главных подгрупп.
Для d-элементов характерно образование разнообразных комплексных соединений, например: K3[Fe(CN)6], K2[HgI4], Na2[Zn(OH)4] и др.
В процессе биологической эволюции природа отбирала соединения металлов в таких степенях окисления, в которых они более безопасны, не являются ни сильными окислителями, ни сильными восстановителями, поэтому нахождение d-элементов в высших степенях окисления в организмах маловероятно. Нахождение их в низших степенях окисления более вероятно, так как у них большая устойчивость и меньше
токсичность. Поэтому нахождение катионов в низших степенях окисления в биологических средах оправдано: Ag+, Cu2+, Mn2+, Co2+, Fe2+ и др.
Катионы d-элементов с биологическими лигандами образуют, например, макрокомплексы: гемоглобин – содержат железо, витамин В12 (цианокобаламин) содержит кобальт и т.д. d-Элементы Zn, Cu, Fe, Mn, Co, Mo (относят к металлам жизни) входят в состав многих металлоферментов.
Весьма характерна биологическая роль переходных металлов, если некоторые элементы главных подгрупп содержатся в организмах в больших количествах (С, H, O, N, P, K, Ca и др.), то d-элементы, как правило, присутствуют в организмах в очень малых количествах (микроэлементы), но выполняют в организмах жизненно важные функции.
Ряд соединений d-элементов в повышенных концентрациях оказывают токсические действия на живые организмы (Cd, Hg, V, Ag, Ni), так как образуют с белками нерастворимые соединения – происходит денатурация белков.
Создано много лекарственных препаратов, содержащих d-элементы, об этом будет сказано отдельно при рассмотрении содержания в каждой побочной подгруппе элементов ПСЭ.
319
Вопросы и задания для самостоятельной работы
1.В периодической системе Д.И. Менделеева имеется восемь групп элементов, из них восемь побочных подгрупп d-элементов, у которых валентные
электроны заполняются на предвнешних энергетических уровнях в соответствии с формулой [n-1]dmns2 или ns2[n-1]d1-10. Тогда как в s- и p-элементах главных подгрупп валентные электроны находятся на внешних энергетических уровнях.
Покажите и объясните на конкретных примерах как происходит заполнение валентных электронов у d-элементов побочных подгрупп.
2.Однотипность заполнения валентными электронами d-элементов предвнешних энергетических уровней обуславливает большое сходство общих закономерностей изменения основных параметров и свойств атомов элементов в группах сверху вниз (радиус атомов и ионов, энергия ионизации, электроотрицательность и так далее) и имеются различия. Покажите и объясните это на примерах.
3.Особенности d-элементов или переходных элементов прежде всего связано с электронным строением атомов:
• на внешнем энергетическом уровне атомы d-элементов, как правило, содержат два s-электрона [ns2] или один s-электрон, за счёт «провала» (проскока) электрона;
• у d-элементов невысокие энергии ионизации;
• все d-элементы – это металлы, у них, как правило, переменная валентность и разные степени окисления;
• высокая способность образовывать комплексные соединения;
• атомные и ионные радиусы d-элементов в периодах слева направо уменьшаются медленно, в группах сверху вниз увеличиваются меньше, чем у s- и p- элементов;
• весьма характерна биологическая роль d-элементов для живых организмов, они, как правило, содержатся в организмах в микроколичествах (микроэлементы) и в низших степенях окисления, так как менее токсичны и безопасны и выполняют в организмах жизненно важные функции.
На приведённые примеры приведите конкретные подтверждения и функциональные зависимости.
Впоследующих главах будут представлены и изложены материалы по химии для каждой группы d-элементов.
320
