
книги2 / монография 4
.pdf
У какого элемента э.о. меньше, тот будет иметь знак плюс (+), у какого больше – минус (-). В каждом случае можно подсчитать с.о.
элемента.
Na+1H2+1P x O2-2 - натрия гипофосфит, с.о. фосфора = ?,
+1 + 2 – 4 + х = 0; х = +1;
(Cr2xO7)2-, с.о.(Cr) =?, |
|
|
2x - 14= -2; |
2x = 12; |
x = +6. |
Замечание: с.о. и валентность не |
тождественны. С.о. принято |
|
обозначать арабскими цифрами над элементом: KMn+7O4 или Mn (VΙΙ). Чтобы связь была ионной, надо, чтобы разность о.э.о. была 2-3, если
она меньше, то связь имеет ковалентный характер.
Следует снова подчеркнуть, что с.о. не имеет реального физического смысла, но ею удобно пользоваться при определении окислительновосстановительных коэффициентов.
Степень окисления часто не совпадает ни с реальным эффективным зарядом элемента, ни со структурной валентностью, см. примеры ниже.
Вещество |
CrCl2 |
CrCl3 |
K2Cr2O7 |
KMnO4 |
H2S |
H |
Cl |
с.о. |
+2 |
+3 |
+6 |
+7 |
-2 |
+1 |
-1 |
Реальный |
+1,9 |
+1,2 |
+0,1 |
+0,3 |
-1,0 |
+0,2 |
-0,2 |
заряд |
|
|
|
|
|
|
|
Характер |
почти |
между |
ковалентная |
ковалентная |
ковалентная |
ковалентная |
|
связи |
ионная |
ионной и |
|
|
|
|
|
|
ковалентной |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Из приведенных данных видно, что с.о. растет, а эффективный заряд уменьшается.
Рассмотрим следующие примеры: N2, NH3, NH2OH, N2H4 1) N N, валентность N = 3, с.о. = 0
2) |
валентность N = 3, с.о. = -3 |
3) |
валентность N = 3, с.о. = -2 |
4) |
валентность N = 3, с.о. = -1. |
Вывод: валентность азота одинаковая равна (3), а степень окисления разная.
Примечание: для определения с.о. атома не всегда обязательно изображать графически структурную формулу молекулы.
141
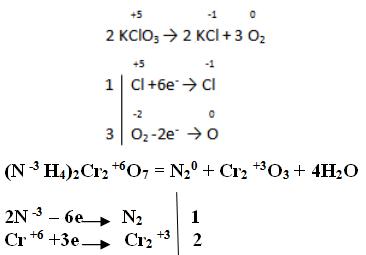
7.2. Классификация химических реакций. Окислительно-восстановительная двойственность атомов элементов
Существующие химические реакции можно разделить на 2 группы: реакции протекающие без изменения степени окисления (обменные, разложения, нейтрализации и др.) и вторая группа ОВР, которые продолжим рассматривать.
Известно большое число самых различных ОВР. Некоторые типы из них мы рассмотрим.
1. Межмолекулярные (межионные) ОВР.
В этих реакциях электроактивные частицы имеют различную химическую природу и находятся в разных веществах (в разных молекулах или ионах). К этому типу относятся большинство ОВР, в том числе уже ранее рассмотренные.
2KBr + Cl2 = Br2 + 2KCl
2. Реакции внутримолекулярного окисления-восстановления В них окислитель и восстановитель находятся в одной и той же
молекуле. Здесь одна составная часть молекул выполняет роль окислителя, а другая часть функцию восстановителя. К ним относятся большинство реакций разложения сложных веществ на простые вещества:
2HgO = 2Hg + O2
3. Реакции диспропорционирования (или самоокислениясамовосстановления).
В таких реакциях роль окислителя и восстановителя выполняют атомы одного и того же элемента, находящиеся в одной и той же степени окисления.
142

При затруднении в подборе стехиометрических коэффициентов в подобных случаях реакцию рассматривают справа налево (как бы в обратном направлении), суммируют коэффициенты и выставляют общий коэффициент в левой части.
Механизм окислительно-восстановительных процессов
Этот механизм понимают как совокупность стадий, из которых складывается ОВР. Много ОВР протекают через ряд последовательных стадий и являются более сложными.
Механизм ОВР зависит от многих факторов:
природа реагирующих веществ, в том числе и растворителя;
концентрация окислителя и восстановителя;
возможное влияние катализатора;
температуры;
pH среды;
окислительно-восстановительная активность реагентов.
ОВР может протекать как с переносом электронов, так и с переносом атомов, например:
143

Окислительно-восстановительная двойственность атомов элементов
Это означает, что при наличии у атомов элементов способности проявить переменные степени окисления, можно рассматривать их крайние и промежуточные состояния окисления. Например, азот может иметь крайние состояния окисления (-3) в аммиаке, аммониевых солях и нитридах металлов, а также (+5) в азотной кислоте, ее солях и производных. Такие же примеры для соединений марганца:
Атомы в молекулах, отвечающие крайним состояниям окисления могут проявлять только свойства либо отдавать, либо присоединять электроны. Азот в аммиаке и нитридах металлов (-3) может только отдавать электроны и не может больше присоединять.
144

В азотной кислоте и ее солях азот достигает максимального положительного состояния окисления и не может больше отдавать электроны:
Если простое вещество или атомы элементов в сложном веществе находятся в промежуточном состоянии окисления, то так же атомы могут вести себя двояко: или принимать, или отдавать электроны. Это зависит от природы (активности) элемента-партнера по реакции, от реакции среды, в которой протекает реакция.
Окислительно-восстановительные свойства атомов элементов зависят от их положения в периодической системе элементов, т.е. от строения их атомов, от их способности отдавать и принимать электроны. Эта способность определяется такими величинами, как ионизационный потенциал, сродство к электрону.
Рассмотрим несколько примеров способности атомов (ионов) проявлять окислительно-восстановительные свойства:
Sо – может отдавать и присоединять электроны; S-2- может только отдавать электроны;
S+6 – может только принимать электроны.
Ионы Cl-, Br-, I- не могут быть окислителями, т.к. имеют заполненный внешний энергетический уровень.
Металлы (Na+, Ca+2), Cl+7 не могут отдавать, а могут только принимать электроны.
Важнейшие окислители и восстановители
Как было отмечено, это свойство различных веществ зависит от строения атомов и условий протекания реакции.
Окислители – это вещества, способные принимать электроны. К ним относятся:
галогены: F, Cl, Br, I;
кислород;
кислородсодержащие кислоты, соли и др (HNO3, H2SO4, K2CrO4,
KMnO4, K2MnO4, Na2Сr2O7, NaClO, KClO3, H2O2 и др.).
Восстановители – это вещества, способные отдавать электроны. К ним относятся:
металлы;
145

кислородсодержащие кислоты и их соли в низших степенях окисления элементов (HNO2, H2SO3, Na2S2O3, H2S, Na2S, H2O2 и др.);
отрицательно заряженные ионы неметаллов;
катионы металлов в низшей степени окисления.
Пероксид водорода H2O2 в зависимости от условий проведения реакции может выступать как окислителем, так и восстановителем. В молекуле H2O2 атомы кислорода связаны друг с другом одной ковалентной связью, и каждый атом кислорода имеет с водородом по одной полярной связи, поэтому степень окисления кислорода (-1).
7.3. Составление уравнений ОВ реакций
Уравнения ОВР часто бывают сложными и практически трудно расставить коэффициенты простым подбором, поэтому используют разные подходы и методы.
Метод электронного баланса
Рекомендуется придерживаться следующего порядка (последовательности):
записывают схему реакции с указанием исходных веществ и продуктов реакции:
+7 |
+4 |
+2 |
+6 |
2 KMnO4 + 5 Na2SO3 + 3 H2SO4 →2 MnSO4 + 5 Na2SO4 + 3 H2O
146

отмечают степени окисления элементов, изменяющих ее в процессе реакции;
составляют электронные схемы перемещения электронов, при этом указывая число электронов, отдаваемых восстановителем, и число электронов, принятых окислителем. Находят коэффициенты при окислителе и восстановителе, определяют электронный баланс:
Баланс составляет 10 электронов. Окислитель принимает 10 электронов, восстановитель отдает 10 электронов.
найденные коэффициенты при окислителе и восстановителе подставляются в схему реакции слева и справа.
подставляют коэффициенты для остальных веществ в реакции, при этом добавляют столько молекул вещества среды, сколько необходимо для связывания всех остальных частей в реакции. При этом следует учитывать, что в водных растворах в реакциях
могут участвовать молекулы H2O, ионы Н+ или ОН-.
Иногда в состав молекулы окислителя или восстановителя могут входить несколько атомов одного или разных элементов. В таком случае подсчитывают общее число отдаваемых или принимаемых электронов. Например:
Во многих ОВР окислитель и восстановитель выполняют и другую функцию – расходуются на образование солей (без изменения с.о.). Чаще всего это характерно для кислот, реже для оснований, например:
0 |
+5 |
+2 |
+2 |
3Cu + 8HNO → 3 Cu(NO ) +3 NO + 4H O |
|||
-2e |
+3e |
|
|
Две молекулы НNO окисляют 3 атома меди, а 6 молекул НNO дополнительно расходуются для образования 3-х молекул меди нитрата. В данной реакции электронный баланс составляет 6 электронов (медь отдает 6 электронов, а азот принимает 6 электронов).
В практике ОВР при нахождении коэффициентов для ускорения работы можно не составлять схему электронного баланса, а можно непосредственно под атомами элементов прямо написать, сколько один элемент принимает электронов, а другой сколько их отдаёт. Это ускоряет
147
процедуру и показано выше в примере реакции меди с азотной кислотой. По мере появления опыта число промежуточных уравнений может быть уменьшено и весь процесс может быть написан в виде одного уравнения.
Ионно-электронный метод (метод полуреакций)
Недостатки метода электронного баланса:
в нем формально и гипотетически указываются заряды ионов, которых в растворах нет: Mn (в перманганате MnO ), S ( в сульфате
SO ²), O ( в пероксиде H O ), Cl (ClO );
в ОВР могут участвовать компоненты среды (HOH, H , OH ) и вносить свой вклад в электронный баланс, и он здесь не учитывается;
такой подход в основном может отражать ОВР, протекающие в газовой и твердой фазе.
Многие ОВР протекают с участием молекул или ионов среды – это составляет основное отличие другого метода полуреакций.
Известно, что многие окислители и восстановители проявляют свои свойства в зависимости от реакции среды (рН): кислой, щелочной и нейтральной. Полнота, направление и скорость таких реакций часто зависит от реакции среды. И ионно-электронный метод рассматривает ОВР, как единый процесс идущий с участием не только веществ
окислителей и восстановителей, но и с участием среды (молекул НОН, ионов Н+ и ОН-).
При составлении ОВР с помощью ионно-электронного метода необходимо обратить внимание, что алгебраическая сумма зарядов частиц
вобоих частях каждого уравнения должна быть одинаковой.
Если полученное вещество содержит больше кислорода, чем исходное, то в кислых и нейтральных растворах расходуется вода, а в щелочной среде - ионы ОН-.
Если образовавшееся вещество содержит меньше кислорода, чем до реакции, то в кислой среде образуется молекула воды, а в нейтральной и щелочной – ионы ОН-.
Вода является очень слабым электролитом и может участвовать в ОВР (практически в виде молекул):
2Н О + 2е = Н + 2ОН (восстановление) 2Н О – 4е = О + 4Н (окисление)
При составлении уравнений ионно-электронным методом надо руководствоваться уже указанными правилами:
1)записывают уравнение, электролиты в виде ионов, а неэлектролиты слабые электролиты, газы и осадки в виде молекул. Ионы, не изменяющиеся в результате реакций в ионную схему, не включаются;
2)электронно-ионные уравнения составляются отдельно для процесса окисления и процесса восстановления;
148

3)находят суммарный заряд всех частиц слева и справа и определяют электронный баланс и соответственно коэффициенты;
4)проверяют правильность итогового уравнения ОВР. Рассмотрим несколько примеров таких реакций.
1. Окисление перманганатом сульфита в кислой среде:
2КMnO + 5Na SO3 + 3H SO = 2MnSO + 5Na SO + K SO + 3H O
2 |
MnO + 8H ᵉ |
Mn² + 4H O |
|
+7 общий заряд |
+2 общий заряд |
5 |
SO ² +HOH ²ᵉ |
SO ² + 2H |
|
-2 общий заряд |
0 общий заряд |
2MnO4 + 5SO ² + 6H = 2Mn² + 5SO ² + 3H O
|
2. |
Окисление перманганатом сульфита в щелочной среде: |
|||||
2КMnO + Na SO3 + 2КOH = 2К MnO + Na SO + H O |
|||||||
2 |
|
|
MnO + ᵉ |
MnO ² |
|||
|
|
||||||
|
|
|
|
-1 |
-2 |
|
|
1 |
|
|
|
SO ² + 2OH ²ᵉ |
SO ² + H O |
||
|
|
|
|
-4 |
|
-2 |
|
|
|
|
|
|
|||
2MnO + SO ² + 2OH = 2MnO ² + SO ² + H O |
|||||||
|
3. |
Окисление перманганатом сульфита в нейтральной среде: |
|||||
2 КMnO + 3Na SO3 + H O = 2MnO + 3Na SO + 2KOH |
|||||||
2 |
|
|
|
MnO + 2H O |
³ᵉ MnO + 4OH |
||
|
|
|
|||||
|
|
|
|
-1 |
|
-4 |
|
3 |
|
|
|
SO ² + H O ²ᵉ |
SO ² + 2H |
||
|
|
|
|
|
|
||
|
-2 |
|
0 |
|
|||
2MnO +3 SO ² + H O = 2MnO + 3SO ² + 2OH
4.2КMnO + 5Na C O + 8H SO = 2MnSO + 10CO + 5Na SO + K SO + 8H O
5 C O ² ²ᵉ 2CO
2 MnO + 8H ᵉ Mn²+ + 4H O
149

|
5.SnS + 2KMnO + 5HNO = 2Mn(NO ) + H SnO + KHSO + KNO + |
H O |
|
1 |
SnS + 7H O 10ᵉ H SnO + HSO + 11H |
2 MnO + 8H ᵉ Mn² + 4H O
SnS + 2MnO + 5 H = 2 Mn² + H SnO + HSO + H O
Влияние среды на характер протекания реакции
Будет ли данное химическое соединение проявлять окислительные или восстановительные свойства часто зависит от рН среды. В зависимости от рН среды может меняться характер протекания ОВР между одними и теми же веществами. Это было показано на примерах взаимодействия калия перманганата и натрия сульфита в кислой, щелочной и нейтральной средах.
Для создания кислой среды обычно пользуются разбавленной серной кислотой, так как азотная кислота проявляет окислительные свойства, а хлороводородная кислота проявляет восстановительные свойства. Для создания щелочной среды пользуются растворами NaOH или KOH.
На течение процессов может оказывать влияние не только рН среды, но и концентрация. Например, реакция диспропорционирования хлора в щелочном растворе в зависимости от условий протекает по-разному:
при нагревании в концентрированном растворе:
3Cl2 + 6NaOH = NaClO3 + 5NaCl + 3H2O
ив холодном разбавленном растворе: Cl2 + 2NaOH = NaClO + NaCl + H2O
7.4.Возможность и направление протекания ОВР
Если взаимодействует сильный окислитель с сильным восстановителем, то протекает односторонний процесс слева направо и практически до конца. При малом различии окислительновосстановительной активности исходных веществ и продуктов реакции процесс является двусторонним.
Для количественной оценки возможности и направления протекания реакции можно определить по значению энергии Гиббса, если она меньше нуля (∆G<0), то реакция может протекать в прямом направлении (это мы уже рассматривали).
Кроме этого, для количественной характеристики окислительновосстановительной активности веществ, находящихся в растворах или
150
