
книги2 / монография 4
.pdfАктивность иона (α) равно его концентрации (с), умноженная на коэффициент активности.
α = с×f
Активность электролита для сильно разбавленных растворов равна его истинной концентрации (с): α = с. Для остальных растворов активная концентрация меньше (α < с).
Коэффициент активности (f) характеризует отличие сильных электролитов и вообще реальных растворов от идеальных.
Коэффициент активности отражает все явления в данной системе
раствора, которые вызывают изменения подвижных ионов:
f c
Для сильно разбавленных растворов, где силы взаимодействия между ионами ничтожно малы из-за отдаленности ионов друг от друга f = 1 и = с. Для реальных растворов коэффициент активности обычно меньше единицы (f < 1).
Коэффициент активности зависит от: природы электролита, концентрации, температуры.
Ионная сила раствора (I) – величина, характеризующая силу электростатического взаимодействия всех ионов в растворе.
Она равна полусумме произведений молярной концентрации (с) каждого иона на квадрат его заряда (Z):
I = 1/2 CZ2
Если раствор содержит ионы трех видов, концентрации которых С1, С2, С3, а заряды Z1, Z2, Z3, то ионная сила выражается:
I = 1/2 (С1Z12 + C2 Z22 + C3Z32)
Чем больше ионная сила раствора, меньше коэффициент активности и меньше активность ионов.
Коэффициент активности ионов в растворах данной концентрации находится в справочных таблицах.
Скорость и направление протекания химических реакций сильно зависит от концентрации электролитов.
В биологических жидкостях и тканях содержится много разных электролитов: NaCl, KCl, CaCl2, NaH2PO4 и др. Их физико-химические свойства можно правильно оценивать только с учетом изложенных закономерностей. Например: при выполнении ряда биохимических, физиологических исследований, при проведении опытов на изолированных органах и тканях необходимо учитывать ионную силу жидкостей, уметь рассчитывать и готовить растворы электролитов с необходимой ионной силой растворов.
121
Ионная сила большинства биологических жидкостей равна (0,15). Ионная сила физиологического (изотонического) раствора, который
широко готовится и используется в медицине, 0,9% NaCl – его ионная сила = 0,15. NaCl 0,9% его молярная концентрация 0,15М. Рассчитаем
ионную силу:
I = ½ (CNa+ · Z2Na+ + CCl- ·Z2Cl-) = ½ (0,15·12 + 0,15·(-1)2) = 0,15
Ионная сила биологических жидкостей (систем) содержит много разных ионов электролитов, которые влияют не только на химическую активность ионов, но и на биологическую функцию белков, аминокислот и т.д., но и влияют на распределение молекул воды в органах, тканях и межклеточной жидкости.
В природе главные процессы происходят в растворах, водных растворах электролитов и неэлектролитов. Для всех живых систем, растений, микроорганизмов, животных и человека жизнь зарождается и продолжается в водной среде. Как эти процессы обеспечиваются питательными и другими веществами, так и жизнедеятельность продолжается. Это интересно и поучительно.
Вопросы и задания для самостоятельной работы
1.Приведите примеры слабых и сильных электролитов, напишите уравнения электролитической диссоциации для слабых и сильных электролитов в водной среде, укажите, какое влияние оказывают молекулы воды в процессе диссоциации веществ.
2.Процесс диссоциации слабых электролитов обратимый, укажите как влияют различные факторы на смещение равновесия, процесса диссоциации и почему?
3.Что называется степенью диссоциации и константой диссоциации? Приведите конкретные примеры ступенчатой диссоциации слабых электролитов и как изменяются значения константы диссоциации для каждой ступени и почему?
4.Дайте объяснения как изменяется степень диссоциации и константа диссоциации при изменении концентрации водных растворов слабых электролитов и почему?
5.Дайте объяснения, почему в случае растворов сильных электролитов используют понятия: «кажущаяся степень диссоциации», «эффективная концентрация ионов», «активность ионов»?
6.Объясните, ионная сила какого раствора больше при одинаковой молярной концентрации: калия фосфата, калия сульфата, калия нитрата?
7.Как могут диссоциировать в воде вещества с ионной связью, полярной и неполярной ковалентной связью. Покажите на примерах и обоснуйте механизм процесса.
8.Приведите уравнение для расчёта ионной силы электролитов. Дайте объяснение почему экспериментально (по электропроводности растворов электролитов) получают результаты не истинные, а «кажущиеся», т.е. при дальнейших расчётах получают численные результаты не истинные, а «кажущиеся», т.е. «кажущаяся степень диссоциации» и др.?
9.Приведите формулу, которая связывает изотонический коэффициент и степень диссоциации и покажите их расчёты для конкретных электролитов.
122
10. Как проявляется кислотно-основной характер диссоциации (ионизации) гидроксидов в зависимости от положения элементов в ПСЭ? Приведите примеры.
11. Расположите в последовательности увеличения осмотического давления водных растворов одинаковой молярности следующих веществ: хлороводород, калия хлорид, кальция хлорид, глюкоза, уксусная кислота и приведите объяснения.
12. Что такое амфолиты? Приведите примеры протолитических реакций с участием некоторых перечисленных молекул и ионов: Η20, Η30+, ΟH-, NH4+, NH3, CH3COO-, H3PO4, H2PO4- .
13.Что такое активная, потенциальная и общая кислотность? Покажите на
примерах.
14.Концентрация ионов [OH-]в растворе равна 6,5∙10-4 моль/л. Вычислите pH этого раствора.
15.Содержания соляной кислоты в желудочном соке человека составляет 0,4-0,5%. Рассчитайте примерную величину pH желудочного сока, приняв его плотность за 1г/мл.
16.Свежая дистиллированная вода имеет pH=7. Почему при стоянии на воздухе pH воды постепенно понижается?
123

Глава 6
Гетерогенные и ионные равновесия
Изучив содержание главы 6, студент должен:
знать
сущность гетерогенного равновесия, растворимость малорастворимых электролитов, константу растворимости (КS);
условия образования и растворения осадков;
гетерогенные равновесия в жизнедеятельности организмов (камнеобразование
вотдельных органах и др.);
реакции осаждения в аналитической практике (аргентометрия и др.);
сущность протолитических реакций (ионизации, нейтрализации, гидролиза);
сущность реакций гидролиза, гидролиз солей разного состава, его механизм и зависимость этого процесса от разных факторов;
степень и константу гидролиза солей, их применение при расчетах и установлении рН среды;
роль реакций гидролиза в природе и различных процессах в водной среде;
сущность обменных реакций в водных растворах, их направление в зависимости от природы веществ, их концентрации и др.;
роль ионных типов реакции, в том числе кислотно-основных взаимодействий при метаболизме лекарств, в анализе лекарственных препаратов, при приготовлении лекарственных смесей, химической совместимости и несовместимости лекарственных веществ;
уметь
писать реакции образования и растворения осадков, протолитические реакции, реакции гидролиза и другие обменные реакции в водной среде;
определять изменение направления смещения химического равновесия разного типа реакций в водной среде;
владеть
техникой составления разного типа химических реакций в растворах в молекулярной и ионно-молекулярной формах.
6.1. Растворение малорастворимых электролитов
Известно, что абсолютно нерастворимых веществ в природе нет. Растворимость твердых веществ колеблется в широких пределах. В практике часто приходится иметь дело с трудно растворимыми веществами и поэтому надо знать их способность и степень растворимости
(AgCl, BaSO4, CaCO3, Ca3(PO4)2) и др.
Рассмотрим растворение AgCl в воде. Это вещество частично растворяется в воде и устанавливается гетерогенное равновесие между осадком и ионами вещества в растворе. Применяя к этому гетерогенному равновесию закон действующих масс и учитывая, что твердая фаза не включается в выражение константы равновесия, получаем:
124
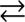
Растворение
AgCl |
|
Ag+ + Cl - |
Осадок кристаллизация
К[AgCl] = [Ag+][Cl-] = конст. = ПРAgCl = Кs = 1,5×10-10 моль/л.
Всистеме устанавливаются гетерогенное равновесие между осадком
иего ионами в растворе.
Таким образом, произведение концентраций ионов в растворе труднорастворимого электролита над осадком, называют произведением растворимости (ПР) или константой растворимости (Кs) труднорастворимого электролита.
Произведение растворимости в моль/л (такие данные находятся в справочниках):
|
AgBr = 5,0·10-13 |
КS |
AgI = 9,3·10-16 |
|
Ag2S = 1,0·10-50 |
|
BaSO4 = 1,4·10-9 |
|
CaCO3 = 4,5·10-9 |
Условия образования и растворения осадков: из правила ПР вытекает
2следствия:
1)если произведение концентрации ионов не достигает величины ПР, то осадок не образуется;
2)если произведение концентрации ионов становится больше ПР, то
выпадает осадок.
В ненасыщенном растворе [Ag+]·[Cl-] < ПР < KS (осадок может растворяться).
В насыщенном растворе [Ag+]·[Cl-] = ПР = KS (равновесие между осадком и раствором).
В перенасыщенном растворе [Ag+]·[Cl-] > ПР > KS (выпадение осадка).
Таким образом, (ПР и КS) характеризуют растворимость трудно - растворимых электролитов.
Гетерогенные равновесия имеют место в жизнедеятельности организмов. В организме человека при избытке или недостатке анионов и катионов могут образоваться или растворяться трудно растворимые электролиты в виде осадков, «камнеобразования» в разных органах.
Реакции осаждения, т.е. образования труднорастворимых осадков находят применение в аналитической химии и количественном анализе фармацевтических препаратов. Например, метод аргентометрии основан
125
на реакциях осаждения нитратом серебра галогенов при их определении в биологических жидкостях.
Образование нерастворимых соединений начинается в плазме крови, где есть ионы: карбонаты, фосфаты, кальций и др., примеры ПР:
Ca3(PO4)2 = 2,0·10-29
Ca(H2PO4)2 = 1,0·10-3
CaHPO4 = 2,7·10-7
CaC2O4 = 2,3·10-9
Основными минеральными компонентами костной ткани являются Ca5(PO4)3OH (KS = 1,6·10-58), а также некоторое количество фосфата кальция Ca3(PO4)2, которые образуют наиболее прочную костную ткань.
При нарушении равновесия концентрации указанных ионов в организме, а также при изменении рН или при появлении конкурентных ионов в крови (например, Sr2+) может происходить избыточное образование осадков (камнеобразование), или, наоборот, (при недостатке) их растворение, вымывание их из костной ткани – различные заболевания «рахит» и др.
6.2. Протолитические реакции. Гидролиз
Протолиты – вещества, способные принимать или отдавать протоны H+. Реакции, протекающие между протолитами, называют протолитическими. Их разделяют на три вида:
реакции ионизации;
реакции нейтрализации;
реакции гидролиза.
Реакции ионизации – это реакции распада электролитов на ионы. По Аррениусу:
CH3COOH CH3COO- + H+,
но этот процесс происходит под действием растворителя, как показано ранее при электролитической диссоциации:
СH3COOH + HOH CH3COO- + H3O+
кислота основание основание кислота
В этом уравнении кислота отдает протоны, основание (НОН) принимает протоны, затем вещества превращаются в сопряженные: кислоту и основание. В этом случае реакция является протолитической.
Реакции нейтрализации – это реакции, протекающие между кислотой и основанием с образованием воды.
1.По Аррениусу:
KOH + HCl = KCl + HOH,
OH- + H+= H2O;
но этот процесс происходит с водными растворами кислот и оснований:
126
2. H+(HOH) + OH-(HOH) = H3O+ + OH- |
||
кислота |
основание |
сопр. к-та сопр. осн. |
В таком случае образуются новые сопряженные кислота и основание. |
||
Например: |
HCl + NH3 = NH4Cl |
|
|
кислота ос-ние |
соль |
По теории Аррениуса аммиак не содержит группу (OH-), но проявляет основные свойства. По протолитической теории аммиак
проявляет основные свойства и присоединяет протон Н+:
NH3 + H+ = NH4+
основание кислота
Тогда NH3 + HOH = NH4+ + OН-
основание кислота сопр.к-та. сопр.осн.
В таких случаях видно – почему такие реакции являются
протолитическими реакциями кислотно-основного взаимодействия, как показывает другой пример:
HF + BF3 = HBF4
BF3 + HOH = HBF3+ + OH-
основание кислота сопр. к-та сопр. осн.
Реакции гидролиза
Реакции химического (обменного) взаимодействия растворенного вещества с водой называются гидролизом. В общем случае, когда химические взаимодействия протекают в среде других растворителей, процесс называется сольволизом.
Гидролизу могут подвергаться различные вещества: белки, жиры, углеводы, сложные эфиры, соли и др. Гидролиз (гидро – вода, лизос – разложение) – это разложение веществ под действием воды.
Рассмотрим примеры реакций гидролиза солей разного состава. Основной причиной гидролиза является нарушение равновесия диссоциации воды: HOH H+ + OH- вследствие образования малодиссоциированных соединений.
Рассмотрим состояние соли калия цианида в водном растворе:
KCN = K+ + CN-
Соли в растворе хорошо диссоциируют и образуется много ионов К+ и CN-, они сталкиваются с Н+ и ОН-. При столкновении К+ и ОН- не образуется молекулы КОН (т.к. это сильный электролит). При столкновении Н+ и CN- частично образуются молекулы HCN, т.к. это малодиссоциирующее вещество (слабая кислота). Образование HCN влияет на равновесие воды, т.е. смещает градиент ее диссоциации влево
( ).
127
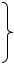
Схематически этот процесс можно представить:
KCN K+ + CN-
+HCN
HOH OH- + H+
В растворе происходит процесс гидролиза, который представляется
следующим образом: |
|
K+ + CN- + HOH |
K+ + OH- + HCN |
CN- + HOH |
HCN + OH- |
Таким образом, гидролиз соли – это взаимодействие соли с молекулами воды с образованием малодиссоциирующих веществ (кислот и оснований).
С точки зрения протолитической теории, гидролиз – это частный случай обратимого процесса реакции нейтрализации кислот и оснований с образованием солей.
Реакции гидролиза не идут до конца. По мере протекания реакции гидролиза в растворе накапливаются ионы гидроксида (ОН-) или ионы водорода (Н+), которые замедляют процесс гидролиза слева направо ( ). Наконец наступает подвижное химическое равновесие процесса гидролиза.
При гидролизе солей, как правило, изменяется реакция среды (из нейтральной в кислую или в щелочную), вследствие накопления в водной среде ионов (Н+) или (ОН-).
Протекание процесса гидролиза зависит от ряда факторов:
состава (природы) солей, какими электролитами (слабыми или сильными) образованы соли;
концентрации раствора солей;
температуры;
присутствия в растворе солей других веществ.
Рассмотрим 4 случая гидролиза солей различной природы.
1.Гидролиз соли, образованной слабой кислотой и сильным основанием, например, натрия ацетат:
Соль в растворе полностью диссоциирует на ионы:
CH3COONa → CH3COO- + Na+
Вода, как отмечалось ранее, является очень слабым электролитом:
HOH OH- + H+ .
Ионы водорода (Н+) взаимодействуют с ацетат-ионами с образованием уксусной кислоты:
CH3COO- + H+ CH3COOH.
128
Таким образом, в полной ионно-молекулярной форме уравнение гидролиза можно представить в следующем виде:
CH3COO- + Na+ + HOH CH3COOH + Na+ + OH-,
в сокращенной форме:
CH3COO- + HOH CH3COOH + OH-
Как видно, в результате гидролиза появилось некоторое избыточное количество гидроксид-ионов, и реакция стала щелочной (рН>7), происходит подщелачивание раствора. Гидролиз идет по иону слабого электролита в составе соли.
2.Гидролиз соли, образованной слабым основанием и сильной кислотой, например аммония хлорида:
NH4Cl → NH4+ + Cl-
(далее см п.1)
Ионы слабого основания взаимодействуют с молекулами воды с образованием слабого основания:
NH4+ + HOH NH4OH + H+
Таким образом, в ионно-молекулярной форме гидролиз можно представить уравнением: NH4+ + HOH NH4OH + H+
В результате данной реакции гидролиза наблюдается некоторый избыток ионов водорода Н+, (рН<7) и реакция среды подкисляется. Гидролиз идет по слабому компоненту.
3. Гидролиз соли, образованной слабой кислотой и слабым основанием, например, аммония сульфидом:
(NH4)2S 2NH4+ + S2-.
В такой соли гидролиз протекает по катиону и по аниону, слабые электролиты NH4OH и H2S образуют данную соль. Соль, как сильный электролит, полностью диссоциирует. А ионы вступают в реакцию гидролиза с молекулами воды:
2NH4+ + S2-+ 2HOH 2NH4OH + H2S
S2- + HOH |
|
HS-+ OH- (1-я ступень) |
HS- + HOH |
|
H2S + OH- (2-я ступень) |
В сокращенной ионно-молекулярной форме гидролиз данной соли протекает по уравнению:
129
2NH4+ + S2- + 2HOH 2NH4OH + H2S
Примечание:
1)реакция водной среды при гидролизе таких солей зависит от силы образующихся слабых электролитов кислот и оснований, т.е. от соотношения константы диссоциации кислоты и основания, образующих соли;
2)образование летучих веществ (газообразных):
NH4OH NH3 + HOH
S2- + 2HOH 2OH- + H2S
в реакции постепенно происходит усиление процесса гидролиза таких солей.
3) если гидролизу подвергаются многозарядные ионы соли, то гидролиз протекает по стадиям.
4. Соль, образованная сильной кислотой и сильным основанием, гидролизу не подвергается, например, калия хлорид.
При взаимодействии ионов солей из сильных электролитов с водой не образуются слабые электролиты. Вследствие такого характера взаимодействия не нарушается равновесие ионов водорода (Н+) и (ОН-) в молекулах воды. Поэтому в растворах таких солей (NaCl, Na2SO4, KClO4 и др.) водная среда остается нейтральной (рН=7).
Влияние температуры на процесс гидролиза
Процесс гидролиза является эндотермическим (ΔН>0), он заканчивается установлением химического равновесия. При нагревании процесс гидролиза усиливается и смещается слева направо ( ) по принципу Ле Шателье. При понижении температуры гидролиз в водной среде уменьшается и равновесие смещается в левую сторону ( ).
Ступенчатый гидролиз
Соли, содержащие в своём составе многозарядные ионы слабых компонентов (многоосновных кислот или многокислотных оснований), гидролизу подвергаются ступенчато (CuCl2, AlCl3, FeCl3, Na3PO4, Na2S и др.), например:
I.FeCl3 + HOH Fe(OH)Cl2 + HCl
130
