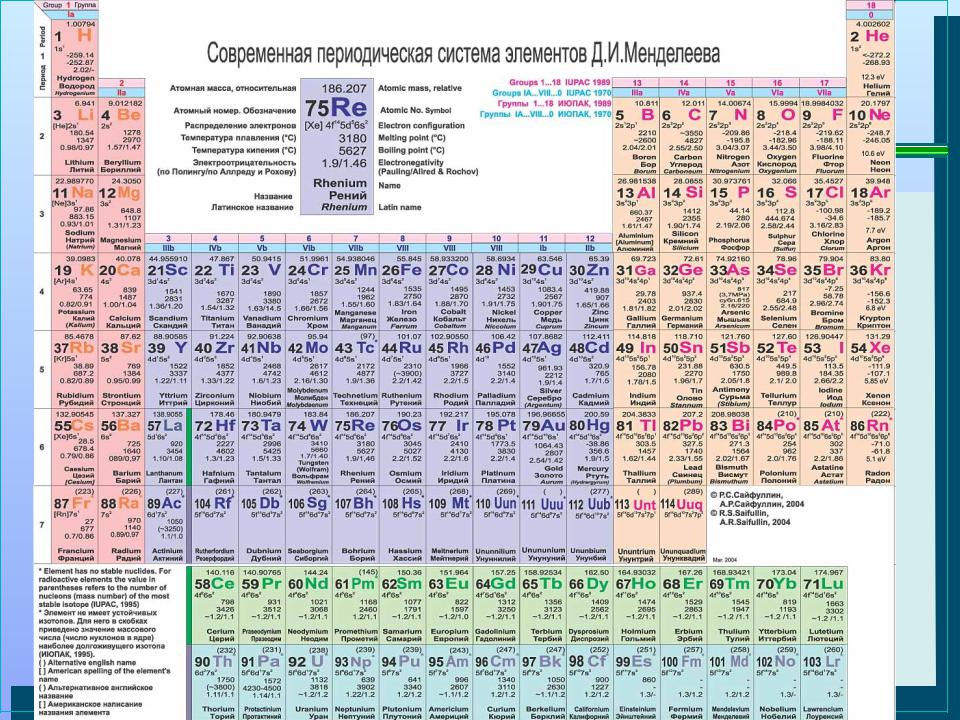
- •Химия
- •Преподаватель
- •Учебные пособия
- •Определение химии
- •Вещество
- •Физические свойства
- •Химические свойства
- •Физические
- •Химическая реакция
- •Химическое уравнение
- •Молекулы и атомы
- •Закон сохранения массы
- •Атомная теория Дальтона
- •Атомные единицы массы
- •Молекулярная масса
- •Моль
- •Этапы стехиометрических
- •Стехиометрические расчеты
- •Стехиометрические расчеты
- •Химическая кинетика
- •Закон действия масс
- •Химическое равновесие
- •Равновесие в
- •Равновесие в газовых
- •Факторы, влияющие на равновесие
- •Принцип Ле Шателье
- •Проявления принципа Ле Шателье
- •Проявления принципа Ле Шателье
- •Агрегатные состояния вещества
- •Давление газа
- •Закон Бойля-Мариотта
- •Закон Гей-Люссака
- •Закон Шарля
- •Закон Авогадро
- •Объем газа при
- •Уравнение состояния идеального газа (Менделеева-Клапейрона)
- •Закон парциальных
- •Концентрация растворов
- •Объемные доли и
- •Массовые доли и
- •Мольные доли и
- •Молярная концентрация
- •Моляльность
- •Закон Генри
- •Закон Рауля
- •Коллигативные свойства
- •Снижение давление пара
- •Повышение температуры
- •Снижение температуры
- •Осмос
- •Сравнение эффекта ионных и ковалентных веществ
- •Особенности свойств
- •Теория электролитической
- •Растворы электролитов
- •Сила электролитов
- •Закон разбавления
- •Кислоты и основания по теории
- •Сильные и слабые
- •Автоионизация воды
- •Сильные кислоты и
- •Константа диссоциации
- •Ионно-молекулярные
- •Реакции ионного обмена
- •Гидролиз
- •Гидролиз
- •Гидролиз
- •Гидролиз
- •Энергия
- •Внутренняя энергия,
- •Экзотермические и
- •Внутренняя энергия
- •Первый закон
- •Реакции при постоянном объеме и
- •Термохимические
- •Стандартная мольная
- •Стандартная мольная
- •Закон Гесса
- •Закон Гесса
- •Энтропия
- •Второй закон
- •Энергия Гиббса
- •Критерий самопроизвольного протекания

Химия |
Преподаватель
Бедило Александр Федорович, к.х.н.
Основное место работы: Институт Катализа им. Г.К. Борескова СО РАН
E-mail: abedilo@bk.ru
Тел. рабочий: 32-69-421
Блог: abedilo.livejournal.com

Учебные пособия |
Курс лекций, методички |
кафедры с контрольными |
работами. |
Учебник «Общая химия» Глинки |
или любой другой учебник |
общей химии для вузов. |
Можно использовать книги для |
подготовки к ЕГЭ |
Определение химии |
Химия – это наука о природе материи и |
ее превращениях. |
Wikipedia, классическое определение |
Химия – это наука о материи, которая исследует |
состав, строение и свойства веществ и их |
превращения. |
Wikipedia, современное определение |
Вещество |
|
Вещество – это отдельный вид материи, |
|
обладающий при данных условиях |
|
определенными физическими |
|
свойствами, не меняющимися от |
|
образца к образцу. |
|
Например: |
|
вода |
кислород |
Шоколад не является индивидуальным веществом, |
|
а смесью, т.к. его свойства меняются от одной |
|
шоколадки к другой |
|
Физические свойства |
|
Свойства, которые не включают в себя |
|
превращения одного вещества в другое, |
|
называют физическими. |
|
Например: |
|
запах |
плотность |
цвет |
температура плавления |
вкус |
сжимаемость |
Химические свойства |
В отличие от физических, химические |
свойства подразумевают возможность |
превращения одних веществ в другие. |
Например: |
Химическим свойством дров |
является их способность к сгоранию |
(горючесть) |
Физические |
превращения |
При физических превращениях |
изменяются свойства, но не природа |
веществ. |
Например: |
плавление |
кипение |
измельчение |

Химическая реакция |
|
При химических превращениях |
|
изменяются как свойства, так и природа |
|
веществ. |
|
Химическая реакция – процесс, в |
|
котором одни вещества превращаются в |
|
другие. |
|
Дрова + кислород |
Углекислый газ + вода + зола |
Реагенты |
Продукты |
Химическое уравнение
Химическое уравнение – это краткая запись химической реакции с использованием химических символов.
В уравнениях должны быть показаны:
все реагенты и продукты;
физические состояния всех веществ;
любые дополнительные условия реакции;
Количество атомов каждого элемента в реагентах и продуктах должны быть равны.
t
CaCO3 (тв) = CaO (тв) + CO2 (газ)