
- •Министерство образования и науки российской федерации
- •Методические указания
- •Раздел 1 Основные понятия и законы химии
- •Раздел 2 Строение атома. Химическая связь
- •2.1 Строение атома
- •2.2 Химическая связь Существует два подхода к описанию химической связи: метод валентных связей (мвс) и метод молекулярных орбиталей (ммо).
- •2.1 Строение атома
- •2.2 Химическая связь
- •Раздел 3 Энергетика химических процессов. Термохимия
- •3.1 Термохимия
- •3.2 Энтропия химических реакций
- •3.3 Энергия Гиббса
- •Раздел 4 Кинетика химических реакций. Химическое равновесие
- •4.1 Скорость химических реакций
- •4.1.1. Скорость химических реакций в гомогенной системе
- •4.1.2 Скорость химических реакций в гетерогенной системе
- •4.2 Факторы, влияющие на скорость реакции
- •4.2.1 Концентрация реагирующих веществ
- •4.2.2. Давление
- •4.2.3. Температура
- •4.3. Химическое равновесие
- •4.3.1 Принцип Ле-Шателье
- •Раздел 5 Растворы. Концентрация растворов. Гидролиз солей
- •5.1 Концентрация растворов
- •5.2 Свойства растворов неэлектролитов
- •5.2.1 Осмотическое давление
- •5.2.2 Давление пара растворителя над разбавленными растворами
- •5.2.3 Температуры кипения и кристаллизации разбавленных растворов неэлектролитов
- •5.3 Свойства растворов электролитов
- •5.3.1 Степень диссоциации
- •5.3.2 Константа диссоциации
- •5.3.3 Ионное произведение воды. Водородный показатель
- •5.4 Реакции ионного обмена
- •5.5 Гидролиз солей
2.2 Химическая связь Существует два подхода к описанию химической связи: метод валентных связей (мвс) и метод молекулярных орбиталей (ммо).
Метод валентных связей исходит из того, что химическая связь осуществляется связывающими электронными парами, каждая из которых принадлежит двум атомам. Связывающие электронные пары могут образовываться по обменному или донорно-акцепторному механизму.
По обменному механизму связь возникает за счет перекрывания электронных орбиталей неспаренных электронов двух атомов. В связывающей электронной паре электроны имеют антипараллельные спины.
Пример 1. Покажите, какие орбитали и как участвуют в образовании химиче- ской связи в молекулах: а) Li2; б) LiF; в) F2. Напишите графические формулы этих молекул.
Решение: Электронные формулы атомов лития и фтора имеют вид:
3Li 1s22s12p0 9F 1s22s22p5
и электронно-графические формулы их соответственно:
2s 2p 2s 2p







 ↓
↑↓ ↑↓ ↑↓ ↑
↓
↑↓ ↑↓ ↑↓ ↑
Li F
Неспаренный электрон атома лития занимает 2sорбиталь, а атома фтора 2pорбиталь. Следовательно, эти орбитали участвуют в образовании химической связи вышеприведенных соединений. Это можно представить:

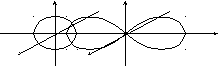
Li-Li Li-F

F-F
Число связей, которые образует атом по обменному механизму, как правило, равно числу его неспаренных электронов в основном или валентно-возбужденном состоянии. В методе валентных связей исходят из того, что валентновозбужденные состояния атома, отличающиеся от основного большим числом неспаренных электронов, получают переводом одного или нескольких электронов электронных пар на свободные орбитали другого подуровня того же электронного уровня.
Пример 2. Сколько связей по обменному механизму могут образовать атомы серы и кислорода? Напишите эмпирические формулы их соединений со фтором.
Решение. Кислород с порядковым номером восемь является элементом 2-го периода. Электронная формула 8О 1s22s22p6. На валентном уровне атом имеет 4 орбитали и 6 электронов:
2s 2p



 ↑↓ ↑↓
↑ ↑
↑↓ ↑↓
↑ ↑
В валентном электронном уровне атома кислорода нет вакантных орбиталей. Следовательно, атом кислорода может образовать по обменному механизму только две связи. Соединение со фтором имеет формулу ОF2 и соответственно графическую F-O-F.
Сера с порядковым номером шестнадцать – элемент 3-го периода. Электронная формула 1s22s22p63s23p4.
Валентный уровень серы состоит из 3-х подуровней и 9 орбиталей.
Атом серы может иметь два валентно-возбужденных состояния.
3s 3p 3d








 ↑↓ ↑↓ ↑ ↑
↑↓ ↑↓ ↑ ↑
3s 3p 3d








 ↑↓ ↑ ↑ ↑ ↑сера
(IV)
↑↓ ↑ ↑ ↑ ↑сера
(IV)
3s 3p 3d








 ↑ ↑ ↑ ↑ ↑
↑сера
(VI).
↑ ↑ ↑ ↑ ↑
↑сера
(VI).
Она может образовывать 2, 4 и 6 связей по обменному механизму.
Соединения серы со фтором имеют формулы SF2; SF4; SF6.
Связи между атомами могут быть кратными (двойными, тройными). Кратные связи образуются с участием σ- и π- связей.
Пример 3. Покажите, какие орбитали и как участвуют в образовании связи в молекуле С2. Напишите графическую формулу молекулы С2.
Решение. Электронная конфигурация атома углерода с порядковым номером шесть 6С 1s22s22p2 и соответственно электронно-графическая формула имеет вид:
2s 2p



 ↑↓ ↑ ↑
↑↓ ↑ ↑
В образовании связей у каждого атома углерода могут участвовать два рэлектрона (Рх, Ру): одна связывающая электронная пара образует σсвязь (РхРх), другая π (РуРу)

+ +
С С

Связь может образоваться за счет неподеленной пары электронов одного атома и свободной орбитали другого атома. Атом, представляющий для образования
с вязи
электронную пару, называется донором
(Д), а атом, имеющий свободную орбиталь,
называется акцептором (А).
вязи
электронную пару, называется донором
(Д), а атом, имеющий свободную орбиталь,
называется акцептором (А).
Д + А = Д А
Например, образование иона аммония:
2s
2p
, 1s![]()




 ↑↓ ↑
↑ ↑
↑↓ ↑
↑ ↑
N
H![]()
N + 3H NH3
N
H




 Н +
Н +













 Н
N
+H+
= H
N
Н
Н
N
+H+
= H
N
Н
H H

Д А
Геометрическую структуру молекул, направленность ковалентных связей определяет теория гибридизации атомных орбиталей центрального атома.
Гибридизация – это перераспределение электронной плотности между разными, но близкими по энергии атомными орбиталями одного энергетического уровня и образование гибридных атомных орбиталей, численно равных количеству исходных и одинаковых по форме и по энергии.
Н апример,
в гибридизации могут участвовать s
и pорбитали
одного энергетического уровня, обладающие
различной симметрией. В результате
образуются две гибридные орбитали.
Гибридные атомные орбитали (ГАО) имеют
несимметричную форму. У таких орбиталей
электронная плотность по одну сторону
выше, что и определяет перекрывание
электронных облаков и делает более
устойчивой химическую связь.
апример,
в гибридизации могут участвовать s
и pорбитали
одного энергетического уровня, обладающие
различной симметрией. В результате
образуются две гибридные орбитали.
Гибридные атомные орбитали (ГАО) имеют
несимметричную форму. У таких орбиталей
электронная плотность по одну сторону
выше, что и определяет перекрывание
электронных облаков и делает более
устойчивой химическую связь.

Типы гибридизации атомных орбиталей
Комбинация одной s и одной p-орбиталей приводит к sp-гибридизации. Образуются два гибридных облака, ориентированных в пространстве под углом 1800.
Например, образование молекулы ВеСl2:
4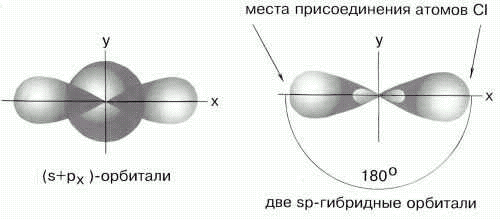 Be
Be
1s22s2
![]()
![]() *Be 1s22s12p1
(перевод в
возбужденное состояние). В результате
гибридизации 2s и 2p орбиталей образуется
линейная связь и линейная молекула
*Be 1s22s12p1
(перевод в
возбужденное состояние). В результате
гибридизации 2s и 2p орбиталей образуется
линейная связь и линейная молекула
 Cl
Be Cl
Cl
Be Cl
1800
Элементы II группы, подвергаясь sp-гибридизации, образуют линейные молекулы.
Комбинация одной s- и двух p-орбиталей приводит к sp2-гибридизации.
Например, образование молекулы ВН3.
5В
1s22s22p1
![]() B* 1s22s12p2.
В результате гибридизации одной s- и
двух p- орбиталей образуется треугольная
плоская молекула.
B* 1s22s12p2.
В результате гибридизации одной s- и
двух p- орбиталей образуется треугольная
плоская молекула.


Элементы III группы, подвергаясь sp2-гибридизации, образуют треугольные плоские молекулы.
Комбинация одной s- и трех p- орбиталей приводит к sp3- гибридизации.
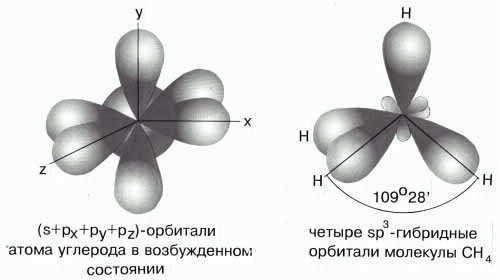 Например,
образование молекулы СH4:
Например,
образование молекулы СH4:
6С
1s22s22p2
![]() C* 1s22s12p3
C* 1s22s12p3
 В
результате гибридизации одной s- и трех
p-орбиталей образуется тетраэдрическая
молекула.
В
результате гибридизации одной s- и трех
p-орбиталей образуется тетраэдрическая
молекула.
1090 28
Элементы IV группы, подвергаясь sp3-гибридизации, образуют тетраэдрические молекулы.
Задачи к разделу 2:
«Строение атома. Химическая связь»
