
- •Глава 1. Введение в эндокринологию…………………………….….……7
- •Глава 2.Анатомия и физиология гипоталамо- гипофизарной
- •Глава 3. Заболевания островкового аппарата поджелудочной железы….69
- •Глава 4. Заболевания щитовидной железы……………………….……119
- •Глава 5. Заболевании паращитовидных (околощитовидные) желез…192
- •Глава 6. Заболевания надпочечников………………………………..…222
- •Глава 7.Ожирение......................................................................................256
- •Глава 1. Введение в эндокринологию
- •Глава 2 . Гипоталамо-гипофизарная система
- •2.1.Анатомия и физиология гипоталамо- гипофизарной системы
- •Эндокринная система
- •2.2. Нарушения роста у детей.
- •Первичные нарушения роста:
- •Вторичные нарушения роста:
- •Гипотиреоз.
- •Врожденные формы
- •Приобретенные формы
- •Скелетные дисплазии с укорочением туловища
- •Мукополисахаридозы
- •Синдром Дауна
- •Больной ребенок с синдромом Дауна Синдром Шерешевского-Тернера
- •Синдром Шерешевского-Тернера
- •Синдром Рассела-Сильвера
- •Синдром Секкеля
- •Синдром Нунан
- •Прогерия
- •Синдром Коккейна
- •Синдром Прадера-Вилли
- •Синдром Блума
- •Синдром Рубинштейна-Тейби
- •Вторичные нарушения роста
- •Псевдогипопаратиреоз типа 1а и 1с
- •Синдром Кушинга
- •Синдром Мариака
- •Витамин д-резистентный рахит (фосфат-диабет)
- •Заболевания сердечно-сосудистой системы
- •Заболевания органов дыхания
- •Заболевания почек
- •Заболевания желудочно-кишечного тракта
- •Конституциональная задержка роста и пубертата
- •Дефицит гормона роста
- •Идиопатический дефицит гр
- •Синдром Ларона
- •Опухоли гипоталамо-гипофизарной системы
- •Лечение низкорослости
- •2.3.Акромегалия и гигантизм
- •2.4. Несахарный диабет
- •Центральный
- •Нефрогенный
- •Первичная полидипсия
- •Глава 3. Заболевания островкового аппарата поджелудочной железы
- •3.1Анатомия и физиология островкового аппарата поджелудочной железы
- •3.2.Сахарный диабет
- •4. Гестационный сахарный диабет.
- •3.3.Отдельные типы сахарного диабета. Генетические нарушения функции β клеток
- •3.4. Сахарный диабет 1 типа
- •Инсулиновая помпа и его установка
- •3.5. Острые осложнения сахарного диабета
- •Острые осложнения сахарного диабета -комы
- •Инсулинотерапия
- •3.6.Хронические осложнения сахарного диабета Диабетическая ретинопатия
- •Диабетическая нефропатия (дн)
- •Метод расчета скф
- •Ограниченная подвижность суставов(Хайропатия)
- •Глава 4. Заболевания щитовидной железы
- •4.1. Анатомия и физиология щитовидной железы
- •Биосинтез, секреция и механизмы действия гормонов щитовидной железы.
- •1. Острая стадия
- •6. Проба с перхлоратом
- •1. Злокачественные опухоли щитовидной железы
- •Глава 5. Заболевания паращитовидных желез
- •5.1.Анатомия и физиология
- •5.2.Регуляция фосфорно-кальциевого обмена
- •Обследование больных с наpушением фосфорно-кальциевого обмена включает:
- •5.3.Гипопаратиреоз
- •5.4.Гиперпаратиреоз
- •Глава 6. Заболевания надпочечников
- •6.1.Анатомо-физиологические сведения
- •6.2. Методы исследования надпочечников
- •1) Феохромоцитома;
- •6.3.Гиперфункция коры надпочечников
- •6.4.Опухоли обменного типа (синдром Кушинга)
- •6.5.Первичный гиперальдостеронизм
- •Заболеваемостьсиндромом Конна среди население
- •6.6.Гипофункция коры надпочечников
- •6.7.Хроническая недостаточность коры надпочечников.
- •6.8.Врожденная дисфункция коры надпочечников
- •6.9. Феохромоцитома
- •Глава 7. Ожирение
- •7.1. Физиология жировой ткани
- •Центральные механизмы контроля энергетического баланса
- •Классификация
- •Обследование
- •Лечение
- •Тесты и задачи по темам
- •Заболевания щитовидной железы
- •Надпочечники
Глава 3. Заболевания островкового аппарата поджелудочной железы
3.1Анатомия и физиология островкового аппарата поджелудочной железы
П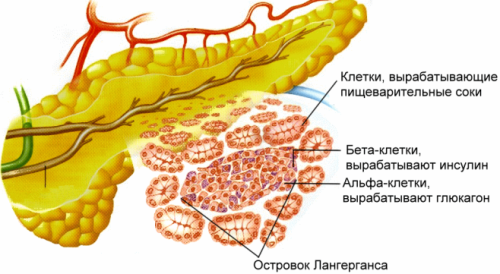 оджелудочная
железа (лат. pancreas)
– непарный орган, расположенный
ретроперитонеально и секретирующий
ферменты (экзокринная часть) и различные
гормоны (эндокринная часть). Поджелудочная
железа расположена в брюшной полости
и лежит на уровне тел 1-2 поясничных
позвонков позади желудка, от которого
отделена сальниковой сумкой. Вес ее в
среднем составляет 80-100 г, длина 14-18см,
ширина 3-9см, толщина 2-3 см. Железа имеет
тонкую соединительнотканную капсулу
и снаружи покрыта брюшиной. В ее строении
выделяют головку, тело, хвост.
оджелудочная
железа (лат. pancreas)
– непарный орган, расположенный
ретроперитонеально и секретирующий
ферменты (экзокринная часть) и различные
гормоны (эндокринная часть). Поджелудочная
железа расположена в брюшной полости
и лежит на уровне тел 1-2 поясничных
позвонков позади желудка, от которого
отделена сальниковой сумкой. Вес ее в
среднем составляет 80-100 г, длина 14-18см,
ширина 3-9см, толщина 2-3 см. Железа имеет
тонкую соединительнотканную капсулу
и снаружи покрыта брюшиной. В ее строении
выделяют головку, тело, хвост.
Анатомия островкового аппарата поджелудочной железы
Эндокринная часть поджелудочной железы представлена островками Лангерганса, диффузно распределенными в экзокринной паренхиме поджелудочной железы. Диаметр островков колеблется от 50 до 400 мкм (большая часть островков диаметр 200 мкм). В поджелудочной железе взрослого человека насчитывается примерно 1 млн островков.
Инсулярный аппарат в начале процесса развития составляет большую часть массы pancreas. У эмбриона 20 см длиной масса инсулярного аппарата и мезенхимы составляет 2/3 массы железы, т. е. в это время поджелудочная железа представляет собой железу внутренней секреции. После рождения инкреторная часть составляет уже 30%, уменьшаясь в процессе дальнейшего роста до 1—1,5%, как у взрослых людей.
Экзокринный аппарат, развиваясь, постепенно вытесняет соединительную ткань, составляющую значительно больший процент массы железы у детей после рождения. Только к 2 годам гистологическое строение поджелудочной железы начинает приближаться к таковому у взрослых.
К особенностям развития поджелудочной железы у детей можно отнести относительную незрелость экзокринной части после рождения и мощное раннее развитие функционирующего эндокринного аппарата.
Кровоснабжение железы осуществляется через панкреатодуоденальными артериями, который отходит от верхней брыжеечной артерии или из пачечной артерии . Верхняя брыжеечная артерия обеспечивает нижние панкреатодуоденальные артерии, в то время как гастродуоденальная артерия обеспечивает верхние панкреатодуоденальные артерии. Артерии, разветвляясь в междольковой соединительной ткани, образуют плотные капиллярные сети, оплетающие ацинусы и проникающие в островки. Кровоток в эндокринной части в 5-10 раз выше, чем в экзокринной части железы. Он ориентирован таким образом, что инсулин из центра островков попадает на периферию, где тормозит секрецию глюкагона α клетками. Венозный отток проходит через селезеночную, верхнюю и нижнюю, а также левую желудочную вены.
Лимфатическая система поджелудочной железы у детей не имеет каких-либо анатомических особенностей. Лимфа из этих узлов может поступать в лимфатическую систему желудка, печени, желчного пузыря, большой сальник, парааортальные узлы и другие органы.
Иннервация поджелудочной железы осуществляется парасимпатическими и симпатическими волокнами.
Островки Лангерганса представлены следующими типами клеток: А(£), Б(β), D(δ), П(γ), F или РР. А(£) клетки составляет 20-25 % клеточного состава островков и являются местом образования глюкагона. Основное количество (75-80 %) клеток островка составляют В (β)- клетки, которые служат местом синтеза и депонирования инсулина. (δ) клетки являются местом образования соматостатина, который угнетает функцию многих желез. Кроме того в поджелучдочной железе имеется и РР-клетки, секреторные гранулы, которых имеются свои отличительной особенности. Они являются источником панкреатического полипептида (подавляет секрецию поджелудочной железы и стимулирует секрецию желудочного сока).
Таблица №3.1
Типы клеток |
Примерная доля объема островков |
Секреторные продукты |
|
дорсальных |
вентральных |
||
А-клетки (£) |
10% |
<5% |
Глюкагон |
В-клетки (β) |
70-80% |
15-20% |
Инсулин, с-пептид, проинсулин, амилин, γ-аминомаслянная кислота(ГАМК) |
D-клетки(δ) |
3-5% |
<1% |
Соматостатин |
PP-клетки (F) |
<2% |
80-85% |
Панкреатический полипептид (ПП) |
ИНСУЛИН. В 1921 году Бантинг и Бест получили из поджелудочной железы собак экстракт, устранявший гипергликемию и глюкозурию, и уже через год были приготовлены препараты инсулина, применявший для лечения больных с сахарным диабетом. Химическая структура инсулина была расшифровано в 1953г. Сэнджером.
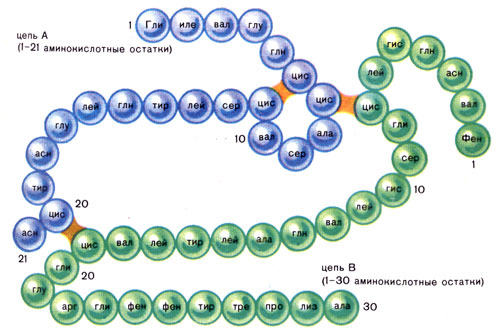
Инсулин синтезируется β клетками поджелудочной железы. Ген инсулина расположен на коротком плече 11-й хромосомы. В начале образуется молекула препроинсулина, затем проинсулина, которая в дальнейшем расщепляется на молекулы инсулина и С-пептид.
В составе 86-аминокислотной последовательности проинсулина содержатся А и В-цепи инсулина, а также соединительный сегмент из 35 аминокислот. После расщепления двух пар основных аминокислот карбоксипептидазой Е образуется молекулы инсулина (51 аминокислотный остаток) и С-пептид (31 аминокислотный остаток).
При отщеплении инсулина от проинсулина образуется С-пептид(цепь из 31 аминокислоты, молекулярная масса 3000). Его биологическая активность неизвестна. Он секретируется β-клетками в эквимолярных с инсулином количествах и разрушается и выводится главным образом почками.
Инсулин, белок из 51 аминокислоты, содержит две цепи: А-цепь (21АК) и В-цепь (30АК). Цепи соединены между собой двумя дисульфидными мостиками. Еще один дисульфидный мостик связывает между собой аминокислоты 6 и 11 в А-цепи. Молекулярная масса инсулина человека равна-5808. Период полужизни эндогенного инсулина в крови составляет 3-5 минут. Он разрушается главным образом, инсулиназами печени, почек и плаценты. За один пассаж крови через печень удаляется примерно 50% инсулина.

Секреция
Поджелудочная железа здорового человека за сутки секретируется около 30ед инсулина. Его базальная концентрация в крови составляет в среднем 30мкЕд/мл (0,4нг/мл, или 61 пмоль/л). У здорового человека после стандартного завтрака уровень инсулина редко повышает 100мкЕд/мл (610пмоль/л). Концентрация инсулина в периферической крови возрастает через 8-10 минут после приема пищи, достигая максимума через 30-45 минут. Затем его уровень быстро снижается параллельно концентрации глюкозы в крови, которая достигает исходной через 90-120 минут.
Базальная секреция инсулина (т.е. в отсутствие экзогенных стимулов) называют количество инсулина, секретируемого до приема пищи (натощак). Хотя глюкоза в концентрации ниже 80-100 мг% (4,4-5,6 ммоль/л) не стимулирует секрецию инсулина, ее присутствие необходимо (в системах invitro) для реализации действия большинства известных стимуляторов секреции этого гормона.
Стимулированная секреция инсулина возникает под воздействием экзогенных стимуляторов. Invivo β-клетки реагируют на прием пищи. Самым мощным стимулятором секреции инсулина является глюкоза. При остром повышении концентрации глюкозы в системе наблюдается кратковременный выброс инсулина (первая фаза). Далее при сохранении этой концентрации глюкозы секреция инсулина постепенно снижается, но затем начинает нарастать вновь, достигая повышенного стабильного уровня (вторая фаза)
Механизм действия инсулина. Инсулин влияет на обмен углеводов, жиров, белков и электролитов в тканях организма, увеличивая транспорт глюкозы, белка и других веществ через клеточную мембрану.
Свое биологическое действие инсулин осуществляет через соответственный рецептор.Рецептор инсулина представляет собой белок, состоящий из двух субъединиц. Полипептидная цепь СС-субьединицы включает 719 аминокислотных остатков (мол масса 135000), а в-субьединицы – 620 аминокислотных остатков (мол масса 95000). Рецептор выполняет три основные функции:
с высокой специфичностью связывает инсулин;
передает соответствующий сигнал на внутриклеточные процессы;
осуществляет «интернализацию» инсулина, в результате которой гормон подвергается протеолизу в лизосомах, а рецептор возвращается в мембрану клетки. Ген рецептора инсулина расположен на коротком плече 19-й хромосомы.
Основное действие инсулина заключается в усилении транспорта глюкозы через мембрану клетки. Скорость поступления глюкозы внутрь клетки возрастает в 20-40 раз. Это происходит за счет 5-10 кратного увеличения содержания белков-транспортеров глюкозы в мембране при одновременном уменьшении их содержания внутри клетки на 50-60%. Выделяют два класса транспортеров глюкозы: натрий глюкозный котранс-транспортер и 5 изоформ собственных транспортеров глюкозы. Натрий-глюкозный транспортер (симпортер) экспрессируется в реснитчатых клетках тонкой кишки и проксимальных канальцев почек. Этот белок осуществляет активный транспорт глюкозы из просвета кишки или нефрона против градиента ее концентрации путем связывания с теми ионами натрия, которые транспортируются по градиенту концентрации.
Второй класс переносчиков глюкозы представлен мембранными белками, находящимся на поверхности всех клеток и осуществляющие транспорт глюкозы по градиенту ее концентрации (облегченная диффузия).
Среди транспортеров глюкозы различают ГЛЮТ 1 (эритроцитарный тип), ГЛЮТ 2 (печеночный тип), ГЛЮТ 3 (мозговой тип), ГЛЮТ 4 (мышечно-жировой тип) и ГЛЮТ-5 (кишечный тип).
Глюкагон
Биохимия. Панкреатический глюкагон, наряду с несколькими другими биологическими пептидами, образуется из более крупного пептида преглюкагона, который кодируется геном препроглюкагона, расположенным у человека на хромосоме 2.
Глюкагон-одноцепочечный полипептид, состоящий из 29 аминокислотных островков. Его молекулярная масса равна 3485. У здоровогочеловека средняя концентрация иммунореактивного глюкагона в плазме составляет 75пг/мл (25пмоль/л). Период полужизни глюкагона в крови 3-6 минут. Он элиминируется из крови главным образом печенью и почками.
Секреция. Глюкоза ингибирует секрецию глюкагон. Пока не ясно, влияет ли она на α-клетки непосредственно или через повышение продукции инсулина и соматостатина, которые прямо угнетают активность α-клетки. Кроме того, δ-клетки секретируют гамма-аминомасляннуюкислоту (ГАМК), а на α-клеткинедавно были обнаружены ее рецепторы. Поэтому ГАМК может играть роль ингибировании активности α-клетки.
Эффекты глюкагона. В отличие от инсулина, который способствует запасанию энергии в разных тканях, глюкагон обеспечивает ткани энергией между приемами пищи.
В силу анатомической близости к поджелудочной железе, главным органом-мишенью глюкагона является печень. Связывание глюкагона со своими печеночными рецепторами активирует аденалатциклазу и продукцию цАМФ,что, в свою очередь, стимулирует распад гликогена, образование глюкозы из аминокислотных предшественников (глюконеогенез) и кетоновых тел из жирных кислот (кетогенез).
Пептиды, родственные глюкагону.
В клетках тонкой кишки под действием прогормонконвертазы 1/3 из проглюкагонаобразуется другой набор пептидов- глицентин, полипептид, родственный глицентину (ППРГ), оксинтомодулин и два глюкогоноподобных пептида (ГПП – 1 и ГПП – 2).
ГПП-1 существует в двух активных формах: ГПП-1 (7-36) и ГПП-1 (7-37). Он секретируется L- клетками кишки в ответ на прием пищи и связывается со своим рецептором (PCGБ), сходными с рецепторами глюкагона. В крови ГПП-1 быстро инактивируется вездесущий дипептидилпептидазойIV (ДПП IV), которая отщепляет от него два N-концевых аминокислотных остатка. Главной мишенью ГПП-1 является островки поджелудочной железы, где он стимулирует продукцию и секрецию инсулина и соматостатина и ингибирует секрецию глюкагона. Кроме того, ГПП-1 препятствует деструкции β клеток и стимулирует их пролиферацию. К другим мишеням ГПП-1 относится желудок (где этот пептид тормозит его опустошение и стимулирует секрецию соляной кислоты), головной мозг (где ГПП-1 угнетает аппетит, вызывая потерю веса) и сердца (на которое он оказывает ряд защитных влияний). При приеме пищи вместе с ГПП -1 секретируется ГПП-2,он взаимодействует со своим PCGБ , который очень похож на рецепторы глюкагона и ГПП-1, и так же инактивируется ДПП-IV. Его главной мишенью является, кишечник, где он стимулирует рост слизистой и всасывание питательных веществ, одновременно угнетая перистальтику.
Соматостатин
Ген соматостатина локализован на длинном плече хромосомы 3. Он кодирует пептид, состоящий из 116 аминокислотных остатков, (препросоматостатин), С-концевой фрагмент которого ( из 14 аминокислотных остатков, молекулярная масса 1640) представляет собой гормон соматостатин. Соматостатин продуцируется δ клетками, расположенными по периферии островков Лангерганса, но первые был обнаружен в гипоталамусе и получил свое название, благодаря способности ингибировать секрецию гормона роста (ГР, или соматотропина). Позднее соматостатин был найден во многих тканях, включая различные области головного мозга, желудочно-кишечный тракт и поджелудочную железу. В ЦНС и поджелудочной железе преобладает соматостатин-14, но 5-10 % иммунореактивного соматостатина в головном мозге приходится на долю пептида из 28 аминокислотных остатков – соматостатин-28. Его N-концевая последовательность состоит 14 аминокислотных остатков, а С-концевая- представляет собой соматостатина -14. В тонкой кишке, напротив, преобладает соматостатин-28: на его долю приходится 70-75%, а на долю соматостатин-14-лишь 25-30% иммунореактивного гормона. Соматостатин-28 ингибирует секрецию ГР и инсулина в 10 раз сильнее, соматостатин-14. С другой стороны, секреция глюкагона сильнее ингибируется именно соматостатин-14.
Большинство известных стимуляторов секреции инсулина (глюкоза, аргинин, ЖИП и толбутамид) усиливает также секрецию соматостатина δ-клетками. Роль соматостатина, присутствующего в крови, остается неясной. Основная функция этого пептида заключается, по-видимому, в паракринной регуляции активности островковой ткани поджелудочной железы и желудочно-кишечного тракта. У человека физиологический уровень соматостатина в сыворотке редко превышает 80пг/мл (49пмоль/л). Метаболический клиренс экзогенного соматостатина происходит очень быстро.
Панкреатический полипептид
ПП присутствует в F-клетках, концентрирующихся главным образом в островках задней части головки поджелудочной железы. Он состоит из 36 аминокислотных остатков (молекулярная масса 4200). Биосинтез изучен недостаточно.
У здорового человека базальная концентрация ПП составляет в среднем 24±4пмоль/л. С возрастом, при злоупотреблении алкоголем, при диарее, хронической почечной недостаточности, гипогликемии или воспалительных заболеваниях она повышается. Уровни ПП выше 300пмоль/л регистрируется у большинства больных с глюкагономами или опухолями, секретирующими вазоактивной интерстициальный полипептид (ВИП), а также у всех больных с опухолями из островковых F-клеток. Физиологические эффекты ПП неизвестны.
Диагностика нарушения гомеостаза глюкозы
Исследование инкреторной функции поджелудочной железы включает ряд последовательно применяемых проб:
Определение глюкозы в крови натощак, после еды и экскреции с мочой.
Определение глюкозы в крови после нагрузки с глюкозой, проведения перорального глюкозотолерантного теста
Определение концентрации инсулина, С-пептида в крови натощак.
Определение концентрации в крови и в моче биохимических параметров, уровень холестерина, липиды, ацетоуксусная и β- оксимасляная кислоты, лактата, показатели кислотно-основного состояния и др.
Определение антител к антигенам β- клеток
Определение концентрации глюкозы в биологических жидкостях
Для установления нарушения концентрации глюкозы в крови исследуют ее уровень натощак после 8 часового голодания
Таблица № 3.2. Уровни глюкозы в крови и моче у здоровых детей
(ТицН.У., 1997)
Показатель |
Уровни в крови (ммоль/л) в зависимости от возраста |
|||||
Новорожденные |
дети 1-12 лет |
взрослые |
||||
Глюкоза сыворотки крови натощак, глюкозооксидазный метод |
Пуповинная кровь |
2,5-5,3 |
33-5.6 |
4,1-5,9 |
||
Недоношенные в 1-е сутки |
1,7-3,3 |
|||||
Доношенные новорожденные в 1-е сутки |
2,2-3,3 |
|||||
Новорожденные старше 1 сут. |
2,8-4,4 |
|||||
Глюкоза сыворотки крови через 2 ч после еды, глюкозооксидазный метод |
|
<6,66 |
||||
Глюкоза в цельной крови натощак, глюкозооксидазный метод |
|
3,5-5,5
|
||||
Глюкоза в цельной крови через 2 ч после еды, глюкозооксидазныйметод |
|
<7,8 |
||||
Диагностические полоски (OneTouch, Accu-chek), капиллярная кровь, натощак |
|
3,3-7,2 |
||||
Глюкоза в суточной моче |
|
0,1-0,8 ммоль/л <2,8 ммоль/сут. |
||||
Функциональные тесты для определения гомеостаза глюкозы
Пероральный глюкозотолерантный тест (ОГГТ)
Таблица № 3.3. Нормальные показатели ОГТТDiabetesCare 2019 №1
-
Концентрация глюкозы в плазме крови,ммол/л
натощак
3.9-5.8≥ 126 мг/дл (7,0 ммол/л)
через 2 ч после ОГТТ
3.9-6.7 ≥ 200 мг/дл (11,1 ммол/л
А1С
≥ 6,5 % (48 ммол/мол)
Тест позволяет исследовать реакцию β-клеток на стимуляцию глюкозой. За 3 дня до проведения пробы больной получает обычное питание без ограничения углеводов. ОГТТ проводят после ночного (по крайней мере 8 ч.) голодания. Согласно рекомендации комитета экспертов (ISPAD, 2009), уровень глюкозы определяют натощак и через 2 ч после приема глюкозы внутрь в дозе 1,75 г/кг массы тела (не более 75г) (табл № 3,3). Проба не проводится больным ранее диагностированным СД.
Определение антител к антигенам β-клеток поджелудочной железы
Данное исследование имеет прогностическое значение в диагностике СД и в ряде случаев позволяет определить тип диабета. Показано, что отсутствие любых типов аутоантител означает отсутствие риска заболеть СД 1-го типа
