
6 курс / Эндокринология / МЕТОДЫ_УЛЬТРАЗВУКОВОГО_ИССЛЕДОВАНИЯ
.pdf
128
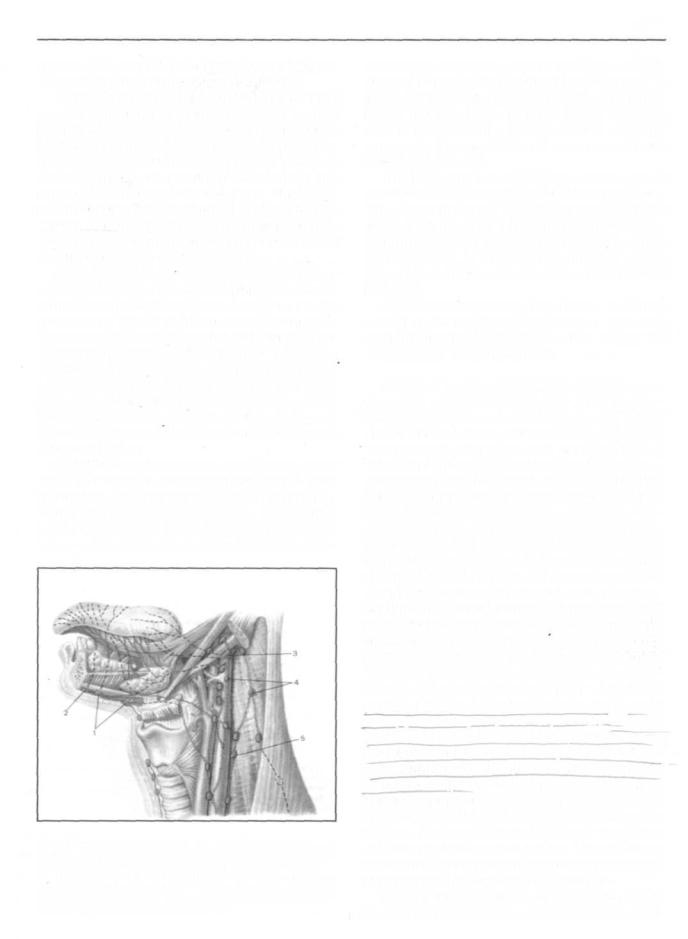
ленную лимфатическую систему (рис.149). Среди основных коллекторов, через которые происходит отток лимфы от ЩЖ, выде-
Рис. 149. Лимфатические сосуды и регионарные лимфатические узлы щитовидной железы. Схема из «Атласа онкологических операций» Б.Е.Петерсон и др., Москва , Медицина. 1987 г.
1 — верхние глубокие шейные лимфатические узлы; 2 — средние глубокие шейные лимфатические узлы; 3 — нижние глубокие шейные лимфатические узлы; 4 — претрахеальные лимфатические узлы; 5 — паратрахеальные лимфатические узлы; 6 — предгортанные лимфатические узлы. В рамке: внутриорганная лимфатическая сеть щитовидной железы.
ляют короткие и длинные отводящие сосуды [8, 10, 16]. Короткие отводящие сосуды впадают в предгортанные и паратрахеальные лимфатические узлы. Длинные отводящие сосуды в виде веера расходятся к глубоким шейным, а также претрахеальным и предгортанным лимфатическим узлам. Основная часть лимфы, оттекающей от щитовидной железы, поступает в собственно глубокие шейные узлы, а также — в пре — и паратрахеальные узлы. Однако эхосканированием зон локализации только этих групп узлов не ограничивается методика ультразвуковой оценки лимфатических узлов у пациентов с заболеваниями щитовидной железы. Это связано с возможностью метастазирования рака щитовидной железы и в поверхностные лимфатические узлы шеи. Ниже представлены данные о топографической анатомии лимфатических узлов шеи, изучению которых уделяют особое внимание при ультразвуковом исследовании зон возможной локализации лимфогенных метастазов рака щитовидной железы.
Собственно глубокие шейные лимфатические узлы. Центральное место в системе лимфатических узлов шеи занимает группа собственно глубоких лимфатических узлов. Это — главный коллектор, собирающий лимфу от щитовидной железы. Кроме того, через них идет отток лимфы от органов и тканей шеи и головы. В этом случае они уже являются узлами второго, третьего, а иногда и четвертого этапов. Собственно глубокие шейные лимфатические узлы
— наиболее многочисленная группа лимфатических узлов шеи. Эта группа включает в себя до 40 лимфатических узлов на каждой стороне шеи. Они располагаются вдоль длинной оси основного сосудисто-нервно- го пучка (см.рис.149). В зависимости от уровня их локализации выделяют верхние, средние и нижние собственно глубокие лимфатические узлы. К группе верхних узлов относят глубокие шейные лимфатические узлы, расположенные в пространстве между верхней и срединной щитовидными артериями. К группе нижних узлов относят глубокие шейные лимфатические узлы, расположенные книзу от места пересечения срединной щитовидной артерии со стволом внутренней яремной вены.
В зависимости от топографо-анатомиче- ских взаимоотношений со стволом внутренней яремной вены и общей сонной артерии, среди собственно глубоких узлов шеи выделяют узлы, расположенные между этими сосудами, а также локализующиеся кзади от яремной вены, латеральнее от нее, медиально и латерально по отношению к стволу общей сонной артерии. В большинстве случаев метастазы рака щитовидной железы локализуются в глубоких шейных узлах, расположенных между внутренней яремной веной и общей сонной артерией [7, 8, 16]. Однако метастазы опухолей этого органа часто поражают и другие группы собственно глубоких лимфатических узлов, расположенных по ходу сосудисто-нервного пучка шеи.
Другим местом «излюбленной» локализации метастазов рака щитовидной железы являются глубокие и поверхностные шейные лимфатические узлы, расположенные вблизи трахеи. Выделяют претрахеальные и паратрахеальные лимфатические узлы.
Претрахеальныелимфатическиеузлы
— располагаются на передней поверхности
трахеи (см.рис.149) и принимают лимфу от нижних отделов щитовидной железы.
Паратрахеальные лимфатические узлы располагаются по бокам от трахеи (см.рис.149). Они образуют 2 цепочки (правую и левую), которые переходят в латеротрахеальные узлы грудной полости. Также, как и претрахеальные лимфатические узлы, паратрахеальные узлы получают лимфу от нижних отделов щитовидной железы. Выносящие лимфатические сосуды паратрахеального сплетения впадают в средние и нижние глубокие шейные узлы.
Поверхностные шейные лимфатические узлы. Наряду с необходимостью тщательного изучения глубоких лимфатических узлов шеи, при выполнении эхосканирования зон возможной локализации лимфогенных метастазов рака ЩЖ определенное внимание уделяют исследованию и поверхностных лимфатических узлов шеи. При этом, методика выполнения ультрасонографии зависит от топографо-анатомических особенностей поверхностных лимфатических сплетений шеи.
Поднижнечелюстныелимфатические узлы располагаются в подчелюстном треугольнике, в фасциальном ложе поднижнечелюстной железы (рис.150). Указанная группа является регионарными узлами первого этапа для таких областей и органов,
Рис. 150. Схема расположения собственно глубокихлимфатических узлов шеи. Схема из «Атласа онкологических операций» Б.Е.Петерсон и др., Москва, Медицина, 1987 г.
1 — поднижнечелюстные лимфатические узлы; 2 — подбородочные лимфатические узлы; 3 — собственно глубокие лимфатические узлы шеи; 4 — верхние глубокие шейные узлы; 5 — средние глубокие лимфатические узлы.
129
как носовая полость, нижняя челюсть и зубы нижней челюсти, поднижнечелюстная и подъязычная слюнная железа, язык, верхняя и нижняя губа, мягкие ткани боковой поверхности лица. В отдельных случаях здесь же локализуются й метастазы рака ЩЖ[6, 7, 10, 16].
Подбородочныелимфатическиеузлы
располагаются в подбородочном треугольнике в количестве 1-2 и являются узлами первого этапа для мягких тканей подбородка и нижней губы, а также для полости рта (см.рис.150). В отдельных случаях здесь могут располагаться и метастазы рака ЩЖ [10, 16].
Собственно поверхностные шейные лимфатическиеузлырасполагаютсяпо ходу наружной яремной вены в боковой области шеи (см.рис. 148).
Методика выполнения эхосканирования зон возможной локализации лимфогенных метастазов базируется на представленных выше данных о топографо-ана- томическом расположении лимфатических сплетений шеи, а также на результатах исследований о наиболее частой локализации лимфогенных метастазов рака щитовидной железы. По окончании ультразвукового исследования щитовидной железы датчик устанавливают в правой надключичной области и получают изображение общей сонной артерии (рис. 151 а). Она является ориентиром, по ходу которого осуществляют дальнейшее перемещение датчика до уровня сосцевидного отростка. Такой методический прием позволяет произвести оценку морфофункционального состояния поверхностных и глубоких лимфатических узлов, расположенных вдоль сосудисто-нервного пучка. В норме лимфатические узлы шеи не визуализируются на ультрасонограммах. Обнаружение гипоэхогенных и (или) увеличенных в размерах лимфатических узлов является основанием для предположения о наличии^ метастазов (рис.1516). Таким больным производят прицельную биопсию из ультрасонографически измененного лимфатического узла. Для изучения лимфатических узлов левого яремного сплетения аналогичное вышеописанному исследование производят вдоль левой общей сонной артерии.
Следующим этапом является ультразвуковая оценка поверхностных и глубоких лим-
130
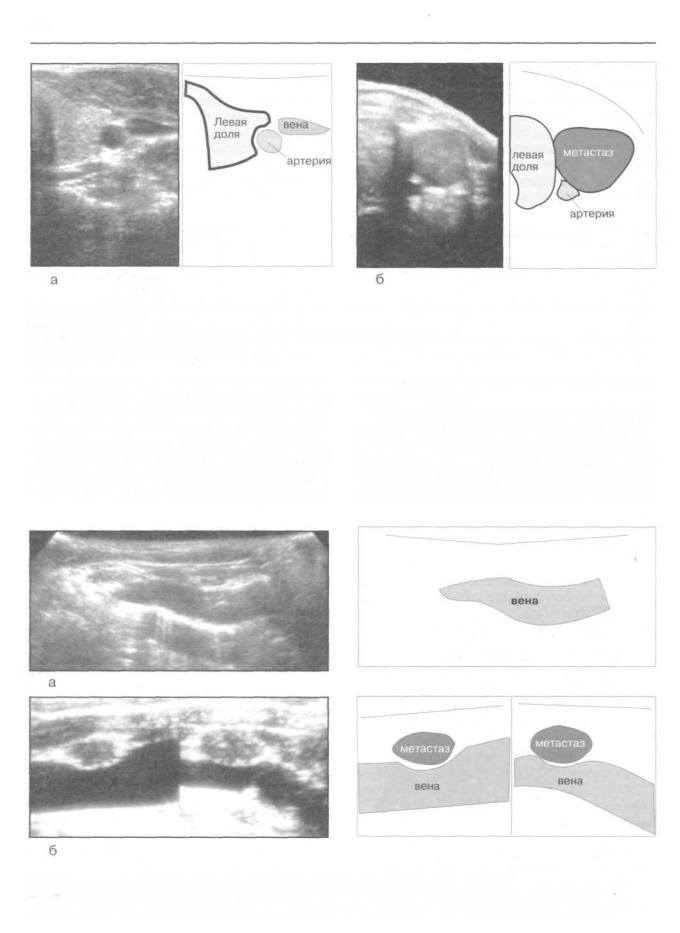
Рис. 151. Эхосканирование зон расположения лимфатических узлов яремного сплетения (собственно глубоких шейных лимфатических узлов):
а) Ультрасонограмма левой доли ЩЖ с прилежащими к ней экстраорганными сосудами.
б) Ультрасонограмма участка яремного лимфатического сплетения шеи больного раком ЩЖ. Визуализируется метастаз, расположенный по латеральному краю ЩЖ.
фатических узлов, расположенных в надключичной области. Датчик устанавливают над верхней поверхностью стернального отдела правой и левой ключиц (рис. 152а). Изменяя угол наклона датчика, добиваются отчетливого изображения надключичной вены (рис.1526). Обнаружение увеличенных в размерах лимфатических узлов служит
основанием для выполнения больному прицельной биопсии.
Для изучения претрахеальных и паратрахеальных лимфатических узлов датчик устанавливают в продольной плоскости на 2- 3 см вправо от срединной линии шеи (рис. 153а). Ориентиром в этих случаях является медиальный край щитовидной желе-
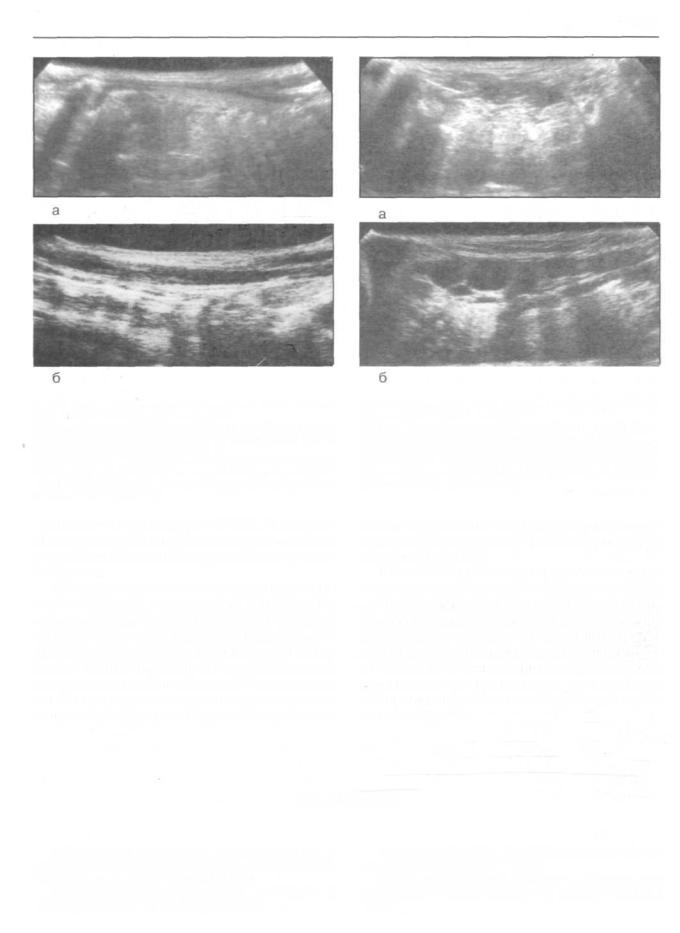
Рис. 152. Эхосканирование зон расположения надключичной группы лимфатических узлов.
а) Ультрасонограмма надключичной области здорового мужчины 56 лет. Визуализируется фрагмент надключичной вены б) Ультрасонограммы больных раком ЩЖ с метастазами в надключичные лимфатические узлы. По переднему контуру надключичной вены визуализируются гипоэхогенные и увеличенные в размерах метастатически измененные лимфатические узлы.
131
Рис. 153. Эхосканирование зон расположения пре- и па- |
Рис. 154. Эхосканированиезон расположенияподнижне- |
ратрахеальных лимфатических узлов. |
челюстных лимфатических узлов. |
а) Ультрасонограмма ЩЖ здоровой женщины 54 лет, выпол- |
а) Ультрасонограмма поднижнечелюстной области шеи здоро- |
ненная в продольной проекции. Визуализируются медиальный |
вого мужчины 37 лет. Визуализируются мышцы шеи. |
край правой доли ЩЖ и кольца трахеи. |
б) Ультрасонограмма поднижнечелюстной области шеи боль- |
б) Ультрасонограмма паратрахеальной области шеи больной |
ного РЩЖ с метастазами в лимфатические узлы шеи. Визуали- |
3. 45 лет. Диагноз: РЩЖ с метастазом в лимфатические узлы |
зируется гипоэхогенный и увеличенный в размерах поднижне- |
шеи. Визуализируется увеличенный в размерах претрахеаль- |
челюстной лимфатический узел. |
ный лимфатический узел. |
|
зы и кольца трахеи (рис.1536). Увеличенные в размерах лимфатические узлы обычно располагаются на наружной поверхности трахеи.
Завершающим этапом эхосканирования зон возможной локализации регионарных метастазов рака щитовидной железы является оценка состояния поднижнечелюстных лимфатических узлов. Датчик устанавливают в подчелюстной области, ориентируя его в горизонтальной плоскости. Смещая датчик книзу до уровня верхнего края перстневидного хряща, производят оценку состоя-
ния поверхностных и глубоких лимфатических узлов, расположенных в подчелюстной области (рис.154).
Использование описанных выше методических приемов позволяет детально изучить состояние лимфатических узлов шеи, часто являющихся локусами расположения регионарных метастазов рака щитовидной железы. При обнаружении увеличенных в размерах гипоэхогенных лимфатических узлов производят тонкоигольную пункционную аспирационную биопсию под эхолокационным контролем.
ЛИТЕРАТУРА
1. Бохман Я.В., Винтергальтер С.Ф., Стенгре- |
3. Зедгенидзе Г.А., Цыб А.Ф. Клиническая лим- |
вицА.А.Лимфографическаядиагностикавонкологи- |
фография. М., Медицина, 1977. |
ческой клинике. Рига, "Занатне", 1980. |
4. Редер К. Лимфография и возможности ее ис- |
2. БехынеМ., ЦыбА.Ф., НестайкоО.В. Атлас |
пользования в онкологии (пер. с нем.). М., Медицина, |
лимфографии. Прага, "Авиценум", 1983. |
1977. |

1 3 3
3.4. ТОНКОИГОЛЬНАЯ ПУНКЦИОННАЯ БИОПСИЯ ПОД УЛЬТРАЗВУКОВЫМ НАВЕДЕНИЕМ ПУНКЦИОННОИ ИГЛЫ
Оценка структурных изменений тиреоидной паренхимы является важнейшей, но не единственной областью применения ультразвуковых методов в диагностике заболеваний щитовидной железы. Заключительным этапом ультразвукового исследования, особенно — у больных с объемными образованиями этого органа, является выполнение биопсий для морфологической верификации диагноза. Цитологический анализ материала позволяет не только установить (или исключить) признаки злокачественности, но и определить степень выраженности анаплазии рака щитовидной железы, судить о клеточных источниках происхождения опухоли и др. [1, 3, 9, 18 ]. У больных с заболеваниями щитовидной железы эффективность цитологической диагностики, т.е. — количество выявленных злокачественных опухолей, достигает 95-96% [1, 2, 4, 6, 7, 10]. При отличительном разграничении коллоидных узлов от рака щитовидной железы точность прицельной биопсии составляет 99,3%- 100% [6, 8, 12, 14], а при доброкачественных опухолях (аденомах) достигает 92-96% [11, 13, 16, 17].
Повышению диагностической эффективности прицельных биопсий из щитовидной железы способствовало применение ультразвукового контроля за движением биопсийной иглы [2, 6, 7, 11]. Этот методический подход позволяет получить материал из очага поражения и исключить риск возможных осложнений [13 — 18].
Как известно, щитовидная железа — поверхностно расположенный орган, доступный для получения материала при выполнении биопсии и под пальпаторным контролем. Однако около 30% всех «слепых» биопсий из щитовидной железы оказываются неинформативными. Это обусловлено ошибками при взятии материала для цитологического (или гистологического) исследования. Кроме того, при выполнении «слепых» биопсий из щитовидной железы, особенно
— начинающими врачами, нельзя полностью исключить риск повреждения кровеносных сосудов и нервных стволов шеи.
Такие данные являются веским аргумен-
том в пользу целесообразности использования ультразвукового контроля при выполнении прицельных биопсий из щитовидной железы [2, 3, 6, 9, 13, 14]. Этот же метод контроля значительно повышает диагностическую эффективность тонкоигольной биопсии и при морфологической верификации лимфогенных метастазов у больных раком щитовидной железы [15, 18].
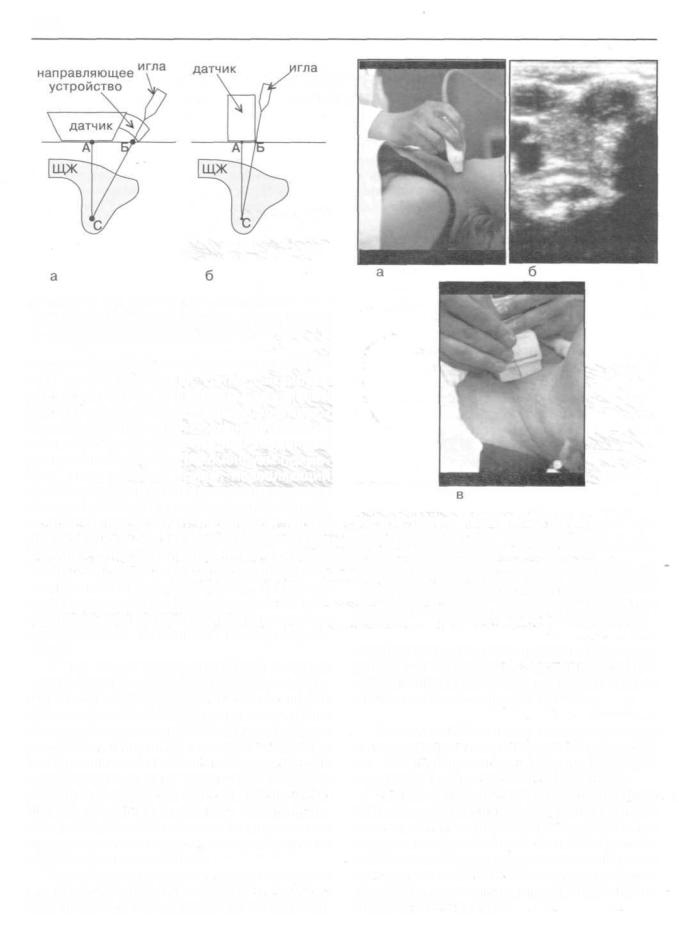
Техника выполнения УЗ-ТПАБ из щитовидной железы. Для проведения тонкоигольной аспирационной биопсии под ультразвуковым контролем (УЗ-ТПАБ) из щитовидной железы использовали высокочастотные датчики секторного или линейного сканирования. По мере накопления опыта применения УЗ-ТПАБ у пациентов с заболеваниями щитовидной железы мы убедились в том, что применение специальных ультразвуковых пункционных датчиков для морфологической верификации диагноза нецелесообразно. При выполнении биопсий с помощью датчика такой конструкции пункционную иглу необходимо ориентировать под углом к его поверхности. Это приводит к увеличению расстояния между датчиком и очагом поражения (рис.155а). Соответственно, увеличивается травматизация ткани щитовидной железы и окружающих структур. Напротив, при использовании обычных датчиков ультразвукового сканирования биопсию можно производить из точки, максимально приближенной к очагу поражения (рис.1556). Пункцию выполняли при положении больного лежа на спине с запрокинутой головой. Место пункции обрабатывали спиртом. В подготовке и подаче инструментария принимала участие операционная медсестра. В зависимости от характера выявленных изменений, использовали иглы диаметром 0,6-0,7 мм (23-27 д) и длиной — 3-10 см.
При обнаружении очага поражения в тиреоидной паренхиме датчик устанавливали над этим участком (рис. 156а). Обычно использовали проекцию сканирования, ориентированную вдоль горизонтальной плоскости шеи (поперечный срез). Датчик пере-
134
Рис. 155. Схема выполнения УЗ-ТПАБ с использованием пункционного (а) и обычного (б) ультразвуковых датчиков.
Расстояние между поверхностью кожи и очагом поражения значительно короче в последнем (б) случае.
мещаем в участок, максимально приближенный к очагу поражения. Затем фиксируем его левой рукой, а правой — выполняем пункцию. Для этого добиваемся отчетливого изображения очага поражения на экране монитора (рис.1566). Перед введением пункционной иглы мы рекомендуем применять методический прием, позволяющий добиться уменьшения расстояния между поверхностью датчика и очагом поражения. С этой целью следует произвести легкое надавливание биопсийной иглой в месте будущей пункции (рис.156в). Это приводит к смещению кожи и очага поражения. Смещение последнего хорошо регистрируется на экране монитора. При обнаружении участка кожи, наиболее приближенного к очагу поражения, выполняем пункцию (рис. 156г).
К игле подсоединяем шприц и создаем оптимальный вакуум. На его высоте совершаем 2-3 поступательных движения иглой в очаге поражения. Кончик иглы на экране монитора визуализируется в виде ярко-све- тящейся точки или полоски (рис.157). При поступлении в канюлю иглы первых порций аспирата постепенно уменьшаем вакуум в шприце до нулевой отметки. После этого шприц отсоединяем от иглы. Аспират, находящийся в игле и канюле, выдуваем на предметное стекло, для последующего его цитологического анализа.
Втаблице6представленыданныеораспределении больных, в зависимости от окончательного диагноза, которым были произ-
Рис. 156. Подготовительные этапы при выполнении УЗТПАБ из щитовидной железы.
а) Ориентация ультразвукового датчика при выполнении УЗТПАБ из щитовидной железы.
б) Ультрасонограмма, выполненная в горизонтальной проекции. Отчетливо видно гипоэхогенное образование овальной формы, локализующееся в правой доле щитовидной железы.
в) Методический прием, позволяющий уменьшить расстояние между местом пункции и очагом поражения ЩЖ. Объяснения— в тексте.
ведены тонкоигольные пункционные аспирационные биопсии из щитовидной железы, выполненные под ультразвуковым наведением кончика иглы (УЗ-ТПАБ).
Накопленный нами опыт позволяет сделать ряд практических рекомендаций,
способствующих повышению диагностической эффективности УЗ-ТПАБ из ЩЖ:
1) При увеличении размеров щитовидной железы, сочетающимся с изменениями ее эхогенности, в первую очередь необходимо определить участки пониженной акустической плотности, а также — изо- и гиперэхогенные участки. УЗ-ТПАБ следует проводить как из участков с пониженной, так и с повышенной эхогенностью.

135
Рис. 157. Визуализация кончика иглы в очаге поражения.
а) Ультрасонограмма больного аденомой щитовидной железы, выполненная в горизонтальной плоскости. Визуализируется гиперэхогенное образование с анэхогенной полостью (кистозная дегенерация аденомы). В центре его — ярко светящаяся точка, являющаяся ультразвуковым изображением кончика аспирационной иглы.
б) Ультрасонограмма, отражающая момент попадания пункционной иглы в кисту небольшого размера (6 мм в диаметре). На фоне мелкозернистой структуры правой доли ЩЖ по ее передней поверхности визуализируется анэхогенное образование округлой формы с ровными краями. В центре кисты — ярко светящаяся точка (кончик пункционной иглы).
в) Ультрасонограмма щитовидной железы больного папиллярным раком при выполнении ему УЗ-ТПАБ. В центре гипоэхогенного образования визуализируется светящаяся точка — кончик аспирационной иглы.
г) Ультрасонограмма, отражающая этап получения материала из метастатически измененного лимфатического глубокого шейного узла больного раком щитовидной железы. В центре гипоэхогенного и увеличенного в размерах лимфатического узла — ярко светящаяся точка.
2) При различных вариантах сочетаний диффузных изменений эхогенности ткани ЩЖ, на фоне которых имеются локальные поражения тиреоидной паренхимы, методические приемы должны иметь определенные особенности. Так, например, при сочетании диффузного снижения эхогенности ткани ЩЖ с гипер-, гипо- и (или) изоэхогенными узлами необходимо пунктировать каждый участок, где есть хотя бы одно из описанных выше нарушений эхоплотности ЩЖ.
В зависимости от ультразвуковой характеристики кист и солидных узлов целесообразно использовать методические приемы, также имеющие определенные особен-
н о с т и . |
•:••..-• • - •- -г • • . - - . • • . |
3) При коллоидных и геморрагических кистах следует использовать относительно толстые иглы (16-18д), в то время как при выполнении УЗ-ТПАБ из кист, содержащих транссудат — тонкие иглы (25-29д).
4)Пункцию сложной кисты нужно проводить из 2-х точек: в начале — из тканевого участка и лишь затем — из полости кисты.
5)При гиперэхогенной аденоме лучше использовать иглы минимального диаметра (23д) и аспирировать материал из нескольких участков.
6)При аденомах с кистозными изменениями первоначально следует пунктировать тканевой компонент (иглами малого диамет-

136
Таблица 6 Распределение больных
сзаболеваниями щитовидной железы, которым была выполнена УЗ-ТПАБ
Группы больных |
|
Количество |
(в зависимости от |
|
|
|
больных |
|
окончательного диагноза) |
|
|
|
|
|
Киста |
|
291 |
Аденома |
|
563 |
Коллоидные узлы |
^ |
1084 |
Рак щитовидной железы |
|
316 |
Диффузный эутиреоидный зоб |
73 |
|
Диффузный токсический зоб |
|
26 |
Аутоиммунный тиреоидит |
|
.__ |
Хашимото |
|
|
Тиреоидит Риделя |
|
6 |
Состояние после операции |
|
|
(подозрение на рецидив рака |
|
231 |
ЩЖ) |
|
|
Метастазы злокачественных |
|
|
опухолей других локализаций в |
42 |
|
ткани ШЖ |
|
|
Срединные кисты шеи |
|
6 |
ВСЕГО: |
|
3043 |
ра) и лишь затем — кистозные полости аденомы (иглами большого диаметра).
7)При обнаружении в аденоме зон с различной акустической плотностью, вначале необходимо аспирировать материал из гипоэхогенных участков и лишь затем — из изо- и гиперэхогенных участков.
8)При пункции узлов со смешанной эхоструктурой для повышения диагностической эффективности УЗ-ТПАБ мы рекомендуем аспирировать материал последовательно из участков, отличающихся по эхоплотности. В начале УЗ-ТПАБ целесообразно производить из гипоэхогенного участка, и лишь затем — из изо- и гиперэхогенных участков.
9)При подозрении на злокачественную опухоль УЗ-ТПАБ необходимо выполнить из нескольких (по крайней мере — двух) ее участков. Вначале следует пунктировать центральный участок, т.к. именно здесь (при подтвержденном впоследствии диагнозе рака) локализуются злокачественно измененные клетки.
10)В тех случаях, когда раковая опухоль неоднородна по акустической плотности, при выполнении УЗ-ТПАБ необходимо по-
лучить материал из гипоэхогенного участка.
Данные литературы и наш собственный опыт выполнения УЗ-ТПАБ с последующим цитологическим исследованием аспирационного материала из ЩЖ позволяют считать этот метод крайне важным для морфологической верификации диагноза. УЗ-ТПАБ приобретает особую значимость в тех случаях, когда совокупность ультразвуковых признаков не позволяет высказать определенного мнения о характере патологического процесса в щитовидной железе. УЗ-ТПАБ еще более важно производить в тех случаях, когда появляется хотя бы малейшее подозрение на злокачественное новообразование. По нашим данным, диагностическая эффективность УЗ-ТПАБ в сопоставлении с результатами гистологического исследования операционного материала составляет,
всреднем, 93%. Такие данные согласуются
сзаключениями и выводами других исследователей [1, 2, 6, 9, 10, 14, 16, 17]. Однако мы, как и другие авторы, не считаем этот этап исследования заключительным. Если остаются сомнения, необходимо прибегать к гистологической верификации ультразвукового и цитологического заключений.
Техника выполнения УЗ-ТПАБ из лимфатических узлов шеи. При обнаружении гипоэхогенных лимфатических узлов на ультрасонограммах в большинстве случаев для верификации диагноза метастазов рака щитовидной железы мы выполняли тонкоигольную пункционную аспирационную биопсию. Также, как и при пункции щитовидной железы, биопсию выполняли под ультразвуковым контролем с помощью датчика секторного сканирования Toshiba-SM- 705. Эту диагностическую процедуру не производили лишь в тех случаях, когда диагноз рака щитовидной железы был верифицирован морфологически, а признаки лимфогенных метастазов были хорошо выражены (пальпировались конгломераты резко увеличенных в размерах лимфатических узлов и на ультрасонограммах идентифицировались увеличенные в размерах цепочки лимфатических узлов). УЗ-ТПАБ была выполнена 617 больным из 871 лимфатического узлов шеи различной локализации (таблица
7).
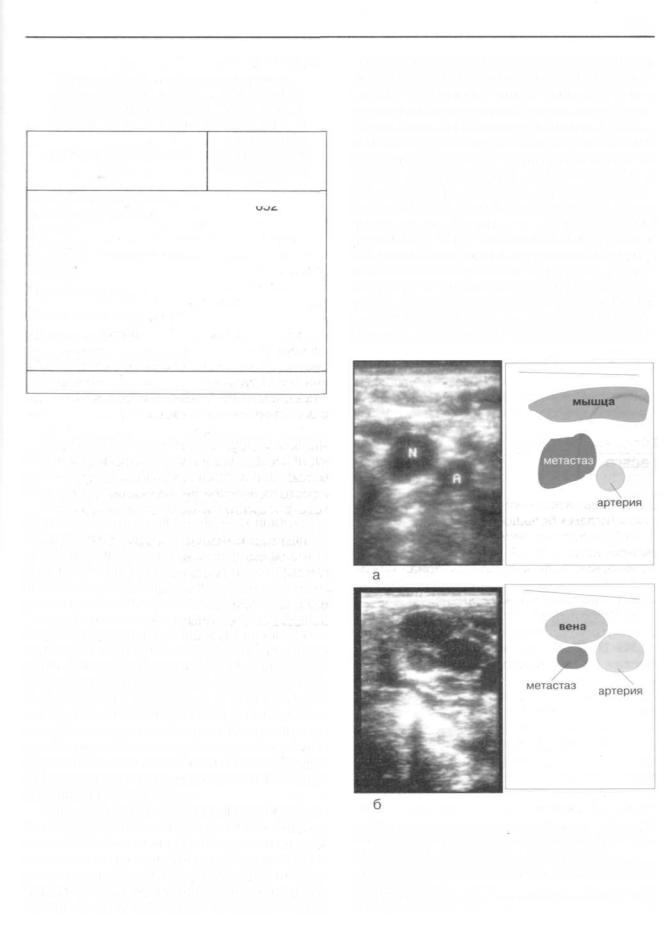
Таблица 7
Группы лимфатических узлов шеи, из которых была выполнена УЗ-ТПАБ, для морфологической верификации метастазов рака щитовидной железы
|
Количество |
|
Группы лимфатических |
пунктированных |
|
узлов |
лимфатических |
|
Собственно глубокие |
узлов |
|
есо |
||
лимфатические узлы |
||
|
||
из них: |
|
|
верхние |
124 |
|
средние |
287 |
|
нижние |
241 |
|
Претрахеальные |
43 |
|
Паратрахеальные |
18 |
|
Надключичные |
162 |
|
Поднижнеподбородочные |
7 |
|
ВСЕГО: |
871 |
В зависимости от локализации измененных лимфатических узлов методика выполнения УЗ-ТПАБ имеет определенные особенности:
УЗ-ТПАБ из собственно глубокихлимфатических шеи. При обнаружении измененных в размерах и (или) гипоэхогенных лимфатических узлов, входящих в состав яремного сплетения, особую значимость приобретает использование ультразвукового контроля за движением биопсийной иглы. Это позволяет исключить риск повреждения сонной артерии и яремной вены, вблизи которых располагаются глубокие шейные узлы. Ультразвуковое исследование этих сосудов является методическим подходом, позволяющим исключить и возможность травматизации блуждающего нерва. Несмотря на то, что этот нервный ствол не визуализируется на сонограммах, его топогра- фо-анатомические соотношения с сосудами шеи служат хорошим ориентиром при выполнении УЗ-ТПАБ.
Для обнаружения измененных лимфатических узлов внутреннего яремного сплетения датчик устанавливаем в горизонтальной плоскости перпендикулярно сосудисто-не- рвному пучку в надключичной области. Постепенно перемещая датчик кверху, в направлении сосцевидного отростка, производим
137
эхосканирование зон возможной локализации лимфогенных метастазов. При обнаружении измененных лимфатических узлов проводим оценку их топографо-анатомичес- ких соотношений с сосудами шеи. В большинстве случаев пораженные метастазами рака лимфатические узлы располагались между стволом общей сонной артерии и внутренней яремной веной (рис. 158а). Нередко измененные лимфатические узлы располагались кзади от яремной вены (рис.1586). В 149 наблюдениях (22,6 % от общего числа больных с метастазами рака) метастазы локализовались в узлах, расположенных медиальнее от общей сонной артерии. Перед выполнением биопсии выбираем наименьшее расстояние между поверхностью датчика и увеличенным лимфати-
Рис. 158. Ультрасонограммы. отражающие различия локализацииметастазовракащитовиднойжелезывлимфатические узлы внутреннего яремного сплетения.
а) Гипоэхогенный лимфатический узел, расположенный между стволом общей сонной артерии и внутренней яремной веной (продольный срез).
б) Лимфатический узел, расположенный кзади от яремной вены (поперечный срез).
138
ческим узлом. Затем производим сдавливание датчиком области шеи, добиваясь прекращения кровотока по внутренней яремной вене. Этот методический прием позволяет производить фиксацию измененного лимфатического узла и, одновременно, способствует минимальной травматизации вены.
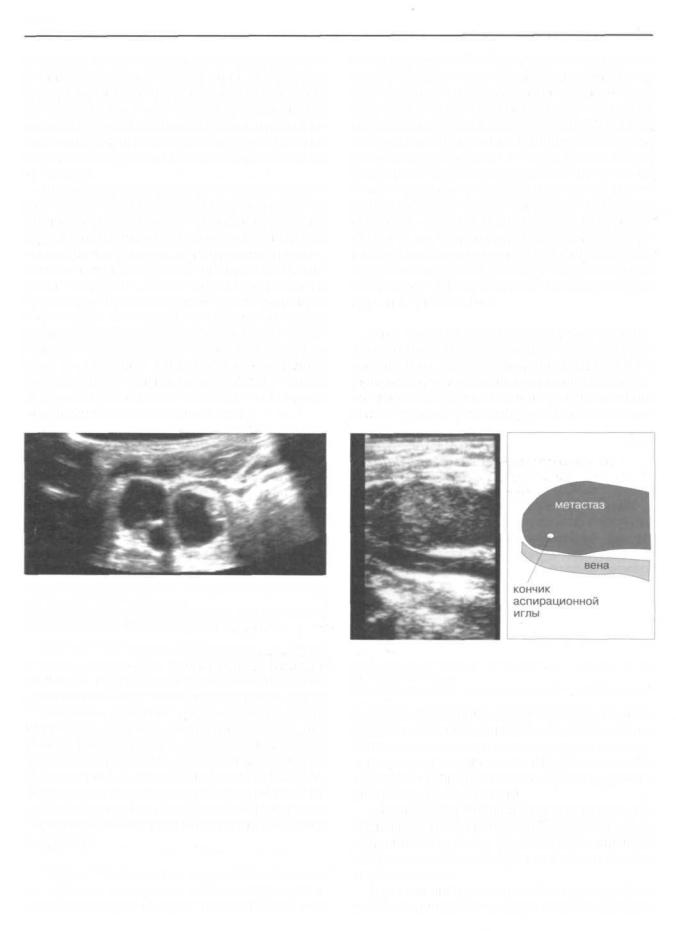
При попадании иглы в ткань лимфатического узла, она визуализируется на экране монитора в виде ярко светящейся точки (рис.159). Для улучшения визуализации кончика иглы используем специальный прием, заключающийся в ее смещении на 3-4 мм в разные стороны. Затем производим активную аспирацию материала узла шприцем объемом 5-10 см3. При этом добиваемся исключения попадания материала в полость шприца. Такой прием позволяет предотвратить разрушение клеток и межклеточных связей. Полученный материал выдуваем на предметное стекло и готовим мазки для цитологического исследования.
Рис. 159. Ультрасонограмма лимфатических узлов внутреннего яремного сплетения.
В центре метастатически измененного лимфатического узла отчетливо визуализируется кончик биопсийной иглы.
УЗ-ТПАБ из надключичныхлимфатических узлов. Для идентификации измененных лимфатических узлов этой области датчик вначале устанавливаем вдоль верхнего края правой и затем — левой ключиц. При этом добиваемся отчетливой визуализации правой или левой надключичных вен (рис.160). При обнаружении ультрасонографически измененного лимфатического узла под контролем ультразвукового датчика выполняем пункцию этого узла. Аспирацию материала производим по методике, описанной выше.
УЗ-ТПАБ из поднижнеподбородочных лимфатических узлов. С помощью ультразвукового датчика, установленного в ниж-
неподбородочной области, производим эхосканирование зон расположения лимфатических узлов этой области шеи. При обнаружении увеличенного в размерах и (или) гипоэхогенного лимфатического узла производим его фиксацию. Медицинская сестра фиксирует датчик в заданном положении, при котором на экране монитора наиболее отчетливо визуализируется измененный лимфатический узел (рис.161). Врач, с помощью указательного и безымянного пальцев левой руки фиксирует пунктируемый узел, контролируя его расположение на экране монитора. Правой рукой производится биопсия. Материал получаем по методике, описанной выше.
Для оценки информативности тонкоигольной пункционной аспирационной биопсии под контролем ультразвука (УЗ-ТПАБ) в диагностике кист, аденом, коллоидных узлов и рака ЩЖ, а также в верификации диагноза регионарных лимфогенных метаста-
Рис. 160. Ультрасонограмма лимфатического узла надключичной области.
Кончик иглы визуализируется в виде ярко светящейся точки.
зов рака щитовидной железы, производили сравнение заключений, основанных на цитологическом анализе аспирационного материала, с результатами морфологического изучения лимфатических узлов, удаленных во время операции.
Диагноз, установленный с помощью тонкоигольной (аспирационной) биопсии разделяли на 3 группы: 1) злокачественный, 2) доброкачественный, 3) недиагносцированная патология.
Вычисляли чувствительность, специфичность и диагностическую точность ультра-
