
3 курс / Фармакология / Трансдермальные_терапевтические_системы_Басок_Ю_Б_,_Кузнецова_Е
.pdf
ТРАНСДЕРМАЛЬНЫЕ ТЕРАПЕВТИЧЕСКИЕ СИСТЕМЫ
Таблица 28
Исследование диффузии инсулина из лабораторных образцов трансдермальной терапевтической системы при различном времени воздействия микроигл на кожу
Время воздействия микроигл |
Масса инсулина, прошедшего |
|
через кожу за 24 часа, мкг (n=5) |
||
|
||
без микроигл |
160,2 ± 78,0 |
|
|
|
|
15 мин |
158,2 ± 54,0 |
|
|
|
|
30 мин |
225,7 ± 64,8 |
|
|
|
|
1 час |
313,0 ± 66,0 |
|
|
|
|
2 часа |
345,0 ± 74,3 |
|
|
|
Накожная аппликация микроигл в течение 15 мин. не повлияла на количество гормона, прошедшего через неконсервированную кожу кролика in vitro. С увеличением времени воздействия микроигл количество продиффундировавшего инсулина начинает возрастать с 225,7 ± 64,8 мкг для 30 минутной аппликации до 345,0 ± 74,3 мкг для 2 часовой.
Один и два часа предварительного воздействия микроигл одинаково влияют на диффузию инсулина из ТТС через кожу. Между значениями массы гормона, прошедшего через кожу после одно- и двухчасовой аппликации микроигл (соответственно, 313,0 ± 66,0 мкг и 345,0 ± 74,3 мкг) нет статистически достоверного отличия (р>0,5), в то время как увеличение массы продиффундировавшего ЛВ по сравнению с контролем достоверно.
При проведении дальнейших экспериментов in vitro было выбрано время воздействия микроигл на кожу кролика равное 1 часу.
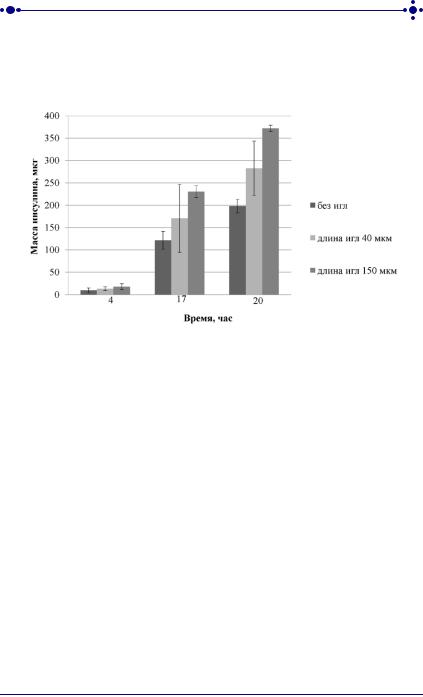
На рисунке 41 представлена динамика выхода инсулина in vitro из ТТС через неконсервированную кожу в течение 20 часов после предварительного воздействия на нее аппликатора с микроиглами длиной 40 мкм и 150 мкм в течение 1 ч. В качестве контроля
150
ПРИМЕРЫ ОПТИМИЗАЦИИ СИСТЕМ ЧРЕСКОЖНОЙ ДОСТАВКИ С ПОМОЩЬЮ ХИМИЧЕСКИХ И ФИЗИЧЕСКИХ АКТИВАТОРОВ ПЕРЕНОСА ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ
использовали образцы растворов из приемных камер ячеек Франца после диффузии инсулина из ТТС через неконсервированную кожу без предварительной аппликации микроигл.
Рис. 41. Динамика выхода инсулина из трансдермальных терапевтических систем через неконсервированную кожу кролика in vitro
Из представленных диаграмм следует, что через 4 ч от начала эксперимента масса прошедшего через кожу инсулина после предварительной аппликации микроигл длиной 40 мкм составляет 13,4 ± 4,3 мкг, что в 1,5 раза больше, чем в контрольных образцах (9,6 ± 5,3 мкг, р<0,5). Через 17 часов и 20 часов масса инсулина в системе с использованием таких микроигл составляет 170,7 ± 75,7 мкг и 282,5 ± 61,1 мкг, соответственно, что в 1,4 раза больше, чем в системе без игл (р<0,5).
При этом отметим, что увеличение длины микроигл еще более усиливает диффузию инсулина. При аппликации микроигл длиной 150 мкм количество продиффундировавшего гормона составляет 17,9 ± 8,6 мкг, 230,4 ± 13,2 мкг и 372,3 ± 7 мкг, через 4, 17 и 20 часов соответственно. Это примерно в 1,9 раз больше по сравнению с ТТС без использования микроигл.
151
Рекомендовано к изучению сайтом МедУнивер - https://meduniver.com/

ТРАНСДЕРМАЛЬНЫЕ ТЕРАПЕВТИЧЕСКИЕ СИСТЕМЫ
Проведенные модельные эксперименты показали, что предварительная аппликация микроигл повышает диффузию инсулина через кожу in vitro, при этом сформированные в роговом слое каналы сохраняют свою способность усиливать диффузию инсулина в течение 20 часов.
152

ГЛАВА 6.
ИССЛЕДОВАНИЕ БИОЛОГИЧЕСКОГО ДЕЙСТВИЯ СИСТЕМ ЧРЕСКОЖНОЙ ДОСТАВКИ
Н. В. Перова, Е. Г. Кузнецова, В. И. Севастьянов
Разработка системы чрескожной доставки – сложный и длительный процесс, включающий в себя не только поиски состава, конструкции, технологических решений, но и проведение различных исследований по безопасности применения разрабатываемого лекарственного средства и оценки его функциональных свойств. Такие исследования включают в себя изучение биологического действия, фармакокинетики и функциональной активности разработанной системы чрескожной доставки в составе ТТС.
Объем проводимых исследований должен определяться требованиями соответствующего раздела Руководства по проведению доклинических исследований лекарственных средств в зависимости от того, к какой фармакотерапевтической группе относится активный компонент [269]. Гарантировать безопасность и эффективность применения конкретного препарата можно только после тщательного изучения фармакокинетических и фармакодинамических свойств лекарственного средства, обусловленных физико-химическими свойствами молекулы действующего вещества [270].
Так как создание ТТС того или иного лекарственного вещества, как правило, связано с разработкой нового способа введения уже имеющегося лекарственного средства, то известны результаты влияния активной субстанции на организм и определены терапевтически эффективные концентрации вещества в крови. Таким образом, функциональные свойства разработанной системы чрескожной доставки в составе ТТС можно подтверждать результатами фармакокинетики лекарственного вещества в крови животного in vivo или изучением специфической фармакологической активности на экспериментальных моделях в сравнении с традиционными способами введения.
153
Рекомендовано к изучению сайтом МедУнивер - https://meduniver.com/
ТРАНСДЕРМАЛЬНЫЕ ТЕРАПЕВТИЧЕСКИЕ СИСТЕМЫ
При проведении доклинических исследований трансдермальных терапевтических систем при разработке схемы применения лекарственной формы необходимо учитывать возможное накопление и остаточное количество лекарственного вещества в слоях кожи в концентрациях, оказывающих терапевтическое действие.
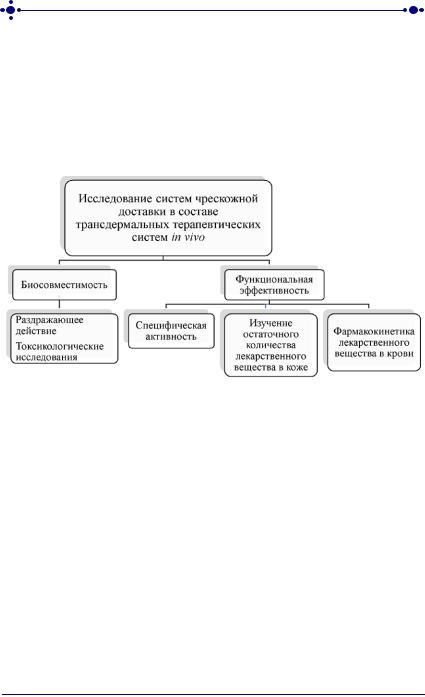
На рисунке 42 представлена блок-схема исследования разработанных систем чрескожной доставки in vivo.
Рис. 42. Схема исследований in vivo разработанных систем чрескожной доставки
Исследования биологического действия разработанных систем чрескожной доставки в составе трансдермальных лекарственных форм проводят в соответствии с ГОСТ ISO 10993 «Изделия медицинские. Оценка биологического действия медицинских изделий» Часть 10 – Исследования раздражающего и сенсибилизирующего действия и Часть 11 – Исследование общетоксического действия. Исследования включают в себя оценку острой и субхронической токсичности, а также местнораздражающего действия.
Исследования острой токсичности на животных обязательны для всех новых лекарственных препаратов. Острая токсичность – это токсическое действие вещества, введенного в однократной дозе или в многократных дозах в течение не более 24 ч, которое может выражаться в расстройстве физиологических функций или
154

ИССЛЕДОВАНИЕ БИОЛОГИЧЕСКОГО ДЕЙСТВИЯ СИСТЕМ ЧРЕСКОЖНОЙ ДОСТАВКИ
нарушении морфологии органов экспериментальных животных, а также гибели животного [271]. Исследование острой токсичности лекарственной формы оценивают на двух видах животных обоих полов [269, 272, 273]. Сведения, получаемые по результатам таких исследований, используют для предварительного выяснения органов-мишеней токсичности и иногда для выявления отсроченной токсичности. Исследования острой токсичности также могут содействовать в выборе начальных доз в исследованиях I фазы у человека.
Так как в работе авторы разрабатывали системы чрескожной доставки для лекарственных веществ с уже известными терапевтическими концентрациями, то исследования острой токсичности не проводили.
Биосовместимость системы чрескожной доставки в значительной степени зависит от входящих в ее состав вспомогательных веществ, которые порой могут составлять до 99% и более состава лекарственной формы. В соответствии с современными представлениями состав вспомогательных веществ может обусловливать не только профиль эффективности лекарственного препарата, но и профиль безопасности его медицинского применения. Объем требований токсикологических исследований лекарственного средства включает изучение общетоксических свойств вспомогательных веществ и их специфической токсичности.
Изменение отношения к статусу вспомогательных веществ обусловило изменение уровня требований к их доклиническому изучению. С точки зрения риска медицинского применения оценивается безопасность использования вспомогательных веществ предлагаемым способом введения. Не допускается их влияние на основное терапевтическое действие препарата, а также способность в используемом количестве оказывать токсическое или местно-раздражающее действие [274].
В качестве примера приводятся результаты испытаний биологического действия, полученные авторами для полимерной и эмульсионной систем чрескожной доставки в составе ТТС без лекарственных веществ (полимерная и эмульсионная ТТС плацебо).
155
Рекомендовано к изучению сайтом МедУнивер - https://meduniver.com/

ТРАНСДЕРМАЛЬНЫЕ ТЕРАПЕВТИЧЕСКИЕ СИСТЕМЫ
6.1. Исследование субхронической токсичности
Субхроническая токсичность – это совокупность токсических эффектов, вызываемых повторным введением того или иного токсического вещества в одинаковой дозе в течение определенного периода времени.
Исследование токсического действия вспомогательных веществ СЧД в составе ТТС на системы организма и внутренние органы животных при их многократном аппликационном применении было проведено в работе на двух видах животных [269]:
–крысы аутбредные (самцы), вес 230–250 г.,
–кролики (самцы), порода: Новозеландский белый, вес 2200–2500 г.
Животные были получены из питомника ООО «КролИнфо» Орехово-Зуевский район, деревня Новая. Карантин для крыс составлял 14 ней, для кроликов 21 день. Во время этого периода все животные оставались здоровыми. Микробиологический статус кормов для животных соответствовал «Ветеринарно-санитарным нормам и требованиям к качеству кормов для непродуктивных животных» и не оказывает негативного влияния на результаты проводимого теста. Животные получали корм без ограничения, лишали корма только на ночь перед взвешиванием и эвтаназией. Микробиологический статус воды соответствовал СанПиН 2.1.4.1074–01 «Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения». Доступ к воде не ограничивался.
Для субхронического эксперимента было изготовлено 182 лабораторных образца ТТС плацебо с полимерной системой чрескожной доставки и столько же образцов ТТС плацебо с эмульсионной. Составы ТТС плацебо представлены в таблицах 29 и 30.
При проведении исследования животные были рандомизированы по группам. В качестве критерия отбора принималась масса тела. При этом индивидуальное значение массы не должно было отклоняться от среднего более чем на 10%. Были сформированы три группы (контрольная и две опытные) крыс по 10 голов в каждой
итри аналогичные группы кроликов по 3 головы в каждой. В течение 14 суток ежедневно животным опытных групп на заранее
156

ИССЛЕДОВАНИЕ БИОЛОГИЧЕСКОГО ДЕЙСТВИЯ СИСТЕМ ЧРЕСКОЖНОЙ ДОСТАВКИ
выбритый участок спины наклеивали ТТС плацебо площадью 10 см2. В качестве контрольных групп были использованы интактные животные (крысы и кролики).
Таблица 29
Состав полимерной трансдермальной терапевтической системы плацебо
Компоненты |
Количество, г |
|
|
– Активное лекарственное веще- |
– |
ство |
|
– «Композиция акриловая адгезив- |
|
ная для трансдермальных терапев- |
0,8 |
тических систем» |
0,7 |
– спирт этиловый |
|
– 9,8% раствор альфа–токоферо- |
0,04 |
ла ацетата в масле ядер косточек |
|
абрикоса |
|
Таблица 30
Состав эмульсионной трансдермальной терапевтической системы плацебо
Компоненты |
Количество, г |
|
|
Активное лекарственное вещество |
– |
Композиция эмульсионная, |
0,989 |
в том числе вспомогательные |
|
вещества: |
|
– 9,8% раствор альфа–токоферо- |
|
ла ацетата в масле ядер косточек |
0,325 |
абрикоса |
|
– диоктилсульфосукцинат натрия |
|
– полиглицерил-6 полирицинолеат |
0,057 |
(Decaglyn PR-20) |
|
– водный экстракт коры дуба |
|
– гидрокарбонат натрия |
0,025 |
|
0,572 |
|
0,010 |
|
|
|
|
157 |
|
Рекомендовано к изучению сайтом МедУнивер - https://meduniver.com/

ТРАНСДЕРМАЛЬНЫЕ ТЕРАПЕВТИЧЕСКИЕ СИСТЕМЫ
В течение исследования ежедневно утром и во второй половине дня вели наблюдение за каждым животным. При осмотре оценивали: выживаемость, внешний вид, состояние шерстного покрова, глаз, носа, характер дыхания, поведение (возбудимость, агрессивность), реакцию на внешние раздражители, болевую реакцию, потребление корма и воды, количество и консистенцию фекальных масс, цвет мочи.
До начала применения ТТС плацебо (фон) и в конце исследования регистрировали следующие показатели:
●масса тела;
●потребление корма и воды;
●температура (измеряли ректально с помощью электрического медицинского термометра ТПЭМ 1);
●клинический анализ крови;
●биохимический анализ крови;
●биохимическое исследование мочи.
Забор крови производили из хвостовой вены крысы и из краевой вены уха кролика после 18 часов голодания. Исследования крови проводили на гематологическом анализаторе Mindray BC 2800 vet (Mindray, Китай), на биохимических фотометрах Stat Fax 1904+ и Stat Fax 4500+ (Awareness Technology Inc., США) с использованием стандартных наборов реагентов UTS (ООО «Биосенсор АН», Россия и Ольвекс Диагностикум, Россия).
Анализы мочи проводили на анализаторе Урискан Оптима (YD Diagnostics, Южная Корея) с помощью полосок Uriscan.
Животных из эксперимента выводили (наркотизировали ингаляционно диэтиловым эфиром) через сутки после открепления последней ТТС плацебо с дальнейшим макроскопическим, морфометрическим исследованием органов и тканей.
Перечень органов, подлежавших макроскопическому исследованию: кожа, лимфатические узлы, аорта, сердце, гортань, трахея, легкие, тимус, пищевод, желудок, тонкий кишечник, толстый кишечник, печень, поджелудочная железа, селезенка, почки, надпочечники, мочевой пузырь, семенники, подчелюстная слюнная железа с лимфатическими узлами, щитовидная железа, головной мозг.
158

ИССЛЕДОВАНИЕ БИОЛОГИЧЕСКОГО ДЕЙСТВИЯ СИСТЕМ ЧРЕСКОЖНОЙ ДОСТАВКИ
Определяли массу сердца, легких, тимуса, печени, селезенки, почек, головного мозга, семенников.
Морфометрическую оценку параметров органов животных осуществляли с помощью весов Shinko AJ 1200CE (Shinko Denshi CO. Ltd, Япония) с вычислением относительной массы органов и их стандартных отклонений.
На протяжении исследования все животные оставались живы. В контрольных группах и в группах, получавших ТТС плацебо, животные выглядели здоровыми, охотно поедали корм, реагировали на внешние раздражители, проявляли интерес к людям. Мышечный тонус не отличался повышенной возбудимостью. Как крысы, так и кролики истощением не страдали. Шерстный покров густой, ровный и блестящий, без изменения естественного цвета, плотно прилегал к поверхности тела, выпадения или ломкости шерсти не выявлено. Область живота в объеме не увеличена. Дыхание ровное, обычного ритма. Слюноотделение без патологии. Ушные раковины розового цвета без корок, не воспалены, подергиваний не замечено. Зубы обычного цвета, поломок не наблюдалось. Цвет мочи, желудочно-кишечные показатели, мышечный тонус, рефлексы соответствовали физиологической норме. Помутнения роговицы, слезотечения или каких-либо патологических признаков со стороны глаз не отмечено. Зоосоциальное поведение не отличалось от контрольных животных.
Результаты взвешивания животных показали, что масса тела крыс и кроликов, получавших ТТС плацебо, на протяжении исследования была сопоставима с массой тела у животных контрольных групп. Ректальная температура у всех животных практически не изменялась после нанесения ТТС плацебо. Количество съедаемого корма и выпиваемой воды также оставалось прежним после применения исследуемых ТТС плацебо.
Результаты проведенных исследований показали, что 14 дневные аппликации ТТС плацебо не повлияли на показатели крови в организме крыс (таблица 31) и кроликов (таблица 32).
159
Рекомендовано к изучению сайтом МедУнивер - https://meduniver.com/
