
3 курс / Фармакология / Синтез_и_изучение_свойств_новых_материалов_с_противоопухолевой
.pdf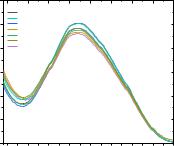
|
|
|
|
|
71 |
|
|
|
|
|
1.2 |
|
|
|
|
|
|
|
|
|
|
0 мкМ |
|
|
|
|
|
|
|
|
|
1 мкМ |
|
|
|
|
|
|
|
|
1.0 |
5 мкМ |
|
|
|
|
|
|
|
|
|
10 мкМ |
|
|
|
|
|
|
|
|
|
25 мкМ |
|
|
|
|
|
|
|
|
|
50 мкМ |
|
|
|
|
|
|
|
|
0.8 |
100 мкМ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
A |
0.6 |
|
|
|
|
|
|
|
|
|
0.4 |
|
|
|
|
|
|
|
|
|
0.2 |
|
|
|
|
|
|
|
|
|
0.0 |
|
|
|
|
|
|
|
|
|
220 |
230 |
240 |
250 |
260 |
270 |
280 |
290 |
300 |
|
|
|
|
|
l / нм |
|
|
|
|
Рис. 3.23. Спектры поглощения растворов ДНК (6,1 мкM), содержащих различные концентрации соединения 1.57 (1–100 мкМ) в физиологическом растворе (0,9 % NaCl).
Наблюдается заметный гипохромный сдвиг полосы поглощения ДНК при увеличении концентрации соединения 1.57. Такие изменения могут говорить о том, что соединение 1.57 взаимодействует с ДНК, вызывая изменение её спектральных характеристик.
Спектроскопия кругового дихроизма является одним из наиболее чувствительных методов исследования конформационных изменений,
обусловленных взаимодействием малых молекул с ДНК [101] и часто используется для установления типов взаимодействий биологически активных молекул с ДНК [102].
На Рис. 3.24 представлены спектры кругового дихроизма растворов ДНК,
которые включают положительные полосы при 275 нм, обусловленные стекинг-
взаимодействиями нуклеотидов, и отрицательные полосы при 246 нм, связанные с хиральностью правозакрученной В-формы двойной спирали ДНК [103]. При этом увеличение концентрации соединения 1.57 приводит к уменьшению интенсивности поглощения положительной полосы и увеличению интенсивности поглощения отрицательной полосы. Наблюдаемые изменения при добавлении соединения 1.57 носили концентрационно-зависимый характер. Таким образом,
72
можно предположить, что наблюдаемый эффект является результатом комбинации нескольких типов взаимодействий соединения 1.57 с ДНК.
|
2.0 |
|
|
|
|
|
|
|
|
|
|
|
|
0 мкМ |
|
|
|
|
|
|
|
|
|
|
1.5 |
1 мкМ |
|
|
|
|
|
|
|
|
|
мград |
5 мкМ |
|
|
|
|
|
|
|
|
||
|
10 мкМ |
|
|
|
|
|
|
|
|
||
|
25 мкМ |
|
|
|
|
|
|
|
|
||
1.0 |
50 мкМ |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
||
/ |
|
|
|
|
|
|
|
|
|
|
|
дихроизм |
0.5 |
|
|
|
|
|
|
|
|
|
|
0.0 |
|
|
|
|
|
|
|
|
|
|
|
Круговой |
-0.5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-1.0 |
|
|
|
|
|
|
|
|
|
|
|
-1.5 |
|
|
|
|
|
|
|
|
|
|
|
220 |
230 |
240 |
250 |
260 |
270 |
280 |
290 |
300 |
310 |
320 |
|
|
|
|
|
|
l/нм |
|
|
|
|
|
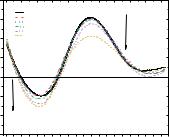
Рис. 3.24. Спектры кругового дихроизма ДНК (C = 6,1 мкM) в зависимости от
концентрации соединения 1.57 (C = 1–100 мкМ).
Увеличение температуры оказывает сильное влияние на стабильность двухцепочечной структуры ДНК, вызывая разрыв до однонитевой структуры, так называемое «плавление» нуклеиновой кислоты. Температура, при которой 50 %
дуплексной ДНК остаётся в двухцепочечном состоянии, считается температурой плавления ДНК (Tm) [104]. Температура плавления ДНК (Tm) напрямую зависит от стабильности её двойной спирали. Взаимодействие ДНК с малыми молекулами может стабилизировать структуру нуклеиновой кислоты, вызывая конформационные изменения, что обычно приводит к увеличению значения Tm.
Изучение плавления ДНК методом УФ-спектроскопии в присутствии соединения 1.57 показало, что температура плавления ДНК практически не меняется, хотя возрастает ширина перехода (Рис. 3.25), что свидетельствует о наличии взаимодействия. Аналогичный вид кривой плавления наблюдается при взаимодействии цисплатина с ДНК при аналогичных соотношениях. Таким образом можно предположить, что связывание в обоих случаях осуществляется с основаниями ДНК.
Рекомендовано к изучению сайтом МедУнивер - https://meduniver.com/
73
1.25 |
ДНК |
|
|
|
|
|
|
0.006 |
|
|
|
|
|
|
|
||
|
ДНК + соединение 1.57 |
|
|
|
|
|
||
1.20 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0.004 |
1.15 |
|
|
|
|
|
|
|
Ad |
А |
|
|
|
|
|
|
|
td / |
1.10 |
|
|
|
|
|
|
|
0.002 |
1.05 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0.000 |
1.00 |
|
|
|
64,4 |
65,9 |
|
|
|
|
|
|
|
|
|
|
|
|
20 |
30 |
40 |
50 |
60 |
70 |
80 |
90 |
100 |
|
|
|
Температура / °C |
|
|
|
||
Рис. 3.25. Кривые плавления ДНК (6,1 мкМ) в отсутствие и в присутствии соединения 1.57 в физиологическом растворе (0,9 % NaCl) при стехиометрическом соотношении [соединение 1.57] / [ДНК] = 1,5.
Предполагая равновесный характер связывания, мы рассчитали величины
Kbin для соединения 1.57 с ДНК с использованием уравнения Вольфа — Шиммерa
[105]:
|
[ДНК] |
= |
[ДНК] |
+ |
1 |
, |
(3.19) |
|
|
Kbin ( b - f ) |
|||||
|
a - f |
b - f |
|
|
|||
где Kbin — константа связывания; [ДНК] — концентрация ДНК, εa, εf и εb — коэффициенты экстинкции комплекса лиганда (соединение 1.57) с ДНК, лиганда и лиганда, связанного с ДНК в стехиометрическом количестве, соответственно.
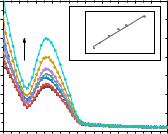
Как показано на Рис. 3.26, зависимость [ДНК] / (εa − εf) от [ДНК] является линейной. Основываясь на уравнении Вольфа — Шиммера, константы связывания, полученные для соединения 1.57, составляют 3,44·107 М−1, что указывает на то, что соединение 1.57 обладает высокой способностью образовывать связи с ДНК предположительно по ковалентному механизму.
Следует отметить, что значения констант связывания, полученные по данным калориметрического титрования и спектрофотометрического метода, хорошо согласуются.
|
|
|
|
|
74 |
|
|
|
|
|
|
|
0.7 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
Чсм |
|
y = 0,12x + 0,504 |
|
|
|
|
|
|
|
|
|
|
R² = 0,9827 |
|
|
|
|
|
|
0.6 |
|
|
|
2 |
2,5 |
|
|
|
|
|
|
|
|
|
M |
|
|
|
|
|
||
|
|
|
|
, |
|
|
|
|
|
|
|
|
|
|
|
|
10 |
|
|
|
|
|
|
|
|
|
|
|
10 |
2 |
|
|
|
|
|
|
|
|
|
|
f)}Ч |
|
|
|
|
|
|
|
|
|
|
|
− |
1,5 |
|
|
|
|
|
|
0.5 |
|
|
|
a |
|
|
|
|
|
|
|
|
|
|
]/( |
|
|
|
|
|
|
|
Поглощение |
|
|
|
|
{[ДНК |
1 |
|
|
|
|
|
|
|
|
|
0,5 |
|
|
|
|
|
||
0.4 |
|
|
|
1 |
6 |
1 1 |
16 |
2 1 |
|
||
|
|
|
|
|
[ДНК] / мкМ |
|
|
|
|||
0.3 |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
||
|
0.2 |
|
|
|
|
|
|
|
|
|
|
|
0.1 |
|
|
|
|
|
|
|
|
|
|
|
0.0 |
|
|
|
|
|
|
|
|
|
|
|
200 |
220 |
240 |
260 |
280 |
300 |
320 |
340 |
360 |
380 |
400 |
|
|
|
|
|
l / нм |
|
|
|
|
|
|
Рис. 3.26. Спектры поглощения растворов ДНК (C = 3,6–24,4 мкМ) при постоянной концентрации соединения 1.57 (C = 5,4 мкM), а также зависимость в координатах [ДНК] / (εa − εf) от [ДНК] (R2 = 0,982) при [ДНК] = 3,6, 5,4, 8,2, 11,1, 13,5, 1,89 и 24,4 мкМ.
Значение G составило −43,03 кДж/моль.
3.5.3.Антиоксидантная активность
3.5.3.1.Изучение антирадикальной активности
Для количественной оценки скорости реакции между веществом 1.57 и
ДФПГ была использована кинетическая модель реакции псевдопервого порядка,
описываемая уравнением (3.20):
ln |
A - At |
= -kt , |
(3.20) |
||
A - A |
|||||
|
|
|
|||
|
|
0 |
|
|
|
где A∞, At и A0 — оптические плотности раствора спустя «бесконечность» (через шесть дней после начала эксперимента), в момент времени t и в начальный момент времени, соответственно.
Рекомендовано к изучению сайтом МедУнивер - https://meduniver.com/
75
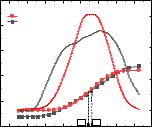
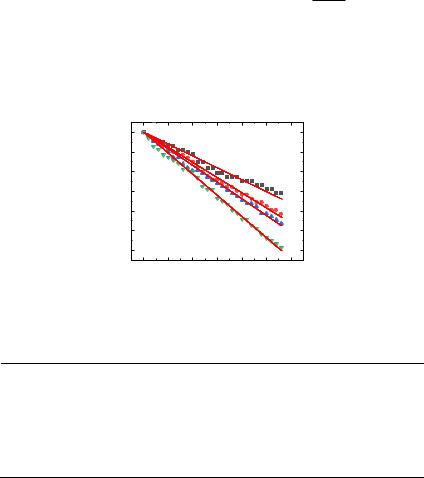
Из тангенсов углов наклона кривых в координатах ln A - At от t (Рис. 3.27)
A - A0
были получены значения кажущихся констант скорости при различных температурах (Табл. 3.9).
|
0.00 |
|
|
|
|
|
|
)] |
-0.02 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
− A |
-0.04 |
|
|
|
|
|
|
∞ |
|
|
|
|
|
|
|
(A |
|
|
|
|
|
|
|
) / |
-0.06 |
|
|
|
|
|
|
t |
|
|
|
|
|
|
|
− A |
|
|
|
|
|
|
|
∞ |
-0.08 |
|
|
|
|
|
|
ln[(A |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-0.10 |
|
|
|
|
|
|
|
-0.12 |
|
|
|
|
|
|
|
0 |
5 |
10 |
15 |
20 |
25 |
30 |
|
|
|
|
t / мин |
|
|
|
Рис. 3.27. Кинетическая зависимость восстановления ДФПГ веществом 1.57 при
303,15 К (■), 308,15 К (●), 313,15 К (▲), 318,15 К (▼).
Табл. 3.9. Значения констант скорости восстановления ДФПГ веществом 1.57.
T / К |
k·10−3 / мин−1 |
|
|
303,15 |
2,43 ± 0,06 |
308,15 |
3,14 ± 0,05 |
313,15 |
3,40 ± 0,03 |
318,15 |
4,30 ± 0,03 |
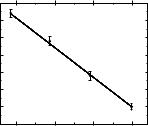
Далее были построены зависимости в координатах lnk от T−1 (Рис. 3.28) и
рассчитаны значения энергии активации (Еa = 28,74 ± 0,38 кДж·моль−1) и фактора частоты (lnA = 5,40 ± 1,46) в соответствии с уравнением Аррениуса:
ln k = ln A - |
Ea |
, |
(3.21). |
i |
RT |
|
|
|
|
76 |
|
|
-5,4 |
|
|
|
|
-5,5 |
|
|
|
|
-5,6 |
|
|
|
-1 |
|
|
|
|
/lnмин |
-5,7 |
|
|
|
|
|
|
|
|
lnk |
-5,8 |
|
|
|
|
|
|
|
|
|
-5,9 |
|
|
|
|
-6,0 |
|
|
|
|
-6,1 |
|
|
|
|
0,00315 |
0,00320 |
0,00325 |
0,00330 |
|
|
|
T-1/ K-1 |
|
Рис. 3.28. Температурная зависимость логарифма константы скорости реакции взаимодействия вещества 1.57 с ДФПГ. T — абсолютная температура, k —
константа скорости псевдопервого порядка.
3.5.3.2. Изучение фотодинамических свойств
Исследование фотообесцвечивания Радахлорина в присутствии соединения 1.57 позволяет оценить антиоксидантные свойства препарата при облучении видимым светом. Практическая значимость исследования заключается в том, что полученные данные позволяют оценить возможность использования веществ для реализации фотодинамической терапии, которая активно используется в онкологии [106,107] и лечении неопухолевых заболеваний [108].
Проведение фотодинамической терапии требует выбора эффективных фотосенсибилизаторов, селективных по отношению к мишени и имеющих достаточный квантовый выход синглетного кислорода при облучении. Этим требованиям соответствуют препараты хлорина e6, которые хорошо зарекомендовали себя в клинической практике. В данной работе использовался препарат Радахлорин — фотосенсибилизатор второго поколения,
предназначенный для флуоресцентной диагностики и фотодинамической терапии злокачественных опухолей [109,110]. Метод фотодинамической терапии основан на способности Радахлорина избирательно накапливаться в опухоли при его
Рекомендовано к изучению сайтом МедУнивер - https://meduniver.com/
77
введении и генерировать синглетный кислород, который оказывает токсическое действие на опухолевые клетки и разрушает их плазматические мембраны при воздействии света с длиной волны, соответствующей максимуму поглощения Радахлорина. Несомненно, образование активных форм кислорода может быть усилено прооксидантами и ослаблено антиоксидантами. Таким образом,
прооксиданты ускоряют фотообесцвечивание препарата, а антиоксиданты его ингибируют.
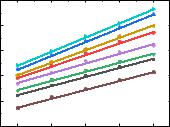
Деградацию фотосенсибилизатора оценивали путём измерения констант скорости фотодеградации (kdeg), значения которых определяли по тангенсу угла наклона кинетических зависимостей в координатах ln(At /A0) – t. Уменьшение kdeg
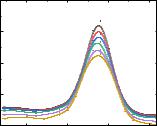
указывает на наличие у исследуемого соединения свойств гасителя синглетного кислорода. В свою очередь, увеличение kdeg указывает на то, что тестируемое соединение обладает свойствами индуктора синглетного кислорода. Спектры поглощения Радахлорина измеряли в отсутствие и в присутствии различных концентраций соединения 1.57 (Рис. 3.29), кинетическая зависимость фотовыцветания Радахлорина представлена на Рис. 3.30. В данной работе в качестве контроля использовали раствор азида натрия (C = 500 мкМ). Из представленных результатов можно сделать вывод о ярко выраженных антиоксидантных свойствах соединения 1.57 при облучении.
|
0.4 |
|
|
|
|
0.3 |
|
|
|
A |
0.2 |
|
|
|
|
0.1 |
|
|
|
|
0.0 |
|
|
|
|
620 |
645 |
670 |
695 |
|
|
l / нм |
|
|
Рис. 3.29. Снижение оптической плотности Радахлорина в присутствии соединения 1.57 (C = 5–100 мкМ) при облучении: ▬ без облучения; ▬ 10 с, ▬ 20 с, ▬ 30 с, ▬ 40 с, ▬ 50 с.
|
|
|
78 |
|
|
|
1.8 |
|
|
|
|
|
1.6 |
|
|
|
|
) |
1.4 |
|
|
|
|
t |
|
|
|
|
|
/A |
|
|
|
|
|
0 |
|
|
|
|
|
ln(A |
1.2 |
|
|
|
|
|
|
|
|
|
|
|
1.0 |
|
|
|
|
|
0.8 |
|
|
|
|
|
10 |
20 |
30 |
40 |
50 |
|
|
|
время / с |
|
|
Рис. 3.30. Кинетическая зависимость фотовыцветания Радахлорина (►) в
присутствии соединения 1.57 (▲ 5 мкМ, ▼ 10 мкМ, ● 25 мкМ, 50 мкМ, ▼75
мкМ, ■ 100 мкМ) в сравнении с азидом натрия (● 500 мкм). A0 и At —
оптические плотности растворов Радахлорина при длине волны 664,9 нм до и после облучения.
3.5.3.3. Фотоиндуцированный гемолиз
Известно, что лизис эритроцитов инициируется облучением ультрафиолетом или видимым светом в присутствии фотосенсибилизаторов,
наиболее эффективными из которых являются порфирины и их производные
[109], в частности Радахлорин. Установлено, что фотодинамический эффект в первую очередь связан с генерацией синглетного кислорода, а затем и других активных форм кислорода. Связывание порфиринов с клеточными мембранами приводит к снижению фотостабильности мембран [110].
На Рис. 3.31 показана концентрационная зависимость степени фотоиндуцированного гемолиза в присутствии соединения 1.57. Как видно из полученных результатов, соединение 1.57 подавляет гемолиз, индуцированный Радахлорином, что проявляется в увеличении времени гемолиза. Из полученных
Рекомендовано к изучению сайтом МедУнивер - https://meduniver.com/

79
результатов можно сделать вывод, что соединение 1.57 проявляет дозозависимую антиоксидантную активность.
контроль |
50 |
/ TC |
|
соединение1.57 |
50 |
TC |
|
1.6
1.5
1.4
1.3
1.2
1.1
1.0
0 |
50 |
100 |
150 |
200 |
C / мг∙л−1
Рис. 3.31. Зависимость степени фотоиндуцированного гемолиза в присутствии соединения 1.57. C — молярная концентрация соединения 1.57, Т50соединения 1.57 —
время фотоиндуцированного гемолиза 50 % эритроцитов в присутствии соединения 1.57, T50контроль — время фотоиндуцированного гемолиза 50% в
присутствии физиологического раствора.
3.5.3.4. Антирадикальная активность соединения 1.57 по отношению к NO-
радикалу
Несбалансированность между прооксидантными и антиоксидантными системами часто может приводить к оксидативному стрессу организма, поэтому важно учитывать влияние на эти процессы биологически-активных веществ,
которые в перспективе могут использоваться в качестве лекарственных средств.
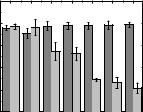
На Рис. 3.32 представлена зависимость степени связывания NO-радикалов с веществом 1.57 в диапазоне концентраций 1–200 мкМ. В качестве вещества сравнения использовался азид натрия [111]. Из полученных данных видно, что в отличие от азида натрия, вещество 1.57 практически не взаимодействует с NO-
радикалами.
80
0.5 |
|
|
|
|
|
|
0.4 |
|
|
|
|
|
|
0.3 |
|
|
|
|
|
|
A |
|
|
|
|
|
|
0.2 |
|
|
|
|
|
|
0.1 |
|
|
|
|
|
|
0.0 |
|
|
|
|
|
|
0 |
10 |
25 |
50 |
75 |
100 |
200 |
|
|
|
C / мкМ |
|
|
|
Рис. 3.32. Эффективность захвата NO-радикалов веществом 1.57 (темно-серый)
по сравнению с азидом натрия (светло-серый). С — молярная концентрация вещества 1.57.
3.5.4. Генотоксичность соединения 1.57
Средние значения % содержания ДНК в хвосте кометы, длины хвоста и момента хвоста комет, наблюдаемые из МКПК человека, инкубированных в присутствии H2O2 (положительный контроль), PBS (отрицательный контроль) и
соединения 1.57, представлены в Табл. 3.10. Видно, что количество повреждений ДНК в присутствии H2O2 значительно выше, чем у контрольных клеток. В
качестве примера на Рис. 3.33 представлены микрофотографии ДНК-комет в присутствии H2O2 (C = 100 мкМ), PBS, и соединения 1.57 в диапазоне концентраций 1–200 мкМ. Анализ Табл. 3.10 показывает, что инкубация МКПК человека с соединением 1.57 вызывает дозозависимое повреждение целостности ДНК.
Рекомендовано к изучению сайтом МедУнивер - https://meduniver.com/
