3 курс / Фармакология / Основы_GMP_производство_лекарственных_средств_Федотов_А_Е_2012
.pdf

474 |
Гдава 19 |
7. Персонал:
-не определена ответственность персонапа;
-нет ПОРЯдка действий персонала в экстремальных ситуациях;
системы обучения персонала;
- сотрудники не знают правил работы. не выполняют требова
ния поведения, rигиены, переодевания и пр.;
- операторы не опрятны, был слу<шй работы оператора в acell- тической зоне с фурункулом на лице и т.д,
8. Качество, аналнз отклонений:
-MHOro обших слов без реального смысла;
-нет анализа отклонении от спецификаций;
-нет данных о мерах по устранению причин отклонений:
-нет плана и нет документального подтверждения работы по-
вышению качества.
Приведенные замечания являются отдельными примерами и не
претендуют на полноту. Ниже рассмотрим другие случаи.
"ример тoro, что инспектор "не УВlЩела~
Нам показали лабораторию микробиологического контроля как
образцовое подразделение предприятия спустя короткое время после
ею посещения инспектором. Действительно, стены и потолок были
ощтукатурены И покрашены, установлены пластиковые окна и двери,
СЛОВОМ, ВI:>Iполнен <'<Свроремоит».
Мы обратили внимание на то, что приготовление и розлив пита тельной среды в чашки Петри выполнялся в обычном помещении, без ламинарного шкафа, Со слов переонала лаборатории у них НИКОГда не было пробпем с тестами на микробиологическую чистоту и стериль
НОСТЬ. Эго странно. На питательную среду открытой чашки в обычном
(не чистом) помещении обязательно осядут частицы с микроорганиз мами, т. е. возможен ложноположительный результат.
Переонал лаборатории был одет в обычные халаты, волосы были открыты, косметика присyrcтвовала в больших количествах, т. е. сам персонал вдобавок к не слишком {IИСТОМУ воздуху помещения вносил существенные загрязнения. В таких помещениях концентрация микро
орraнизмов доеТИI"3ет 400-500 КОЕ/м3. Для того, чтобы в пробу НИ{lего
не осело, воздух должен быть стерильным.
Ламинарный шкаф ШlЯ того и нужен, чтобы исключить привнесе ние загрязнений до и после отбора проб. Если в отчетах опроведении
анализов ламинарного шкафа ланные благополучны, то следует по
требовать проведения контрольных анализов и разобраться в таком фе
номене. Грязный воздух в лаборатории и чистые пробы |
явление |
|
настораживающее. |
|
|
Расхождение меЖ11У ИСПiННЫМИ |
результатами контроля и |
что |
пишут в документах, бывает |
в США, в условиях жесткою |
|
контроля со стороны FDA встречаются случаи фа,1ЬСИфИкации протоко лов анализов (глава 20).


478 |
|
|
|
|
|
Глава 20 |
||
|
|
|
|
|
|
|
Таблица 20./ |
|
|
Письма-предупреЖдения FDA США за 2010 г. |
|||||||
|
|
|
|
|||||
|
Об1.ект предупреждения |
Количество писем- |
|
|||||
|
|
|
|
|
п |
ждеиий |
|
|
|
Производсmo лекарственных средств ми человека |
|
|
149 |
|
|||
|
(омр) |
|
|
|
|
|||
|
Лроизводство активных фармаuевтических су6стан- |
|
|
11 |
|
|||
|
uии (омр) |
|
|
|
|
|||
|
Лекарственные средства для клиtlИчеСI<ИХ исслело- |
|
|
24 |
|
|||
|
ваний (ОСР) |
|
|
|
|
|||
|
Испытания лекарственных средств в лаборатории |
|
|
I |
|
|||
|
GLP) |
|
|
|
|
|||
|
изводство препаратов из клеток и тканей |
|
|
3 |
|
|||
|
Производсmo медицинских изделий |
|
|
169 |
|
|||
|
Производсmo лекарственных средств мя жив(Лных |
|
|
6 |
|
|||
|
(ОМР) |
|
|
|
|
|||
|
|
|
|
|
|
|||
|
Лроизвопство продуктов питания дЛЯ человека |
|
|
172 |
|
|||
|
(ОМР) |
|
|
|
|
|||
|
Лроизводство диетических пропуктов (ОМР) |
|
|
11 |
|
|||
|
Лроизводство кормов дЛЯ животных (ОМР) |
|
|
6 |
|
|||
|
Наличие остатков препаратов у дойных коров |
|
|
I |
|
|||
|
Наличие остатков препаратов у забитых животных |
|
|
40 |
|
|||
|
Лроизводство табачной продукции |
|
|
5 |
|
|||
|
Больницы |
|
|
7 |
|
|||
|
Самолеты |
|
|
I |
|
|||
|
Суда |
|
|
I |
|
|||
|
Всеro |
|
|
607 |
|
|||
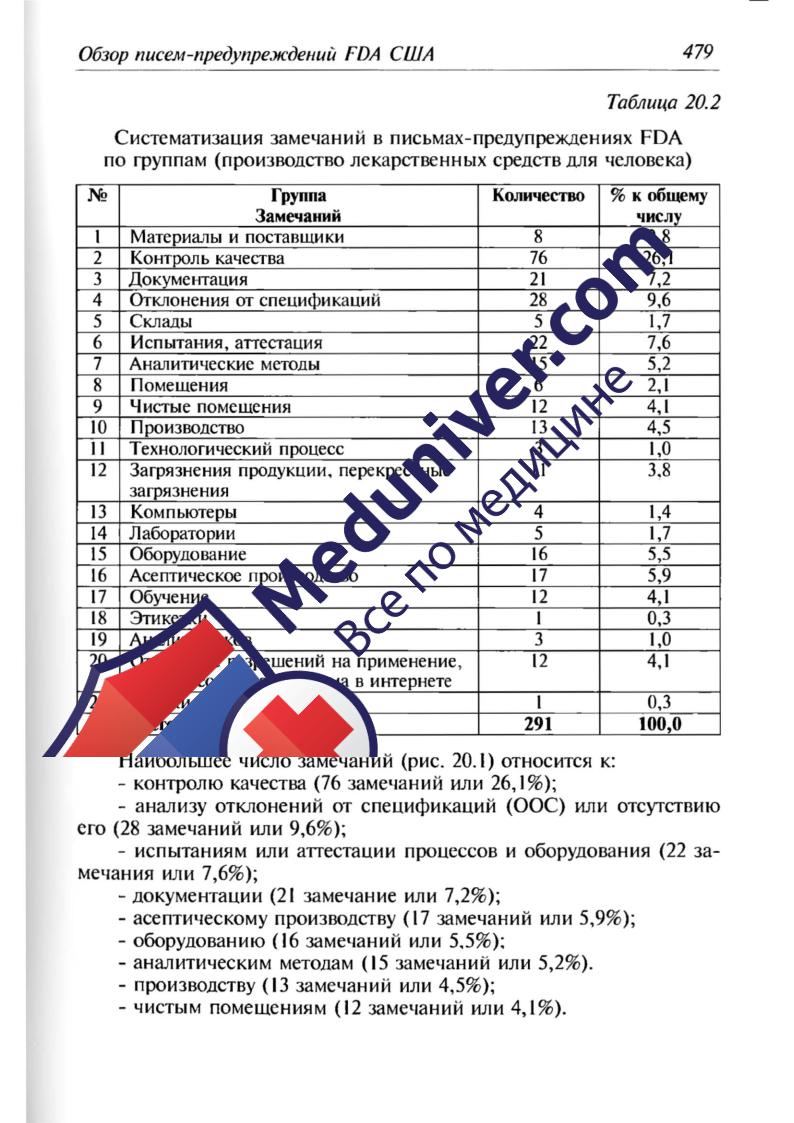
20.2 Пронзводство Jlекарственных средств для чеJlОвека
В 2010 г. FDA направила 149 писем-предупреЖдений производитс
лям лекаретвенных средств дня человека в связи с нарушениями требо
ваний ОМР, обнаруженными при инспектировании IlРОИЗВОДСТВ.
При этом было дано 291 замечание (8 одном письме
предупреЖдении содержится, как правило, несколько заме<lаниЙ). Под
Счет числа замечаний носит в определенной степени УСJЮВНЫЙ харак
тер, поскольку зависит от степени детализации замечаний. НО ЭТО не
меняет дела: анализ писем-предупреЖдений производствам, нахоДЯ
щимся в США и за их пределами, дает системную картину отклонений
от требовании GMP и показывает характерные трудные места.
В таблиuе 20.2 все замечания ра:шелены на 21 группу. Асептическое
проиэоодство (п. 16) вьшслено в самостоятельную группу ввиду особых
требований к нему и сложностей выполнения требований ОМР.