
3 курс / Фармакология / Миронов_А_Н_,_Бунатян_Н_Д_и_др_Руководство_по_проведению_доклинических
.pdfпозволяет определять способность препарата тормозить эксфлагелляцию (дисфлагеллирующее действие препарата).
У зараженной птицы (чиж, чечетка, канарейка, цыпленок) исследуют кровь в период наличия паразитов. При этом наряду с бесполыми формами, как правило, обнаруживается и некоторое количество половых форм. В пастеровской пипетке смешивают каплю крови с каплей лимоннокислого натрия (3,8%) и физиологического раствора. Жидкость, помещенную между покровными стеклами, исследуют во влажной камере под иммерсионной системой микроскопа при температуре не ниже 25 °С.
В крови зараженной птицы, содержащей паразитов, уже через 5–10 мин можно наблюдать микрогаметы в виде подвижных жгутов, прикрепленных к остаточному телу. Жгуты отчетливо видны при несколько затемненном поле зрения. Обычно наблюдаются в поле зрения 2–3 эксфлагеллирующих формы.
Перед введением препарата устанавливают число этих форм у каждой птицы, затем вводят изучаемое вещество и вновь исследуют кровь через 6–24–48 ч. Препарат, обладающий дисфлагеллирующим действием, тормозит процесс эксфлагелляции в течение 1–2-х дней (гамостатическое действие) и эксфлагеллирующие гаметы не удается наблюдать в течение этого срока. Параллельно необходимо проводить контрольные исследования с кровью птиц, не получавших препарат.
5.3.2.Влияние препарата на число гаметоцитов в крови
Вкрови зараженных птиц обнаруживаются бесполые и половые формы паразита в разных стадиях развития. В исследование подбирают птиц с примерно одинаковым общим количеством паразитов в крови и подсчитывают у них процентное содержание половых форм (мужских и женских) по отношению к эритроцитам. Препарат вводят однократно. Снижение численности гамонтов через 24–48 ч после лечения указывает на активность препарата.
5.3.3. Влияние на заражаемость комаров
Птице в период значительного содержания паразитов в крови вводят однократно определенную дозу исследуемого препарата. Через 12–24 ч птицу подсаживают к комарам, предварительно голодавшим в течение суток. Напившихся комаров (исследуемая группа) отсаживают в отдельный садок и в дальнейшем кормят 4-процентным раствором глюкозы. Контрольную партию комаров кормят на той же птице до введения ей препарата. Для определения зараженности комаров вскрывают на 6–10-е сутки после кормления и определяют наличие цист в желудках и спорозоитов в слюнных железах, отсутствие цист или задержка в слюнных железах спорозоитов. Отсутствие цист или задержка в их развитии у комаров исследуемой группы при нормальном половом созревании паразитов в контрольной группе указывает на активность препарата.
Заключение
Материалы оформляются в виде научного отчета в соответствии с ГОСТ 7.32-2001 и Приказом Минздравсоцразвития России от 23 августа 2010 г. № 708н «Об утверждении правил лабораторной практики» с предоставлением в таблицах как первичных данных по каждому веществу, так и статистически обработанных результатов. К отчету необходимо приложить аналитические паспорта или нормативные документы на референтные и тестируемые вещества.
Литература
1.Астафьев Б.А., Яроцкий Л.С., Лебедева М.Н. Экспериментальные модели паразитозов. — М.: Наука, 1989. — С. 278.
2.Кожевников П.В., Добротворская Р.В., Латышев Н.И. Учение о кожном лейшманиозе. — М.: 1947. — С. 370.
3.Бакулина Н.А., Краева Э.Л. Микробиология. — М.: Медицина, 1980. — С. 444.
601
4.Павлова Е.А. Среда для культивирования простейших кишечника. Мед паразитол. 1938. – VII, в. 2. — С. 224–227.
5.Першин Г.Н. Методы экспериментальной химиотерапии. — М.: Медицина, 1971. — С. 536.
6.Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. — М.: Ремедиум, 2000. — С. 297–308.
7.Diamond L.S. The establishment of various Trichomonas of animals and man in axenic cultures. J. parasitol, 1957. — V. 43.4. — P. 488–490.
8.Diamond L.S. et al. A new medium for the axenic cultivation of Entamoeba histolytica and other Entamoeba. Trans. R.S. Trop. Med. Hyg., 1978. — V. 72. — P. 431–432.
9.Keister D.B. Axenic cultivation of Giardia lamblia in TYI-S-33 medium supplemented with bile. Trans R. S. Trop. Med. Hyg., 1983. — V. 7. — P. 487–488.
10.Levine N.D. et al. A new revised classification of the Protozoa. G Protozoa., 1980. — V. 27. — P. 37–58.
11.Clark C.G. & Diamond L.S. Methods for Cultivation of Luminal Parasitic Protists of Clinical Importance. Clinical Microb. Rev., 2002. — V. 15, № 3. — P. 329–341.
ГЛАВА 37
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО ДОКЛИНИЧЕСКОМУ ИЗУЧЕНИЮ АНТИГЕЛЬМИНТНОЙ АКТИВНОСТИ ЛЕКАРСТВЕННЫХ СРЕДСТВ
Составители: д. м. н., проф. Б.А. Астафьев; д. м. н., проф. М.Н. Лебедева;
д.м. н., проф. Ф.П. Коваленко; к. м. н. Г.А. Гицу; к. б. н. В.И. Джабарова;
к.б. н. Л.В. Федянина; акад. РАМН, проф. В.П. Сергиев;
к.м. н. А.А. Фролова; Е.И. Самочатова
Введение
Поиск новых антигельминтиков и доклиническая разработка новых методов химиотерапии гельминтозов ведутся, как правило, на лабораторных моделях животных, экспериментально зараженных гельминтозами, имеющими медицинское или ветеринарное значение или близких к ним по систематическому положению возбудителей и особенностям течения. Наличие адекватных моделей гельминтозов позволяет решить ряд важных теоретических и практических вопросов и открывает перспективы выявления новых химиотерапевтических средств, а в ряде случаев — и разработки наиболее эффективных схем их назначения. Основной целью скрининга является выявление новых активных соединений, превосходящих по своей эффективности, широте применения и токсикологическим показателям уже применяемые на практике или же позволяющие снизить затраты на их производство.
Новые противопаразитарные препараты должны удовлетворять всем требованиям медицинской или ветеринарной практики, а именно:
1.Низкая токсичность с отсутствием побочного действия на организм хозяина.
2.Высокая эффективность специфического действия.
3.Активность в отношении разных стадий развития гельминта.
4.Простота синтеза, доступность исходного сырья, химическая устойчивость препарата.
5.Дешевизна и удобство для массового применения.
Вещества, предлагаемые для практического применения, должны превосходить уже апробированные на практике главным образом в эффективности и переносимости.
Для успешного решения проблем химиотерапии и профилактики гельминтозов желательно иметь препараты с лечебным и профилактическим (овицидным и/или ларвицидным действием).
Настоящие методические рекомендации разработаны с целью унификации методов моделирования гельминтозов и экспериментального доклинического изучения новых антигельминтных препаратов, обеспечивающих получение сопоставимых данных и объективных выводов.
1.Общая часть
1.1.Обследование лабораторных животных на зараженность гельминтозами
При экспериментальных исследованиях необходимо предварительное обследование животных на зараженность гельминтозами, а также в ходе эксперимента. С целью диа-
603
гностики кишечных гельминтозов применяют исследование фекалий методами: нативного мазка, толстого мазка по Като, флотации и осаждения.
Для исследования по методу Като 100 мг фекалий без добавления воды или какойлибо другой жидкости наносят на предметное стекло, покрывают специально обработанной полоской целлофана и придавливают на предметном стекле резиновой пробкой ровным слоем, но так, чтобы фекалии не выдавливались из-под целлофана. Из гидрофильного целлофана толщиной 22 мкм готовят полоски площадью 8,2 см² и обрабатывают их путем погружения в раствор следующего состава: 6 мл 3% водного раствора малахитовой зелени, 500 мл глицерина, 500 мл 6% раствора фенола. Микроскопию мазка проводят через 30–40 мин после его приготовления.
При небольшом количестве яиц или личинок гельминтов в фекалиях прибегают к методам обогащения. Для исследования яиц большинства видов гельминтов применяют метод флотации по Фюллеборну. Флотационный раствор готовят следующим образом: 444 г соли растворяют в 1 л воды, доводят до кипения, остужают и фильтруют через вату или марлю в отдельный сосуд. Фекалии тщательно размешивают в насыщенном растворе поваренной соли в стаканчике объемом 10–20 мл и с помощью проволочной петли удаляют всплывшие частицы клетчатки. Затем на стаканчик накладывают обезжиренное предметное стекло, доливают насыщенный раствор соли доверху, так, чтобы мениск жидкости соприкасался с поверхностью предметного стекла. Через 25–30 мин стекло быстрым движением снимают, переворачивают нижней поверхностью вверх и микроскопируют. Этот метод пригоден для диагностики всех гельминтозов пищеварительного тракта, кроме трематодозов, так как удельный вес яиц трематод превышает таковой флотационной жидкости, вследствие чего они выпадают в осадок.
Для исследования фекалий на наличие личинок гельминтов или для обнаружения их в легких, крови, печени и других органах и тканях применяют метод Бермана: фекалии или измельченные органы наносят на мелкую металлическую сетку и помещают ее в стеклянную воронку, закрепленную на штативе. На нижний конец воронки надевают резиновую трубку с зажимом. В воронку наливают подогретую до 40°С воду, так, чтобы нижняя часть сетки с фекалиями или частицами органов была погружена в воду. Личинки выходят из исследуемого объекта и скапливаются в нижней части резиновой трубки. Через 2–4 ч (при выделении личинок из фекалий) или через сутки (при выделении личинок из тканей) открывают зажим и спускают жидкость в пробирку. Личинки постепенно оседают на дно пробирки. Процесс можно ускорить центрифугированием. Осадок микроскопируют.
При некоторых цестодозах выделяются целые зрелые членики гельминтов. Для их обнаружения фекалии промывают на мелком сите. Можно применять также отстаивание осадка со сливанием поверхностного слоя жидкости. После неоднократного повторения этой процедуры просматривают осадок на темном фоне, на котором хорошо заметны членики цестод, во всех случаях имеющие белый цвет.
1.2. Метод выделения яиц гельминтов из фекалий инвазированных животных
Яйца гельминтов для заражения новой партии животных можно получить двумя способами:
1.При вскрытии ранее зараженных животных выделяют и измельчают паразитов. При этом среди яиц, выделившихся из матки гельминтов, оказывается большое количество незрелых яиц.
2.Яйца выделяют из фекалий животных. Для этого отбирают необходимое количество доноров. Животных помещают в клетки с сетчатым дном. Фекалии ежедневно выбирают с поддонника клетки, на который предварительно помещают увлажненную фильтровальную бумагу. Фекалии можно накапливать в течение нескольких дней, сохраняя их при температуре 4 °С. Выделение яиц из фекалий осуществляют флотационно-
604
центрифужным методом. Фекалии тщательно размешивают в насыщенном растворе поваренной соли и разливают по центрифужным пробиркам. Смесь центрифугируют 5–7 мин при 1500 оборотах в минуту. Поверхностную пленку со всплывшими яйцами снимают проволочной петлей, состоящей из нескольких колец, и стряхивают в стаканчик с солевым раствором. После этого содержимое пробирок опять размешивают с солевым раствором и вновь центрифугируют. Эту манипуляцию повторяют несколько раз. Собранные яйца отмывают водой 7–8 раз с последующим центрифугированием, после чего собирают со дна пробирки с помощью шприца с иглой.
1.3. Методы культивирования яиц и личинок гельминтов
Для развития яиц большинства гельминтов (аскаридаты, трихоцефаляты, гангулетеракисы и др.) до инвазионной стадии их помещают на часовое стекло в 1% раствор соляной кислоты. Раствор заменяют через каждые 2–3 дня. Часовые стекла хранят в чашках Петри в термостате при температуре 25–30°С. На дно чашек под часовое стекло помещается увлажненная фильтровальная бумага. Чашку накрывают крышкой, которую каждые 2–3 суток рекомендуется открывать на 20–30 мин. В ходе культивирования необходимо следить за количеством раствора на часовом стекле. По мере его испарения добавляют 1% HCl до прежнего уровня.
Культивирование до инвазионной стадии свободноживущих личинок нематод (трихостронгилят, стронгилоидесов и др.) также проводят в чашках Петри в смеси фекалий с почвой или активированным углем. Можно применять для этой цели агар (1,5 г агара на 100 мл воды). Агар разливают в большие чашки Петри и оставляют до застывания. На середину пластинки агара наносят слои смеси из фекалий и активированного угля высотой 0,5 см. При этом слой агара по краям, по крайней мере на 3 см, должен оставаться свободным. Вылупившиеся из яиц личинки выползают на агар и проникают в него, скапливаясь на краю.
При культивировании личинок стронгилят, в том числе ниппостронгилюса, наилучшие результаты получаются при использовании следующего способа. Фекалии, содержащие достаточное количество яиц (2–7 или более в поле зрения при 70-кратном увеличении) в тонком мазке, увлажняют 0,1% раствором салициламида в дехлорированной водопроводной воде и смешивают в равных пропорциях с активированным углем. Салициламид предотвращает развитие плесени. Эту массу слоем толщиной не более 0,5 см наносят на круг фильтровальной бумаги, на 1 см отступив от края. Фильтровальную бумагу со слоем фекалий помещают в чашку Петри на круг из губки, слегка смоченной водой (вместо губки можно использовать и другой влагоемкий материал). Чашки Петри закрывают крышками и помещают в термостат при температуре 25–30 °С. Инвазионные личинки скапливаются по краю фильтровальной бумаги, где их видно невооруженным глазом. При появлении в копрокультуре плесени следует оросить ее 1% раствором нистатина. По достижении личинками инвазионной стадии края фильтровальной бумаги отрезают и помещают их для сбора личинок в аппарат Бермана.
1.4. Методы заражения лабораторных животных гельминтами и введения испытуемых препаратов
Инвазионный материал, необходимый для заражения лабораторных животных, получают различными путями в зависимости от биологических особенностей тех или иных видов гельминтов. Личинок биогельминтов, находящихся в тканях промежуточных хозяев, скармливают животным вместе с тканями промежуточного хозяина или выделяют из последних и вводят в очищенном виде. Личинок стронгилят, в частности ниппостронгилюса, вводят иглой шприца под кожу.
Взвесь инвазионных яиц гельминтов вводят животным в пищевод или желудок с помощью шприца с канюлей.
Для дозирования инвазионного материала тщательно встряхивают водную взвесь инвазионных яиц или личинок гельминтов. Из только что перемешанной взвеси с помощью
605
шприца с иглой берут несколько капель взвеси и в 3 каплях, нанесенных на предметное стекло, подсчитывают количество яиц или личинок. Определив среднее число яиц или личинок в 1 капле, умножают на число капель в 1 мл взвеси. После этого рассчитывают количество взвеси, содержащее необходимое число инвазионного материала. При подсчете учитывают только жизнеспособные яйца или личинки.
При отборе и дальнейшем изучении препаратов способы их введения зависят от вида животного и характера инвазии. Обычно препараты вводят в желудок или пищевод, иногда — внутримышечно, подкожно или внутривенно.
Мышам, крысам, морским свинкам и другим мелким грызунам препараты вводят в
пищевод или желудок при помощи шприца с металлической оливой на конце иглы или пипеткой с оплавленным концом. Мышам можно вводить не более 0,3–0,5 мл, крысам и морским свинкам не более 1–2 мл жидкости на животное. Хорошо растворимые вещества мелким животным вводят в виде водных растворов, а нерастворимые — в виде суспензии в жидком крахмальном геле.
При эхинококкозах исследование препаратов проводят и при внутрибрюшинном введении.
Для оценки эффективности препаратов используют сравнение доз, вызывающих одинаковый эффект, или определяют эффект одинаковых доз препаратов. Масса испытуемого вещества чаще выражается в весовых соотношениях: г/кг или мг/кг массы тела животных. В отдельных случаях, особенно при сравнении активности препаратов определенного ряда, представляет интерес сравнить их в эквимолярных дозах в пересчете на основание.
1.5. Методы учета антигельминтной эффективности лекарственных средств
Методы исследования препаратов и учета их эффективности различаются в зависимости от вида животных, на которых проводят исследования, и гельминтов, которыми они заражены. При первичном исследовании препаратов на крупных животных препараты вводят в различных дозах, используя для каждой дозы 2–3 животных.
Предварительно определяют токсичность препарата, для чего его вводят в возрастающих дозах белым мышам или животным других видов. Определяют каждую ЛД16, ЛД50, ЛД84 по Литчфилду–Уилкоксону для белых мышей, крыс. На каждую дозу берут по 7–10 животных.
При использовании крупных животных применяют два метода учета эффективности дегельминтизации. Первый метод заключается в подсчете яиц, выделяющихся в определенных порциях фекалий до исследования препарата и через различные сроки после него. В дальнейшем вычисляют процент снижения выделения яиц. Одновременно ведут сбор фекалий, их промывку и подсчет отошедших паразитов. В ряде случаев, особенно при небольших размерах гельминтов, проследить за их элиминацией (отхождением) не представляется возможным, особенно в связи с их деформацией или перевариванием в кишечнике хозяина. Перевариванию могут способствовать и некоторые препараты (фенасал и др.). В таких случаях эффективность терапии учитывают посредством подсчета яиц в фекалиях. При некоторых цестодозах (тениидозы, дифиллоботриозы) учитывают отошедшие сколексы. В отдельных случаях можно вести контроль за эффективность действия препаратов по отсутствию выделения яиц или проглоттид через сроки, необходимые для регенерации стробилы.
Для количественного определения яиц, выделяемых с фекалиями леченых и контрольных животных, в мерную стеклянную колбочку наливают децинормальный раствор едкого натрия до отметки «56 мл», затем добавляют испражнения до тех пор, пока уровень жидкости не достигнет 60 мл. После взбалтывания со стеклянными бусами забирают для исследования 0,075 мл (1 каплю) смеси, помещают на предметное стекло, покрывают покровным стеклом и микроскопируют при увеличении 56. Обнаруженное число яиц умножают на 200 и получают количество яиц в 1 мл экскрементов.
606
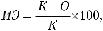
Второй метод учета эффективности дегельминтизации заключается в подсчете отошедших гельминтов, а при последующем вскрытии пролеченных животных — также и в подсчете оставшихся паразитов. Это наиболее точный метод. После введения препарата ежедневно собирают отдельно от каждого животного и промывают фекалии, подсчитывают число отошедших гельминтов. Через 7–20 дней животных подвергают эвтаназии и подсчитывают количество паразитов в органах, в которых они локализуются (метод неполных гельминтологических вскрытий по К.И. Скрябину).
Эффективность препарата определяют по двум показателям: учитывают количество или процент животных, полностью освободившихся от гельминтов, — экстенс- эффективность(ЭЭ)ичислоилипроцентотошедшихпаразитов—интенс-эффективность (ИЭ). При определении эффективности препаратов ЭЭ часто не учитывают, так как для получения достоверных величин требуется значительное число животных. В связи с трудностью или невозможностью подсчета отошедших паразитов для вычисления ИЭ сравнивают среднее число гельминтов у вскрытых животных в леченой и контрольной группах и определяют ИЭ (в %) по формуле:
где К — среднее число гельминтов в контрольной группе, О — среднее число гельминтов в леченой группе.
Для леченой и контрольной групп следует использовать животных одного вида и возраста, содержащихся в одинаковых условиях. Следует иметь в виду, что на заражаемость животных гельминтозами и эффективность дегельминтизации может влиять сезон года. Время суток также может оказывать существенное влияние на эффективность химиотерапии.
При отборе (скрининге) химических соединений или растительных препаратов, обладающих антигельминтными свойствами, большая часть испытуемых соединений оказывается неэффективной. В связи с этим при первичном скрининге рекомендуется вводить препараты в максимально переносимой дозе. При ИЭ ниже 50% препарат характеризуют как слабоэффективный. Если эффективность препарата свыше 50%, а особенно 80–100%, его рекомендуется испытать повторно из-за возможной нестабильности результатов экспериментальной химиотерапии. Окончательную эффективность устанавливают при проверке нескольких серий препарата, каждой — не менее чем на трех различных партиях животных. Определяют среднюю эффективную дозу (ЭД50), а также ЭД16, ЭД84. Достоверность результатов вычисляют методами биологической статистики.
Для получения более достоверных данных в леченые и контрольную группы следует включать не менее 7–10 животных. С целью экономии лабораторных животных отобранные для дальнейших исследований препараты следует испытывать на партиях по 100– 150 животных, имея для них одну контрольную группу. Часто у животных, получивших неэффективный препарат, интенсивность инвазии бывает выше, чем у контрольных животных, что обусловлено его токсическим действием с последующим ослаблением иммунобиологических реакций организма хозяина.
Широко применяемым в химиотерапии тестом определения качества препаратов является их химиотерапевтический индекс (ХТИ), который определяют путем сопоставления минимально эффективной и максимально переносимой доз или средней эффективной и средней смертельной доз. Однако препараты, обладающие антигельминтными свойствами и незначительной острой токсичностью, при повторных введениях в небольших дозах могут вызвать тяжелые побочные явления и хронические поражения органов и систем. В связи с этим правильнее определять ХТИ путем сравнения минимально эффективных доз и доз, не вызывающих хронических изменений в организме хозяина. Рекомендуется определять химиотерапевтические индексы, характеризующие степень безопасности препарата, относительно каждого конкретного повреждающего эффекта.
607
Такие индексы называют органомишеневыми терапевтическими индексами (ОМТИ). ОМТИ вычисляется через отношение минимальной дозы, повреждающей тот или иной орган (систему) экспериментального животного к предполагаемой лечебной дозе этого препарата для человека.
Существенным недостатком проводимых фармакологических и токсикологических исследований антигельминтиков является то, что они выполняются только на здоровых животных. Однако известно, что чувствительность к химическим препаратам как организма хозяина, так и обитающих в нем гельминтов может существенно изменяться при развитии патологических процессов.
2.Специальная часть
2.1.Нематодозы
2.1.1. Энтеробиоз
Энтеробиоз — гельминтоз из группы нематодозов, вызываемый острицей Enterobius vermicularis, паразитирующей в кишечнике только человека, особенно часто у детей, и проявляющийся нарушениями преимущественно органов пищеварения, нервной системы, развитием иммунодефицитных состояний. Характерен зуд в перианальной области.
Вкачестве моделей для изучения терапии энтеробиоза наиболее целесообразно использовать белых мышей, у которых встречаются два вида оксиурид: Aspiculuns tetraptera
иSyphacia obvelata. Нередко в качестве лабораторной модели используют также мышей или крыс, экспериментально зараженных Gangyleterakis spumosa. Значительно более дорогой является модель Passaluns ambiguus на кроликах.
При температуре 37 °С в водопроводной воде яйца A. tetraptera и S. оbvelata развиваются до инвазионной стадии в течение соответственно 23–24 и 20–22 ч, но в изотоническом растворе натрия хлорида при той же температуре сроки их развития удлиняются до 45–48 и 35–40 ч соответственно. Эти условия содержания яиц не отражаются на их жизнеспособности.
Вматке самок A. tetraptera зрелые яйца появляются на 10–12 день инвазии. Для оксиурид характерны 4 линьки. Две из них осуществляются в яйце. Третью и четвертую линьку личинка совершает в организме хозяина. Личинки A. tetraptera третью линьку проходят на 3–4 день инвазии, а четвертую — на 6–7 день. У личинок S. оbvelata третья линька происходит на 2–3, четвертая — на 4–5 сутки после заражения.
При экспериментальном заражении мышей аспикулорозом или сифациозом им вводят per os по 100 инвазионных яиц. При изучении активности против личинок оксиурид химиопрепараты следует вводить на 4–5 день после заражения аспикулорозом и на 3–4 день — сифациозом. Для исследования химиотерапевтической активности препаратов на половозрелой стадии их вводят на 10–11 день при использовании модели аспикулороза
ина 8–9 день при сифациозе. Учет результатов химиотерапии проводят через 3–4 суток после окончания курса лечения одновременно в леченых и контрольной группах.
Гангулетеракидозом крыс хорошо заражаются белые мыши. Это значительно облегчает и удешевляет работу. От инвазированных мышей собирают яйца паразитов. Яйца культивируют при 27 °С в течение 14 дней. К этому времени в них формируется подвижная личинка. Мышам вводят по 100 инвазионных яиц G. spumosa, в результате чего у животных развивается по 40–95 нематод. Выделение яиц начинается через 25–38 дней после заражения. Инвазия стойко сохраняется не менее 5 мес. Паразиты развиваются примерно у 90% животных. Для экспериментальной терапии предварительно обследуют мышей и отбирают выделяющих яйца гангулетеракиса. Исследование препаратов начинают с 40 дня после заражения мышей. Препараты вводят в течение 1–3 дней. Для предварительного отбора достаточно использовать по 8–10 животных на каждый препарат. Учет эффективности через 3–4 суток одновременно в леченых и контрольной группах.
608
Яйца пассалуруса (P. ambiguus) становятся инвазионными при температуре 35–36 °С через 7–8 сут. В кишечнике кроликов паразит достигает половозрелой стадии на 17– 24 сутки. Однако препатентный период (до момента выползания самок из ануса) длится 56–67 сут. Для изучения антигельминтного действия препаратов на личиночные стадии пассалуруса химиотерапию следует проводить на 10–14 сутки, на половозрелую — на 25–27 сутки.
2.1.2. Аскаридоз
Аскаридоз — один из наиболее распространенных в мире гельминтозов человека с выраженной аллергической симптоматикой в острой (миграционной) стадии заболевания (при первичном заражении и особенно в случаях суперинвазии) с преобладанием явлений со стороны органов дыхания, кроветворения, а в стадии паразитирования гельминтов в тонкой кишке — со стороны органов пищеварения, нервной и других систем. Возбудитель — аскарида (Ascаris lumbricoides Linnaeus, 1758) — строго специфичный паразит человека. У животных A. lumbricoides может паразитировать только как транзитный паразит, т.е. на личиночной (миграционной) стадии, никогда не достигая следующей кишечной стадии. Воспроизводство на лабораторных моделях личиночной стадии аскариды может представлять большой интерес для исследователей и быть весьма информативным. В связи со значительными трудностями получения инвазионного материала экспериментаторы часто предпочитают использовать близкий вид — Ascaris suum, паразитирующий у свиньи.
Аскарид свиньи обычно получают с мясокомбината. В лабораторных условиях (обязательно только в вытяжном шкафу, так как возможны аллергические реакции на испарения аскарид, вплоть до анафилактического шока) вскрывают самок аскарид. Отсекают периферический отдел матки с двумя ее рогами, каждый размером до 1,5–2 см, выдавливают из матки яйца гельминта на часовое стекло диаметром 8,0 см. В него наливают 1% раствор соляной кислоты (для профилактики развития посторонней микрофлоры, особенно грибковой) так, чтобы культура яиц слегка была им прикрыта, и помещают во влажную камеру в чашку Петри. Чашку помещают в термостат при температуре 30 °С не менее чем на 18 дней. С целью аэрации культуры яиц крышку чашки Петри необходимо ежедневно приоткрывать, а содержимое часового стекла перемешивать вращением вокруг вертикальной оси или покачиванием. Через этот срок яйца достигают инвазионной стадии. С целью контроля за инвазионностью яиц через 8 сут после экспериментального заражения убивают 3 белых мышей. Их легкие мелко иссекают ножницами и с помощью метода Бермана (см. раздел 1.1.) определяют наличие мигрировавших в легкие личинок аскарид.
Для экспериментального заражения обычно используют белых мышей, реже крыс или морских свинок. Личинки мигрируют в тканях печени, а затем легких в течение 10–16 дней. В связи с этим при исследовании антигельминтного действия препаратов на личиночной стадии A. lumbricoides или А. suum завершить исследование рекомендуется в течение первых 9 дней после заражения. Для этого животных лечат на 6–7 сутки инвазии, вскрывают — на 9 сутки.
Моделями кишечной стадии аскаридоза могут служить кошки, зараженные Toxocara mystax, или собаки, зараженные T. canis.; используют спонтанно зараженных животных, которых отбирают при копрологическом обследовании. Обычно лучше заражены молодые животные. Результаты исследования препаратов учитываются путем сбора отошедших нематод, по динамике выделения яиц или посредством подсчета обнаруженных при вскрытии животных живых паразитов.
2.1.3.Токсокарозы — ларвальные нематодозы человека
Учеловека нередко возникают заболевания, которые относят к группе болезней, вызываемых мигрирующими личинками гельминтов животных — larva migrans. В условиях
609
умеренного климата наиболее часто возбудителями этих болезней являются нематоды собак и кошек — Toxocara canis и Toxocara mystax. Эти заболевания по своему течению весьма напоминают миграционную фазу аскаридоза с поражением тех же органов и систем: легких, печени, кроветворных и других органов, а также, в отличие от аскаридоза, головного мозга человека.
Половозрелые токсокары локализуются в тонкой кишке собак и кошек, с фекалиями которых во внешнюю среду выделяются яйца гельминтов. После созревания во внешней среде они становятся инвазионными в том числе и для человека.
Яйца токсокар собирают от инвазированных животных. При температуре 25–30 °С (в условиях термостата) и достаточной влажности они становятся инвазионными в течение не менее 14 дней. Животных (обычно лабораторных мышей) заражают по 50– 100 яиц с помощью шприца с канюлей, которую вводят в пищевод. Исследование препаратов проводят в первые 5 дней после заражения. Учет результатов лечения производят через 2–3 сут после окончания лечения. Для этого подсчитывают количество личинок токсокар в головном мозге и легких леченых животных. Указанные органы мелко иссекают ножницами и исследуют по методу Бермана (см. 1.1).
2.1.4. Трихоцефалез
Трихоцефалез — один из наиболее распространенных в мире кишечных гельминтозов человека. Возбудитель — власоглав Trichocephalus trichiurus (Linnaeus, 1771; Blanchard, 1895) — строго специфичный гельминт человека, паразитирующий преимущественно в слепой кишке. Заболевание характеризуется хроническим течением с преобладающим поражением пищеварительного тракта и нервной системы.
Представители рода Trichocephalus Schrank, 1788 встречаются у ряда животных, но наиболее доступной и удобной лабораторной моделью являются белые мыши, зараженные T.muris Schrank, 1788. Первоначально модель воспроизводится при сборе нематод от домовых мышей, которые наиболее интенсивно заражены в районах с теплым и влажным климатом, в частности на Кавказе. Яйца трихоцефалюсов от лабораторных мышей получают флотационно-центрифужным методом или из самок нематод, извлеченных из слепой кишки инвазированных животных. Для развития яиц гельминта до инвазионнойстадии их помещают в термостат при температуре 30 °С. Методика описана в разделе 1.3. К 16–20 дню подвижными становятся большинство личинок, однако инвазионнойстадии они достигают лишь через 5–10 дней после этого. К этому моменту на головном конце становится заметным втянутый маленький хитиновый стилет, играющий важную роль в пенетрации слизистой оболочки кишки хозяина.
Паразит начинает откладывать яйца на 36–40 день инвазии. Период выделения яиц длится в среднем 45 дней (31–56), а продолжительность жизни мышиного власоглава составляет в среднем 88,3 дня (от 76 до 100). При инвазионной дозе 50 яиц развивается от 8 до 45 особей власоглава, при дозе 100 яиц наблюдается значительный падеж мышей к моменту достижения гельминтом половозрелой стадии.
Оптимальными являются лабораторные модели с использованием мышей самцов линии DBA/2 или AKR/y, что обусловлено их высокой восприимчивостью к этой инвазии и незначительным разбросом в группах по ее интенсивности. Это позволяет получать более точные результаты исследований.
При массовом отборе препаратов целесообразно каждый из них вводить 8–10 животным. Для экспериментальной терапии используют мышей с момента выделения яиц и в течение последующих 10 дней. Препараты вводят в течение 2–4 дней подряд. Вскрытие животных леченых и контрольной групп производят через 5–7 дней после окончания курса лечения.
При оценке результатов исследований следует учитывать, что трихоцефалюсы у мышей значительно более устойчивы к антигельминтикам, чем паразитирующий у человека Т.trichiurus.
610
