
3 курс / Фармакология / Миронов_А_Н_,_Бунатян_Н_Д_и_др_Руководство_по_проведению_доклинических
.pdf
|
Таблица 2 |
Клиническое применение индукторов интерферона |
|
Название препарата |
Клинические показания |
Амиксин |
Герпес, вирусные гепатиты, энтеровирусные инфекции, грипп и |
|
др. ОРВИ, бактериальные заболевания |
Кагоцел |
Грипп и др. ОРВИ, генитальный герпес |
Ларифан |
Грипп и др. ОРВИ, различные формы герпеса (генитальный, |
|
офтальмогерпес, опоясывающий), гепатит В |
Мегосин |
Герпес 1 и 2 типа, опоясывающий лишай |
Неовир |
Герпесвирусные инфекции, острый вирусный гепатит А, хрониче- |
|
ские вирусные гепатиты В и С, грипп и др. ОРВИ |
Полудан |
Герпетический кератит и кератоконьюктивит |
Ридостин |
Арбовирусные инфекции, герпес, хламидиоз |
Циклоферон |
Гепатит, герпес, ВИЧ-инфекция, хламидиоз |
1.Цели и задачи исследования
Внастоящих методических рекомендациях суммированы методы, используемые для доклинической оценки специфической активности новых клинически перспективных ИИ.
Специальные разделы рекомендаций посвящены определению динамики продукции интерферонов в ответ на введение этих фармакологических веществ in vitro и in vivo, определению противовирусной, интерферониндуцирующей, иммуномодулирующей, антитуморогенной и радиопротективной активности ИИ, способности ИИ синтезировать интерферон и цитокины в различных органах и тканях, определению гипореактивной фазы при повторном введении ИИ и ряд других свойств этих препаратов.
2.Первичный скрининг индукторов интерферонов in vitro
Первичный этап изучения ИИ включает определение in vitro токсичности и максимально переносимой концентрации препарата, его противовирусной и интерферониндуцирующей активности.
Основные материалы и методы
Вирусы. Для первичного отбора ИИ целесообразно использовать вирусы, которые отличаются высокой чувствительностью к действию интерферонов и имеют короткий цикл размножения — венесуэльского энцефаломиелита лошадей (ВЭЛ), Синдбис (ВС), везикулярного стоматита, штамм Индиана (ВВС) и энцефаломиокардита мышей (ЕМС).
Клетки. В работе могут быть использованы клетки, чувствительные к действию ИФН: первично трипсинизированные клетки — фибробласты эмбрионов кур (ФЭК) и человека (ФЭЧ), почки и легкие эмбрионов человека (ПЭЧ и ЛЭЧ), а также перевиваемые клетки диплоидных фибробластов человека (ДФЧ) и культуры мышиных (L929) и обезьяньих (BSC-1) клеток.
Поскольку огромное большинство индукторов ИФН, к числу которых относятся многие низкомолекулярные вещества (акриданоны, флуореноны и др.), неспособны индуцировать синтез ИФН в фибробластах, с целью определения интерферониндуцирующей способности таких препаратов в работе могут быть использованы клетки периферической крови мышей. Методы выделения клеток периферической крови описаны в разделе «Определение интерферониндуцирующей активности препарата in vivo».
Культивирование клеток. В работе используют 24-часовой монослой клеток, выращенных в 96-луночных плоскодонных планшетах в среде RPMI 1640 или двойной среде; иглу с добавлением 10% прогретой бычьей (для первичных клеток) или 10% телячьей
551
эмбриональной сыворотки, глютамина (0,3 мг/мл) и гентамицина (0,08 мг/мл) в термостате с СО2.
Иммунокомпетентные клетки культивируют в круглодонных 96-луночных планшетах в среде RPMI 1640 с добавлением 10% телячьей эмбриональной сыворотки, глютамина (0,3 мг/мл) и гентамицина (0,08 мг/мл) в термостате с СО2.
Эталонные индукторы ИФН. В качестве эталона может быть использован комплекс поли (И)- поли(Ц) фирмы «Calbiochem», а также амиксин, ридостин и циклоферон.
2.1.1. Определение токсичности индуктора ИФН in vitro
Готовят 10-кратные разведения препарата, в культуральной среде, обычно от 1000 до 0,01 мкг/мл и вносят в культуры клеток, достигших монослоя (по 4 повтора на каждое разведение). Контакт препарата с клетками осуществляют 4 и 24 ч при 37°С, после чего планшеты микроскопируют для определения цитодеструктивного действия, отмечаемого по 4-крестовой системе, по методу Финтера, где 100% деструкция клеток обозначается 4+, 25% — 1+. Минимальная концентрация препарата, вызывающая цитотоксический эффект на 50% (++), рассматривается как цитопатогенная доза (ТЦД50). На основании полученных данных определяют максимально переносимую концентрацию препарата (МПК), которая составляет ¼ ТЦД.
2.1.2. Исследование интерферониндуцирующей активности препарата in vitro
ИФН обладают видовой специфичностью. Поэтому первичную оценку интерферониндуцирующей активности препарата проводят в культуре первично трипсинизированных или диплоидных клеток человека и животных (в зависимости от условий эксперимента). Пробы культуральной жидкости (по 4 повтора на каждое разведение) берут через 4 и 24 ч после контакта изучаемого препарата с клетками. Параллельно (в качестве контроля) используют стандартные индукторы ИФН в максимальной интерферониндуцирующей концентрации, рекомендованной для каждого эталонного индуктора ИФН. Собранные пробы хранят при температуре –20°С.
Титрование ИФН проводят в 96-луночных плоскодонных планшетах с культурой диплоидных фибробластов человека (ДФЧ) или животного, выращенных в ростовой среде до образования монослоя. В качестве индикаторного тест-вируса используют вирус энцефаломиокардита мышей (ЕМС). За единицу активности ИФН (Ед/мл) принимается величина, обратная его максимальному разведению, которая защищает 50% клеток от цитопатогенного действия 100 ТЦД50 вируса. В каждом титровании используется также референс-препарат ИФН для перевода полученной активности ИФН в международные единицы (МЕ).
2.1.3. Определение противовирусной активности исследуемого препарата
После удаления из опытных планшет культуральной жидкости для определения уровня ИФН, индуцированного различными концентрациями исследуемых препаратов, клетки заражают тест-вирусом в дозе, вызывающей 100% поражение клеток (ТЦД50) через 24–48 ч после заражения. В качестве контроля используют клетки, не обработанные препаратами.
Определение противовирусного действия препарата проводят методом титрования проб, собранных через 24 ч после заражения вирусом культуры клеток, чувствительных к данному вирусу, выращенных в плоскодонных планшетах. Исследование противовирусной активности препаратов в иммунокомпетентных клетках не проводят.
2.1.4. Оценка результатов исследования препаратов in vitro
При оценке результатов исследования препаратов в культуре клеток основным следует считать их способность индуцировать продукцию интерферона.
Противовирусная активность учитывается в том случае, если у препарата обнаруживается интерферониндуцирующая активность. Для оценки противовирусной актив-
552

ности пригодны параметры, разработанные для широкого круга химиотерапевтических препаратов, обладаюших этим свойством. Противовирусная активность соединения оценивается по степени ингибиции размножения тест-вируса. Препаратом, обладающим выраженным антивирусным эффектом, следует считать соединение, подавляющее размножение вируса в культуре клеток на 1,7–2,0 lg.
При обнаружении способности препарата индуцировать в клетках ИФН следует определить минимально эффективную концентрацию препарата (МЭК), что позволит вычислить химиотерапевтический индекс (ХТИ) исследуемого вещества in vitro. ХТИ представляет собой отношение максимально переносимой концентрации (МПК) к минимально эффективной концентрации (МЭК):
Схема первичной оценки препаратов in vitro, таким образом, включает три основных параметра (интерферониндуцирующая способность, антивирусное действие и ХТИ).
|
|
|
Таблица 3 |
|
Оценка эффективности индукторов интерферона in vitro |
||||
Показатель эффективности |
Неактивные, |
Активные |
Высокоактивные |
|
слабоактивные |
||||
|
|
|
||
Титры ИФН МЕ/мл |
<4–8 |
>16–32 |
>32–64 |
|
Снижение титра вируса, lg |
<1,78 |
>1,78 |
>3–6 |
|
ХТИ |
<4 |
>8 |
>16 |
|
2.2. Первичный отбор индукторов интерферона in vivo
Первичная оценка индукторов ИФН in vivo проводится, как правило, на белых беспородных мышах или мышах линии СВА и включает несколько этапов.
1.Определение ЛД50 препарата при внутрибрюшинном введении.
2.Определение индукции сывороточного ИФН через 6 и 24 ч после внутрибрюшинного введения препарата.
3.Определение противовирусной активности на мышах по показателю защиты от смертельной вирусной инфекции.
4.Определение безвредности препарата.
Основные материалы и методы
Вирусы. При изучении ИИ in vivo целесообразно использовать вирусы, отличающиеся высокой чувствительностью к действию интерферонов, одним из них может, в частности, служить вирус энцефаломиокардита мышей (ЕМС).
Животные. В работе используются мыши линии СВА и нелинейные белые мыши, массой 10–12 г и 16–18 г.
Эталонные индукторы ИФН.
В качестве эталонных могут быть использованы известные индукторы ИФН с коммерческими названиями — амиксин, ридостин и циклоферон в максимально эффективных концентрациях in vivo.
Титрование ИФН осуществляется по методике, описанной выше, в культуре мышиных перевиваемых клеток L 929 с использованием индикаторного тест-вируса — ЕМС.
2.2.1. Определение ЛД50 препарата in vivo
ЛД50 препарата определяют на белых нелинейных мышах, массой 10–12 г. Животным внутрибрюшинно в объеме 0,2 мл вводят препарат в различных концентрациях. Каждый день в течение 2 недель регистрируют смертность животных и затем вычисляют ЛД50 препарата по одному из общепринятых методов.
553
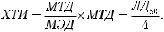
2.2.2. Определение интерферониндуцирующей активности препарата in vivo
Для определения интерферониндуцирующей активности препарата используют мышей массой 18–20 г, которым внутрибрюшинно вводят разные концентрации исследуемого препарата, меньшие 1/4–1/16 ЛД50. Через 6 и 24 ч после введения препарата у животных собирают кровь. Эти сроки рекомендуется использовать для того, чтобы в испытываемой зоне учесть препараты с различной динамикой продукции стимулируемого ИФН. Для забора крови и приготовления сыворотки используются обычные методы. Для каждой пробы используют не менее 4–5 животных. Пробы ИФН титруют параллельно с контролем и стандартом мышиного ИФН по ЦПД, вызываемому ЕМС на перевиваемой линии мышиных клеток L 929, выращенных на пластиковых плоскодонных 96-луночных планшетах описанным выше способом.
2.2.3. Определение противовирусной активности препарата по выживаемости животных
Определение противовирусной активности in vivo производят на белых беспородных мышах массой 10–12 г. На каждое условие эксперимента используют по 10 животных. Предварительно выбирают инфицирующую дозу вируса. С этой целью вирус, используемый для моделирования экспериментальной инфекции, титруют на мышах и высчитывают инфицирующую дозу вируса, которая должна вызывать от 80 до 95% погибших животных. Препарат в ранее определенных in vivo интерферониндуцирующих дозах вводят мышам внутрибрюшинно в объеме 0,2 мл за 24 и 2 ч до заражения вирусом. На каждое условие эксперимента используют не менее 10 животных. Наблюдение проводят в течение 14 дней ежедневно, отмечая количество погибших животных, и вычисляют количество оставшихся живыми в %. Если выживаемость составляет менее 30% — препарат считается слабоактивным, от 30 до 60% — активным и более 60% — высокоактивным.
2.2.4. Определение химиотерапевтического индекса
ХТИ представляет собой отношение минимальной токсической дозы (МТД) к минимальной эффективной дозе (МЭД).
Соединения, имеющие ХТИ<4, считаются слабоактивными, >8 — активными и >16 — высокоактивными.
Оценка эффективности индукторов ИФН in vivo |
Таблица 4 |
|||
|
||||
Показатель эффективности |
Неактивные, |
Активные |
Высокоактивные |
|
слабоактивные |
||||
|
|
|
||
Титры ИФН МЕ/мл |
<32 |
>32–100 |
>100 |
|
Выживаемость в % |
<30 |
>30–60 |
>60 |
|
ХТИ |
<4 |
>8 |
>16 |
|
Следующим этапом в изучении отобранных в результате скрининга индукторов интерферона является исследование безвредности индукторов интерферонов (отсутствие острой и хронической токсичности, аллергенности, эмбриотоксичности, мутагенности, карценогенности). Безвредность препаратов изучают в следующих тестах:
2.2.5. Определение токсичности на животных
Острая токсичность ИИ исследуется на мышах и собаках, которым исследуемый препарат вводится в виде водного раствора однократно. Выбирается оптимальный спо-
554
соб введения препарата (перорально, внутрибрюшинно или подкожно). Каждая доза испытывается не менее, чем на 6 животных. Токсической дозой считается та, при которой погибает 50% животных. Препарат проходит исследования на токсичность, если токсическая доза превышает оптимальную интерферониндуцирующую по крайней мере в 10 раз.
Переносимость и безвредность ИИ исследуется на собаках, которым препарат вводится однократно в разных дозах. Оценка производится по поведению экспериментальных животных.
Хроническая токсичность препарата исследуется на крысах. Отмечается потребление корма и воды, состояние волосяного покрова, слизистых оболочек, показателей всех систем организма (ССС, ЦНС, выделительной). После окончания эксперимента (обычно через 15 дней) проводятся патологоанатомические исследования.
2.2.6. Определение аллергизирующих свойств препарата
Изучение местнораздражающего и кожно-резорбтивного действия исследуемых препаратов проводится на кроликах породы Шиншилла массой тела 2,5–3,0 кг при однократном нанесении препарата на кожу и введении в конъюнктивальный мешок глаза.
Сенсибилизирующее действие препарата испытывается в реакциях кожной анафилаксии и гиперчувствительности замедленного типа на мышах.
Исследование реакций прямой дегрануляции тучных клеток — на крысах.
Конъюнктивальная проба изучается на морских свинках.
Препарат считается не обладающим аллергенными свойствами, если в дозе, превышающей в 10 раз терапевтическую, он не выявляет анафилактических реакций, положительных реакций конъюнктивальных проб, реакции дегрануляции тучных клеток и гиперчувствительности замедленного типа.
2.2.7. Эмбриотоксическое действие препарата
Эмбриотоксическое действие препарата изучается на крысах (линейные самки), разделенных на 4 группы. Препарат вводится ежедневно в терапевтических дозах и превышающих в 10 раз терапевтический уровень в течение всего периода беременности. Исследуются показатели:
Гибель эмбрионов в получающей препарат и контрольной (в качестве плацебо вводится дистиллированная вода) группах.
Размер плодов, состояние внутренних органов плодов, аномалии развития, дефекты скелета.
2.2.8. Мутагенные свойства препарата
Учет аберраций хромосом в клетках костного мозга мышей СВА, которым препарат вводят однократно в дозе, превышающей терапевтическую по крайней мере в 10–15 раз, и многократно в течение 8 дней.
Учет доминантных летальных мутаций в зародышевых клетках мышей при однократном введении препарата.
Учет генных мутаций на микроорганизмах в тесте Эймса.
При отсутствии токсичности, эмбриотоксичности и мутагенности исследуемых препаратов приступают к углубленному исследованию биологических свойств ИИ.
3. Углубленное доклиническое изучение индукторов интерферонов
Отобранные в результате первичного скрининга наиболее высокоактивные и малотоксичные индукторы интерферона подвергаются углубленному исследованию, которое включает следующие тесты:
— исследование способов введения и определение динамики продукции ИФН;
555
—определение интерферонпродуцирующей способности иммунокомпетентных клеток (спленоцитов, тимоцитов, клеток периферической крови и костного мозга) в ответ на индукцию исследуемым препаратом;
—определение способности синтезировать ИФН различными органами и тканями мышей в ответ на индукцию исследуемым препаратом;
—определение гипореактивной фазы in vitro и in vivo;
—определение иммуномодулирующего эффекта;
—определение антитуморогенной и радиопротективной активности;
—определение спектра антивирусного действия;
—отработка оптимальных схем введения.
Основные материалы и методы
Вирусы. При изучении антивирусного эффекта препаратов in vivo целесообразно использовать вирусы, вызывающие заболевания животных, сходные с соответствующими инфекционными заболеваниями человека (вирусы гриппа, герпеса, гепатита, бешенства, энцефалита).
Животные. В работе используют мышей линии СВА и нелинейных белых мышей, массой 10–12 г и 16–18 г.
Эталонные индукторы ИФН. В качестве эталонных могут быть использованы следующие индукторы ИФН: амиксин, ридостин и циклоферон в максимально эффективных концентрациях при исследованиях in vivo.
Культивирование клеток и титрование ИФН осуществляется по методикам, описанным выше.
3.1.Определение динамики продукции ИФН
испособов введения препарата in vivo
Исследование способов введения и определение динамики продукции ИФН в ответ на индукцию тестируемого препарата является необходимым этапом для оптимизации схем его введения. Исследования желательно проводить на мышах линии СВА, т. к. эти животные обладают высокой способностью к продукции ИФН.
Для определения динамики продукции ИФН используются мыши, массой 18–20 г, которым препарат вводят в объеме 0,2 мл разными способами (внутрибрюшинно, внутривенно, внутримышечно, подкожно, перорально, интраназально и ректально). При внутрибрюшинном, внутривенном, внутримышечном и подкожном способах препарат вводят в максимально эффективной дозе, установленной в ходе доклинического отбора препарата in vivo. При внутримышечном, пероральном, интраназальном и ректальном способах введения, кроме этой дозы используют еще одну концентрацию препарата, равную 1/10 максимально эффективной дозы, поскольку в ряде случаев при этих способах введения индукторов максимальный эффект достигается при использовании вещества в концентрациях в 5–10 раз меньших, чем при внутрибрюшинном его применении. Через 2, 4, 6, 8, 12, 24, 48, 72 и 96 ч после введения препарата у животных собирают кровь и определяют концентрацию ИФН в сыворотке. В связи с тем что у линейных мышей результаты колеблются в незначительном диапазоне, можно использовать по 4 мыши на каждую точку.
Для забора крови, приготовления сыворотки и титрования ИФН используют стандартные методы.
3.2. Определение интерферонпродуцирующей способности иммунокомпетентных клеток в ответ на индукцию исследуемым препаратом
Индукторы ИФН обладают уникальной способностью «включать» синтез ИФН в определенных популяциях клеток и органов, что в ряде случаев имеет определенные
556
преимущества перед мультипотентной стимуляцией иммуноцитов интерферонами. При этом надо иметь в виду, что при разных способах введения препарата в продукции ИФН могут принимать участие различные органы, ткани и клетки иммунной системы.
Одним из важных этапов доклинического исследования индукторов ИФН является определение интерферонпродуцирующей способности иммунокомпетентных клеток (спленоцитов, тимоцитов, клеток периферической крови, лимфоузлов и костного мозга) в ответ на индукцию исследуемым препаратом. Этот тест может помочь установить какие клетки иммунной системы принимают участие в продукции ИФН в ответ на индукцию исследуемым препаратом. Исследование проводят 3-я методами.
1.Интерферонпродуцирующая способность различных клеток иммунной системы, выделенных от интактных животных в ответ на индукцию исследуемым препаратом. Этот эксперимент позволяет ответить на вопрос: способны ли и в какой степени те или иные клетки иммунной системы синтезировать ИФН в ответ на индукцию исследуемым препаратом. С этой целью обескровливают 5 интактных животных линии СВА, массой 18–20 г, собирая кровь в центрифужную пробирку с 1–2 каплями гепарина. Затем животных препарируют, собирая в отдельные емкости со средой (RPMI 1640 c добавлением 0,08 мг/мл гентамицина) берцовые кости, тимусы, подмышечные лимфоузлы и селезенки. Клетки из тимуса, лимфоузлов и селезенки выдавливают в стерильные чашки Петри при помощи шпателя, а из костей — при помощи шприца с тонкой иглой, дважды отмывают центрифугированием при 1000 об/мин в течение 10 мин в растворе Хенкса,
суспендируют в малом объеме среды RPMI, подсчитывают концентрацию клеток в камере Горяева и разводят средой инкубирования до конечной концентрации 5–10×106 кл/ мл. Кровь разводят в 10 раз той же средой. Клетки индуцируют максимально эффективной дозой препарата, установленной in vitro, и инкубируют в 96-луночных круглодонных планшетах (по 3 лунки на условиях эксперимента). Пробы культуральной жидкости собирают через каждые 24 ч в течение 3–5 сут. Титры ИФН исследуют в гомологичной культуре клеток L929 методами, описанными выше.
2.Интерферонпродуцирующая способность клеток иммунной системы, выделенных от животных, индуцированных различными способами. Данный метод позволяет ответить на вопрос: какие клетки иммунной системы принимают участие в продукции ИФН при разных способах введения исследуемого препарата?
Клетки выделяют из животных, индуцированных разными способами, описанными выше. Для эксперимента используют максимально эффективные in vivo концентрации препарата. Выделение и культивирование клеток, а также отбор проб и титрование ИФН осуществляют так же, как в предыдущем эксперименте.
3.Определение способности синтезировать ИФН различными органами и тканями мышей в ответ на индукцию исследуемым препаратом.
Метод позволяет уточнить эффективность разных способов введения вещества и наметить круг инфекций, при которых данный препарат может оказаться эффективным.
Для определения динамики продукции ИФН в различных органах используют мышей, массой 18–20 г, которым препарат вводят в объеме 0,2 мл разными способами, описанными выше, в максимально эффективной концентрации для данного способа введения вещества. Через 4, 24, 48, 72, 96 и 120 ч животных (по 4–5 на каждую точку) подвергают эвтаназии и стерильно извлекают в отдельные емкости мозг, легкие, кишечник, печень, мышцы.
Собранные органы взвешивают, растирают в стерильных ступках, предварительно обработанных хромпиком, чтобы остатки детергента не влияли на определение активности ИФН. Для снижения активности протеаз в тканях все процедуры осуществляют на холоде в кратчайшие сроки. Ступки предварительно охлаждают при 4 °С, помещая в ледяную баню. Выделение ИФН осуществляют в буфере Hepes 10 mM. Для предотвращения протеолитического гидролиза ИФН в элюирующий буфер добавляют контрикал до конечной концентрации 500 ЕД/мл. Для получения 20% взвеси добавляют 4 мл
557
раствора на 1 г ткани. Разрушение клеток осуществляют троекратным замораживанием и оттаиванием образцов жидким азотом, который приливают прямо в ступки. Для более полной элюции ИФН, связанного с мембранами, пробы обрабатывают Na2ЭДТА, которую добавляют до конечной концентрации 10 mM. Пробы инкубируют при 4°С 2 ч, после чего удаляют нерастворимый осадок центрифугированием (500 об/мин в течение 30 мин). Титры ИФН в надосадочной жидкости определяют методами, описанными выше.
Нейтрализацию Na2ЭДТА в пробах проводят непосредственно перед титрованием ИФН, для чего добавляют в раствор соли двухвалентных катионов Ca++ и Mg++. Молярное соотношение Na2ЭДТА/двухвалентные катионы составляет 1:0,6 или 1:0,8.
Ниже приводятся примеры, иллюстрирующие эффективность метода.
Таблица 5 Влияние химической обработки тканей на уровень тестируемого ИФН (Ед/мл)
Исследуемый |
|
Химические добавки |
|
|
|
|
|
Na2ЭДТА + |
|
орган |
– |
Na2ЭДТА |
Контрикал |
|
|
контрикал |
|||
Мозг |
160 |
10000–25000 |
10 |
200 |
Селезенка |
10 |
640 |
10 |
400 |
Мышцы |
10 |
100 |
10 |
100 |
Кишечник |
10 |
10 |
5000–10000 |
10000 |
Из представленных данных видно, что добавление Na2ЭДТА к пробам мозга, селезенки и мышц существенно повышает выход тестируемого ИФН, в то время как добавление Na2ЭДТА к пробам кишечника не влияет на биологическую активность выделенного ИФН. Наоборот, контрикал не повышает выход ИФН из тканей мозга, селезенки и мышц, в то время как его добавление существенно увеличивает выход ИФН из кишечника.
Поскольку комплексная обработка в ряде случаев оказывается менее эффективной, для определения биологической активности ИФН в кишечнике рекомендуется применять контрикал, а Na2ЭДТА — для определения в других органах и тканях.
4. Определение гипореактивной фазы in vitro и in vivo при введении индукторов интерферонов
Долгое время считалось, что индукторы ИФН активны только при профилактическом применении. Циркуляция ИФН в организме животных и человека в ответ на введение индуктора ИФН ограничена, как правило, 2-я сутками. Это ограничение связано с тем, что ИФН, образовавшийся в организме животных и человека в ответ на введение исследуемого препарата, быстро выводится из кровотока. Кроме того, вслед за индукцией ИФН, параллельно с продукцией, происходит быстрое включение контрольных механизмов синтеза ИФН, которое влечет за собой период рефрактерности (неспособности синтеза ИФН в ответ на повторную индукцию тем же препаратом как in vitro, так и in vivo). Эта фаза наступает после достижения максимума продукции ИФН. Рефрактерность развивается в ответ на первое введение препарата. Повторное введение индуктора только помогает выявить фазу гипореактивности. Рефрактерное состояние организма необходимо учитывать при разработке схем применения индуктора (кратности и сроков повторного введения исследуемого препарата).
Рефрактерность до последнего времени была одним из ограничений применения индукторов ИФН, поскольку повторное введение индуктора в организм, находящийся в состоянии гипореактивности по меньшей мере нецелесообразно.
558
Рефрактерное состояние клеток (организма) обусловлено механизмами, ограничивающими способность клеток синтезировать ИФН и, в частности, образованием белковрепрессоров, контролирующих продукцию ИФН. Белок-репрессор, образовавшийся в ответ на индукцию конкретным индуктором, обладает тканевой специфичностью и специфичностью по отношению к индуктору.
Поэтому длительность фазы рефрактерности зависит как от клеток, так и от использованного индуктора и места введения препарата в организм.
4.1. Определение гипореактивной фазы in vitro
Удобным методическим приемом для определения гипореактивной фазы является повторное внесение индуктора ИФН в культуральную жидкость через определенные интервалы времени.
С этой целью используют культуру первично-трипсинизированных или диплоидных клеток человека и животных, выращенных в 96-луночных плоскодонных планшетах. Степень ИФН ответа клеток оценивают по титрам ИФН, регистрируемым в культуральной жидкости, собранной (по 3 лунки на условие) через 18 ч после повторного использования индуктора. Титрование ИФН осуществляют в гомологичной культуре методами, описанными выше.
4.2. Определение гипореактивной фазы in vivo
Для определения рефрактерной фазы in vivo используются мыши линии СВА и нелинейные белые мыши, массой 16–18 г. Животным вводят препарат внутрибрюшинно в максимально эффективной концентрации. Повторное введение препарата в той же концентрации осуществляется через определенные интервалы времени. Животных обескровливают через интервал времени, необходимый для осуществления полноценного синтеза, индуцированного данным препаратом. ИФН в сыворотке крови исследуют, титруя пробы ИФН в культуре клеток L 929, методами, описанными выше.
5. Определение иммуномодулирующей активности индукторов интерферонов
Помимо этиотропного действия, индукторы ИФН обладают, подобно ИФН, выраженной иммуномодулирующей активностью. Индукторы стимулируют образование не только ИФН, но и ряда других цитокинов, контролирующих гемопоэз и процессы иммуногенеза. Поэтому следующим этапом является изучение иммуномодулирующей активности исследуемых препаратов. Исследование включает следующие тесты:
1.Определение влияния препарата на абсолютное число лейкоцитов и лимфоцитов периферической крови.
2.Оценка эффективности воздействия препарата на клеточный иммунный ответ (влияние препарата на абсолютное и относительное число Т- и В-лимфоцитов с помощью Е-розеткообразования и иммунофенотипирования).
3.Оценка функционального состояния клеток иммунной сиситемы в ответ на воздействие исследуемого препарата.
4.Определение цитокининдуцирующей активности препарата.
5.1.Оценка эффективности влияния препарата на клеточный иммунитет
Исследуют влияние препарата на относительное и абсолютное число Т- и В-лимфо-
цитов, ЕК (естественных киллерных клеток), нейтрофилов.
Для определения относительного и абсолютного числа Т- и В-лимфоцитов используют известные тесты иммунофенотипирования, а также Е-розеткообразования.
5.1.1. Определение субпопуляций Т-лимфоцитов
Основано на выявлении теофиллинчувствительных и теофиллинрезистентных лимфоцитов. Определение Т-супрессоров и Т-хелперов проводят в тесте розеткообразова-
559
ния. Оно основано на том, что Т-супрессоры имеют рецепторы к теофиллину, в то время как Т-хелперы не имеют. При добавлении в среду инкубирования раствора теофиллина он взаимодействует с чувствительными к его действию Т-супрессорами и ингибирует реакцию спонтанного розеткообразования этих клеток с ЭБ. Т-хелперы таких рецепторов не содержат, поэтому при взаимодействии с ЭБ они образуют «розетки» в присутствии теофиллина.
5.1.2. Использование метода проточной цитофлюориметрии для определения субпопуляций лимфоцитов
В последние годы для определения субпопуляций Т-лимфоцитов используют добавление к взвеси лимфоцитов моноклональных антител и комплемента, что приводит к лизису соответствующей фракции лимфоцитов. С помощью моноклональных антител можно выявить все известные субпопуляции Т-, В- и О-лимфоцитов, а также ЕК (естественных киллеров). Для определения поверхностных антигенов лимфоцитов применяются моноклональные антитела, меченные флюорохромом, и проточный цитофлюориметр.
5.2. Оценка эффективности воздействия препарата на гуморальный иммунный ответ
Концентрацию сывороточных иммуноглобулинов основных классов (IgA, IgM, IgG) определяют методом иммуноферментного анализа (ИФА).
Число IgМ-антителобразующих клеток (АОК) селезенки определяют методом локального гемолиза в агаре по Jerne N.K. & Norbin A.A. (1968). Исследования проводят на мышах СВА, массой 18–20 г, иммунизированных внутрибрюшинным введением эритроцитов барана (Э.Б.) в дозе 2×108 клеток в объеме 0,5 мл. Препараты вводят внутрибрюшинно в разные сроки по отношению к антигену (Э.Б.). Контрольным животным вводят физиологический раствор в те же сроки и в том же объеме. Селезенки извлекают на 4 сутки после иммунизации животных. Количество прямых АОК подсчитывали по числу зон гемолиза в геле. Число подсчитанных АОК в контроле в расчете на 106 ядросодержащих клеток исследуемого пула клеток селезенки принимают за 100%.
Для определения субпопуляций В-лимфоцитов используют метод иммунофлюоресценции с мембранными иммуноглобулинами.
5.3.Оценка функционального состояния клеток иммунной ситемы
вответ на воздействие исследуемого препарата
Для характеристики состояния клеточного иммунитета важно оценить не только количестворазличных популяций лейкоцитов, Т- и В-лимфоцитов и их субпопуляций, но и функциональную активность иммунокомпетентных клеток. Для этой цели используют следующие методы:
—реакцию торможения миграции лейкоцитов (РТМЛ),
—реакцию бластной трансформации (РБТЛ),
—определение хемотаксической активности нейтрофилов,
—определение фагоцитарного индекса нейтрофилов.
5.4.Определение цитокин-индуцирующей способности препаратов
Отражением функциональной активности индукторов ИФН является продукция ци-
токинов и, в первую очередь, разных антигенных типов ИФН, поскольку известно, что все без исключения антигенные типы ИФН являются иммуномодуляторами.
Определение цитокин-индуцирующей способности препаратов проводят in vitro в 24-луночных планшетах. Для этого в планшеты вносят кровь доноров или мышей линиии СВА, разведенную в 10 раз в среде RPMI-1640 (с глютамином, 2% телячьей сыворотки и антибиотиками). Затем в планшеты вносят индукторы ИФН в различных
560
