
3 курс / Фармакология / Миронов_А_Н_,_Бунатян_Н_Д_и_др_Руководство_по_проведению_доклинических
.pdfвисочной мышцы кверху, при этом обнажается височная ямка, дно которой образует крыловидная мышца с проходящим рядом нижнечелюстным нервом. С помощью специально сконструированного ранорасширителя раздвигается крыловидная мышца, вследствие чего открывается поверхность черепа между овальным отверстием и отверстием зрительного нерва. В этой области, а именно под нижним краем височно-челюстного сустава, сверлится отверстие диаметром около 2 мм и тем самым обнажается место расположения среднемозговой артерии. Дальнейшую операцию по перевязке указанной артерии проводят под микроскопом с большим фокусным расстоянием (f=190 мм) под большим увеличением (14,0×3,3). Под левую среднюю мозговую артерию подводят иглу с этиконовой нитью толщиной 10/0 (Ethicon Ltd.), прокалывая иглой твердую мозговую оболочку. Перевязку среднемозговой артерии проводят у ее основания. После перевязки ток крови по средней мозговой артерии прекращается, что можно наблюдать в поле зрения под микроскопом.
С целью проведения исследований на бодрствующих животных по возможности восстанавливают топографию мышц и мягких тканей операционного поля. В частности, прикрепляют сухожилия височной мышцы к нижней челюсти для сохранения жевательного процесса. При такой постановке исследований создается возможность для проведения исследований на оперированных животных в течение месяца и более.
2.2.2. Локальная преходящая ишемия мозга, вызванная интралюминальной окклюзией мозговых сосудов
Вариантом модели локальный ишемии головного мозга с рециркуляцией является модель интралюминальной окклюзии мозговых сосудов у крыс. Крыс наркотизируют этаминалом натрия (60 мг/кг внутрибрюшинно) и отпрепаровывают общую сонную артерию (правую либо левую), наружную сонную артерию (в области бифуркации общей сонной артерии) и внутреннюю сонную артерию до места ее вхождения в полость черепа через каротидный канал. После лигирования проксимального конца отпрепарованного участка общей сонной артерии накладывают клипсу на ее дистальный (краниальный) конец, подводят под сосуд лигатуру и через разрез вводят силиконизированную нейлоновую нить диаметром 0,13 мм. Суживают просвет дистального участка общей сонной артерии лигатурой, не затягивая ее полностью, снимают клипсу и под контролем зрения продвигают нейлоновую нить через внутреннюю сонную артерию в полость черепа приблизительно на 15–20 мм от места бифуркации сонной артерии (в зависимости от размера крысы), что соответствует отхождению средней мозговой артерии от виллизиева круга. Манипуляции осуществляют под контролем тканевого кровотока в участках мозга, снабжающихся кровью через среднюю мозговую артерию с помощью высокочастотной ультразвуковой или лазерной допплерографии.
При моделировании необратимой окклюзии средней мозговой артерии лигатуру на краниальном участке общей сонной артерии затягивают и рану ушивают.
При моделировании локальной ишемии через 30–60 мин нить извлекают, лигатуру затягивают, рану ушивают.
В зависимости от времени окклюзии средней мозговой артерии формируется значительное повреждение коры и стриатума головного мозга, сопровождающееся отеком мозговой ткани.
2.2.3. Глобальная ишемия головного мозга
Модели глобальной ишемии включают модель преходящей ишемии и модель глобальной ишемии головного мозга.
2.2.3.1. Модели глобальной преходящей ишемии
Билатеральная окклюзия общих сонных артерий в сочетании с контролируемой гипотензией. Модель воспроизводят у крыс билатеральной окклюзией общих сонных артерий в сочетании с контролируемой гипотензией. Артериальное давление понижают до 50 мм
481
рт. ст. Гипотензия необходима для моделирования ишемии мозга, так как двусторонняя перевязка общих сонных артерий не обеспечивает понижения мозгового кровотока до величин, при которых развивается ишемическое поражение. Понижение артериального давления достигается контролируемым кровопусканием или применением ганглиоблокаторов, α-адреноблокаторов.
Двусторонняя перевязка общих сонных артерий и понижение артериального давления вызывают морфологические изменения в клетках избирательно уязвимых структур — в пирамидальных нейронах СА 1, в гиппокампе, caudoputamen и новой коре. При этом развиваются также нарушения энергетического обмена в ткани мозга.
Двусторонняя окклюзия сонных артерий после предварительной перевязки (коагуляции) позвоночных артерий. Крыс наркотизируют этаминалом натрия (60 мг/кг внутрибрюшинно) и фиксируют спиной кверху, удаляют в области шеи шерстный покров, делают разрез кожи от проекции остистого отростка II шейного позвонка к нижнему краю уха. Тупым методом раздвигают мышцы, ориентируясь на поперечный отросток I шейного позвонка, и обнажают дорсальную поверхность последнего. Находят отверстие вертебрального канала и коагулируют тонким каутером вертебральную артерию. Рану ушивают и коагулируют аналогичным образом вертебральную артерию контрлатеральной стороны.
Через 3–5 дней для моделирования глобальной транзиторной ишемии головного мозга проводят билатеральную окклюзию общих сонных артерий на 30–60 мин, при этом кровоснабжение головного мозга осуществляется через виллизиев круг только по a. spinalis ventralis с развитием тяжелого ишемического поражения головного мозга. Наблюдается расширение зрачков, побледнение видимой части сосудистой оболочки глаза, нарушение ритма дыхания вплоть до его остановки (требует использования аппарата искусственной вентиляции легких).
2.2.3.2. Глобальная ишемия, вызванная гравитационной перегрузкой Продольные гравитационные перегрузки, создаваемые центрифугой, вызывают на-
рушения кровоснабжения головного мозга, тяжесть и характер которых зависит от величины, продолжительности и вектора радиальных ускорений. При краниокаудальном векторе ускорений (положительное радиальное ускорение) происходит перемещение крови в каудальном направлении, и в результате резкого и значительного снижения перфузионного давления во всех сосудах головы развивается ишемия мозга. Объективным показателем ишемии при указанных гравитационных перегрузках является снижение артериального давления в сонных артериях до нулевого уровня. Животных помещают в специальные контейнеры центрифуги (диаметром 2 см) в строго краниокаудальном направлении относительно вектора ускорения, величина которого составляет 10–15 с. По данным литературы такую перегрузку в краниокаудальном направлении можно использовать для тестирования различных видов животных, включая крыс.
2.2.4.Геморрагическое поражение мозга
2.2.4.1.Субарахноидальное кровоизлияние
Субарахноидальное кровоизлияние моделируют на наркотизированных кошках путем введения крови под оболочки мозга. Голова животного фиксируется в стереотаксическом приборе, обнажаются кости черепа. После расчета стереотаксических координат тонким сверлом делают отверстие в кости в области передней супрасильвиевой борозды правого полушария. С помощью тонкой инъекционной иглы с полумягким катетером вводят в
субарахноидальное пространство 2 мл аутогенной крови. При морфологическом контроле гематома определяется в виде подоболочечного кровоизлияния вдоль поверхности артерии, проходящей в супрасильвиевой борозде. Изменения кровоснабжения мозга, внутричерепного давления, сопротивления мозговых сосудов и артериального давления соответствуют динамике этих показателей у больных с субарахноидальным кровоизлиянием.
482
2.2.4.2. Интрацеребральная геморрагия Может быть воспроизведена у бодрствующих или наркотизированных крыс и кошек.
Унаркотизированных крыс зубным бором высверливают отверстие в проекции внутренней капсулы: H=4 мм, L=3 мм, А= –1,3 мм от брегмы). Потом прокалывают твердую мозговую оболочку с помощью заточенной иглы-канюли и погружают ее с помощью стереотаксического прибора до требуемой глубины (4 мм). Затем мандрен-ножом производят деструкцию мозговой ткани в области внутренней капсулы, с последующим (через 2–3 мин) введением в место повреждения крови животного (0,1–0,2 мл), взятого из бедренной артерии. В большинстве случаев кровь распределяется в виде хорошо очерченной гематомы у конца инъекционной иглы с деформацией и разрушением подкорковых структур в области ядер таламуса, реже — в подкорковом белом веществе.
Укошек после предварительного стереотаксического вживления полой иглы в область внутренней капсулы внутримозговое кровоизлияние вызывают медленным (в течение 3–4 мин) введением аутогенной крови в объеме 2 мл. Кровь распределяется в виде хорошо очерченной гематомы у конца инъекционной иглы с деформацией и разрушением подкорковых структур в области ядер таламуса, реже — в подкорковом белом веществе. Внутримозговая геморрагия приводит к стойкому понижению общего и локального мозгового кровотока, сопровождающегося в ряде случаев мозаично расположенными очагами гиперемии, и гипоксии мозговой ткани.
2.2.5. Спазмы мозговых сосудов, вызванные серотонином
Моделирование цереброваскулярных расстройств серотонинергической природы необходимо для поиска средств для лечения мигрени. Эксперименты проводятся как на изолированных сосудах мозга, так и на целом животном с регистрацией мозгового кровотока. Влияние веществ на изменения мозгового кровотока и уровень артериального давления, вызванные серотонином (20 мкг/кг, внутривенно), изучают на крысах под общей анестезией (хлоралгидрат 350–400 мг/кг или уретан 1,3 г/кг, внутрибрюшинно) или кошках под общей анестезией (уретан 500 мг/кг и хлоралоза 50 мг/кг внутривенно) в условиях искусственной вентиляции легких с регистрацией напряжения углекислоты в артериальной крови (pCO2=38–40 мм рт. ст.). Локальный мозговой кровоток регистрируют с помощью методики лазерной допплеровской флоуметрии. Игольчатый датчик флоуметра диаметром 0,8 мм устанавливают на теменной или другой области коры большого мозга крысы с помощью микроманипулятора и коромысла. Одновременно регистрируют изменения артериального давления через предварительно введенный в бедренную артерию полиэтиленовый катетер. Запись показателей кровотока и артериального давления производят на полиграфе фирмы «BIOPAK» США, соединенном с персональным компьютером. Регионарный мозговой кровоток регистрируют с помощью ультразвукового или электромагнитного флоуметров, датчики которых диаметром 1–2 мм устанавливают на общей сонной артерии. При этом у крыс перевязывают наружную сонную артерию. У кошек тщательно перевязывают все артерии, питающие кровью экстракраниальные ткани головы, а именно каудальную и краниальную артерии, мышечные ветви, затылочную артерию, язычную, наружную челюстную, большую ушную, поверхностную височную и нижнюю зубную артерии. Артериальное давление регистрируют в бедренной артерии. Серотонин (20 мкг/кг, внутривенно) в большинстве исследований вызывает уменьшение объемной скорости мозгового кровотока на 40–50% и понижение уровня артериального давления. Эффект серотонина наблюдается сразу же после введения и продолжается 5–7 мин. Необходимо отметить, что серотонин при многократном введении (4–6 раз) с интервалом в 30 мин вызывает аналогичные изменения мозгового кровотока и артериального давления. Поэтому после двух контрольных реакций на серотонин вводится испытуемое вещество и затем вновь вводится серотонин.
Учитывая необходимость перорального применения противомигреневого средства, после отбора эффективного соединения следует изучить его влияние на изменения моз-
483
гового кровотока, вызванные серотонином, при введении per os. В этих исследованиях продолжительность наблюдения увеличивается до 60–120 мин, что обусловлено особенностями прохождения препарата через ЖКТ.
Как и на предыдущем этапе исследования, методики оценки мозгового кровообращения, применяемые дозы исследуемого соединения, пути, режимы и продолжительности его введения, а также продолжительность всего эксперимента определяются задачами исследования, протоколом исследования.
2.3. Изучение механизмов действия
Для выяснения механизма действия отобранных на втором этапе соединений рекомендуются следующие методические подходы:
1. Изучение собственно сосудистых механизмов действия, включающее:
а) исследование воздействия на рецепторный аппарат стенок мозговых сосудов с помощью агонистов и антагонистов адрено-, холино-, серотонино-, гистамино-, ГАМК-, пептидергических рецепторов (эксперименты in vivo и in vitro с применением соответствующих анализаторов);
б) исследование мембранного компонента действия (определение активности Na+, K+-АТФазы, Са2+-АТФазы), определение содержания цАМФ в стенке мозговых сосудов, их способности продуцировать вазоактивные простагландины, полипептиды и др.;
в) изучение влияния соединения на механизмы формирования сосудистого тонуса гладкомышечных клеток, обмен ионов кальция в гладкомышечных клетках.
2.Исследование влияния соединений на центральные механизмы регуляции мозгового кровообращения путем изучения рефлекторных реакций мозговых сосудов.
3.Изучение реологических свойств крови (вязкости крови и плазмы, гематокрита, агрегации и деформируемости эритроцитов).
4.Изучение влияния соединения на обмен нейромедиаторов (норадреналина, серотонина, ГДМК, глутамата, опиодных пептидов и др.) в ЦНС.
5.Исследование метаболических аспектов действия соединения, в частности на углеводный, белковый и липидный обмен мозговой ткани.
6.Изучение влияния соединений на содержание оксида азота и продуктов перекисного окисления липидов в ткани мозга.
7.Изучение влияния соединения на функциональное состояние мозга.
8.Исследование противоотечных свойств соединения, его влияния на уровень внутричерепного давления, вязкоэластические свойства мозга.
Этот этап исследования не является обязательным, но он направлен на выяснение механизмов сосудистого, нейротропного и метаболического действия соединения.
Заключение
Выбор конкретных методических подходов определяется участием тех или иных возможных механизмов действия соединения в патогенетической терапии конкретного сосудистого заболевания мозга.
Экспериментальные данные по изучению препаратов для лечения нарушений мозгового кровообращения и мигрени должны быть статистически обработаны и представлены в виде отчетов в соответствии с ГОСТ 7.32-2001 и Приказом Минздравсоцразвития России от 23 августа 2010 г. № 708н «Об утверждении правил лабораторной практики» с предоставлением в таблицах как первичных данных по каждому веществу, так и статистически обработанных результатов. К отчету необходимо приложить аналитические паспорта или нормативные документы на референтные и тестируемые вещества.
Литература
1.Гаевый М.Д., Аджиенко Л.М., Макарова Л.М., Абдулсалам А.А. Ишемия головного мозга, вызванная гравитационной перегрузкой. Эксперим. и клин. фармакол. — 2000. — Т. 63, № 3. — С. 63–64.
484
2.Луньшина Е.В., Ганьшина Т.С., Макарова Л.М., Погорелый В.Е., Мирзоян Р.С. Нейропротекторные свойства пироглутаминовой кислоты в сочетании с пирролидоном // Эксперим. и клин. фармакол. — 2003 — Т. 66, № 1. — С. 20–22.
3.Макаренко А.Н., Косицын Н.С., Пасикова Н.В., Свинов М.М. Метод моделирования локального кровоизлияния в различных структурах головного мозга у экспериментальных животных, Журнал высшей нервной деятельности, 2002. — Т. 52, № 6. — С.765–768.
4.Плотников М.Б., Ваизова О.Е., Суслов Н.И. Анализ изменений спектра мощности электроэнцефалограммы на новой модели ишемии мозга у крыс. Бюл. эксперим. биол. и мед., 1994, № 2, С. 565–567.
5.Топчян А.В., Мирзоян Р.С., Баласанян М.Г. Локальная ишемия мозга крыс, вызванная перевязкой средней мозговой артерии. Эксперим. и клин. фармакол., 1996. — Т. 59, № 5. — С. 62–64.
6.Manual of stroke models in rats. Ed. Yanlin Wang-Fischer. CRC Press. Boca Raton, London, New York, 2009.
7.Koizumi J., Yoshida Y., Nakazawa T., Ooneda G. Experimental studies of ischemic brain edema. 1. A new experimental model of cerebral embolism in rats in with recirculation can be introduced he ischemic area. Japan J. Stroke, 1986, 8, P. 1–8.
8.Plotnikov M.B., Logvinov S.V., Suslov №.I., Aliev O.I., Tyukavkina №.A., Tikhonov V.N. The neuroprotective e ect of antioxidant complex comprising dihydroquercetin and ascorbic acid in cerebral ischemia. New Trends in Brain Hypoxia Ischemia Research. USA: Nova, 2008, P. 93–133.
9.Pulsinelli W.A., Brierley J. A new model of bilateral hemispheric ischemia in the anaesthetized rat. Stroke, 1979, 10, Р. 267–272.
10.Yoshida S., Abe K., Busto R., et al. Influence of transient ischemia on lipid-soluble antioxidants, free fatty acids and energy metabolites in rat brain. Brain Res., 1982, 245, Р. 307–316.
ГЛАВА 29
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО ДОКЛИНИЧЕСКОМУ ИЗУЧЕНИЮ
ЛЕКАРСТВЕННЫХ СРЕДСТВ ДЛЯ ЛЕЧЕНИЯ БРОНХИАЛЬНОЙ АСТМЫ
И ХРОНИЧЕСКОЙ ОБСТРУКТИВНОЙ БОЛЕЗНИ ЛЕГКИХ
Составитель: д. м. н., проф. Д.Б. Утешев
Введение
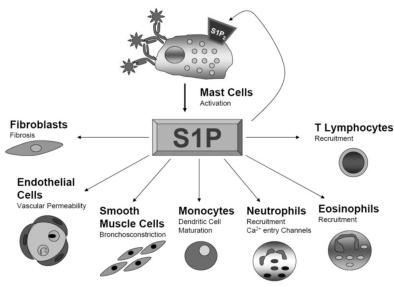
Бронхиальная астма (БА) — одно из наиболее часто встречающихся заболеваний. По данным эпидемиологических исследований ее распространенность достигает 5% общей популяции населения, в том числе в детской популяции колеблется в широких пределах 1–30%. С патофизиологических позиций БА рассматривается как хроническое аллергическое воспалительное заболевание дыхательных путей, которое сопровождается синдромом бронхиальной обструкции. К развитию БА предрасполагает атопия — генетически детерминированная повышенная продукция иммуноглобулинов класса E (IgE) тучными клетками в ответ на контакт с аллергенами. Наряду с этими клетками в патогенезе БА участвуют многие другие виды клеток, образующие такие бронхоконстрикторные медиаторы и нейротрансмиттеры как: гистамин, лейкотриены (LTD4), простагландины (PGD2), тромбоксан, брадикинин, эндотелины, фактор активации тромбоцитов, ацетилхолин, и др. В последнее время особое внимание уделяется Сфингозину-1-фосфату (S1P) — высокоактивному метаболиту сфинголипидного комплекса, который может связываться с специфическими белками на поверхности многих клеток, вовлеченных в процессы аллергического воспаления при БА. Это
Рис.1. Участие Сфингозин-1-фосфата (S1P) в воспалительных реакциях при бронхиальной астме по Oskeritzian СА и др., 2007
486

вещество вырабатывается под действием специфических ферментов (сфингозинкиназы) в тучных клетках и может оказывать влияние на все виды клеток воспаления (рис.1). В эксперименте было показано, что нейтрализующие S1P моноклональные антитела могут предотвращать развитие бронхоспазма. В связи с этим рассматривается терапевтическая стратегия, связанная с созданием ЛС, влияющих как на выработку S1P, так и на внедрение в клиническую практику моноклональных антител и специфических антагонистов к S1P рецепторам.
Синдром бронхиальной обструкции при БА может быть двух видов:
—Острый, связанный с бронхоконстрикцией и отеком слизистой оболочки бронхов.
—Хронический, обусловленный гиперпродуцией вязкого бронхиального секрета и ремоделированием бронхов (рис. 2).
Основой клинической картины БА являются приступы бронхоспазма, возникающие на фоне генетической предрасположенности к гиперреактивности бронхов. В развитии синдрома бронхиальной обструкции при БА важную играет роль окружающая среда (аэроаллергены и аллергены жилых помещений; табакокурение; вирусные, грибковые
ибактериальные заболевания дыхательных путей; профессиональные вредности; поллютанты) и различные специфические (антигены) и неспецифические (химические раздражители, холодный воздух, физические нагрузки, эмоциональные стрессы) стимулы (триггеры) (рис. 3).
Рис. 2. Формирование синдрома бронхиальной обструкции при БА
Рис. 3. Факторы, приводящие к развитию приступов бронхиальной астмы
Хроническая обструктивная болезнь легких (ХОБЛ) является серьезной проблемой для здравоохранения из-за широкой распространенности, прогрессирующего течения, сокращения продолжительности жизни больных. Смертность от этой болезни среди лиц старше 45 лет занимает 4–5-е место в общей структуре, что подтверждает лидирующую роль болезней органов дыхательной системы в формировании высокого социального бремени и высокой смертности. По современным представлениям ХОБЛ — это хроническое воспалительное заболевание, с преимущественным поражением дистальных отделов дыхательных путей и паренхимы легких, характеризующееся нарушением вентиляционной функции по обструктивному типу, частично обратимым под воздействием современных методов лечения. Для ХОБЛ характерно частично необратимое ограничение скорости воздушного потока. Снижение вентиляционной функции связано (вне зависимости от степени тяжести заболевания) с воспалительным процессом преимущественно бронхов мелкого калибра и деструкцией легочной паренхимы. Ведущая патофизиологическая чер-
487
та ХОБЛ — ограничение воздушного потока по экспираторному типу (по данным спирометрии), и нарушения вентиляционной функции легких при адекватной современной терапии частично обратимы.
Развитие ХОБЛ может быть наследственно детерминированным при врожденном дефиците α1-антитрипсина, но чаще оно обусловлено активным или пассивным курением, загрязнением воздушной среды, длительным воздействием профессиональных факторов (пыль, пары, химические раздражители, горячий сухой воздух), неблагоприятной атмосферой жилища (кухонный чад, бытовая химия), рецидивирующими вируснобактериальными заболеваниями органов дыхания в детском возрасте, дефицитом массы тела при рождении. Заболевания легких:
—ХОБЛ;
—хронический обструктивный бронхит;
—эмфизема легких.
Патогенетическую основу ХОБЛ формирует хронический воспалительный процесс трахеобронхиального дерева, легочной паренхимы и сосудов, при котором выявляются повышенные количества макрофагов, Т-лимфоцитов и нейтрофилов. Воспалительные клетки выделяют большое количество медиаторов: LT В4, ИЛ-8, фактор некроза опухоли и другие, способные повреждать структуру легких и поддерживать нейтрофильное воспаление. Кроме этого, в патогенезе ХОБЛ имеют значение дисбаланс протеолитических ферментов и антипротеиназ и оксидативный стресс. Морфологически в трахеобронхиальном дереве воспалительные клетки инфильтрируют поверхностный эпителий. Расширяются слизистые железы и увеличивается число бокаловидных клеток, что ведет к гиперсекреции слизи. В мелких бронхах и бронхиолах воспалительный процесс происходит циклично со структурным ремоделированием бронхиальной стенки, характеризующимся повышением содержания коллагена и образованием рубцовой ткани, приводящей к стойкой обструкции дыхательных путей.
За прошедшие 20 лет появилось большое множество сообщений о разработке новых экспериментальных моделей для изучения БА и ХОБЛ [26]. Однако чисто механический перенос результатов этих исследований на человеческую популяцию представляется не совсем корректным, так как фенотипические особенности воспалительного процесса у человека сильно варьируют. В нашей стране большая работа по доклиническому изучению лекарственных веществ для лечения бронхиальной астмы была проведена профессором, доктором медицинских наук В. Л. Ковалевой, которая долгое время возглавляла лабораторию фармакологии исполнительных органов Всероссийского научного центра по изучению биологически активных веществ. При ее непосредственном участии проводился углубленный поиск, изучение и создание ЛС для лечения бронхолегочной патологии, таких как хорошо известный в клинической практике препарат «Рузам». Профессором В.Л. Ковалевой были разработаны методические рекомендации по доклиническому изучению противоастматических средств (2005).
Таким образом основным принципом фармакотерапевтического подхода к лечению БА и ХОБЛ является: быстрое купирование спазма бронхов, обеспечение нормализации тонуса бронхов и надежный контроль аллергического воспаления дыхательных путей. Это достигается за счет использования основных двух групп препаратов: бронхолитиков и препаратов противовоспалительной направленности действия. Термин «противовоспалительные средства» в отчете экспертов Национального института Сердце, Легкие и Кровь (США) «Рекомендации по диагностике и лечению астмы», (EPR-2), заменен на «средства длительного контроля, использующиеся для достижения и поддержания контроля над персистирующей астмой». К бронхолитическим средствам относятся:
—адреностимуляторы (в т.ч. короткодействующие β2-агонисты как «средства быстрой помощи для купирования острых симптомов и обострений»);
—м-холиноблокаторы;
—препараты теофиллина.
488
Противовоспалительные средства (длительного контроля) представлены:
—глюкокортикостероидами;
—стабилизаторами мембран тучных клеток;
—антилейкотриеновыми средствами.
Антагонисты Н1-гистаминовых рецепторов в терапии БА и ХОБЛ не используются в силу наличия у них холиноблокирующей активности, приводящей к сухости слизистых оболочек дыхательных путей, что само по себе является ирритативным фактором. Кроме того, гистамин — лишь один из медиаторов аллергического воспаления и его роль в патогенезе бронхиальной астмы второстепенна. Однако в экспериментальной фармакологии модель бронхоспазма, вызванного гистамином, является классической, что лишний раз подтверждает постулат о том, что результаты, полученные на животных, нельзя автоматически переносить на человеческую популяцию.
1. Первичное изучение бронхолитической активности веществ на экспериментальных моделях in vitro
Для первичного отбора (скрининга) новых веществ, обладающих бронхорасширяющей активностью, необходимы простые, доступные и недорогие экспериментальные модели, позволяющие быстро получить результаты исследования нового химического соединения. К числу таких относятся модели контрактуры гладких мышц изолированных органов морской свинки, в первую очередь, трахеи и главных бронхов; в некоторых случаях — повздошной кишки и матки. В качестве классических бронхоконстрикторных агентов применяют гистамин и ацетилхолин (или карбахолин). Необходимо учитывать, что для скрининга и изучения веществ с предполагаемым бета 2-адреномиметическим действием лучше использовать трахею, главные бронхи или матку морской свинки (в которых превалируют бета-рецепторы 2-го типа), а бронхолитическую активность веществ с неизвестным механизмом действия можно исследовать на любой из указанных моделей, но желательно начинать с контрактуры изолированной трахеи.
1.1.Приготовление изолированного гладкомышечного препарата трахеи
Вэксперименте используют морских свинок — самок и самцов — массой 500–600 г. У наркотизированной морской свинки осторожно извлекают трахею и разрезают
на кольца по 2 хряща в каждом. Полученные кольца (по 5 колец) соединяют в цепочку и разрезают хрящи. Подготовленную цепочку (изолированный препарат трахеи) помещают в термостатируемую камеру (37 °С), соединенную с датчиком и содержащую раствор Кребса-Хенсляйта (119 mM NaCl, 4,8 mM KCl, 1,2 mM MgCl2, 1,2 мМ СaCl2, 2,53 mM NaHCO3, 24,8 глюкозы, pH=7,4). В качестве датчика, преобразующего механический сигнал в электрический, может быть использован отечественный прибор Механотрон 6М×2Б или другой датчик.
Исследование релаксирующей способности изучаемых веществ проводят либо в изотоническом либо в изометрическом режиме. В зависимости от этого исходная нагрузка на препарат должна составлять 0,5–0,7 г при работе гладкомышечного органа в изотоническом режиме и 1,5–2 г при работе в изометрическом режиме.
Сокращение трахеи регистрируют с помощью самописца. Релаксацию гладкомышечного препарата трахеи выражают в процентах от максимальной амплитуды сокращения, вызываемого добавлением в инкубационную среду медиатора. Определяют среднюю величину от измерений 4–5 отрезков. Строят кривую доза–эффект. Cреднеэффективную концентрацию (ЭК50) определяют графически по методу Литчфилда и Уилкоксона.
1.2. Модель гистамин- и ацетилхолин-индуцированной контрактуры гладких мышц изолированной трахеи морской свинки
Сокращение гладкомышечного препарата изолированной трахеи, приготовленного описанным выше способом, вызывают добавлением в инкубационную среду гистамина
489
(Sigma) или ацетилхолина (Sigma) в концентрации 10-5–10-6 М. Через 30–60 с после внесения спазмогена регистрируют максимальную амплитуду сокращения трахеи. Исследуемое соединение вносят на высоте контрактуры в тот момент, когда амплитуда сокращения достигает плато. Вещества добавляют в ванночку кумулятивно в концентрации от 10-12 M до 10-4 М после добавления медиатора на высоте амплитуды сокращения или однократно предварительно (в том же диапазоне концентраций) за 3 мин до инициации контрактуры.
Для оценки бронхорасширяющей активности исследуемого вещества в качестве препаратов сравнения удобно использовать традиционные бронхолитики — сальбутамол, теофиллин с тем, чтобы сопоставить их среднеэффективные концентрации (IC50).
1.3. Модель анафилактической контрактуры гладких мышц изолированной трахеи активно сенсибилизированной морской свинки (реакция Шульца-Дейла) [28]
Морскую свинку активно сенсибилизируют внутрибрюшинным или внутримышечным введением 0,5 мл физ.р-ра, содержащего овальбумин (Sigma, grade III) (антиген) в дозе 20 мкг и 100 мг Al(OH)3 (адъювант) на свинку. Показано, что при таком способе сенсибилизации (антиген в маленькой дозе + адъювант в большой дозе) у животного через 3–4 недели образуются гомоцитотропные антитела, принадлежащие к классу IgE [16].
Эксперимент начинают через 4–5 недель после сенсибилизации. Выделение трахеи
иприготовление из нее препарата осуществляют по описанному выше способу. Сокращение препарата трахеи вызывают добавлением в культуральную среду овальбумина в концентрации 1–10 мкг/мл. Исследуемое соединение вносят в ванночку в концентрации 10-12–10-5 М в кумулятивном режиме. Предварительно вызывают сократительный ответ гладкомышечного препарата трахеи на воздействие гистамина (10-5 М). Амплитуда сокращения, вызванного ОА, должна составлять не менее 80% от амплитуды сокращения, вызываемого гистамином. Определение эффекта изучаемого соединения производится описанным выше способом. В том случае, если испытуемое соединение плохо растворяется в воде, его растворяют в ДМСО. Наш опыт работы показал, что 10–20% концентрация ДМСО не оказывает расслабляющего влияния на гладкую мускулатуру.
Однако необходимо учитывать склонность сенсибилизированной гладкой мышцы к спонтанному расслаблению. В силу этого обстоятельства необходимы строгие контроли
инеоднократные повторения эксперимента с одними и теми же концентрациями изучаемого вещества.
Вкачестве препарата сравнения удобно использовать кромогликат натрий (интал), недокромил натрий или другие антиаллергические препараты.
1.4.Модель анафилактической контрактуры гладких мышц изолированного препарата ileum морской свинки [21]
Внекоторых случаях, когда необходимо испытать одновременно несколько веществ, можно использовать в качестве гладкомышечного препарата отрезок тонкого кишечника морской свинки. Преимущество работы с изолированными отрезками тонкой кишки состоит в том, что таких отрезков от одной и той же морской свинки можно получить в большом количестве — до 7–15. Недостатком же является вероятность значительных межиндивидуальных различий по степени сенсибилизированности антигеном.
Методика активной сенсибилизации овальбумином (ОА) морской свинки описана выше. У животного после эвтаназии немедленно извлекают из брюшной полости тонкую кишку, выделяют участок ileum, ближайший к илеоцекальному углу. Участок разрезают на сегменты длиной 10 мм. Отдельный сегмент кишки прошивают с обеих сторон и помещают в термостатируемую ванночку при 37 °С, содержащую раствор Кребса-Хенсляйта. Сегмент прикрепляют к тонкому крючку, соединенному с датчиком, и уравновешивают его в течение 60 мин с помощью базальной нагрузки, равной 0,5–0,7 г (в изотоническом режиме).
490
