
3 курс / Фармакология / Микробная терапия
.pdf
Глава 27. Антимикробная профилактика инфекций
разрезе или биопсии кожи (с предварительной хирургической обработкой);
обрезании.
Антимикробная профилактика не показана также в случае отсутствия инфекции при:
катетеризации уретры;
расширении шейки матки и выскабливании;
медицинском аборте;
стерилизации;
установке или удалении внутриматоч- ных противозачаточных средств.
Рекомендуемые схемы антимикробной профилактики инфекционного эндокардита при различных медицинских манипуляциях
Âобласти полости рта, пищевода, дыхательных путей (в скобках указаны дозы приема для детей до 12 лет)
Стандартная схема:
Амоксициллин внутрь 2 г (50 мг/кг) за 1 ч до процедуры.
При невозможности перорального приема:
Ампициллин в/в или в/м 2 г (50 мг/кг) за 30 мин до процедуры.
При аллергии к пенициллинам:
Внутрь за 1 ч до процедуры: Азитромицин/кларитромицин 500 мг (15 мг/кг); Клиндамицин 600 мг (20 мг/кг);
Цефалексин/цефадроксил 2 г (50 мг/кг).
При аллергии к пенициллинам и невозможности перорального приема:
За 30 мин до процедуры: Клиндамицин в/в 600 мг (20 мг/кг); Цефазолин в/м или в/в 1 г (25 мг/кг).
Âобласти желудочно-кишечного и урогенитального трактов у больных разных групп риска (в скобках указаны дозы приема для детей до 12 лет)
Группа высокого риска:
За 30 мин до процедуры:
Ампициллин в/м или в/в 2 г (50 мг/кг) + Гентамицин в/м или в/в 1,5 мг/кг (не более 120 мг).
Через 6 ч:
Амоксициллин внутрь1 г (25 мг/кг); Ампициллин в/м или в/в 1 г (25 мг/кг).
Группа высокого риска с аллергией к пенициллинам:
Ванкомицин в/в 1 г (20 мг/кг) 1—2 ч + Гентамицин в/в или в/м 1,5 мг/кг (не более 120 мг) — введение завершить за 30 мин до процедуры.
Группа умеренного риска:
Амоксициллин внутрь 2 г (50 мг/кг) за 1 ч до процедуры.
Ампициллин в/м или в/в 2 г (50 мг/кг) за 30 мин. до процедуры.
Группа умеренного риска с аллергией к пенициллинам:
Ванкомицин в/в 1 г (20 мг/кг) 1—2 ч — введение завершить за 30 мин до процедуры.
Âклинической практике возможны ситуации, когда больные из групп риска уже получают по другим показаниям антибактериальные препараты, используемые для профилактики ИЭ. В подобных случаях целесообразно не увеличивать дозу применяемого препарата, а назначать антибиотик другой группы.
Если позволяют обстоятельства, предполагаемую процедуру желательно провести через 9—14 дней после окончания антимикробной терапии, что позволяет восстановиться обычной микрофлоре.
Схема приема антибиотиков, назначаемых с целью профилактики рецидивов острой ревматической лихорадки, не соответствует таковой для предупреждения ИЭ. У больных, длительно получавших препараты пенициллина внутрь для профилактики рецидивов острой ревматической лихорадки, существует высокая вероятность носительства зеленящих стрептококков, относительно устойчивых к антибиотикам этой группы. Этим больным для профилактики ИЭ рекомендуются макролиды (азитромицин, кларитромицин) или клиндамицин.
Предупреждение инфекций по эпидемиологическим показаниям
При эпидемических вспышках или угрозе их возникновения адекватная антимикроб-
665
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/

РАЗДЕЛ II. КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
ная профилактика с целью предотвращения распространения инфекции должна проводиться всем лицам, контактировавшим с источником инфекции.
Менингит, вызванный N. meningitidis: Внутрь:
Рифампицин 0,6 г (детям по 10 мг/кг) 2 р/сут 2 дня; Спирамицин 1,5 млн. ЕД (детям 25 мг/кг) 4 р/сут 5 дней.
Однократно:
Цефтриаксон в/м 0,25 г (детям 125 мг); Моксифлоксацин внутрь 0,5 г. Менингит, вызванный H. influenzae, òèï b:
Внутрь 4 дня:
Рифампицин 0,6 г 1раз/сут.
Дифтерия
Внутрь 7—10 дней: Эритромицин 0,5 г 4 р/сут.
Коклюш
Внутрь 14 дней: Эритромицин 0,5 г 4 р/сут.
Сибирская язва ЛС выбора (схемы лечения)
Внутрь 60 дней: Моксифлоксацин 0,5 г 2 р/сут.
Альтернативные ЛС (схемы лечения)
Внутрь в течение 60 дней: Амоксициллин 0,5 г 3 р/сут; Доксициклин 0,1 г 2 р/сут.
При одновременном применении вакцины (не менее 3 доз) срок антимикробной профилактики составляет 1—1,5 мес.
×óìà
Внутрь 2 р/сут 7 дней: Доксициклин 0,1 г; Моксифлоксацин 0,5 г.
Туляремия (в течение 24 часов после контакта):
Внутрь 2 р/сут 7 дней: Доксициклин 0,1 г Моксифлоксацин 0,5 г
Боррелиоз Лайма
Внутрь 3—5 дней (от момента укуса клеща):
Доксициклин 0,1 г 2 р/сут.
Ошибки и необоснованные назначения
Одной из наиболее распространенных ошибок является назначение антимикробных препаратов при острых респираторных вирусных инфекциях с целью профилактики бактериальных осложнений. Показано, что частота бактериальных осложнений примерно одинакова как при приеме антибиотиков "с профилактической целью", так и при отсутствии такового.
Ошибочной также является точка зрения о необходимости назначения одновременно с антибиотиком противогрибковых средств с целью профилактики грибковых осложнений. При кратковременном применении современных антимикробных препаратов возможность развития грибковой суперинфекции достаточно мала. Профилактическое назначение антимикотиков системного действия (флуконазол, кетоконазол) оправдано только при назначении антимикробной терапии больным с выраженными иммунными нарушениями, обусловленными как самим заболеванием (ВИЧ-инфекция, злокачественные новообразования), так и применением цитостати- ческих препаратов. Назначение нистатина или леворина с целью профилактики грибковых суперинфекций или дисбактериоза кишечника не обосновано.
Литература
1.Bartlett J.G. Pocket Book of Infectious Disease Therapy. 11th ed. Baltimore etc., Williams & Wilkins, 2000.
2.Dajani A.S., Taubert K.A., Wilson W. et al. Prevention of bacterial endocarditis: recommendations of American Heart Associa- tion.—JAMA, 1997; 277: 1794—1801.
3.The Sanford Guide to Antimicrobial Therapy. Eds. Gilbert D.N., Moellering R.C., Sande M.A. 30th ed. Antimicrobial Therapy, Inc., USA, 2000.
666

Глава 27. Антимикробная профилактика инфекций
Антимикробная профилактика госпитальных инфекций в хирургической практике
Указатель описаний ЛС |
|
|
|
В хирургии |
под антимикробной профилактикой |
|
|
|
|
(ÀÌÏ) подразумевают предупреждение инфекций, |
|||
|
|
|
|
|||
Аминогликозиды |
|
|
|
возникающих вследствие хирургических или других |
||
742 |
|
|
инвазивных вмешательств либо имеющих с ними |
|||
Гентамицин |
|
|
связь, но не лечение фоновой инфекции, на устранение |
|||
Нетилмицин |
832 |
|
|
|||
|
|
которой направлено хирургическое вмешательство. |
||||
Гликопептиды |
|
|
|
|||
|
|
|
По данным официальной статистики, госпитальные |
|||
Ванкомицин |
737 |
|
|
инфекции возникают у 2—30% госпитализированных |
||
Эдицин |
957 |
|
|
|||
|
|
больных, а летальность при различных нозологиче- |
||||
Линкозамиды |
|
|
|
ских формах колеблется от 3,5 до 60%, достигая при ге- |
||
Линкомицин |
805 |
|
|
нерализованных формах такого же уровня, как в доан- |
||
Макролиды |
|
|
|
тибиотическую эру. |
||
|
|
|
За последние 15—20 лет наиболее значимые успехи до- |
|||
Эритромицин |
964 |
|
|
|||
Нитроимидазолы |
|
|
|
стигнуты в |
профилактике хирургических инфекций. |
|
|
|
|
Многочисленными экспериментальными и клинически- |
|||
Метронидазол |
816 |
|
|
|||
|
|
ми данными убедительно доказано, что рациональное |
||||
Пенициллины |
|
|
|
|||
|
|
|
применение антибиотиков с профилактической целью в |
|||
Амоксициллин/клавуланат |
717 |
|
|
определенных ситуациях снижает частоту послеопера- |
||
Амоксиклав |
709 |
|
|
ционных раневых инфекций с 40—20 до 5—1,5%. |
||
Аугментин |
726 |
|
|
|
|
|
Медоклав |
813 |
|
|
|
|
|
Принципы антимикробной |
||||||
|
|
|
|
|||
Цефалоспорины |
|
|
|
профилактики |
||
Цефуроксим |
946 |
|
|
|
|
|
|
Современная концепция АМП базируется на несколь- |
|||||
Аксетин |
707 |
|
|
|||
|
|
ких принципах, каждый из которых подтвержден мно- |
||||
Кетоцеф |
779 |
|
|
|||
|
|
гочисленными научными исследованиями. |
||||
Цефазолин |
929 |
|
|
|||
|
|
Микробная контаминация операционной раны явля- |
||||
|
|
|
|
|||
ется неизбежной даже при идеальном соблюдении правил асептики и антисептики, и к концу операции в 80—90% случаев раны обсеменены различной микрофлорой, чаще всего — стафилококками. Как показано
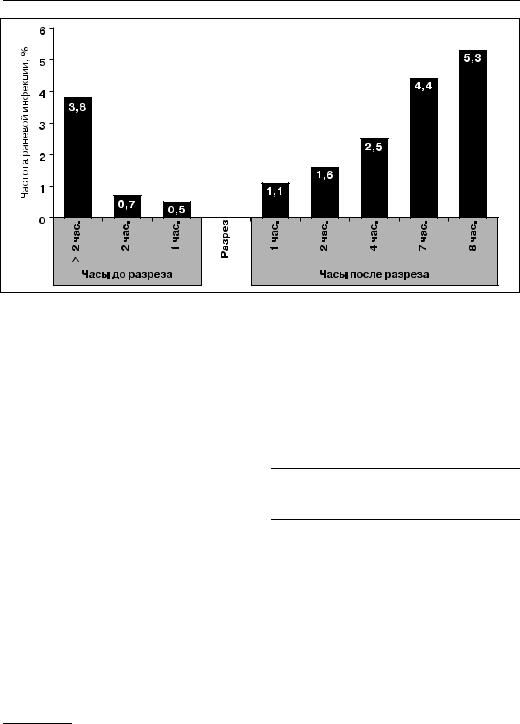
âклассической работе Дж. Бурке, если в течение первых 3 часов после контаминации операционной раны уменьшить число попавших в нее бактерий1, то тем самым можно предотвратить развитие послеоперационной раневой инфекции. Введение антибиотика ранее чем за 1 час до операции или после ее окончания является неэффективным в плане снижения частоты гнойных хирургических осложнений (ðèñ. 19).
Эти и многие другие проведенные исследования позволили сформулировать задачи и основные положения АМП, которые сводятся к следующему.
При осуществлении АМП необходимо стремиться не к полной эрадикации микроорганизмов, а к снижению их числа до того уровня, при котором иммунная система
âсостоянии защитить организм от развития инфекции.
1 Превышение экспериментально установленного уровня 105–106 клеток на 1 г ткани способствует развитию раневой инфекции.
667
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
РАЗДЕЛ II. КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ |
Рисунок 19. Зависимость частоты послеоперационной раневой инфекции от сроков введения |
антибиотика до начала операции |
Эффективная концентрация антибиотика в операционной ране, превышающая МПК для возбудителей раневой инфекции, должна сохраняться на протяжении всей операции и поддерживаться к моменту наложения швов, когда микробная контаминация достигает максимума.
Решающими для развития инфекции являются первые 3 часа от момента попадания бактерий в рану, поэтому применение антибиотиков после этого срока является запоздалым, а продолжение АМП более 24 часов после операции в большинстве случаев — излишним и не ведет к снижению частоты развития послеоперационной инфекции1.
На частоту послеоперационных осложнений влияют следующие факторы:
вирулентность микроорганизмов, инфицировавших рану;
величина инфицирующей дозы;
состояние раны (наличие инородных тел, дренажей, сгустков крови, омертвевших тканей; недостаточное кровоснабжение);
состояние больного (наличие сахарного
1Продление АМП из-за наличия катетера и дренажа научно не обосновано и экономически не оправдано.
диабета и других сопутствующих тяжелых заболеваний; лечение стероидами и иммуносупрессорами; ожирение; опухолевая кахексия; пожилой возраст);
технические факторы (вид оперативного вмешательства, предоперационная техника, продолжительность операции).
Риск послеоперационных инфекций при различных типах хирургических вмешательств
Для стандартизации риска послеоперационных инфекций и обеспечения возможности сравнения результатов различных исследований выделяют четыре типа хирургических вмешательств.
"Чистые" операции:
плановые операции, не затрагивающие ротоглотку, дыхательные пути, желу- дочно-кишечный тракт или мочевыводящие пути;
первично закрытые раны (мастэктомия и струмэктомия, оварио- и/или тубэктомия, грыжесечение, флебэктомия у больных без трофических нарушений, протезирование тазобедренного сустава, артропластика бедра);
668

Глава 27. Антимикробная профилактика инфекций
ортопедические операции;
сосудистые операции (на сердце и аорте, артериях конечностей).
Риск послеоперационных гнойных осложнений менее 5%.
"Условно чистые" операции:
чистые операции с риском развития инфекционных осложнений (плановые операции на ротоглотке, органах брюшной, грудной полости и малого таза, которые, как правило, сопровождаются контаминацией раны нормальной микрофлорой больного);
повторное вмешательство через "чистую" рану в течение 7 дней;
флебэктомия у больных с трофическими нарушениями тканей (без трофических язв);
погружной остеосинтез при закрытых переломах;
ургентные и неотложные операции, по другим критериям входящие в группу "чистых";
тупые травмы без разрыва полых органов.
Риск послеоперационных гнойных осложнений составляет около 10—12%.
"Загрязненные" операции:
операционные раны, имеющие признаки негнойного воспаления;
значительный заброс содержимого ЖКТ, вовлечение мочеполовой системы или желчных путей и наличие инфицированной мочи или желчи соответственно;
открытые раны перед трансплантацией или закрытием;
операции при травматических повреждениях и проникающих ранениях, обработанных в течение 4 часов.
Риск послеоперационных гнойных осложнений составляет около 20%.
"Грязные" операции:
оперативные вмешательства на заведомо инфицированных органах и тканях;
операции на перфорированных органах;
оперативные вмешательства по поводу старых травматических ран;
проникающие ранения и травматические раны, обработанные по истечении 4 часов.
Риск послеоперационных гнойных осложнений составляет около 30—40%.
Показания для антимикробной профилактики
В широком плане профилактическое применение антибиотика является обоснованным только в двух ситуациях: 1 — при наличии высокого риска развития послеоперационной инфекции и 2— когда инфекция, несмотря на относительно невысокую частоту развития, представляет непосредственную угрозу жизни или здоровью больного.
Поэтому при операциях II òèïà у больных с двумя и более факторами риска развития послеоперационной инфекции (см. выше) и III òèïà АМП является крайне желательной, в то время как IV òèï оперативных вмешательств требует скорее терапевтического, чем профилактического применен"ия антибиотиков.
Что касается операций I òèïà, большинством специалистов признана целесообразность проведения АМП при следующих оперативных вмешательствах:
операциях на сердце и сосудах (протезировании клапанов, коронарном шунтировании, имплантации электрокардиостимулятора, реконструктивных операциях на сосудах брюшной полости и нижних конечностей);
больших ортопедических операциях (протезировании тазобедренного сустава, спондилодезе, тотальной артропластике бедра);
реконструктивных операциях на костях с использованием металлоконструкций (штифтов, пластин и др.);
операциях на голове и шее;
любых чистых операциях продолжительностью более 3 часов.
Критерии выбора антибиотика для антимикробной профилактики
Спектр активности антибиотика должен охватывать наиболее частых возбудителей послеоперационных инфекций. Прежде
669
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/

РАЗДЕЛ II. КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
всего, это относится к грамположительной микрофлоре кожных покровов и, в первую очередь, к стафилококкам (золотистому и эпидермальному), вызывающим более 70% от общего числа послеоперационных нагноений. Антибиотик также должен перекрывать дополнительные группы эндогенных бактерий, контаминирующих рану при нарушении целостности внутренних органов и слизистых оболочек. В то же время для того, чтобы уменьшить риск селективного давления и колонизационной резистентности, препарат должен иметь как можно более узкий спектр активности.
Антибиотик должен быть безопасным для больного, хорошо проникать в ткани и не влиять на фармакокинетику средств для анестезии, в первую очередь, миорелаксантов. С этих позиций наиболее удач- ной группой являются цефалоспорины I—II поколения и защищенные пенициллины, имеющие относительно узкий антимикробный спектр (преимущественно грамположительные бактерии) и характеризующиеся хорошей переносимостью. Из цефалоспоринов для АМП, как правило, рекомендуются цефазолин и цефуроксим, наиболее полно удовлетворяющие вышеперечисленным требованиям. Цефалоспорины III поколения редко применяют для профилактики раневой инфекции (за исключением цефтриаксона — препарата с длительным периодом полувыведения), так как они в 2—4 раза менее активны против стафилококков и уступают цефалоспоринам I и II поколений с позиции стоимость/эффективность при АМП.
При высоком риске контаминации раны анаэробными бактериями, особенно Bacteroides spp. (в абдоминальной хирургии, операциях на органах малого таза, в области головы и шее), к цефалоспорину добавляют клиндамицин или метронидазол, либо используют амоксициллин/клавуланат, не уступающий цефазолину и цефуроксиму по спектру активности против грамположительных бактерий и высоко активный против анаэробов.
При аллергии на бета-лактамы èëè âû-
соком риске инфицирования раны метициллинорезистентными стафилококками для АМП применяют ванкомицин.
Аминогликозиды имеют ограниченное применение при АМП из-за высокого риска нейромышечной блокады в сочетании
ñмиорелаксантами, в то время как их нефро- и ототоксичность представляют значительно меньшую опасность в связи
ñнепродолжительным (1—2 дозы) введением. Применение фторхинолонов при АМП практически не изучено, кроме того, они противопоказаны детям и подросткам.
Режимы антимикробной профилактики
Для проведения АМП обычно используют одну дозу препарата. Однако при длительных операциях или у больных группы риска может возникнуть необходимость в повторных введениях антибиотика для поддержания оптимальной концентрации в сыворотке крови и, следовательно, в интерстициальной жидкости и ране. Для бета-лактамов важно, чтобы эта концентрация превышала МПК для стафилококков, стрептококков и кишечной палочки в 4 раза, когда гибель бактерий достигает максимума и уже не зависит от дальнейшего нарастания концентрации препарата, но коррелирует со временем, в течение которого его уровень превышает МПК. Поэтому цефалоспорины и пенициллины относят к антибиотикам с не зависимым от концентрации, но зависимым от времени типом бактерицидного действия. Поскольку кратность введения антибиотиков определяется клиренсом препарата или периодом полувыведения, теоретически повторная доза должна вводиться через интервал времени, в 2 раза превышающий период полувыведения. С учетом поправки на активность собственных защитных сил макроорганизма, интервалы между повторным введением цефазолина, цефуроксима и амоксициллин/клавуланат при проведении АМП составляют, в среднем, 6—8 ча- сов.
670

Глава 27. Антимикробная профилактика инфекций
Варианты АМП1 при операционных и инструментальных вмешательствах
На голове/шее (опухоли глотки, гортани):
Амоксициллин/клавуланат 1,2 г; Цефуроксим 1,5 г + метронидазол 0,5 г (раздельно).
На молочной железе:
Амоксициллин/клавуланат 1,2 г; Цефазолин 2 г.
На пищеводе, желудке, двенадцатиперстной кишке:
Цефазолин 2 г; Цефуроксим 1,5 г.
На желчных путях:
Цефазолин 2 г; Цефуроксим 1,5 г.
При грыжесечении (см. схему лечения при высоком риске осложнений)
Цефазолин 2 г; Цефуроксим 1,5 г.
На тонком кишечнике и органах малого таза:
Амоксициллин/клавуланат 1,2 г; Цефазолин 2 г + Метронидазол 0,5 г; Цефуроксим 1,5 г + Метронидазол 0,5 г (раздельно).
При высоком риске осложнений2 дополнительно вводят 2—3 дозы цефуроксима, цефазолина или амоксициллин/клавуланат (соответственно через 5—6 и 10—12 ч после первой дозы).
При кесаревом сечении3, экстирпации матки из брюшного или влагалищного доступа:
Через 6—8 ч (всего 2 дозы): Амоксициллин/клавуланат 1,2 г + 0,6 г; Цефуроксим 1,5 г + 0,75 г.
При медицинском аборте (второй триместр беременности):
Однократно: Амоксициллин/клавуланат 1,2 г;
1Антибиотик вводят внутривенно за 15—30 мин до операции во время вводного наркоза.
2Антибиотик вводят сразу после пережатия пуповины.
3 Профилактика газовой гангрены.
Цефазолин 1 г; Цефуроксим 1,5 г.
При протезировании тазобедренного сустава, спондилодезе:
Каждые 6—8 ч (всего 3 дозы): Амоксициллин/клавуланат 1,2 г + 0,6 г + 0,6 г; Цефазолин 2 г + 1 г + 1 г;
Цефуроксим 1,5 г + 0,75 г + 0,75 г.
При протезировании сустава, кроме тазобедренного:
Однократно: Ванкомицин 1г.
Остеосинтез штифтом: при закрытых переломах верхних конечностей:
Однократно: Цефазолин 2 г; Цефуроксим 1,5 г.
Принципы антимикробной профилактики при аппендектомии
Диагноз аппендицита обычно устанавливают на основе клинических признаков, а по результатам патоморфологического исследования удаленного отростка выделяют
три формы заболевания:
катаральный аппендицит;
флегмонозный аппендицит;
перфоративный или гангренозный аппендицит (в том числе, осложненный перитонитом и абсцедированием).
Óбольных с перфоративным гангренозным è флегмонозным аппендицитом, не получавших антибиотики с профилакти- ческой целью, частота послеоперационной инфекции составляет 20—50%, а в группе больных, где проводилась АМП, — менее 5%. Аналогичная тенденция наблюдается и при интактном отростке (20% осложнений без применения антибиотиков и 4—6% — на фоне АМП), поскольку независимо от патоморфологического диагноза удаление отростка подвергает брюшную полость контаминации микрофлорой кишечника. Более чем в половине случаев инфекция может развиться в отдаленном периоде (вплоть до 2—4 нед после выписки больного из стационара).
Интерпретация данных бактериологиче-
671
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/

РАЗДЕЛ II. КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
ского исследования при перфоративном |
Цефуроксим 1,5 г 3 р/сут + |
|
||||
или гангренозном аппендиците чрезвы- |
Метронидазол 0,5 г 3 р/сут. |
|
||||
чайно сложна из-за полимикробного ха- |
|
|
|
|
|
|
рактера микрофлоры (в одном образце в |
|
|
||||
Особенности антимикробной |
||||||
среднем можно обнаружить 11 различных |
профилактики |
|
|
|||
видов бактерий). Среди облигатных ана- |
при колоректальных операциях |
|||||
эробов чаще встречается B.fragilis, а среди |
|
|
|
|
|
|
Инфекции, развивающиеся после коло- |
||||||
факультативных — E.coli. У лихорадящих |
||||||
больных необходимо проводить посев кро- |
ректальных операций, включают широкий |
|||||
ви (не менее трех раздельных венопунк- |
спектр аэробных бактерий, факультатив- |
|||||
ций в течение 1 ч) в аэробных и анаэроб- |
ных и облигатных анаэробов, которые по- |
|||||
ных условиях. |
падают в операционную рану из просвета |
|||||
Из-за недостаточной точности предопе- |
кишечника, |
обильно |
колонизированного |
|||
рационного и даже интраоперационного |
микрофлорой. В среднем в каждом случае |
|||||
диагноза, трудностей этиологической ди- |
инфекции можно обнаружить пять раз- |
|||||
агностики инфекционного процесса и в |
личных микроорганизмов, способных дей- |
|||||
связи с необходимостью срочного опера- |
ствовать независимо или синергидно, что |
|||||
тивного лечения всех больных с предполо- |
создает сложности в распознавании эти- |
|||||
жительным диагнозом острого аппендици- |
ологического агента, а бактериологические |
|||||
та считают подверженными риску перфо- |
лаборатории часто не располагают воз- |
|||||
рации, поэтому они нуждаются в обяза- |
можностями выделять и идентифициро- |
|||||
тельном проведении АМП. |
вать бактерии, требующие особых условий |
|||||
Применяемый препарат должен обла- |
культивирования. |
|
|
|||
дать бактерицидной активностью против |
Основными факторами риска послеопе- |
|||||
грамотрицательных бактерий кишечной |
рационных инфекций являются тип опера- |
|||||
группы и анаэробных микроорганизмов — |
ции, ее продолжительность: |
|
||||
бактероидов, клостридий, пептострепто- |
Абдоминально-перитонеальная |
резек- |
||||
кокков. Этим антимикробным спектром об- |
|
ция прямой кишки сопряжена с более |
||||
ладает амоксициллин/клавуланат, либо |
|
высокой частотой развития инфекции, |
||||
комбинация цефуроксима с метронидазо- |
|
чем интраперитонеальная резекция. |
||||
лом (или клиндамицином). Препараты вво- |
Операции, продолжающиеся более 3— |
|||||
дят внутривенно за 15—30 минут до перво- |
|
4 часов, чаще осложняются инфекцией, |
||||
го операционного разреза. |
|
чем менее длительные операции. |
|
|||
В большинстве случаев достаточно одно- |
Профилактическое применение адекват- |
|||||
кратного применения антибиотика (ката- |
ных препаратов снижает частоту ране- |
|||||
ральный и флегмонозный аппендицит без |
|
вой инфекции с 30—60 до 3—9%. Однако |
||||
перфорации), но при перфоративном аппен- |
вопрос о выборе антибиотика, пути и |
|||||
диците и местном перитоните или абсцеди- |
|
продолжительности |
его применения, |
|||
ровании продолжают применение антиби- |
|
предпочтительности назначения одного |
||||
отиков в течение 3—5 дней, так как речь |
препарата или комбинированной профи- |
|||||
идет скорее о терапии, чем о профилактике. |
лактики до конца не изучен. |
|
||||
Катаральный и флегмонозный аппенди- |
|
В колоректальной хирургии существует |
||||
цит без перфорации: |
три основных подхода к АМП: |
|
||||
Однократно: |
|
Применение антибиотиков внутрь — |
||||
Амоксициллин/клавуланат 1,2 г; |
обычно используют неомицин и эритроми- |
|||||
Цефуроксим 1,5 г ± метронидазол 0,5 г. |
цин, которые назначают накануне дня опе- |
|||||
Перфоративный и гангренозный аппен- |
рации. Частота раневой инфекции снижа- |
|||||
дицит: |
åòñÿ ñ 43% |
(группа |
больных с |
плаце- |
||
Амоксициллин/клавуланат 1,2 г 3 р/сут; |
бо-контролем) до 9%. |
|
|
|||
Линкомицин 0,6 г 3 р/сут + |
|
Введение антибиотика внутривенно — |
||||
Гентамицин 5 мг/кг 1 р/сут; |
как правило, используют цефалоспорины |
|||||
672

Глава 27. Антимикробная профилактика инфекций
I—II поколения (в сочетании с клиндамицином или метронидазолом). Послеоперационная раневая инфекция наблюдается чаще, чем при применении антибиотиков внутрь.
Комбинация перорального и внутривенного пути введения — наиболее оптимальная схема АМП, особенно при наличии факторов риска развития инфекции:
Внутрь: Неомицин 1 г +
Эритромицин-основание 1 г в 13, 14 часов и в 21 час накануне дня операции.
Â/â:
Цефазолин 2 г или цефуроксим 1,5 г двукратно через 6—8 ч в день операции.
Необходимым предварительным условием операций на толстой кишке является удаление содержащихся в кишечнике жидкости и фекалий путем его механической подготовки. Подготовка с помощью перорального промывания кишечника изотони- ческим раствором удаляет из толстой кишки воздух, жидкость, фекалии и снижает число анаэробов в сигмовидной кишке более действенно, чем общепринятая трехдневная подготовка с использованием клизм.
Оценка эффективности лечения
Профилактику хирургической инфекции
считают неэффективной ïðè:
Возникновении послеоперационной инфекции, а также абсцессов в зоне первичного операционного разреза и/или брюшной полости (в том числе перитонита).
Не находящем объяснений использовании антимикробных препаратов в тече- ние 4 недель после первичной операции.
Возникновении необходимости дренирования операционной зоны, а также брюшной полости и прилежащих к ней образований в связи с инфекцией.
Инфекцию в отдаленных областях (например, инфекцию мочевыводящих путей, пневмонию, инфицирование внутрисосудистых систем и устройств) не рассматривают как неэффективность профилактики.
Профилактическое применение антибиотиков не заменяет общепринятых сани- тарно-гигиенических мероприятий, мето-
дов асептики и антисептики. АМП не может компенсировать недостаточного опыта
èтехнических ошибок хирурга, нарушения санитарно-эпидемиологического и температурного режима в операционной, обширной кровопотери и угнетения иммунитета и не заменяет выхаживания послеоперационного больного. АМП также не предотвращает развития таких госпитальных инфекций, как вентилятор-ассоци- ированная пневмония, инфекции мочевыводящих путей, катетер-ассоциированные инфекции и других.
Кроме того, необходимо помнить, что широкое применение АМП неизбежно ведет к селекции резистентных штаммов и повышает вероятность возникновения суперинфекции у прооперированных больных. Этот риск можно свести к минимуму, если антибиотик применяется непосредственно перед операцией, а не задолго до нее,
èиспользуется менее 24 часов в послеоперационном периоде. Такая тактика оправдана и с экономических позиций.
Литература
1.Зубков М.Н и соавт. Антибиотикопрофилактика и антибиотикотерапия гнойных осложнений в травматологии и ортопедии. Пособие для врачей. — М: МЗ РФ, 2000; 23 с.
2.Кузин М.И., Костюченок Б.М. Раны и раневая инфекция. М.: Медицина, 1990; 590 с.
3.Александер Дж., Гуд Р.Р. Иммунология для хирургов. Пер. с англ. — М.: Медицина, 1974; 191 с.
4.Bauer T., et al. Antibiotic prophylaxis in acute nonperforated appendicitis. Ann Surg 1989; 209: 307—311.
5.Bennion R.S., et al. The bacteriology of gangrenous and perforated appendicitis— revisited. Fnn Surg 1990; 21: 165—171.
6.Bennion R.S., Thomson J.E., Baron E.J., Finegold S.M. Gangrenous and perforated appendicitis with peritonitis: treatment and bacteriology. Clin Ther 1990; 12: 1—14.
7.Burke J.F. The effective period of preventive antibiotic action in experimental incision and dermal lesions. Surg 1961; 50: 161—168.
673
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/

РАЗДЕЛ II. КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
8.Classen D.C., et al. The timing of prophylactic administration of antibiotics and the risk of surgical wound infection. N Engl J Med 1992: 326: 281—286.
9.Condon R.E., et al. Efficacy of oral and systemic antibiotic prophylaxis in colorectal operations. Arch Surg 1983: 118: 496—501.
10.Gilbert D.N., Moellering R.C., Sande M.A. The Sanford Guide to Antimicrobial Therapy. 31st ed. 2001; 142 p.
11.Heseltine P.N.R., et al. Perforated and gangrenous appendicitis: an analysis of antibiotic failures. J Infect Dis 1983; 148: 222—229.
12.Lau W.J., Chu K.W., Ho K.K. Prophylactic antibiotics in elective colorectal surgery. Br J Surg 1988; 75: 782—785.
13.Page C.P., et al. Antimicrobial Prophylaxis
for Surgical Wounds: Guidelines for Clinical Care. Arch Surg 1993; 128:79—88.
14.Weaver M., Burdon D.W., Youngs D.J. Oral neomycin and erythromycin compared with single-dose systemic metronidazole and ceftriaxone prophylaxis in elective colorectal surgery. Am J Surg 1986; 151: 437—442.
15.Weff B.G., et al. A new bowel preparation for elective colon and rectal surgery. Arch Surg 1988; 123: 895—899.
16.Wenzel R.P. Epydemiology of Hospital-Ac- quired Infections. In. Management of hos- pital-acquired infections. 6th ICID Congress. 1991; 4—9.
17.Wenzel R.P. Prevention and control of nosocomial infections. Williams and Wilkins. Baltimore, 1987; 64 p.
674
