
3 курс / Фармакология / Микробная терапия
.pdf
Глава 24. Вирусные инфекции
Герпетические инфекции
Указатель описаний ЛС |
|
|
Эпидемиология |
|
|
|
Герпетические инфекции — одни из наиболее рас- |
|
|
|
|
Средства, селективно |
|
|
пространенных инфекций человека — имеют раз- |
активируемые вирусной |
|
|
личные клинические проявления. По данным ВОЗ, |
тимидинкиназой |
727 |
|
около 0,03% новорожденных инфицированы вируса- |
Ацикловир |
|
ми простого герпеса (ÂÏÃ) è 1,5% — цитомегалови- |
|
Валацикловир |
736 |
|
|
|
русами (ÖÌÂ). |
||
Фамцикловир |
|
|
|
|
|
Генитальный герпес встречается все чаще, предпо- |
|
Противовирусные ЛС |
|
|
|
|
|
ложительно им инфицировано более 15% населения |
|
разных групп |
|
|
России. Ветряная оспа поражает преимущественно |
Пенцикловир |
|
|
|
|
|
детей в возрасте от 1 до 14 лет. Чаще оно протекает по |
|
|
|
|
|
|
|
|
типу эпидемических вспышек в организованных дет- |
|
|
|
ских коллективах. Опоясывающий лишай носит спо- |
|
|
|
радический характер, встречается среди лиц любого |
|
|
|
возраста, но наиболее часто — после 50 лет. Зараже- |
|
|
|
íèå вирусом Эпштейна—Барра обычно наблюдается в |
|
|
|
раннем детском возрасте, антитела к нему имеют бо- |
|
|
|
лее 90% взрослых людей. |
|
|
|
По данным ВОЗ, смертность от герпеса среди всех |
|
|
|
вирусных заболеваний находится на втором месте пос- |
|
|
|
ле гепатита (15 и 35,8% соответственно). |
Этиология
Известно более 80 представителей семейства вирусов герпеса (ВГ) (Herpesviridae), из которых 8 типов патогенны для людей (òàáë. 65). Все они представлены ДНК-содержащими вирусами с единой морфологией, не дифференцируемой при электронной микроскопии.
Наиболее широко распространены ВПГ-1, ВПГ-2, ВЗВ и ЦМВ. Предполагают, что ВПГ-2 является этиологическим фактором карциномы шейки матки. В ка- честве потенциально онкогенного агента рассматривают также ЦМВ.
В последние годы все чаще встречаются смешанные (микст) инфекции, вызванные ассоциацией возбудителей.
Патогенез
Основные пути передачи инфекции:
контактно-бытовой;половой;трансфузионный;
трансплантационный;
воздушно-капельный (вирус V. zoster).
625
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/

РАЗДЕЛ II. КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
Таблица 65. Герпесвирусы и вызываемые ими заболевания
Типы герпесвирусов |
Вызываемые заболевания |
|
|
ВПГ-1 (вирус простого герпе- |
Поражение: кожи, слизистой оболочки ротовой полости, конъюнктивы или роговицы |
ñà 1-ãî òèïà) |
глаза; энцефалиты |
ВПГ-2 (вирус простого герпе- |
Поражение слизистых оболочек половых органов, у новорожденных — центральной |
ñà 2-ãî òèïà) |
нервной системы |
|
|
ВЗВ (вирус ветрянки) |
Ветряная оспа, опоясывающий лишай, постгерпетическая невралгия; язвенно-не- |
|
кротическая форма опоясывающего герпеса (СПИД-индикаторный признак) |
ЦМВ (цитомегаловирус) |
Патология новорожденных; осложнения после трансплантации органов и костного |
|
мозга: интерстициальная пневмония, гастроинтестинальные расстройства, гепатиты |
|
|
ВЭБ (вирус Эпштейна—Барра) |
Инфекционный мононуклеоз, лимфома Беркитта, рак носоглотки |
ÂÃ-6 |
Фатальные интерстициальные пневмонии и инфекционные розеолы новорожденных |
|
|
ÂÃ-7 |
Выделен у больных с синдромом хронической усталости |
ÂÃ-8 |
Выделен из биоптата больного саркомой Капоши, ассоциирован с лимфопролифе- |
|
ративными заболеваниями |
|
|
Попадая в организм человека, вирус простого герпеса (ВПГ) пожизненно персистирует в нем, периодически вызывая рецидивы различной тяжести. ВГ (ВПГ и ЦМВ) находятся в латентном состоянии в виде L-PREP частиц в паравертебральных сенсорных ганглиях. В период обострения вирусы активизируются.
Персистенция ВГ в организме человека связана со способностью вирусов "ускользать" от иммунного пресса. ЦМВ и ВПГ обладают способностью повреждать клеточный иммунитет, оказывая иммуносупрессивное воздействие и проявляя свой онкогенный потенциал. Длительная персистенция вирусов приводит ко вторичному иммунодефициту, который, в свою оче- редь, способствует активации вирусов. В связи с этим в патогенезе заболевания большое значение имеет иммунокомпетентность организма.
Длительный хронический процесс приводит к негативной иммунной перестройке: развитию вторичной иммунной недостаточности, угнетению реакций клеточного иммунитета, снижению неспецифической защиты, выражающемуся в снижении α è γ ИФН-продуцирующей способности лейкоцитов, гипоиммуноглобулинемии и сенсибилизации к антигенам вируса.
При смешанной инфекции инфекционные агенты могут вступать в различные взаимоотношения. Возможны как взаимостимуляция (аддитивный эффект), так и
угнетение одним агентом размножения других (интерференция). Так, при инфекции, вызванной генитальным герпесом и хламидиями, выделяется эндогенный интерферон (ИФН), снижающий или полностью подавляющий репродукцию вируса, что и обусловливает более легкое или даже латентное течение инфекции.
Реактивация ВПГ может происходить многократно, причем как на фоне моноинфекции, так и на фоне других инфекций (смешанная инфекция). Нарушения иммунной системы прогрессируют по мере повторных реактиваций. Длительная персистенция вирусов приводит к необратимости клеточных и тканевых процессов в органах и системах с последующим апоптозом. По последним данным, реактивация ВГ в ганглиях тройничного нерва и антигенемия коррелируют с повышением уровня цитокинов, в том числе ИФН-γ, ÈË-6, ÈË-10, ÔÍÎ-α. Это является еще одним доказательством вовлеченности в патогенез реактивации латентных герпесвирусных инфекций (ВПГ, ЦМВ) системы ИФН и каскада цитокинов.
Клинические признаки и симптомы
У иммунокомпетентных лиц герпесвирусы могут циркулировать в организме бессимптомно, но у людей с иммуносупрессией способны вызвать тяжелые заболевания со смертельным исходом.
626

Глава 24. Вирусные инфекции
Герпетическая инфекция проявляется разнообразной клинической картиной, локализацией и тяжестью течения. Основные клинические проявления представлены в
таблице 65.
Инфекции, вызываемые вирусами ВПГ-1, ВПГ-2, ВЗВ и ЦМВ, имеют тенденцию к прогрессированию и рецидивированию. При генитальном герпесе инфекция часто персистирует пожизненно, а рецидивы отмечаются в 50—75% случаев.
Диагноз и рекомендуемые клинические исследования
Диагноз герпетической инфекции в большинстве случаев основывается на клини- ческих данных и анамнезе заболевания. К лабораторной диагностике прибегают лишь в трудных случаях.
Методы лабораторной диагностики включают:
обнаружение морфологических изменений в инфицированных клетках;
обнаружение вирусного антигена;
тесты для определения антигена или ДНК ВГ с помощью полимеразной цепной реакции;
серологические методы идентификации и определение титра герпесвирусных антител.
Общие принципы фармакотерапии
Эффективность лечения во многом определяется своевременностью диагностики. В частности, успех терапии при генитальном герпесе зависит от раннего выявления
инфекционных агентов, вызывающих урогенитальные заболевания.
Несмотря на достаточно большое коли- чество специфических противовирусных препаратов, герпетические заболевания остаются плохо контролируемыми, причи- ны этого:
разнообразие клинических поражений;
отсутствие радикальных способов терапии (невозможность полного удаления вируса из организма);
вариабельность чувствительности больных к используемым препаратам;
развитие резистентности вируса к лекарственным средствам;
выработка механизмов, способствующих собственному выживанию ВГ путем модификации эффективности иммунного ответа хозяина (молекулярная мимикрия, т.е. общие антигены вируса и тканей хозяина).
Чувствительность ВГ к противовирусным препаратам представлена в таблице 66. Максимальная эффективность антигерпетической терапии достигается при предварительном выявлении индивидуальной чувствительности лейкоцитов пациента к химиотерапевтическим средствам с помощью определения интерферонового и цитокинового статуса. Штаммы, устойчи- вые к ацикловиру, также устойчивы к валацикловиру и фамцикловиру, поэтому в этом случае следует использовать фоскарнет.
В комплексной терапии иногда применяют индукторы интерферона и другие иммуномодуляторы, однако их эффективность не доказана в клинических исследованиях.
Таблица 66. Чувствительность ВГ к противовирусным химиопрепаратам
ТК вирусов/ |
ЛС/ трифосфатные формы соответствующих ЛС (ФФФ) |
|
|
|||
ÄÍÊ-ïîëè- |
|
|
|
|
|
|
Ацикловир/ФФФ |
Пенцикловир/ФФФ |
Ганцикловир/ФФФ |
Соривудин/ФФФ |
Фоскарнет/ФФФ |
||
мераза |
||||||
|
|
|
|
|
|
|
ÂÏÃ-1 |
-/+ |
+/+ |
-/+ |
+/- |
+/+ |
|
ÂÏÃ-2 |
-/+ |
-/+ |
+/- |
-/- |
+/+ |
|
|
|
|
|
|
|
|
ÂÇÂ |
-/+ |
-/+ |
-/- |
+/+ |
+/+ |
|
ÖÌÂ |
-/+ |
-/- |
-/+ |
- // |
+/+ |
|
|
|
|
|
|
|
|
ÂÝÁ |
-/+ |
-/- |
- // |
- // |
+/+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
627 |
|
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/

РАЗДЕЛ II. КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
Простой герпес (ВПГ I и II)
Первичный клинический эпизод
Внутрь 5 сут:
Ацикловир по 200 мг 5 р/сут; Фамцикловир по 250 мг 3 р/сут.
Внутрь 7 сут:
Валацикловир по 500 мг 2 р/сут.
При тяжелом течении длительность ле- чения может быть увеличена до 10 дней.
Рецидивирующий герпес (обострение)
Внутрь 10 сут:
Ацикловир по 200 мг 5 р/сут; Валацикловир по 500 мг 2 р/сут.
Внутрь 5 сут:
Фамцикловир по 125 мг 2 р/сут.
Профилактическое лечение (супрессивная терапия для профилактики клинически
выраженных и латентно протекающих рецидивов герпетической инфекции)
Внутрь (длительность терапии определяется индивидуально):
Ацикловир по 400 мг 2 р/сут; Валацикловир по 500 мг 1 р/сут; Фамцикловир по 250 мг 2 р/сут.
Наружная терапия при простом герпесе
âлюбой клинической стадии
Ацикловир (крем 3% и 5%) 5 р/сут 5— 10 сут; Пенцикловир каждые 2 ч днем 4 сут.
Герпес Varicella zoster
При инфекциях, вызываемых вирусом V. zoster (в том числе боли при острой и постгерпетической невралгии), показано:
Внутрь 3 р/сут 7 сут: Валацикловир по 1000 мг. Фамцикловир по 250 мг
(при постгерпетической невралгии — по 500 мг).
Литература
1.Григорян С.С. Индукторы интерферона: действие на интерфероновый ста-
тус в норме и патологии [диссертация]. — М., 1992.
2.Джумиго П.А. Интерферонообразование и продукция специфических антител в процессе комбинированной терапии реафероном и антиоксидантами у больных простым рецидивирующим герпесом [диссертация]. — М., 1990.
3.Ершов Ф.И., Чижов Н.П. Лечение вирусных инфекций. Клиническая фармакология и терапия 1995; 4. 75—8.
4.Козлова В.И., Пухнер А.Ф. Вирусные, хламидийные и микоплазменные заболевания гениталий. — М., 1995, 314.
5.Маслюкова Т.М., Ванько Л.В., Атаева Г.Б.
èäð. Клинико-иммунологическая характеристика новорожденных у матерей с цитомегаловирусной инфекцией и генитальным герпесом. Российский Вестник перинатологии и педиатрии. 1993; 38(5): 6—9.
6.Матвеева Н.К., Файзуллин Л.З. и др. Особенности состояния иммунной системы у женщин с воспалительными заболеваниями гениталий хламидийной и вирусной этиологии. Акушерство и гинекология. 1995; 1: 45—8.
7.Оспельникова Т.П., Григорян С.С., Евсеев А.А., Бесаева Т.П., Денисова Е.Н., Коваленко А.Л., Ершов Ф.И. Эффективность циклоферона в лечении вирусассоциированных воспалительных гинекологических заболеваний. Вопр. вирус. 1999; 3: 130—3.
8.Посевая Т.А., Цукерман В.Г. и др. Роль герпетической инфекции при эпителиальных дисплазиях шейки матки и опыт лечения противогерпетическими препаратами. Вопр. вирус. 1991; 1: 78.
9.Сухих Г.Т., Ванько Л.В., Кулаков В.И. Иммунитет и генитальный герпес. —
Í.Новгород—Москва; 1997.
10.Agut H. Le cytomegalovirus en pediatrie. Semin hop Paris 1988; 64 (16):1103—9.
11.Kinghorm G.R. Epidemiology of genital herpes. J Internat Med Res 1994; 22 (Suppl 1): 14—23.
12.Reyburn H.T., Mandelboim O., et al. The class I MHC homologue of human cytomegalovirus inhibits attack by natural killer cells. Nature 1997; 386 (3): 514—7.
628

Глава 24. Вирусные инфекции
Цитомегаловирусная инфекция
Указатель описаний ЛС
Противовирусные ЛС разных групп
Фоскарнет натрия*
Средства, селективно активируемые вирусной тимидинкиназой
Ганцикловир
Цитомегаловирусная инфекция (ЦМВИ) относится к широко распространенным антропонозным вирусным заболеваниям и имеет многообразные клинические проявления.
Эпидемиология
Антитела к цитомегаловирусам (ЦМВ) обнаруживают в среднем у 90—95% взрослого населения. Из органов мочеполовой системы ЦМВ выделяют у 3—35% муж- чин и женщин. Врожденная ЦМВИ (пренатальная и перинатальная) является наиболее частой врожденной инфекцией. В США ее диагностируют у 0,2—2% (30 000—40 000) новорожденных. Постнатальная ЦМВИ встречается у детей первых лет жизни в разных странах с частотой от 8—13% до 42—55%. Инфицирование наиболее часто происходит в возрасте до 5—6 лет. Вторым критическим периодом инфицирования является возраст 16—30 лет.
Этиология и патогенез
Возбудителем заболевания является цитомегаловирус.
Группы высокого риска инфицирования ЦМВ:
новорожденные;
пациенты после трансплантации органов или костного мозга/стволовых клеток;
больные СПИДом;
реципиенты крови и ее препаратов.
Пути передачи инфекции:
вертикальный (от матери ребенку в период беременности);
через молоко матери при грудном вскармливании;
контактно-бытовой;
половой;
трансфузионный.
Во время беременности возможно первичное инфи-
цирование (0,7—4%, в среднем 2%), реактивация ЦМВИ или реинфекция. Наибольший риск для плода представляет первичная инфекция на ранних сроках гестации. При первичном инфицировании вирус передается плоду в 35—50% случаев, при реактивации ЦМВИ или реинфекции — в 0,2—2% случаев. В передаче инфекции значительную роль играет состояние иммунной системы матери, титр материнских антител, а также локализация и вирулентность вируса. Материнский иммунитет не только ограничивает передачу инфекции, но и определяет течение ЦМВИ у плода.
629
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/

РАЗДЕЛ II. КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
В детском возрасте возможна передача инфекции от матери или от других детей, выделяющих вирус. Источником инфекции являются дети с субклинической формой инфекции. В возрасте 16—30 лет передача ЦМВ осуществляется главным образом половым путем.
При переливании крови риск инфицирования составляет 0,4—2,4%. В настоящее время неясно, является ли инфекция результатом эндогенной реактивации вируса или реинфекции у серопозитивных реципиентов. Источники инфекции у больных, перенесших трансплантацию солидных органов или костного мозга, также не совсем ясны. Важную роль здесь могут играть инфицированные ЦМВ эндотелиальные клетки. У этих пациентов возможно первичное инфицирование, эндогенная реактивация инфекции или реинфекция.
После первичного инфицирования ЦМВ может долго персистировать в организме, находясь в латентном состоянии, при этом он может локализоваться в любом органе, однако центральную роль в персистировании герпесвирусов, включая ЦМВ, играют клетки, принимающие участие в гемопоэзе. Реактивация вируса возможна в любое время.
ЦМВИ, по-видимому, играют важную роль в патогенезе воспалительных и пролиферативных сосудистых заболеваний. Обнаружение вирусного антигена и ДНК ЦМВ в гладкомышечных клетках артерий коррелирует с пролиферацией этих клеток и лимфатическими инфильтратами, наблюдающимися при ЦМВИ. Часто ДНК ЦМВ обнаруживают при рестенозе коронарных артерий после ангиопластики. В эксперименте на крысах подтверждено, что ЦМВИ является одной из причин развития атеросклероза после пересадки сердца. Сосудистые поражения почечного трансплантата также могут быть обусловлены ЦМВИ.
ЦМВ подвергается репликации в моче- вых путях и выделяется с мочой. Вирус обнаружен в проксимальных почечных канальцах, петле Генле и почечных клубоч- ках. У здоровых людей проникновение ЦМВ в почки, как правило, не вызывает
дисфункции органа. Обсуждается возможность развития почечной недостаточности при поражениях почек ЦМВ после трансплантации почки.
При субклинической форме ЦМВИ мононуклеарные инфильтраты с типичными цитомегаловирусными клетками обнаруживают в печени (особенно в области портальных трактов). У новорожденных цитомегаловирусные клетки находят в эпителии желчных протоков, в меньшем количе- стве — в капиллярах эндотелия и крайне редко — в клетках паренхимы печени. У взрослых обнаруживают гепатоциты, инфицированные ЦМВ.
Цитомегаловирусное поражение ÆÊÒ чаще наблюдается у пациентов со СПИДом или другими формами иммунодефицита. Наиболее часто поражаются пищевод, тонкая и толстая кишки, прямая кишка, однако возможно поражение всех отделов ЖКТ. Цитомегаловирусные антигены были выявлены в кишечных инфильтратах.
Инфицированию часто подвергаются органы бронхолегочной системы, включая слизистую оболочку верхних дыхательных путей, особенно у пациентов, перенесших трансплантацию костного мозга, сердца или легких. Инфицированные клетки находят главным образом в альвеолах и эпителии бронхов.
 ÖÍÑ выявлено поражение нервных клеток и глии.
Клинические признаки и симптомы
У иммунокомпетентных пациентов ЦМВИ, как правило, не проявляется клинически. В редких случаях может наблюдаться клиническая картина, напоминающая инфекционный мононуклеоз, который невозможно отличить от мононуклеоза, вызванного вирусом Эпштейна—Барра. ЦМВ обусловливает около 10% всех случаев инфекционного мононуклеоза.
У пациентов с иммуносупрессией риску инфицирования подвержен практи- чески каждый орган, поэтому ЦМВИ может иметь разнообразные клинические проявления, включая угрожающие жизни
630

Глава 24. Вирусные инфекции
и приводящие к летальным исходам. По- чти все больные СПИДом являются ЦМВ-серопозитивными с высоким риском реинфицирования. Наиболее частым проявлениeм ЦМВИ при СПИДе является ретинит (85%), который без лечения неминуемо приводит к потере зрения. По- чти у 20—25% больных развивается симптоматика цитомегаловирусного ретинита, указывающего на поражение ЦНС. В большинстве случаев инфицированию подвергаются ЦНС (диффузные энцефалопатии) и в 2—13% — органы ЖКТ (эзофагит, гастрит и энтерит). Более чем у 40% больных СПИДом развивается генерализованная форма ЦМВИ. Летальность при генерализованной форме составляет 11—20%.
Óпациентов после трансплантации активная форма ЦМВИ встречается в 38— 96% случаев.
Óдетей, рожденных от иммунокомпетентных матерей, клинические симптомы заболевания проявляются редко. Клиниче- ская картина ЦМВИ у детей, родившихся здоровыми у матерей, инфицированных ЦМВ, может проявляться в более старшем возрасте (например,через несколько лет у 5—15% детей можно выявить нарушения слуха различной тяжести).
Óдетей, рожденных у матерей с первич- ной инфекцией, проявления ЦМВИ наблюдаются в 8—10% случаев. Наблюдаются как поражения средней тяжести (гепатоспленомегалия, тромбоцитопения, петехии, микроцефалия, ретинит и гепатит), так и серьезные — при генерализованной форме. У новорожденных описаны генерализованные и локальные поражения ЦНС. Летальность при генерализованной форме составляет 11—20%.
Óбольшинства реципиентов после переливания крови ЦМВ инфекция остается бессимптомной.
Угрозу для жизни могут представлять
тяжелые поражения ЖКТ и бронхолегоч- ной системы, а также бактериальная, грибковая или протозойная суперинфекция.
После трансплантации костного мозга самым тяжелым осложнением считается интерстициальная цитомегаловирусная
пневмония, которая диагностируется в 10—15% случаев. Несмотря на химиотерапию, у 80—90% больных пневмония вызывает летальный исход. У больных, перенесших трансплантацию печени, к числу серьезных осложнений относится гепатит, который может приводить к печеночной недостаточности и необходимости повторной пересадки печени.
Диагноз и рекомендуемые клинические исследования
Диагностика ЦМВИ основывается на выявлении симптомов поражения того или иного органа и выявления ЦМВ в нем. Например, диагноз цитомегаловирусной пневмонии основывается на клинической картине заболевания и определении ЦМВ
âбронхоальвеолярных смывах.
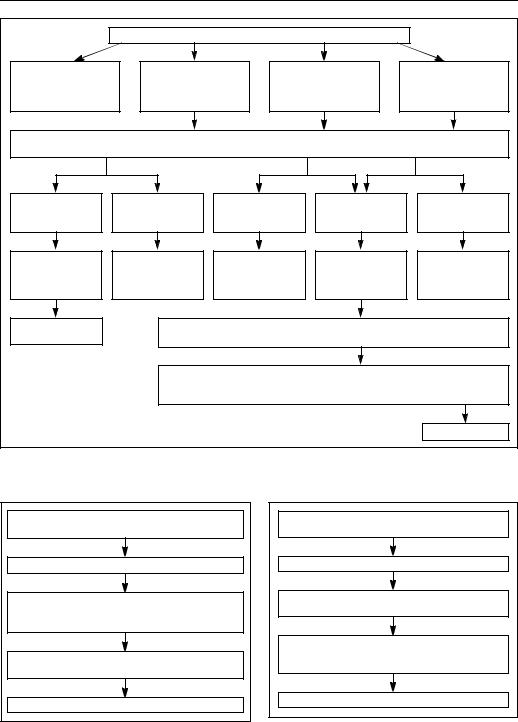
Âранние сроки беременности необходимо определение анти-ЦМВ антител. При клинических проявлениях заболевания и/или активной инфекции во время беременности важно определить, является ли она первичной или реактивацией/реинфекцией. Схема диагностики ЦМВИ во время беременности представлена на рисунке 16.
Óноворожденных ЦМВИ можно диагностировать методом полимеразной цепной реакции (ПЦР) или культуральным методом выявления вируса в моче.
Âтрансплантологии важное значение имеет диагностика ЦМВИ у донора и реципиента до операции и как можно более раннее выявление активной ЦМВИ после трансплантации. В этом случае наиболее часто определяют анти—ЦМВ антитела. Методом выбора являются ПЦР и тест на антигенемию. На рисунке 17 представлена схема диагностики ЦМВИ в трансплантологии.
Óбольных СПИДом количество ДНК, определяемой в лейкоцитах или плазме крови, выше при поражении ЦМВ внутренних органов. Альтернативой ПЦР служит тест на антигенемию. Оба теста также используют для контроля терапии. На рисунке 18 представлена схема диагностики ЦМВИ у пациентов со СПИДом.
631
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
РАЗДЕЛ II. КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ |
|
|
|
|
|
1-ое исследование крови на наличие ЦМВ антител |
|
||
IgG+/IgM- |
IgG+/IgM+ |
|
IgG-/IgM+ |
IgG-/IgM- |
предположительно |
предположительно |
первичная |
серонегативная |
|
латентная фаза |
первичная |
инфекция или |
или инкуб. фаза |
|
|
инфекция |
неспецифич. IgM |
|
|
два образца крови через 2 недели и определение возбудител я инфекции в крови (рр65 антиген, |
||||
|
ПЦР) и моче (24-часовое выделение вируса) |
|
||
IgG/IgM+ |
òèòð IgG íå |
IgG-/IgM+ |
IgG-/IgM+ |
IgG-/IgM- |
вирус+ |
изменился/ |
вирус- |
вирус+или- |
вирус- |
|
IgM+вирус- |
|
|
|
ÖÌÂ IgG-/? |
латентн. |
неспецифич. |
первичная |
3-е исслед. |
(до беремен.) |
инфекция с |
реакция |
инфекция |
через |
|
персистенцией |
|
|
2—3 недели |
|
IgM |
|
|
|
первичная |
определение ЦМВ IgM в пупов.крови на 22—23 нед. берем.; |
|||
инфекция (?) |
определение вируса в амниотич. жидкости (ПЦР; выделение вируса) |
|||
|
Материнская первичная инфекция подтверждена, ЦМВ IgM |
|||
|
определены в пуповинной крови, выделен вирус из амниотической |
|||
|
|
|
жидкости |
|
|
|
|
|
Аборт? |
Рисунок 16. Диагностика ЦМВИ во время беременности |
|
|||
Определение титра IgG у донора (Д) и реципиента (Р) до трансплантации
Ä-Ð-; Ä-Ð+; Ä+Ð-; Ä+Ð+
Интенсивный (еженедельный) мониторинг крови реципиента (ПЦР и/или тест
на антигенемию)
Положительный результат в одном (антигенемия) или двух (ПЦР)
Терапия
Рисунок 17. ЦМВ-диагностика в трансплантологии
Определение серологического статуса (ELISA, фиксация комплемента)
Ig G+
Если CD4+ <100/мм3, ПЦР через интервалы 2—3 мес
Подтверждение клинического диагноза определением вируса (ПЦР)
в пораженном органе
Терапия
Рисунок 18. Диагностика ЦМВИ у больных СПИДом
632

Глава 24. Вирусные инфекции
Общие принципы фармакотерапии
Такие проявления ЦМВИ, как гепатит, эзофагит, колит успешно поддаются ле- чению. Исход лечения в значительной степени зависит от своевременности диагностики и назначения адекватной терапии.
Для лечения цитомегаловирусного ретинита, колита, эзофагита, пневмонии и других поражений внутренних органов или тяжелой системной ЦМВИ без выявленных поражений внутренних органов используют ганцикловир и фоскарнет натрия*.
Начальная терапия
Ганцикловир в/в инфузионно (в течение 1 ч с постоянной скоростью) по 5 мг/кг каждые 12 ч 14—21 сут; Фоскарнет натрия* в/в инфузионно ( в течение 30 мин) 60 мг/кг (в 5% р-ре
глюкозы или 0,9% р-ре NaCl) 3 р/сут, затем по 90—120 мг/кг в качестве поддерживающей терапии.
Фоскарнет натрия* инфузионно вводят в
центральные вены по 24 мг/мл или в периферические вены по 12 мг/мл.
Поддерживающая терапия
Ганцикловир в/в инфузионно (в течение 1 ч с постоянной скоростью) по 6 мг/кг 5 р/ нед или по 5 мг/кг 1 р/сут ежедневно.
При цитомегаловирусном ретините комбинированное лечение ганцикловиром и фоскарнетом натрия* позволяет продлить ремиссию заболевания. Более эффективно внутриорбитальное введение ганцикловира и/или фоскарнета натрия*. Однако внутриорбитальное введение может приводить к серьезным осложнениям — отслойке сет- чатки или инфицированию другого глаза, поэтому местную терапию нужно сочетать с систематическим внутривенным назна- чением ганцикловира и/или фоскарнета натрия*. В клинических испытаниях показана высокая эффективность валганцикловира у больных с цитомегаловирусным ретинитом на фоне СПИДа.
Для поддерживающей терапии цитоме-
галовирусного ретинита пациентам с ослабленным иммунитетом назначают:
Ганцикловир в/в инфузионно (в течение 1 ч с постоянной скоростью) по 1г 3 р/сут или по 0,5 г 6 р/сут
Пациенты, перенесшие трансплантацию
Лечение пациентов, перенесших трансплантацию солидного органа или костного мозга, следует начинать в случае положительной ПЦР в двух последовательно взятых клинических образцах или выявлении > 5/100 000 антиген-положитель- ных клеток. Несмотря на лечение, более 2/3 больных после трансплантации органов умирают от пневмонии, поэтому обсуждаются новые подходы к лечению, в частности, проведение коротких курсов, снижающих риск развития резистентности и токсического действия лекарственных препаратов. У пациентов после аллогенной трансплантации костного мозга эффективность профилактического назначения противовирусных препаратов не доказана. Ганцикловир позволяет уменьшить частоту и тяжесть осложнений, вызванных ЦМВ, в раннем периоде после трансплантации костного мозга, однако он не влияет на продолжительность жизни у этих пациентов, что может быть частично связано с увеличением частоты суперинфекций (бактериальной, грибковой).
Для профилактики и лечения ЦМВИ у лиц с иммуносупрессией эффективен новый противовирусный препарат валганцикловир.
Во многих медицинских центрах мира стала стандартной пассивная иммунопрофилактика ЦМВИ с помощью иммуноглобулинов. В настоящее время обсуждается эффективность профилактического назна- чения иммуноглобулина у пациентов после трансплантации.
Вакцина против ЦМВ до сих пор не создана. В стадии разработки находится субъединичная вакцина из белка вирусной оболочки gB.
В комплексной терапии ЦМВИ применяют индукторы интерферона и другие иммуномодуляторы.
633
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/

РАЗДЕЛ II. КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
Профилактика
С целью профилактики ЦМВИ необходимо внедрять методы широкого выявления первичной инфекции у беременных.
Для профилактики ЦМВ у ВИЧ-поло- жительных лиц с факторами риска цитомегаловирусной инфекции назначают ганцикловир.
Литература
1.Boppana S.B., Pass R.F., Britt W.J. et. al. Symptomatic congenital cytomegalovirus infection: neonatal morbidity and mortality. Pediatr Infect Dis J 1992; 11: 93—9.
2.Bowden R.A. Cytomegalovirus infections in transplant patients: methods of prevention of primary cytomegalovirus. Transplant Procob 1991; 23: 136—8.
3.Chandler S.H., Alexander E.R., Holmes K.K. Epidemiology of cytomegaloviral infection in heterogeneous population of pregnant women. J Infect Dis 1985; 152: 249—56.
4.Dieterich D.T., Rahmin M. Cytomegalovirus colitis in AIDS: presentation in 44 patients and a review of the literature. J Acquir Immune Defic Syndr 1991; 4 (Suppl 1): S29—35.
5.Drew W.L., Mintz L., Miner R.S., et al. Prevalence of cytomegalovirus infection in homosexual men. J Infect Dis 1981; 143: 188—92.
6.Emanuel D., Cunningham I., Jules-Elysee K., et al. Cytomegalovirus pneumonia after bone marrow transplantation successfully treated with the combination of ganciclovir and high-dose intravenous immune globulin. Ann Intern Med 1988; 109: 777—82.
7.Francisci D., Tosti A., Baldelli F., et al. The pp65 antigenemia test as a predictor of cy- tomegalovirus-induced end-organ disease in patients with AIDS. AIDS 1997; 11: 1341—5.
8.Gnann J.W., Ahlmen J.J., Svalander C. et al. Inflammatory cells in transplanted kidneys are infected by human cytomegalovirus. Am J Pathol 1988; 132: 239—48.
9.Grattan M.T., Moreno-Cabral C.E., Starnes V.A. et al. Cytomegalovirus infection is associated with cardiac allograft rejection and atherosclerosis. JAMA 1989; 261: 3561—66.
10.Griffiths P.D., Baboonian C. A prospective study of primary cytomegalovirus infection during pregnancy: final report. Br J Obstet Gynaec 1984; 91: 307—15.
11.Hammitt D.G., Aschenbrenner D.W., Williamson R.A. Culture of cytomegalovirus from frozen-thawed semen. Fertil Steril 1988; 49: 554—7.
12.Hendrix M.G., Salimans M.M., van-Boven C.P. et al. High prevalence of latently present cytomegalovirus in arterial walls of patients suffering from grade III atherosclerosis. Am J Pathol 1990; 136: 23—8.
13.Ho M., Cytomegalovirus biology and infection. Plenum Medical Book Co., York, 1991.
14.Klemola E., Kaariainen L. Cytomegalovirus as a possible cause of a disease resembling infections mononucleosis. Brit Med J 1965; 2: 1099—102.
15.Ljungman P., Engelhard D., Link H. et al. Treatment of intestitial pneumonitis due to cytomegalovirus with ganciclovir and intravenous immune globulin: experience of European Bone Marrow Transplant Group. Clin Infect Dis 1992; 14: 831—5.
634
