
4 курс / Фак. Терапия / ВБ ССС книга
.pdf

Рис. 6.63. Двухмерная эхокардиограмма, зарегистрированная у больного с инфарктом миокарда заднебазальных отделов ЛЖ и заднемедиальной сосочковой мышцы, разрывом папиллярной мышцы с формированием острой недостаточности митрального клапана
4. При допплеровском режиме исследования обнаруживается эксцентрически расположенная струя регургитации, распространяющаяся в левое предсердие в сторону от пораженной створки. При разрыве передней папиллярной мышцы струя направлена в сторону заднебоковой стенки ЛП, а при разрыве задней сосочковой мышцы — в сторону МЖП.
Лечение разрывов сосочковой мышцы только хирургическое. Перед операцией необходима стабилизация гемодинамики и состояния больного, в связи с чем используют внутривенные инфузии нитроглицерина и натрия нитропруссида, а также внутриаортальную баллонную контрпульсацию. Если эти предварительные лечебные мероприятия имеют успех, целесообразно отложить проведение радикальной операции на 4–6 недель после инфаркта. Если же состояние больного не улучшается, следует настаивать на экстренном оперативном вмешательстве.
Следует помнить, что относительная недостаточность митрального клапана у больных ИМ может развиться не только в результате разрыва сосочковой мышцы, но и при их выраженной дисфункции, которая наблюдается у большинства больных ИМ с зубцом Q в течение 1-й недели заболевания. Дисфункция сосочковых мышц
в этих случаях обусловлена их ишемией или вовлечением в некротический процесс. Определенное значение может иметь изменение размеров и формы ЛЖ, обусловленное его ремоделированием и снижением сократимости.
Клинически при этом также определяется систолический шум на верхушке, проводящийся в левую подмышечную область, и признаки систолической регургитации крови в ЛП при допплер-ЭхоКГ- исследовании. Однако в этих случаях отсутствует основной признак разрыва сосочковой мышцы — “молотящая” створка митрального клапана и выявляется лишь небольшое пролабирование одной из створок клапана. Дисфункция сосочковой мышцы, как правило, не требует специального лечения: в большинстве случаев на фоне интенсивной терапии ИМ признаки дисфункции уменьшаются.
6.5.5. Перикардит
У большинства больных трансмуральным ИМ на 2–4-е сутки болезни может развиться реактивный асептический перикардит (pericarditis epistenocardica). Как правило, он носит характер фибринозного или серозно-фибринозного с небольшим объемом выпота в полость перикарда. В то же время клинически перикардит обнаруживают только у 5–10% больных ИМ, что связано со сложностью его диагностики.
Клиническая картина. Перикардит у больного ИМ с зубцом Q можно заподозрить по следующим клиникоинструментальным признакам.
582
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/

Источником тромбоэмболий артерий большого круга кровообращения являются 1) пристеночные тромбы в полости ЛЖ, особенно часто располагающиеся в области аневризмы, и 2) тромбы в левом предсердии, нередко формирующиеся при возникновении фибрилляции предсердий. Особенно большую опасность
представляют подвижные тромбы — тромбы на “ножках”. Отрываясь от места их образования, тромбы или их частицы окклюзируют артериальное сосудистое русло, вызывая ишемию и некроз тех или иных органов.
Тромбоэмболия сосудов головного мозга сопровождается разнообразной, внезапно возникающей неврологической симптоматикой, чаще всего — признаками нарушения мозгового кровообращения (гемипарез, гемиплегия, дизартрия, потеря сознания, расстройства функции тазовых органов и т.д.).
Тромбоэмболия мезентериальных артерий является причиной некроза кишечника и развития перитонита. Внезапно у больных появляются очень интенсивные и быстро нарастающие жгучие и нестерпимые боли в животе, которые не купируются ни спазмолитиками, ни наркотическими анальгетиками. Быстро развивается парез кишечника и появляются симптомы острого перитонита и нарастающей интоксикации. В крови определяется выраженный лейкоцитоз и значительный сдвиг лейкоцитарной формулы влево.
Тромбоэмболия артерий конечностей проявляется несколькими внезапно наступающими симптомами:
резкой нестерпимой болью в конечности;
побледнением и похолоданием конечности (рис. 6.64, см. цветную вклейку);
отсутствием артериального пульса ниже места окклюзии.
Быстро развиваются трофические изменения и гангрена конечности.
Тромбоэмболия почечной артерии приводит к развитию инфаркта почек. Внезапно появляются боли в поясничной области и в левом или в правом подреберье, гематурия, олигурия. Обычно отмечается подъем АД, обусловленный ишемией почки.
Тромбоэмболия легочной артерии (ТЭЛА) развивается гораздо чаще, чем эмболии артерий большого круга кровообращения, Источником ТЭЛА в большинстве случаев являются тромбы в глубоких венах нижних конечностей. Последние нередко существуют бессимптомно. Клиническая картина, методы диагностики и лечения ТЭЛА подробно изложены в главе 14.
Профилактика тромбоэмболических осложнений включает:
1.Своевременную диагностику внутрисердечных тромбов и тромбов в глубоких венах нижних конечностей у всех больных трансмуральным ИМ. Наилучшим способом неинвазивной диагностики служит эхокардиография и дуплексное ультразвуковое исследование вен нижних конечностей.
2.При обнаружении подвижных тромбов в полости ЛЖ целесообразно назначение антикоагулянтов: нефракционированного или низкомолекулярных гепаринов с последующим переводом больных на прием непрямых антикоагулянтов (варфарин, фенилин и др.) в течение длительного времени (до 3–6 месяцев).
3.Для профилактики тромбоза глубоких вен нижних конечностей рекомендуется по возможности ранняя активизация больных, занятия лечебной физкультурой.
Более подробно способы профилактики ТЭЛА изложены в главе 14.
6.5.7. Постинфарктный синдром Дресслера
Постинфарктный синдром, впервые описанный в 1955 г. Дресслером, — это аутоиммунное поражение перикарда, плевры и легких, возникающее обычно на 2–6-й неделе от начала ИМ. Типичная триада, характерная для постинфарктного синдрома (перикардит, плеврит, пневмонит), иногда сочетается
саутоиммунным поражением синовиальных оболочек суставов. Постинфарктный синдром связывают
собнаружением в организме больных ИМ аутоантител к миокардиальным и перикардиальным антигенам.
Клиническая картина постинфарктного синдрома различается у разных больных в зависимости от преимущественного поражения перечисленных серозных оболочек и легких. Однако обязательным является асептический аутоиммунный процесс в перикарде — перикардит.
584
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/


1.Наиболее характерными клиническими проявлениями постинфарктного синдрома Дресслера является триада: перикардит, плеврит, пневмонит. Эти патологические состояния развиваются обычно на 2–6-й неделе от начала ИМ.
2.Лечение постинфарктного синдрома заключается в назначении НПВС, а в более тяжелых случаях — глюкокортикоидов.
3.Антибиотики не эффективны при постинфарктном синдроме.
4.При подтверждении диагноза синдрома Дресслера антикоагулянты должны быть отменены.
6.6. Инфаркт миокарда правого желудочка
До недавнего времени считалось, что ИМ правого желудочка встречается очень редко. Однако в последние годы доказано, что примерно у 1/4 больных с заднедиафрагмальным (нижним) трансмуральным ИМ ЛЖ некроз распространяется и на область ПЖ, чаще его задней стенки. Поражение ПЖ в этих случаях определяет некоторые важные особенности нарушения гемодинамики, которые обязательно должны учитываться при лечении больных ИМ.
Особенности клинической картины. Начальные клинические проявления ИМ ПЖ (в частности, болевой синдром), динамика гиперферментемии и признаков резорбционно-некротического синдрома в целом соответствуют таковым, характерным для инфаркта задней стенки ЛЖ.
Некроз миокарда ПЖ быстро приводит к снижению его сократимости и появлению отдельных признаков или развернутой клинической картины острой правожелудочковой недостаточности, как правило, сопровождающейся также артериальной гипотонией.
При физикальном исследовании можно обнаружить следующие клинические симптомы:
1.Набухание шейных вен, обусловленное застойными явлениями в венозном русле большого круга кровообращения. Нередко набухание вен увеличивается на вдохе (симптом Куссмауля) в результате инспираторного увеличения притока крови в центральные вены и правые отделы сердца, обусловленного присасывающим действием отрицательного давления грудной клетки во время вдоха. У здорового человека такое инспираторное увеличение притока крови к правому сердцу (увеличение преднагрузки на ПЖ) сопровождается адекватным увеличением УО ПЖ (механизм Старлинга), и весь объем крови поступает в систему легочной артерии. Поэтому в норме во время вдоха шейные вены не набухают, а спадаются. При
резком снижении систолической функции ПЖ его инспираторная объемная перегрузка сопровождается не увеличением, а заметным уменьшением УО ПЖ, связанным с неспособностью ПЖ “протолкнуть” этот дополнительный объем в легочную артерию. В результате происходит инспираторное набухание шейных вен.
2.Гепатомегалия, быстрое развитие которой при острой правожелудочковой недостаточности сопровождается болями в правом подреберье и болезненностью при пальпации печени.
3.Перкуторные признаки расширения полости ПЖ (смещение правой границы сердца вправо и расширение абсолютной тупости сердца), что подтверждается при рентгенографии и эхокардиографическом исследовании.
4.Правожелудочковый протодиастолический ритм галопа (патологический III тон сердца) выслушивается
в нижней трети грудины или у ее левого края. Здесь же иногда можно выслушать систолический шум относительной недостаточности трехстворчатого клапана.
5.Отсутствие клинических признаков острой левожелудочковой недостаточности и застоя крови в малом круге кровообращения (одышки, удушья, влажных хрипов в легких и др.), что связано с уменьшением количества крови, выбрасываемой ПЖ в легочную артерию, и, соответственно, со снижением ДЗЛА и давления наполнения ЛЖ.
6.Артериальная гипотония связана не с угнетением насосной функции ЛЖ, а со снижением систолической функции ПЖ и уменьшением количества крови, поступающей в левые отделы сердца из малого круга кровообращения (уменьшение преднагрузки ЛЖ). Другой причиной артериальной гипотензии могут служить различные брадиаритмии (СССУ, АВ-блокады и др.), характерные для ишемического поражения ПЖ, что связано с окклюзией ПКА, участвующей в кровоснабжении СА-узла и АВ-соединения.
7.Парадоксальный артериальный пульс — снижение во время вдоха систолического АД больше 10–12 мм
рт. ст. и инспираторное уменьшение наполнения пульсовой волны. Этот признак, по сути, обусловлен теми же причинами, что и увеличение набухания вен шеи на вдохе (симптом Куссмауля): снижением УО ПЖ и,
586
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
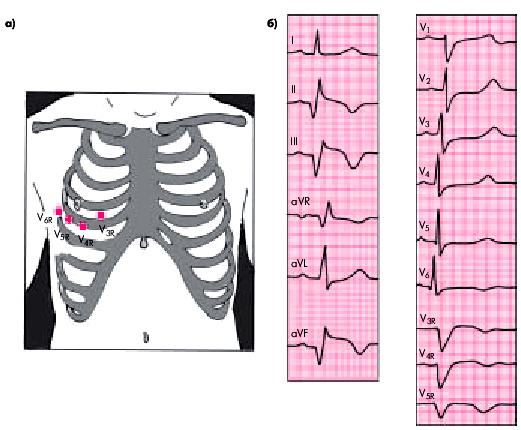

грудной клетки V3R и V4R при отсутствии этих изменений в отведениях V1 и V2. Нередко на ЭКГ выявляются также фибрилляция предсердий и АВ-блокады.
Эхокардиография. Эхокардиограмма, зарегистрированная в двухмерном и допплеровском режимах, позволяет выявить ряд признаков поражения ПЖ и снижение его систолической функции.
Расширение полости ПЖ.
Признаки гипокинезии или акинезии задней, боковой или передней стенки ПЖ.
Парадоксальное движение МЖП в сторону ЛЖ, что объясняется выраженной объемной перегрузкой ПЖ и его неспособностью “протолкнуть” кровь в систему малого круга кровообращения.
Расширение нижней полой вены с ее недостаточным спадением (коллабированием) на высоте глубокого вдоха, что указывает на повышение ЦВД (давления в полости ПП).
Исследование транстрикуспидального диастолического потока крови в допплеровском режиме иногда позволяет выявить признаки трикуспидальной регургитации крови из ПЖ в ПП, обусловленной дисфункцией клапанного аппарата, возникающей в результате дилатации и снижения сократимости ПЖ.
Катетеризацию правых отделов сердца и легочной артерии катетером Свана–Ганца у больных ИМ ПЖ проводят для подтверждения диагноза и разработки адекватной тактики лечения больных. Наиболее типичными изменениями гемодинамики, выявляемыми у больных ИМ ПЖ с помощью катетеризации правых отделов сердца и легочной артерии, являются:
увеличение среднего давления в ПП (выше 10 мм рт. ст.), которое иногда достигает уровня диастолического давления в легочной артерии или ДЗЛА. Это объясняет наличие застоя крови в венах большого круга кровообращения и отсутствие застоя крови в легких;
систолическое давление в легочной артерии нормально или даже несколько снижено, что частично объясняет сравнительно низкие значения давления наполнения ЛЖ и системного АД.
Коронароангиография, как правило, позволяет выявить окклюзию или критическое сужение ПКА, кровоснабжающей заднюю стенку как левого, так и правого желудочков. Реже встречается поражение ОВ ЛКА (обычно при левом типе кровоснабжения сердца).




 Запомните
Запомните
Классической триадой, характерной для инфаркта миокарда ПЖ (помимо болевого синдрома), считают:
артериальную гипотензию;
увеличение давления в яремных венах и правом предсердии;
отсутствие хрипов при аускультации легких
2.Для ИМ задней стенки ПЖ (наиболее частая локализация инфаркта ПЖ) характерны наличие патологического зубца Q и/или
подъем сегмента RS–Т в дополнительных отведениях с правой половины грудной клетки V3R и V4R при отсутствии этих изменений в отведениях V1 и V2. Нередко выявляются также фибрилляция предсердий и АВ-блокады.
3.Наиболее типичным изменением гемодинамики, выявляемом у больных ИМ ПЖ с помощью катетеризации правых отделов сердца и легочной артерии, являются:
увеличение среднего давления в ПП (выше 10 мм рт. ст.), которое иногда достигает уровня диастолического давления
588
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/

В подавляющем большинстве случаев (около 85–90%) причиной внезапной сердечной смерти является ИБС, причем любые ее клинические варианты, включая бессимптомное течение, когда внезапная смерть является
первым и последним клиническим проявлением болезни. В целом примерно больных верифицированной ИБС умирает внезапно. Наибольшему риску внезапной сердечной смерти подвержены:
больные острым ИМ (особенно в первый час развития инфаркта);
больные НС;
пациенты, перенесшие в прошлом ИМ, особенно лица с кардиомегалией и застойной сердечной недостаточностью;
больные ИБС с желудочковыми аритмиями высоких градаций;
больные ИБС, имеющие несколько основных факторов риска (АГ, ГЛП, курение, нарушения углеводного и жирового обменов и др.).
Следует заметить, что внезапная смерть, наступившая в ранней (острейшей) фазе ИМ, верифицированного клинически или на аутопсии, расценивается как “смерть от инфаркта”. Тем не менее по своим механизмам, клинической картине и комплексу необходимых реанимационных мероприятий она полностью соответствует внезапной сердечной смерти, развивающейся при других формах ИБС, и поэтому рассматривается в данном разделе.
Кдругим причинам внезапной сердечной смерти (помимо ИБС) относятся:
любые заболевания сердца, сопровождающиеся выраженной гипертрофией миокарда (например, ГКМП, стеноз устья аорты и т.п.);
застойная сердечная недостаточность любого генеза;
кардиогенный шок любого генеза (помимо острого ИМ);
тампонада сердца любого генеза (например, при экссудативном перикардите и т.п.);
тромбоэмболия легочной артерии;
синдром удлиненного интервала Q–Т
Особенности патогенеза
У большинства больных ИБС (85–90%), умерших внезапно, в том числе у пациентов с бессимптомным течением заболевания, на аутопсии обнаруживают значительные атеросклеротические изменения КА: сужение их просвета более чем на 75% и многососудистое поражение коронарного русла. Только у 10–15% внезапно умерших эти изменения отсутствуют. Атеросклеротические бляшки, расположенные преимущественно в проксимальных участках КА, как правило, бывают осложненными, с признаками повреждения эндотелия и образованием пристеночных или (сравнительно редко) полностью окклюзирующих просвет сосуда тромбов.
Эти изменения вместе с возможной в этих условиях динамической окклюзией (выраженным спазмом) венечных сосудов и увеличением потребности миокарда в кислороде являются причиной развития острого очагового ишемического повреждения сердечной мышцы, лежащего в основе внезапной сердечной смерти.
Правда, на аутопсии только у 10–15% больных ИБС, умерших внезапно, выявляются макроскопические и/или гистологические признаки острого ИМ. Это объясняется тем, что для формирования таких признаков требуется не менее 18–24 ч (В.В. Серов с соавт, 1997). Тем не менее результаты электронной микроскопии показывают, что уже через 20–30 мин после прекращения коронарного кровотока начинается процесс необратимых изменений клеточных структур миокарда, который завершается уже через 2–3 ч коронарной окклюзии. Возникают выраженные необратимые нарушения метаболизма миокарда, ведущие к электрической нестабильности сердечной мышцы и фатальным нарушениям ритма.
Основными непосредственными причинами внезапной сердечной смерти являются: 1) фибрилляция желудочков и 2) асистолия сердца, электрофизиологические механизмы которых подробно разбираются в главе 3.
Фибрилляция желудочков — это частое (до 200–500 в мин), но беспорядочное, нерегулярное возбуждение и сокращение отдельных мышечных волокон. В результате такой хаотической активации отдельных групп кардиомиоцитов одномоментное синхронное их сокращение становится невозможным. Наступает асистолия желудочков, и кровоток прекращается.
Асистолия сердца — это полное прекращение деятельности сердца, его остановка. Первичная асистолия обусловлена нарушением функции автоматизма СА-узла, а также водителей ритма II и III порядка (АВ-
590
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/





 Запомните
Запомните



 Запомните
Запомните



 Запомните
Запомните



 Запомните
Запомните