
4 курс / Общая токсикология (доп.) / Врожденные пороки сердца
.pdf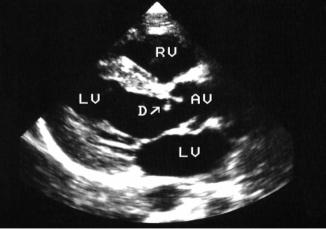
782 |
Часть 10. ПОРОКИ ВЫВОДНОГО ТРАКТА ЛЕВОГО ЖЕЛУДОЧКА |
|
|
|
|
Для фиброзного типа субаортального стеноза характерно наличие светлой поперечной полосы по всей окружности выводного тракта левого же лудочка в виде кольца шириной до 2–3 мм, на большем расстоянии от дна аортального клапана (от 10 до 20 мм). При этом типе отчетливо выявля ется подклапанный карман или «второй желудо чек» между суживающим фиброзным кольцом и аортальным клапаном. Для фибромускулярного типа субаортального стеноза характерны неравно мерные краевые дефекты наполнения в выводном тракте левого желудочка в виде гребнеподобных выступов. В последние годы инвазивные методы диагностики применяются все реже и необходи мость в их использовании возникает только при сложных сочетанных аномалиях (73). Основная роль в предоперационной диагностике субаор тального стеноза отводится ЭхоКГ.
Эхокардиография совершила революцию в ди агностике дискретного субаортального стеноза. Этот метод позволяет получить всю необходимую информацию о внутрисердечной анатомии, так что в большинстве случаев отпадает необходи мость в катетеризации сердца (рис. 2). ЭхоКГ дает возможность с максимальной точностью оценить размер левого желудочка и кольца аортального клапана, степень подклапанного сужения вывод ного тракта левого желудочка, его размер, уровень и протяженность стеноза, а также ГСД на уровне стеноза (45). Исследования возможности ультраз вуковой диагностики субаортального стеноза на чались еще с середины 70 х годов (85–88).
Такие классические ЭхоКГ признаки наличия обструкции выводного тракта левого желудочка, определяемые в одномерном режиме, как раннее систолическое прикрытие аортального клапана и высокочастотное трепетание створок аортального клапана в систолу, являются неспецифическими и
Рис. 2. Эхокардиограмма при подклапанном стенозе аорты. Видна фиброзная диафрагма
не могут определять тип субаортальной обструк ции. Кроме субаортального стеноза, они встреча ются и при других нарушениях гемодинамики (89). Диагностическая ценность этого симптома несомненна — он имеет огромное значения для предварительной диагностики субаортального стеноза.
Двухмерная ЭхоКГ расширила возможности метода в определении места и вида обструкции (90, 91). Левая парастернальная и апикальная по зиции в сечении по длинной оси позволяют хоро шо визуализировать выводной тракт левого желу дочка (35). При индивидуальном подборе сечений удается непосредственно лоцировать субаорталь ный стеноз и определить его анатомию. Данные ЭхоКГ хорошо коррелируют с данными инвазив ных методов диагностики (92).
Выраженность ГСД является основным факто ром, определяющим тяжесть гемодинамических расстройств и клиническое течение заболевания. Еще до широкого применения допплер ЭхоКГ для определения ГСД были предложены расчеты ГСД по ЭхоКГ показателям морфометрии левого желудочка, однако они не нашли широкого при менения, несмотря на неплохую корреляцию с данными инвазивных исследований. Формулу для определения ГСД между левым желудочком и аор той при врожденных стенозах устья аорты приме нили Gutgesell и соавторы (111):
|
225 + ЗСс |
|
ГСД = |
|
— АДсист, |
|
||
|
КСР |
|
где ЗСс — толщина задней стенки в систолу; КСР — конечно систолический размер; АДсист. — систолическое артериальное давле ние на руках в момент исследования; 225 — константа левожелудочкового пикового давле ния (93, 94).
Градиент систолического давления традицион но определяли при катетеризации сердца. По ве личине ГСД больные распределены на 3 клини ческие группы:
•I — с умеренным субаортальным стенозом (ГСД до 50 мм рт. ст.);
•II — с выраженным субаортальным стенозом (ГСД 50–80 мм рт.ст.);
•III — с резким субаортальным стенозом (ГСД свыше 80 мм рт. ст.) (2).
При импульсной допплер ЭхоКГ можно опре делить скорость кровотока в небольшом «конт рольном объеме». Возможность измерения высо ких скоростей в области обструкции ограничена максимально возможной частотой повторения
Глава 54. ПОДКЛАПАННЫЙ СТЕНОЗ АОРТЫ |
783 |
|
|
|
|
импульсов в используемой аппаратуре. Макси мальная скорость кровотока, или черта Найквис та, была равна 2 м/с, или, в перерасчете согласно уравнению Бернулли, — 16 мм рт. ст. При нахож дении «контрольного объема» в зоне потоков со скоростью выше черты Найквиста наблюдался aliasing эффект — искажение допплеровского спектра с появлением сигнала, направленного в противоположную сторону от реального (95).
Непрерывная допплер ЭхоКГ открыла новые возможности предоперационной неинвазивной диагностики субаортального стеноза, позволяю щей оценить его степень и показания к операции. Непрерывный режим давал возможность изме рить скорость кровотока до 8 м/с, или, в перерас чете на ГСД, — 256 мм рт. ст. (96).
Количественная оценка тяжести субаортально го стеноза с помощью допплер ЭхоКГ — одна из самых эффективных областей применения метода. При непрерывной допплер ЭхоКГ для измерения ГСД между левым желудочком и аортой необходи мо направить ультразвуковой луч точно по потоку стенотической струи. Поэтому у каждого пациента следует искать стенотическую струю из нескольких доступов: апикального, супрастернального и пра вого парастернального Поток через зону обструк ции может быть эксцентричным, и заранее невоз можно предсказать, какая позиция датчика будет оптимальной для расчета ГСД (96). Неточная ори ентация ультразвукового луча (под углом к стено тической струе) приводит к недооценке тяжести субаортального стеноза. Наибольшую скорость кровотока через субаортальный стеноз обычно удается зарегистрировать при исследовании из апикального или супрастернального доступа.
Градиент систолического давления, определя емый при катетеризации сердца, не полностью со ответствует ГСД, вычисляемому при допплер ЭхоКГ (96). Скорость кровотока через аортальный клапан, превышающая 4 м/с, указывает на выра женный аортальный стеноз; скорости ниже 3 м/с
— на нетяжелый стеноз (97), поэтому при субаор тальном стенозе допплер ЭхоКГ должна давать более высокие значения максимального ГСД меж ду левым желудочком и аортой, чем катетеризация полостей сердца.
Градиент систолического давления, определен ный при допплер ЭхоКГ, в среднем превышает таковой, определенный при катетеризации, на 6,7 мм рт. ст. При небольшой степени стеноза рас хождения между ГСД могут достигать 50%, а при выраженном стенозе при ГСД 100 мм рт. ст. ошиб ка не превышает 7 %. Тем не менее многие авторы демонстрируют очень высокую корреляцию мак
симальных ГСД, определенных при допплер ЭхоКГ и при катетеризации полостей сердца у больных со стенозами устья аорты.
В настоящее время ЭхоКГ имеет всеобщее признание в качестве наиболее точного метода ди агностики и оценки степени гипертрофии левого желудочка, особенно в повседневной клиничес кой практике. Наиболее простой метод выявления гипертрофии левого желудочка — измерение в од номерном режиме толщины межжелудочковой перегородки и задней стенки в диастолу. О нали чии гипертрофии левого желудочка говорят при толщине стенок более 1,1 см в диастолу (98,99). Однако использование линейных размеров тол щины стенок сердца может привести к неправиль ной оценки наличия и степени гипертрофии лево го желудочка, так как у одного и того же человека толщина стенок сердца зависит от диастолическо го наполнения левого желудочка. При сниженном диастолическом наполнении толщина стенок мо жет превышать норму при нормальной ММ, и на оборот, при дилатации левого желудочка стенки остаются тонкими даже при выраженном увеличе нии ММ (100).
Более точным признаком гипертрофии левого желудочка является увеличение ММ левого желу дочка, рассчитанной по данным одномерного ис следования. В основе метода лежит расчет объема миокарда по принципу формулы «возведения в куб» (101):
ММ — 1,047 х (КДР + МЖП + ЗС)3 — 1,047 х КДР3,
где КДР — конечно диастолический размер лево го желудочка; МЖП и ЗС — толщина межжелу дочковой перегородки и задней стенки левого желудочка в диастолу; 1,047 — удельная плот ность миокарда.
Восновном и по настоящее время для расчета
ММв одномерном режиме используется формула Devereux и Reichek (1977), которая была выведена на основании сопоставления результатов ЭхоКГ с данными ангиокардиографии и аутопсии (102). Многочисленные исследования информативнос ти одномерной ЭхоКГ для определения ММ обнаружили высокую корреляцию данных ЭхоКГ с инвазивными методами исследования и патоло гоанатомическими данными (103–105).
При расчете ММ в одномерном режиме необ ходимо помнить о неизбежности возникновения погрешности в измерении толщины стенок левого желудочка и его конечно диастолического разме ра, которые используются в расчетах ММ. Следует учесть, что при применении формулы «возведения
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
784 |
Часть 10. ПОРОКИ ВЫВОДНОГО ТРАКТА ЛЕВОГО ЖЕЛУДОЧКА |
|
|
|
|
в куб» даже небольшая погрешность в измерении исходных параметров приводит к «кубическому» увеличению ошибки в расчете ММ. Вследствие этой погрешности ММ, рассчитанная по одно мерной ЭхоКГ, может варьировать в пределах 8±3,5 г (8–15%). Возможные погрешности расче тов ММ необходимо принимать во внимание при оценке отдаленных результатах лечения. Различия значений ММ у одного больного, рассчитанные в разное время, могут ошибочно трактоваться как динамика показателя (74).
Сравнение показателей ИММ до и после про тезирования аортального клапана по поводу сте ноза аорты или пересадки почки у больных с арте риальной гипертензией свидетельствуют о значи тельном снижения ММ (до 150 г у некоторых больных) (100). Однако говорить о регрессии или о прогрессе ММ можно только в том случае, если динамика этого показателя будет превышать 10%, или 10 г/м2 (74, 106). В основном динамика ММ и гипертрофии левого желудочка исследована для оценки результатов терапевтического лечения ги пертонической болезни, и этот вопрос наиболее изучен в данной области (74,106).
Вопросы регрессии ММ и степени гипертро фии левого желудочка у больных с субаортальным стенозом после кардиохирургического лечения недостаточно освещены в литературе. Неясны сроки, в течение которых происходит достовер ная регрессия гипертрофии левого желудочка, не установлена зависимость степени регрессии гипе ртрофии левого желудочка от изначальной степе ни его гипертрофии. Неизвестно, происходит ли обратное развитие ММ у больных с выраженной степенью гипертрофии левого желудочка, с боль шим «стажем» порока и миокардиофиброзом.
Расчет ММ, так же как и объемов левого желу дочка, следует проводить только по данным двух мерного режима (100). Принцип всех формул оди наков: из общего объема левого желудочка вычита ют конечно диастолический объем и получают объем миокарда (107–109). Расчеты ММ в двух мерном режиме ММ показали более высокую кор реляцию с инвазивными методами по сравнению с одномерным режимом, так как учитываются все индивидуальные особенности геометрии левого желудочка (110). Расчет ММ в двухмерном режиме более сложен и трудоемок (46). Однако учитывая, что левый желудочек у больных с субаортальным стенозом имеет правильную геометрическую фор му, симметричную гипертрофию и не нарушенную секторальную сократимость, вполне допустимо применение для этих целей и одномерного режима под контролем двухмерной ЭхоКГ (110–112).
До сих пор нет единого мнения о том, при ка ких значениях ММ уже можно говорить о гипер трофии левого желудочка. Была выявлена зависи мость ММ от возраста, пола, роста и массы тела и даже от расы человека. При перерасчете ММ на площадь поверхности тела и выражении этого по казателя в виде ИММ (г/м2) индивидуальные раз личия в определенной степени нивелируются. В норме ИММ составляет < 100 г/м2 (46).
Несмотря на то что информативность методов расчетов объемов левого желудочка и фракция выброса, особенно по двухмерной ЭхоКГ, нес колько выше, чем по наиболее распространенно му одномерному ЭхоКГ методу Teichholz, в совре менной литературе по прежнему широко встреча ются исследования как морфометрии левого желу дочка и его гемодинамики, так и расчеты показа телей гипертрофии левого желудочка, основанные на простом и удобном для повседневного практи ческого применения методе одномерной ЭхоКГ.
Метод тканевого допплеровского исследова ния (ТДИ) — это новая ЭхоКГ технология иссле дования сократимости миокарда и скорости его сокращения. В последнее время широко применя ется для изучения общей и секторальной сократи мости левого желудочка (113, 114). Однако прове денные зарубежными авторами сравнительные исследования максимальной скорости сокраще ния миокарда, определенной классическим одно мерным методом и при ТДИ у здоровых лиц, тес но коррелируют между собой (r = 0,87; p < 0,001) (115). В тех случаях, когда отсутствует нарушение сократительной способности миокарда (а у боль шинства больных с субаортальным стенозом сок ратимость хорошая и даже наблюдается гиперки незия стенок левого желудочка), преимуществ у метода ТДИ перед одномерным режимом нет.
ЕСТЕСТВЕННОЕ ТЕЧЕНИЕ
В большинстве сообщений указано, что возраст больных с субаортальным стенозом не превышает 18 лет (26, 28, 52). Еще в 1959 г. Brock предполо жил, что субаортальный стеноз — порок, который без лечения заканчивается летально еще в подро стковом возрасте. После 35 лет он встречается ред ко, так как быстро прогрессирует, без операции до этого возраста доживают только отдельные боль ные или же сам порок приобретает черты вторич ной гипертрофической кардиомиопатии с мио кардиальной недостаточностью (27, 28, 40, 116). Тем не менее Sung и соавторы (1978) сообщают данные о достаточно большой группе взрослых пациентов — 36 из 138 больных с субаортальным
Глава 54. ПОДКЛАПАННЫЙ СТЕНОЗ АОРТЫ |
785 |
|
|
|
|
|
|
|
стенозом: 30 человек были в возрасте от 18 до 50 |
ности аортального клапана зависит от возраста па |
|
лет и 6 — от 50 до 65 лет. В опубликованных сери |
циента на момент операции, величины доопера |
|
ях хирургических вмешательств по поводу изоли |
ционного градиента, наличия кардиомегалии и |
|
рованной формы субаортального стеноза возраст |
применения миэктомии (119). Устранение субаор |
|
самых младших пациентов составлял от 3 до 6 лет, |
тального стеноза уменьшает выраженность аор |
|
и операций практически не делали после 30 лет. |
тальной недостаточности у 86% пациентов с ее на |
|
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ |
личием до операции (120). С другой стороны, не |
|
которые хирурги не нашли никакой пользы от |
||
|
|
операций на ранних стадиях развития гемодина |
Показания к операции. Единственным эффек |
мических нарушений (121). |
|
тивным методом лечения субаортального стеноза |
Тактика хирургического лечения субаорталь |
|
является его хирургическое устранение. Однако |
ного стеноза зависит от анатомической формы по |
|
четкие общепризнанные показания к операции до |
рока. Наиболее «удобным» вариантом для хирур |
|
сих пор не разработаны. Это объясняется многооб |
гического лечения является стеноз в виде дискрет |
|
разием вариантов клинического течения заболева |
ной фиброзно мышечной диафрагмы. В некото |
|
ния и отсутствием связи между объективными по |
рых случаях может применяться оперативное ле |
|
казателями состояния больного и его субъектив |
чение в виде рентгенэндоваскулярной дилатации |
|
ными ощущениями. С одной стороны, учитывая |
(РЭД) стеноза. При диффузной обструкции (тун |
|
прогрессирующее течение порока, сопровождаю |
нельная форма) или при многоуровневой обструк |
|
щееся более выраженными по сравнению с други |
ции выводного тракта левого желудочка и неком |
|
ми видами врожденных стенозов аорты нарушени |
петентности аортального клапана вышеуказанные |
|
ями, было бы желательно как можно раньше осу |
показания сохраняются, но для каждого пациента |
|
ществлять операцию. С другой стороны, высокий |
важна конкретная морфология. Обычная резек |
|
процент рецидивов и необходимость выполнения |
ция неэффективна, и обструкция часто возврат |
|
повторных операций заставляют более тщательно |
ная. В этих случаях показаны сложные пластичес |
|
определять показания к операции (27, 117). |
кие операции: изолированная аортовентрикулоп |
|
Основным показанием к хирургическому вме |
ластика, операции по методу Коnno или их моди |
|
шательству при этом является наличие ГСД на |
фикации, а также трансплантация собственного |
|
уровне обструкции более 50 мм рт. ст. (2, 16). При |
легочного клапана в аортальную позицию |
|
значительно выраженном стенозе (ГСД больше 80 |
(122–125). |
|
мм рт. ст.) показания к операции абсолютные. |
При сочетании субаортального стеноза с |
|
При ГСД от 50 до 80 мм рт. ст. вопрос о необходи |
ДМЖП устранение первого показано при меньшем |
|
мости оперативного лечения решается индивиду |
ГСД (24). Учитывая прогрессирующее течение по |
|
ально. Существенное значение в определении по |
рока, необходимо устранять стеноз через ДМЖП, |
|
казаний во всех спорных случаях имеют выражен |
даже если ГСД составляет 15–20 мм рт. ст. (12). |
|
ность гипертрофии левого желудочка и клиничес |
|
|
ких проявлений. При наличии головокружения, |
Виды вмешательств |
|
боли в области сердца и гипертрофии левого желу |
|
|
дочка по данным ЭКГ, а так же при прогрессиро |
Транслюминальная баллонная дилатация |
|
вании субаортального стеноза или тенденции к |
|
|
развитию левожелудочковой недостаточности |
Метод РЭД был применен как малоинвазивная |
|
операция показана. Выжидательная тактика реко |
альтернатива для снижения ГСД при дискретном |
|
мендуется при отсутствии клинических проявле |
субаортальном стенозе (52). С момента первого со |
|
ний, даже если ГСД больше 50 мм рт. ст. В этих |
общения ряд авторов (25, 28, 126) подтвердили ус |
|
случаях и при незначительной обструкции (ГСД |
пешное применение метода РЭД при дискретном |
|
меньше 50 мм рт. ст.) показаны повторные ЭхоКГ |
субаортальном стенозе у детей и молодых пациен |
|
обследования каждые 6 мес в связи с возможным |
тов. Если сопутствующая аортальная недостаточ |
|
быстрым прогрессированием стеноза (27). |
ность свыше 2+ служит противопоказанием для |
|
Выжидательная тактика не получила абсолют |
баллонной вальвулопластики клапанного стеноза |
|
ного признания. Многие авторы считают, что ран |
аорты, то субаортальный стеноз в виде подклапан |
|
ние вмешательства при градиенте менее 40 мм рт. |
ной мембраны может быть устранен методом бал |
|
ст. могут предотвратить рецидив стеноза и прог |
лонной вальвулопластики, несмотря на аортальную |
|
рессирование деформации аортального клапана |
недостаточность. Регургитация даже свыше 2+ не |
|
(118). Было показано, что вероятность недостаточ |
является противопоказанием, так как воздействие |
|
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
786 |
Часть 10. ПОРОКИ ВЫВОДНОГО ТРАКТА ЛЕВОГО ЖЕЛУДОЧКА |
|
|
|
|
оказывается не на полулунные створки, а на мемб рану (12, 127). Рентгенэндоваскулярная дилатация неэффективна при субаортальном стенозе в виде фиброзно мышечного воротника и туннеля (25). Метод применяется для устранения только мембра нозной формы порока при ГСД больше 50 мм рт. ст., ЭКГ признаках гипертрофии левого желудоч ка, наличии жалоб на одышку, головокружение и потерю сознания, болевой синдром. (128, 129). Учитывая прогрессирующее течение субаортально го стеноза и относительно малое количество ослож нений при РЭД, ряд авторов рекомендуют исполь зовать метод и при умеренно выраженной стадии порока с ГСД меньше 50 мм рт. ст. (130, 131).
По мнению ряда авторов, снижение ГСД после РЭД практически одинаково эффективно как при клапанном стенозе, так и при подклапанной фиб розной диафрагме (на 70% и 60% соответственно). Кроме того, у всех больных с сопутствующей аор тальной недостаточностью и без нее после РЭД степень недостаточности не изменилась или же она не возникла, т. е. наличие аортальной недоста точности не является противопоказанием к РЭД мембранозной формы стеноза (128, 129). При РЭД происходит разрыв мембраны, в ряде случаев до ее основания. Оценка эффективности РЭД прово дится по данным непосредственного инвазивного исследования и по данным допплер ЭхоКГ (127, 132, 133). При этом может наблюдаться различие показателей ГСД, полученных инвазивно непос редственно после РЭД и при допплер ЭхоКГ, что объясняется нарушениями гемодинамики в мо мент вальвулопластики, не проходящими к мо менту завершения процедуры. Контрольную допплер ЭхоКГ необходимо проводить не ранее чем через 2 сут после РЭД в условиях полного вос становления функционального состояния мио карда (128).
Резекция дискретного подклапанного стеноза аорты
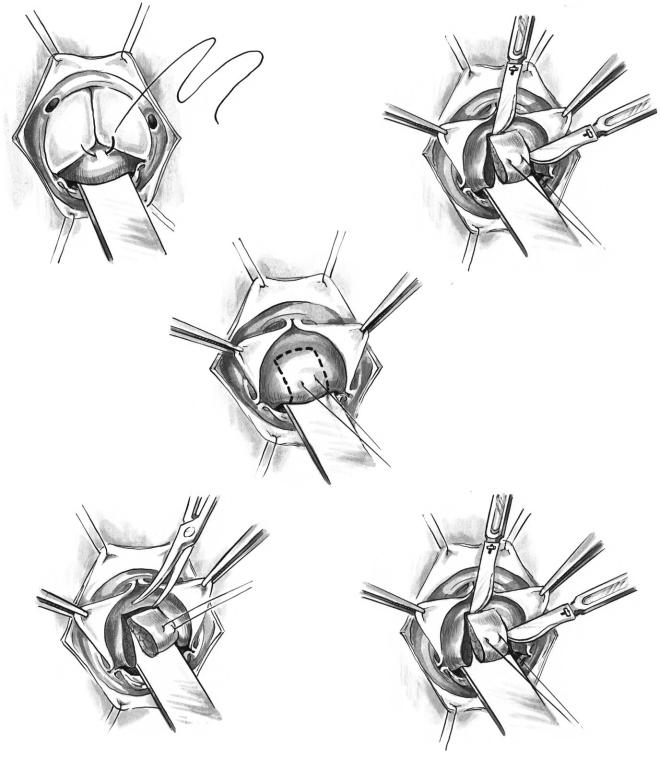
При субаортальном стенозе в виде фиброзно мышечной диафрагмы или воротника применяет ся резекция дискретного подклапанного стеноза аорты в условиях искусственного кровообраще ния. Операцию выполняют через поперечный раз рез аорты (рис. 3, а). Фиброзно мышечный гре бень экспонируют, крючками или мягким оконча тым зажимом отводя створки клапана. Скальпе лем производят два разреза фиброзно мышечного гребня, один из которых проводят ниже комиссу ры между левой и правой коронарными створками и другой — ниже центра правой коронарной
створки (рис. 3, б, в). Митральный клапан защи щают плоским крючком. Миокард перегородки удаляют, глубоко внедряясь в межжелудочковую перегородку между двумя разрезами. Проводящие пути находятся около мембранозной перегородки, которую нужно идентифицировать. Слишком глу бокое рассечение межжелудочковой перегородки чревато возникновением блокады и ДМЖП, хотя миэктомия перегородки улучшает результат опе рации и снижает вероятность рецидива. Далее, двигаясь по часовой стрелке, отсекают фиброзный гребень от перегородки (не внедряясь в нее) и от передней створки митрального клапана (рис. 3, г, д). Агрессивная резекция в области митрального клапана сопряжена с риском ее перфорации. Если мембрана тесно связана с основанием створок аортального клапана и переходит на септальную створку митрального клапана, убирают только фиброзную диафрагму или валик, сбривая его со створки или митрально аортального кольца скальпелем. У большинства взрослых пациентов фиброзная диафрагма может быть вылущена из подлежащей мышечной ткани тупым путем.
Операция может осложниться возникновением ДМЖП, полный блокады и недостаточности аор тального клапана в случае повреждения створок. Появление ятрогенного ДМЖП может быть запо дозрено по систолическому дрожанию на перед ней стенке правого желудочка, скачку сатурации крови на уровне желудочка и подтверждено внут риоперационной ЭхоКГ. Закрытие такого дефекта сопровождается повышенным риском полной AV блокады. У пациентов с выраженной аортальной недостаточностью и подклапанным стенозом ре зекция субаортального сужения может быть вы полнена как часть операции транслокации собственного легочного клапана в аортальную по зицию.
Летальность при этой операции приближается к нулю (16, 117). Рецидив субаортального стеноза возникает у 15–20% больных.
Модифицированная операция Коnnо
При наличии туннельной формы субаорталь ного стеноза, когда обструкция имеет диффузный характер, в сочетании с гипоплазией кольца аор тального клапана или с недостаточностью аор тального клапана показана более радикальная операция, чем простое иссечение фиброзных тка ней и частичная миотомия. Такой операцией яв ляется операция Ross–Konno или классическая операция Konno с протезированием аортального клапана (см. гл. 52).
Глава 54. ПОДКЛАПАННЫЙ СТЕНОЗ АОРТЫ |
787 |
|
|
|
|
а
б
в
г
д
Рис. 3. Резекция субаортального фиброзно мышечного гребня
Аортовентрикулопластика без протезирования |
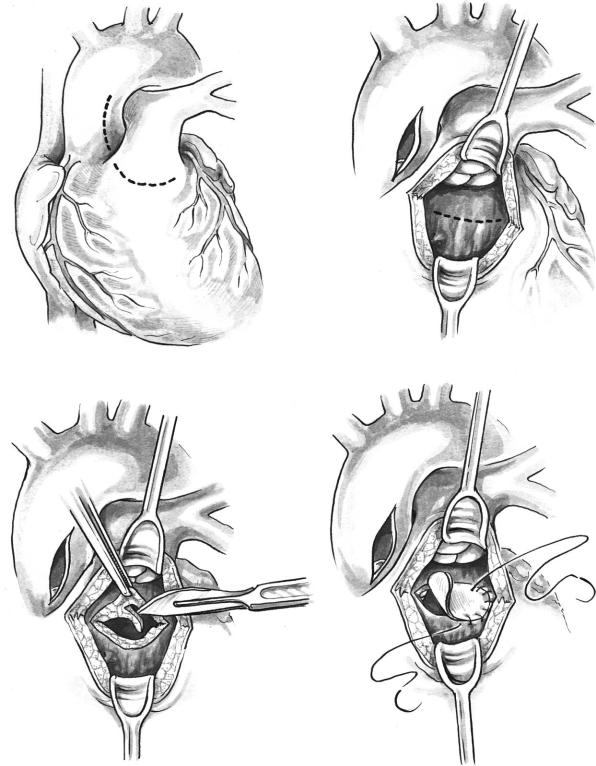
Восходящую аорту открывают через короткий |
аортального клапана является модификацией опе |
продольный разрез в направлении к межкоронар |
рации Коnnо (122, 124, 125, 134). Она выполняется |
ной комиссуре для оценки клапана и выбора мес |
при тяжелом или рецидивирующем дискретном |
та разреза межжелудочковой перегородки (рис. 4, |
субаортальном стенозе, а также при туннелевид |
а). Производят поперечный разрез в инфундибу |
ном стенозе с нормальным аортальным клапаном |
лярном отделе правого желудочка, направляя его |
при отсутствии гипоплазии клапанного кольца |
в сторону межкоронарной комиссуры навстречу |
(16, 135). |
разрезу аорты. Изогнутый зажим вводят в левый |
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
788 |
Часть 10. ПОРОКИ ВЫВОДНОГО ТРАКТА ЛЕВОГО ЖЕЛУДОЧКА |
|
|
|
|
б
а
в |
|
г |
|
|
|
Рис. 4. Модифицированная операция Konno
желудочек через аортальный клапан. Кончиком зажима определяют место разреза межжелудочко вой перегородки. Выполнение разреза может ока заться непростым из за резкого утолщения пере городки. Зажим в левом желудочке позволяет удерживать края разреза в несомкнутом состоя
нии. Продлевают разрез перегородки в направле нии межкоронарной комиссуры аортального кла пана. Идеальным вариантом является продолже ние разреза кверху в комиссуральный треуголь ник между коронарными створками выше осно вания соответствующих синусов. Действовать
Глава 54. ПОДКЛАПАННЫЙ СТЕНОЗ АОРТЫ |
789 |
|
|
|
|
|
|
|
следует очень осторожно, чтобы не повредить |
РЕЗУЛЬТАТЫ |
|
створки. Далее разрез продлевают влево до ниж |
ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ |
|
него конца туннеля. Он должен проходить парал |
|
|
лельно направлению выводного тракта левого же |
Ранняя (госпитальная) смертность при мемб |
|
лудочка (рис. 4, б) кпереди и влево от мышцы |
ранозной и фиброзно мышечной форме порока |
|
Lancisi, чтобы избежать полной блокады или |
достаточно низка и в последние годы приближает |
|
центральной блокады правой ножки пучка Гиса. |
ся к нулю. По данным Kirklin (136), при существу |
|
Важно также, чтобы разрез не прошел по перед |
ющей методике послеоперационные осложнения |
|
ней трабекулярной мышечной перегородке. Фиб |
редки. При соблюдении техники операции можно |
|
розно мышечные компоненты стеноза макси |
избежать основных осложнений: пересечения |
|
мально иссекают только со стороны верхнего края |
проводящих путей сердца, возникновения арти |
|
разреза (рис. 4, в), чтобы не повредить проводя |
фициального ДМЖП, митральной или аорталь |
|
щую систему при опасной попытке резекции по |
ной недостаточности. В серии операций, прове |
|
нижнему краю разреза. Необходимо иссечь до |
денных 78 пациентам, описан всего 1 случай пол |
|
полнительную фиброзную ткань, которая может |
ной AV блокады и 1 — появления артифициаль |
|
простираться на переднюю створку митрального |
ного ДМЖП (136). В комбинированных сериях |
|
клапана. |
операций, по данным различных авторов, леталь |
|
Разрез межжелудочковой перегородки (перед |
ность составляет около 2–3% (137, 138). При вме |
|
няя стенка выводного тракта левого желудочка) |
шательствах в раннем возрасте смертность дости |
|
закрывают заплатой из Gorе Tex или дакрона |
гает 20%, однако следует учитывать, что необходи |
|
(рис. 4, г). Выводной тракт левого желудочка рас |
мость в операции в этом возрасте возникает толь |
|
ширяется за счет расхождения краев разреза меж |
ко при клинически тяжелых формах порока и, как |
|
желудочковой перегородки. Заплату фиксируют |
правило, при диффузных формах субаортального |
|
отдельными матрацными швами с прокладками, |
стеноза (16). Морфология стеноза определяет тя |
|
особенно тщательно у нижнего края разреза, где |
жесть порока и однозначно является доминирую |
|
он близко подходит к передней трабекулярной |
щим фактором риска. При гипоплазии левого же |
|
мышечной перегородке. |
лудочка и резкой обструкции его выводного трак |
|
Разрез аорты ушивают или при необходимости |
та риск оперативного лечения крайне высок (139). |
|
закрывают заплатой из аутоперикарда, обработан |
Обширные операции, такие, как аортовентрику |
|
ного глютаральдегидом. Вентрикулярный разрез |
лопластика Коnnо или Rastan, сопровождаются |
|
также закрывают заплатой из перикарда или поли |
более высокой смертностью — от 8 до 34%, осо |
|
тетрафлюороэтилена швами из того же материала. |
бенно при использовании методики у младенцев и |
|
|
|
детей младшего возраста (140). |
Операция RossñKonno |
Отдаленные результаты также зависят от вида |
|
|
|
операции. Более 15 лет после операции живут |
Операция была предложена для детей раннего |
85–95% пациентов, оперированных по поводу |
|
возраста Clarke в 1978 г. и сочетала протезирование |
дискретного субаортального стеноза (137, 141, |
|
корня аорты клапансодержащим аортальным ал |
142). Вовремя проведенное хирургическое лечение |
|
лографтом с реимплантацией коронарных артерий |
дает хорошие функциональные результаты в отда |
|
и иссечением субаортального стеноза. Эта опера |
ленном периоде. Так, 31 (82%) больной из 38 вы |
|
ция показана при туннельной форме субаорталь |
живших и прооперированных пациентов относит |
|
ного стеноза в сочетании с гипоплазией корня аор |
ся к I классу по NYHA и 7 (16%) — ко II классу |
|
ты у детей раннего возраста, когда протезирование |
(136). Операция приводит к существенному сни |
|
аортального клапана невозможно. Расширения |
жению ГСД, который у большинства пациентов |
|
подклапанной области и клапанного кольца вы |
остается незначительным. У некоторых пациентов |
|
водного тракта левого желудочка можно достичь с |
отмечается увеличение ГСД на протяжении 5–10 |
|
помощью биологического или искусственного ма |
лет послеоперационного периода (29, 142). |
|
териала, а также клапанным аллографтом восходя |
|
|
щей аорты или аутографтом легочной артерии (16). |
Рестеноз после устранения |
|
|
|
субаортального стеноза |
|
|
Рестенозирование наблюдается у значительно |
|
|
го числа больных как после РЭД, так и после хи |
|
|
рургического устранения стеноза (142–144). Так |
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
790 |
Часть 10. ПОРОКИ ВЫВОДНОГО ТРАКТА ЛЕВОГО ЖЕЛУДОЧКА |
|
|
|
|
при РЭД обрывки мембраны остаются в выводном |
шает отдаленную выживаемость и снижает часто |
тракте левого желудочка, предполагалось, что |
ту рестеноза и аортальной недостаточности (150, |
риск и частота рестеноза должны быть выше (145). |
151). Из 16 детей, у которых Roughneen и соавторы |
Однако процент рестенозов при двух методах ле |
(150) выполнили модифицированную операцию |
чения примерно одинаков и варьирует в пределах |
Konno, один ребенок через 7 лет оперирован пов |
от 20 до 50% в отдаленном периоде (129, 141, 142). |
торно по поводу остаточного стеноза выводного |
Наиболее распространенная операция — резекция |
тракта левого желудочка и один ожидает операции |
субаортальных фиброзных тканей — хорошо раз |
в связи с недостаточностью клапана, не связанной |
работана и широко применяется, имеет низкую |
с предшествующим расширением конуса. У дру |
летальность. Однако при этом не устраняется ряд |
гих авторов (152) из 46 пациентов (средний воз |
факторов, приводящих к формированию рециди |
раст 5 лет), оперированных повторно по поводу |
ва, так как сохраняется турбулентность кровотока |
сложных и туннельных форм субаортального сте |
в выводном тракте левого желудочка (125). Разви |
ноза, модифицированная операция Konno приме |
тие рецидива субаортального стеноза после резек |
нена у 15 больных, классическая операция Konno |
ции субаортальных фиброзно мышечных тканей |
— у 3, Ross–Konno — у 2 и резекция конусной пе |
при его дискретных формах наблюдается более |
регородки — у 12. Летальных исходов не было. Ни |
чем у 30% больных (141). Его точное появление по |
в одном случае не возникла блокада и не увеличи |
времени и факторы риска еще недостаточно опре |
лась аортальная недостаточность. Свободными от |
делены. Рецидив субаортального стеноза морфо |
рецидива аортального стеноза к первому году пос |
логически неотличим от первичного, если его |
ле операции были 100% пациентов, к 3 му — 94 % |
возвратная природа не была задокументирована |
и к 5 му — 86%. Авторы подчеркивают преимуще |
(146). Особенно часто это наблюдается при анато |
ство модифицированной операции Konno перед |
мических аномалиях устья аорты: гипоплазии |
классической операцией Konno и операцией Ross, |
устья аорты, удлиненном выводном тракте левого |
так как при ней не требуется применение механи |
желудочка, большом аортосептальном угле и рас |
ческого клапана или гомографта и сохраняется |
ширенном митрально аортальном контакте (22). |
функция клапана. |
Некоторые авторы считают, что повторное разви |
|
тие субаортального стеноза является не рециди |
Недостаточность аортального клапана |
вом, а остаточным резидуальным стенозом, имею |
|
щим место после нерадикального устранения об |
Недостаточность аортального клапана в отда |
турирующих тканей (147, 148). В отдаленном пе |
ленном периоде, по данным клиники Mayo (153), |
риоде сужение, как правило, имеет диффузный ха |
отмечается у 26% пациентов, но обычно она не |
рактер и повторное кардиохирургическое вмеша |
выраженна. У пациентов с дискретным аорталь |
тельство требует расширенной резекции. Наибо |
ным стенозом частота возникновения отдален |
лее эффективна для этих целей модифицирован |
ной недостаточности аортального клапана зави |
ная операция Коnnо — аортовентрикулопластика |
села от объема резекции подклапанных структур: |
(149). Операция конусного расширения с сохране |
у 38,6% больных она возникла после изолирован |
нием аортального клапана возможна при условии |
ной мембранэктомии, у 27,8% — после мембра |
нормальных размеров аортального кольца, когда |
нэктомии и миотомии и только у 7,3% — после |
гипоплазия не распространяется на устье аорты, и |
мембранэктомии и миэктомии. Протезирование |
интактном аортальном клапане (125, 148). Кроме |
аортального клапана потребовалось только 3,5% |
того, эту операцию можно использовать и при |
пациентам. |
мембранозной форме порока для профилактики |
Недостаточность аортального клапана чаще |
рецидивов (149). |
выражена после операции, чем до нее (154). |
Результаты простой резекции у пациентов с вы |
|
раженным туннельным субаортальным стенозом |
|
были проиллюстрированы исследованиями Wright |
|
и соавторов (28), показавших, что у пациентов |
|
этой категории средний ГСД, составлявший 102 |
|
мм рт. ст., снизился всего до 72 мм рт. ст. Это зна |
|
чительно худший результат, чем был достигнут у |
|
пациентов с мембранозным субаортальным стено |
|
зом (52±40 мм рт. ст.). В этом случае очевидны |
|
преимущества операции Коnnо, так как она улуч |
|
Глава 54. ПОДКЛАПАННЫЙ СТЕНОЗ АОРТЫ |
791 |
|
|
|
|
Литература
1.Freedom RM. The long and the short of it: Some thoughts about the fixed forms of left ventricular outflow tract obstruction. J Am Coll Cardiol 1997; 30: 1843–1846.
2.Гетманский В.Н. Современные подходы к хирургическому лечению врожденного стеноза аорты и полученные результаты // Автореф. дис… д!ра мед. наук.– М., 1984. – 30 c.
3.Махкамова М.Н. Клиника, диагностика и дифференциальная диаг! ностика врожденных стенозов аорты и идиопатического гипертро! фического субаортального стеноза // Автореф. дис… д–ра мед. на! ук.– М., 1986. – 28 с.
4.Brounwald E., Goldblatt A., Aygen M.M. et al. Congenital aortic steno! sis. 1. Clinical and hemodynamic findings in 100 patients. II. Surgical treatment and the results of operation // Circulation.–1963.– 27: 426–462.
5.Gutgesell H.P., Smith D., McDaniel N.L.: Internal consistency of echocardiographic estimates of the severity of left ventricular outflow obstruction //J. Am. Soc. Echo.–1989.–.2:88.
6.Keith J.D., Rove R.D., Vlad P. Heart disease in infancy and childhood (second edition). New–York, MacMillian.–1967.– p. 250.
7.McGoon D.C., Geha A.S., Scofield E.L. et al. Surgical treatment of con! genital aortic stenosis// Dis. Chest.–1969.– 55:388–394.
8.Lillehei C.W., Bonnabeau R.C.Jr., Sellers R.D. Subaortic stenosis, diag! nostic criteria, surgical approach, and late follow–up in 25 patients // J. Thorac. Cardiovasc. Surg.–1968.–55:94–104.
9.Pyle R.L., Patterson D.F., Chacko S. The genetics and pathology of dis! crete subaortic stenosis in the new!foundland dog // Am. Heart J.–1976.– 92:324–334.
10.Abdallah H, Toomey K, O'Riordan AC, Davidson A, Marks LA. Familial occurrence of discrete subaortic membrane. Pediatr Cardiol 1994; 15: 198–200.
11.Richardson ME, Menahem S, Wilkinson JL. Familial fixed subaortic stenosis. mt J Cardiol 1991; 30: 35 1–3.
12.Petsas AA, Anastassiades LC, Constantinou EC, Antonopoulos AG. Familial discrete subaortic stenosis. Clin Cardiol 1998; 21: 63–5.
13.Vogt J., Dische R., et al. Fixed subaortic stenosis: an acquired second! ary obstruction? A twenty–seven year experience with 168 patients // Thorac. Cardiovasc. Surg.–1989.–37:199.
14.Rosenquist G.C., Clark E.B., McAllister H.A., Bharati S., Edwards J.E. Increased mitral–aortic separation discrete subaortic stenosis //Circulation.–1979.– 60:70–74.
15.Cyhi J.Y., Sullivan I.D. Fixed subaortic stenosis: anatomical spectrum and nature of progression. // Br Heart J.– 1991.– 65:280.
16.Castaneda A.R., Jonas R.A., Mayer J.E., Hanley F.L. Cardiac surgery of the neonate and infant. W.B. – Saunders Company, Philadelphia. – 1994. – p.506.
17.Leichter D.A., Sullivan I., Gersony W.M. Acquired discrete subaortic stenosis: natural history and hemodynamics // J. Am. Coll Cardiol. – 1989. – 14:1539–1544.
18.Shone J. D., Seller R. D., Anderson R.C., Adams P.Jr., Lillehei C.W., EdwardsJ.E. The development complex of "parachute mitral valve", supravalvar mitral ring of left atrium, subaortic stenosis and coarcta! tion of the aorta //Am. J. Cardiol.–1963.– 11:714.
19.Adyanthaya A.V., Price E.C., Miller G.V., et al. Membranous subvalvular aortic stenosis in tubular sclerosis // Chest. – 1972. – Vol. 61. – P.407– 408.
20.Gewillig M, Daenen W, Dumoulin M, van der Hauwaert L. Rheologic genesis of discrete subvalvular stenosis: a Doppler echocardiographic study. J Am Coll Cardiol 1992; 19: 818–24.
21.Gewilling M., Daenen W., Dumoulin M., Van Der Hauwaert L. Rheologic Genesis of discrete subvalvular aortic stenosis: A doppler echocardio! graphic study. //J Am Coll Cardiol.–1992.– 19:818.
22.Kleinert S., Geva T. Echocardiographic morphometry and geometry of the left ventricle outflow tract in fixed subaortic stenosis // J. Am. Coll.Cardiol.–1993.– 22:1501.
23.Kothari SS, Iyer KS. Anomalous muscle bundle in the left References: Chapter 14C ventricle causing subaortic stenosis. Cardiol Young 1996; 6: 100–1.
24.Chung K.J., Fulton D.R., Kriedberg M.B., Payne D.D., Cleveland R.J. Combined discrete subaortic stenosis and ventricular septal defect in infants and children // Am. J. Cardiol.–1984.– 53:1429.
25.Hardesty R.L., Griffith B.P., Matthews R.A., Siewers R.D., Neches W.H., Park S.C., Bahnson H.T. Discrete subvalvular aortic stenosis. An eval! uation of operative therapy// Thorac. Cardiovascular Surg. – 1977. – 74: 352–361.
26.Kelly D.T., Wulfsberg E., Rowe R.D. Discrete Subaortic Stenosis//Circulation.–1972.–46: 309–322.
27.Vogt J., Rupprath G., de Vivie R., Beuren A.J. Discrete Subaortic Stenosis: the value of cross–sectional sector echocardiography in eval! uation different types of obstruction // Ped. Cardiol.– 1983.– Vol. 4, No.4.– 253–258.
28.Wright G.B., Keane J.F., et al. Fixed subaortic stenosis in the young: medical and surgical course in 83 patients //Am. J. Cardiol.–1983.– 52:830–8.
29.De Vries AC, Hess J, Witsenburg M, Frohn!Mulder IME, Bogers JJS, Bos E. Management of fixed subaortic stenosis: a retrospective study of 57 cases // J Am Coll Cardiol. – 1992. – 19: 1013–1017.
30.Дыкуха С.Е., Наумова Л.Р., Гутовский В.В., Тодуров Б.М., Исаенко В.В., Кнышов Г.В. О хирургическом лечении сочетаний коарктации аорты и субаортального стеноза // Серцево!судинна хірургія.– К., 1999.– №7. – С. 97.
31.Chietlin M.D., Robinowitz M., et al. The distribution of fibrosis in the left ventricle in congenital aortic stenosis and coarctation of the aorta //Circulation.–1980.– 62:823.
32.Freedom R.M., Fowler R.S., Duncan W.J.: Rapid evolution from "nor! mal" left ventricular outflow tract to fatal subaortic stenosis in infancy// Br. Heart J.–1981.–45:605–609.
33.Ben!Shchar G., Moller J.H., Casteneda W., Edwards J.E. Signs of mem! branous subaortic stenosis appearing after correction of persistent com! mon atrioventricular canal //Am. J. Cardiol. – 1981. – Vol.48. P. 340.
34.Freed M.D., Rosenthal A., Plauth W.H. Jr, Nadas A.S. Development of subaortic stenosis after pulmonary artery banding// Circulation.– 1973.
– 47/48 (Suppl III):III.
35.Khan M.M., Varma M.P.S., Cleland J., O'Kane H.O., Webb S.W., Mulholland H.C., Adgey A.A.J.: Discrete subaortic stenosis//Br. Heart J.–1981.– 46:421–431.
36.Taylor N.C., Somerville J.: Fixed subaortic stenosis after repair of ostium primum defects // Br. Heart J.–1981.– 45:689.
37.Vogel M., Freedom RM., Brand A., Trusler GA., Williams WG., Rowe RD. Ventricular septal defect and subaortic stenosis // Am J Cardiol.– 1983.– 52:1258–1263.
38.Cape EG, Vanauker MD, Sigfusson G, Tacy TA, del Nido P1 Potential role of mechanical stress in the etiology of pediatric heart disease: septal shear stress in subaortic stenosis// J Am Coll Cardiol 1997; 30: 247–54.
39.Sung C!S., Price E.C., Cooley D.A. Discrete Subaortic Stenosis in Adults //Am. J. Cardiol.– 1978.–42:283–290.
40.Katz N.M., Buckley M.J., Liberthson R.R.: Discrete membranous subaortic stenosis. Report of 31 patients, review of the literature, end delineation of management// Circulation.–1977.– 56:1034.
41.Krueger SK, French JW, Forker AD, Caudill CC, Popp RL: Echocardiography in discrete subaortic stenosis // Circulation. –1979.–59:506.
42.Werner JC, Gewitz MH, et al. Real time echocardiography (RTE) in dis! crete membranous subaortic stenosis (DMSS) (abstr) // Circulation–1978.– 57,58 (suppl JJ): 51.
43.Weyman AE, Feigenbaum H, et al. Localization of left ventricular out! flow tract obstruction by cross–sectional echocardiography // Am J Med.– 1976.– 60:33.
44.Maron BJ, Redwood DR, Roberts WL. Henry WL, Morrow AG, Epsiein SE. Tunnel subaortic stenosis. Left ventricular outflow tract obstruction produced by fibromuscular tubular narrowing//Circulation.–1976.– 54:404.
45.Frommelt M.A., Snider A.R., Bove EX., Lupinetti F.M. Echocardiographic assessment of subvalvular aortic stenosis before and after operation// J. Am. Coll. Cardiol.– 1992.–19:1018–23.
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
