
4 курс / Общая токсикология (доп.) / Врожденные пороки сердца
.pdf672 |
Часть 8. ПОРОКИ ВЫВОДНОГО ТРАКТА ПРАВОГО ЖЕЛУДОЧКА |
|
|
|
|
Литература
1.Fallot A. Contribution a l'anatomie pathologique de la maladie bleue (cyanose cardiaque). Marseille Med 1888; 25: 77–403.
2.Steno N. Embryo monstro affinis Parissis dissectus. Acta Hafniensia 1673; 1: 300–3.
3.Sandifort E. Observationes anatomico pathologicae caput primum. Eyk et Vygh, Lugduni Batavorum 1777: 1–38.
4.Bennett LR. Sandifort's observations. Chapter 1, concerning a very rare disease of the heart. 1 Tetralogy of Fallot or Sandifort? Bull Hist Med 1946; 20: 539–70.
5.Hunter W. Three cases of mal conformation in the heart. Med Obs Inquiries 1784; 6: 299–304.
6.Taussig HB. Neuhauser lecture. Tetralogy of Fallot: early history and late results. AJR 1979; 133: 423–31.
7.Abbott ME, Dawson WT. The clinical classification of congenital cardiac disease. Int Clin 1924; 4: 156–88.
8.Blalock A, Taussig HB. The surgical treatment of malformations of the heart in which there is pulmonary stenosis or pulmonary atresia. JAMA 1945; 128: 189–92.
9.Gross RE, Hubbard JP. Surgical ligation of a patent ductus arteriosus: report of first successful case. Am Med Assoc J 1939; 112: 729–31.
10.Waugh D. Canadian Medical Lives. Maudie of McGill. Dr. Maude Abbott and the Foundations of Heart Surgery. Toronto and Oxford: Hannah Institute and Dundurn Press, 1992.
11.MacDermot HE. Maude Abbott. A Memoir. Toronto: Macmillan, 1941.
12.Bauer DD, Astbury EC. Congenital cardiac disease: bibliogra phy of the 1,000 cases analyzed in Maude Abbott's Atlas with an index. Am Heart J 1944; 27: 688–732.
13.Keith JD, Rowe RD, Vlad P. Heart Disease in Infancy and Childhood. 3rd ed. New York: Macmillan, 1978:476.
14.Hoffman JI. Incidence of congenital heart disease: II. Prenatal inci dence. Pediatr Cardiol 1995; 16: 155–65.
15.Hoffman JI. Incidence of congenital heart disease: I. Postnatal inci dence. Pediatr Cardiol 1995; 16: 103–13.
16.Keith JD. Prevalence, incidence, and epidemiology. In: Keith JD, Rowe RD, Vlad P, eds. Heart Disease in Infancy and Children, 3rd edn. New York: Macmillan, 1978: 3–13.
17.Pierpont MEM, Moller JH. Genetics of Congenital Heart Disease. Boston: Martinus Nijhoff, 1987: 374.
18.Nora JJ, Gilliland JC, Sommerville RJ, McNamara DG. Congenital heart disease in twins. N Engi J Med 1967; 277: 568 71.
19.Zellers TM, Driscoll DJ, Michels VV. Prevalence of significant congen ital heart defects in children of parents with Fallot's tetralogy. Am J Cardiol 1990;65:523–526.
20.Aranega A, Egea J, Alvarez L, et al. Tetralogy of Fallot produced in chick embryos by mechanical interference with cardio genesis. Anat Rec 1985;213:560–565.
21.Van Praagh R, Van Praagh S, Nebesar RA, Muster AJ, Sinha SN, Paul MH. Tetralogy of Fallot: Underdevelopment of the pulmonary infundibulum and its sequelae. Am J Cardiol 1970; 26:25–33.
22.Santini F, Jonas RA, Sanders SP, Van Praagh R. Tetralogy of Fallot [successful repair without a conduit. Ann Thorac Surg 1995; 59: 747–9.
23.Van Praagh R, Van Praagh S, Nebesar RA et at. Tetralogy of Fallot: underdevelopment of the pulmonary infundibulum and its sequelae. Am J Cardiol 1970; 26: 25–33.
24.Becker AE, Connor M, Anderson RH. Tetralogy of Fallot: a morphome tric and geometric study. Am J Cardiol 1975; 35: 402–12.
25.Anderson RH, Allwork SP, Ho SY, et al. Surgical anatomy of tetralogy of Fal lot. J Thorac Cardiovasc Surg 1981;81: 887–896.
26.Neirotti R, Galinder E, Kreutzer J и др. Tetralogy of Fallot with subpul monary ventricular septal defect. Ann Thorac Surg,1978,85,51–56)
27.Rao BNS, Anderson RC, Edwards JE. Anatomic variations in the tetral ogy of Fallot. Am Heart J 1971;81: 361
28.Keith JD, Rowe RD, Vlad P. Heart Disease in Infancy and Childhood. 3rd ed. New York: Macmillan, 1978:473.
29.Rabinovitch M, Herrera DeLeon V, Cas taneda AR, et al. Growth and development of the pulmonary vascular bed in patients with tetralogy
of Fallot with or without pulmonary atresia. Circulation 1981;64:1234–1249.
30.Edwards WD, Double outlet right ventricle and tetralogy of Fallot: two distinct but not mutually exclusive entities. J Thorac Cardiovasc Surg 1981;82:418–422.
31.Becker A.E., Connor M., Anderson R.H. Tetralogy of Fallot: a morfo metric and gеometriс study. Am. J. Cardiol. – 1975. – Vol. 35. – P. 405–412.
32.Kirklin J.W., Barratt Boyes B.G. Cardiac Surgery I/New York, John Wiley Sons.– 1986.–P. 714.
33.Lorenz CH, Walker EJ, Morgan VL. Normal right and left ventricular mass systolic function, and gender differences by cine magnetic reso nance imaging. J Cardiovasc Mag Res 1999;1 :7 21.
34.Hosking MCK, Benson LN, Nakanishi T, et al.. Intravascular stent pros thesis for ventricular oufflow obstruction. JACC 992;20:373 380.
35.Kato M, Kawashima Y, Fujita I, Mori T, Manabe H. Right ventricular hypertrophy in tetralogy of Failot. In Recent Advances in Studies on Cardiac Structure and Metabolism. University Park press, Baltimore. 1976.vol.12.P.149 155.
36.Hosking MC, Thomaidis C, Hamilton R. Clinical impact of balloon angio plasty for branch pulmonary arterial stenosis. Am J Cardiol 1992;69: 1467 1470.
37.Matsuda H, Hirose H, Nakano S. Age related changes in right and left ventricular function in tetralogy of Fallot. Japanese Circulation Journal. 1986.Vol.50.P.1040–1043.
38.Sanchez Quintana D., Anderson R.H., Siew Yen Ho. Ventricular myoar chitecture in tetralogy of Fallot. Heart. 1996.Vol.76.P.280–286.
39.Sanchez Quintana D., Garcia Martinez V., Climent V., Hurle J.M. Morphological changes in the normal pattern of ventricular myoarhi tecture in developing human heart. Anat Res. J 995. Vol.243. P. 483–495.
40.McManus BM, Waller BE Jones M, et al. The case for preoperative coronary angiography in patients with tetralogy of Fallot and other complex congenital heart diseases. Am Heart J 1982;103: 451–456.
41.Johnson R S, Sauer U, Buhlmeyer K, et al. Hypoplasia of the intrapul monary arteries in children with right ventricular outflow tract obstruc tion, ventricular septal defect and major aortopulmonary collateral arteries. Pediatr Cardiol 1985;6:137–143.
42.Nakajima Y, Nishibatake M, Ikeda K, et al. Abnormal development of fourth aortic arch derivatives in the pathogene sis of tetralogy of Fallot. Pediatr Cardiol 1990;11:69–71.
43.McCaughan BD, Danielson GK, Driscoll DJ, et al. Tetralogy of Fallot with absent pulmonary valve. J Thorac Cardiovasc Surg 1985;89:280–287.
44.Uretzky C, Puga FJ, Danielson CK, et al. Complete atrioventricular canal associated with tetralogy of Fallot. J Thorac Cardiovasc Surg 1984;87:756–766.
45.Cerlis LM, Fiddler CI, Pearse RG. Total anomalous pulmonary venous drainage associated with tetralogy of Fallot: report of a case. Pediatr Cardiol 1983;4:297–300.
46.Capelli H, Ross D, Somerville J. Aortic regurgitation in tetrad of Fallot and pulmonary atresia. Am J Cardiol 1982;49:1979–1983.
47.Hohn AR, Jam KK, Tamer DM. Supravalvular mitral stenosis in a patient with tetralogy of Fallot. Am J Cardiol 1968;22:733–737.
48.Wedemeyer AL, Lewis JL. Improvement in hemostasis following phle botomy in cyanotic patients with heart disease. Pediatrics 1973;83:46–50.
49.Ilbawi MN, Idriss FS, Muster AJ, et al. Tetralogy of Fallot with absent pul monary valve. J Thorac Cardiovasc Surg 1981;81:906–915.
50.Morgan BC, Guntheroth WG, Mullins RS. Physiologic studies of parox ysmal hyperpnea in cyanotic congenital heart disease. Circulation 1965;31 :70–76.
51.Taussig HB, Crocetti A, Eshaghpour E, et al. Long time observations on the Blalock Taussig operation. III: Common complications. Johns Hopkins Med J 1971;129: 274–289.
52.Keith JD, Rowe RD, Vlad P. Heart Disease in Infancy and Childhood. 3rd ed. New York: Macmillan, 1978:483.
Глава 47. ТЕТРАДА ФАЛЛО |
673 |
|
|
|
|
53.Deanfield JE, McKenna WJ, Presbitero P, et al. Ventricular arrhythmia in unrepaired and repaired tetralogy of Fallot. Br Heart J 1984;52:77–81.
54.Coor DA, Lavee J, Smolinsky A, et al. Correction of tetrad of Fallot with reduced incidence of right bundle branch block. Am J Cardiol 1981;48:892–896,
55.Horowitz LN, Simson MB, Spear JF, et al. The mechanisms of appar ent right bundle branch block after transatrial repair of tetralogy of Fallot. Circulation 1979;59:1241–1252.
56.Steeg CN, Krongrad E, Davachi F, et al. Postoperative left anterior hemiblock and right bundle branch block following repair of tetralogy of Fallot. Circulation 1975;51:1026–1029.
57.Levin AR, Boineau JP, Spach MS, et al. Ventricular pressure flow dynamics in tetralogy of Fallot. Circulation 1966;34:4–13.
58.Horowitz LN, Vetter VL, Harken AH, et al. Electrophysiologic character istics of sustained ventricular tachycardia occurring after repair of tetralogy of Fallot. Am J Cardiol 1980;46:446–452.
59.Dabizzi RE Caprioli C, Aiazzi L, et al. Distribution and anomalies of coronary arteries in tetralogy of Fallot. Circulation 1980;61:95 102.
60.Fellows KE, Freed MD, Keane JF, et al. Results of routine preoperative coronary angiography in tetralogy of Fallot. Circulation 1975;51:561–566.
61.Blalock A, Taussig HB. The surgical treatment of malformations of the heart in which there is pulmonary stenosis or pulmonary atresia. JAMA 1945; 128:189–202.
62.Klinner VW, Pasini M, Schaudig A. Anastomose zwischen System und Lungenarterie mit hilfe von Kunststoffprothesen bei Cyanotischen Herzvitien. Thoraxchirugie 1962; 10:68.
63.de Leval MR, McKay R, Jones M, Stark J, Macartney FJ. Modified Blalock Taussig shunt. Use of subclavian artery orifice as flow regula tor in prosthetic systemic pulmonary artery shunts. J Thorac Cardiovasc Surg 1981; 81:112–119.
64.Laks H, Castaneda AR. Subelavian arterioplasty for the ipsilateral Blalock–Taussig shunt. Ann ThoracSurg 1975; 19:319.
65.Potts WJ, Smith I, Gibson S. Anastomosis of the aorta to a pulmonary artery. JAMA 1946; 132 :627–631.
66.Davidson S. Anastomosis between the ascending aorta and the main pulmonary artery in the tetralogy of Fallot. Thorax 1955; 10:348.
67.Waterston DJ. Treatment of Fallot's tetralogy in children under one year of age. Rozhl Chir 1962; 41:181.
68.Brock RC. Pulmonary valvulotomy for relief of congenital pulmonary stenosis. Report of 3 cases. Br Med J 1948; 11121–1126.
69.Sellors TH. Surgery of pulmonary stenosis (a case in which pulmonary valve was successfully divided). Lancet 1948; 1:98.
70.Lillehei CW, Cohen M, Warden HE et al. Direct vision intracardiac surgi cal correction of the tetralogy of Fallot, pentalogy of Fallot and pulmonary atresia defects: Report of the first 10 cases. Ann Surg 1955; 142:418.
71.Kirklin JW, DuShane JW, Patrick RI et al. Intracardiac surgery with the aid of a mechanical pump oxygenator system (Gibbon type): Report of eight cases. Proc Staff Meet Mayo Clin 1955; 30:201.
72.Gott VL. C. Walton Lillehei and total correction of tetralogy of Fallot. Ann Thora Surg 1990; 49:328–332.
73.Klinner W.Indikationsstellung und operative technik fur die korrektur der Fallotschen tetralogy. Langenbecks Archiv fur Klinische Chirurgie 1964; 308 :40.
74.Ross D, Somerville J. Correction of pulmonary atresia with a homo graft aortic valve. Lancet 1966; 2:1446–1447.
75.Barratt Boyes BG, Neutze JM. Primary repair of tetralogy of Fallot in infancy using profound hypothermia with circulatory arrest and. limited cardiopulmonary bypass. A comparison with conventional two stage management. Ann Surg 1973; 178:406 411.
76.Kirklin JW, Blackstone EH, Pacifico AD, Brown RN, Bargeron LM. Routine primary vs two stage repair of tetralogy of Fallot. Circulation 1979; 60:373–386.
77.Lansing AM, Haiderer O. Transaortic closure of the Potts anastomosis in the complete repair of tetralogy of Fallot. J Thorac Cardiovasc Surg 1973; 66:279–282.
78.Alfieri O, Locatelli G, Bianchi I, Vanini V, Parenzan L. Repair of tetralo gy of Fallot after Waterston anastomosis. J Thorac Cardiovasc Surg 1979; 77:826–830.
79.Sokol I, Narkiewicz M, Billewicz O. Subclavian steal syndrome after Blalock–Taussig anastomoses. J Cardiovasc Surg 1969; 10: 350–4.
80.Hussain R, al Faraidi Y. Fore quarter gangrene: complication of Blalock Taussig shunt. Eur J Cardiothorac Surg 1997; 11:582–4.
81.Mearns AJ, Deverall PB, Kester RC. Revasculanzation of an arm for incipient gangrene after Blalock–Taussig anastomosis. Br J Surg 1978; 65: 467–8.
82.Watkins MT, Ricotta JJ, Manning IA, Stewart S. Upper extremity clau dication 10 years after a Blalock Taussig shunt treated with a carotid to subclavian graft. Ann Thorac Surg 1988; 45: 445–6.
83.Zahka KG, Manolio TA, Rykiel MJ et al. Handgrip strength after the Blalock–Thussig shunt: 14 to 34 year follow up. Clin Cardiol 1988; 11: 627–9.
84.Cho SR, Tisnado J, Beachley MC, Lower RR. Blalock–Taussig shunt to a pulmonary vein: an unusual surgical complication. Cardiovasc Intervent Radiol 1980; 3:9–11.
85.Robida A. Doppler imaging of an inadvertent anastomosis of modified Blalock–Taussig shunt to the right upper pulmonary vein. 1 J Cardiol 1994; 47: 75–7.
86.Le Blanc J, Albus R, Williams WG et al. Serous fluid leakage: a com plication following the modified Blalock–Taussig shunt. J Thorac Cardiovasc Surg 1984; 88: 259–62.
87.Powell EC, Banday A. Serous fluid leakage after a modified Blalock–Taussig shunt: a cause of hypercyanotic episodes. Pediatr Emerg Care 1999; 15: 330–1.
88.Rudd SA, McAdams HP, Cohen AJ, Midgley FM. Mediastinal perigraft sero ma: CT and MR imaging. J Thorac Imaging 1994; 9: 120–2.
89.Hiramatsu Y, Atsumi N, Sasaki A, Mitsui T. A successful treatment of serous leakage from a polytetrafluoroethylene Blalock–Taussig shunt with intravenous fibrinogen administration. J Thorac Cardiovasc Surg 1999; 117: 1230–1.
90.Tabata R, Mon A, Magara T et al. [study on the mechanism of serum leakage from expanded polytetrafluoroethylene (EPTFE) vascular pros thesis.] Nippon Kyobu Geka Gakkai Zasshi 1989; 37: 439–48.
91.Rabinovitch M, Herrera de Leon V, Castaneda AR, Reid L Growth and development of the pulmonary vascular bed in patients with tetralogy of Fallot with or without pulmonary atresia. Circulation 1981; 64:1234–1249.
92.Kirklin JK, Blackstone EH, Jonas RA et al. Morphologic and surgical determinants of outcome events after repair of tetralogy of Fallot with pulmonary stenosis: A two institution study. J Thorac Cardiovasc Surg 1992; 103:706–723.
93.Cale AW, Arciniegas E, Creen EW, et al. Crowth 9 the pulmonary annu lus and pulmonary arteries after the Blalock Taussig shunt. J Thorac Cardiovasc Surg 1979;77:459–465.
94.Kirklin JK, Kirklin JW, Pacifico AD. Transannular outflow tract patching for tetralogy: indications and results. Semin Thorac Cardiovasc Surg 1990;2:61–69.
95.Sreeram N, Saleem M, Jackson M, et al. Results of balloon pulmonary valvuloplasty as a palliative procedure in tetralogy of Fallot. J Am Coll Cardiol 1991;18:59–165.
96.Neirotti R, Galindez E, Kreutzer G, et al. Tetralogy of Fallot with subpul monary ventricular septal defect. Ann Thorac Surg 1978;25:51–56.
97.McGoon D.C., Baird D.K., Davis G.D. Surgical management of large bronchial collateral arteries with pulmonary stenosis or atresia // Circulation. –1975.– Vol.52.– P. 109–118.
98.Groh M.A., Meliones J.N., Bove E.L., et al. Repair of tetralogy of Fallot in infancy. Effect of pulmonary artery size on outcome // Circulation. – 1991.– Vol.84(5 Suppl.lll).– P. 206–212.
99.Shimazaki Y., Blackstone E.H., Kirklin J.W., et al. The dimention of the right ventricular outflow tract and pulmonary arteries in tetralogy of Fallot and pulmonary stenosis // J Thorac Cardiovasc Surg.– 1992.– Vol.103.–P.692–705.
100.Oku H., Shirotani H., Yokoyama T., et al. Postoperative size of the right ventricular outflow tract and optimal age in complete repair of tetralogy of Fallot //Ann Thorac Surg.– 1978.–Vol.25.– P.322–328.
101.Nakata S., Imai Y., Takanashi Y., et al. A new method for the quanti tative standartization of cross sectional areas of the pulmonary arter ies in congenital heart diseases with decreased pulmonary blood flow // J Thorac Cardiovasc Surg.– 1984.–Vol.88.– P.610–609.
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
674 |
Часть 8. ПОРОКИ ВЫВОДНОГО ТРАКТА ПРАВОГО ЖЕЛУДОЧКА |
|
|
|
|
102.Blackstone PH, Kirklin JW, Bertranou EG, et al. Preoperative predic tion from cinean giograms of postrepair right ventricular pressure in tetralogy of Fallot. J Thorac Cardiovasc Surg 1979;78:542–552.
103.Kirklin JW, Blackstone EH, Pacifico AD, et al. Routine primary repair vs two stage repair of tetralogy of Fallot. Circulation 1979;60:373–386.
104.Calder AL, Barratt Boyes GB, Brandt PWT, et al. Postoperative evalu ation of patients with tetralogy of Fallot repaired in infancy: including criteria for the use of outflow patching and a radiologi cal assessment of pulmonary regurgita lion. J Thorac Cardiovasc Surg 1979;77: 704–720.
105.Pacifico AD, Kirklin JW, Blackstone EH. Surgical management of pul monary stenosis in tetralogy of Fallot // J Thorac Cardiovasc Surg.– 1977.– Vol.74.– P.382–395.
106.Kirklin JW, Barrat Boyes B.G. Cardiac surgery: morphology, diagnos tic criteria, natural history, techniques, results and indications. 2nd ed.
– New York: Churchill Livingstone Inc. – 1993.– P.701–799.
107.Berry BE, McGoon DC. Total correction for tetralogy of Fallot with anomalous coronary artery. Surgery 1973;74: 894–898.
108.Jonas RA. Comprehensive Surgical management of congenital heart disease. Arnold. 2004.
109.Dandolu BR, Baldwin HS, Norwood WI, Jacobs ML. Tetralogy of Fallot with anomalous coronary artery: double outflow technique. Ann Thorac Surg;1999,67:1178–80.
110.Kirklin JW, Blackstone EH, Kirklin JK, et al. Surgical results and pro tocols in the spectrum of tetralogy of Fallot. Ann Surg 1983; 198: 251–265.
111.Groh MA, Meliones JN, Bove, EL, et al. Repair of tetralogy of Fallot in infancy: effect of pulmonary artery size on outcome. Circulation 1991;84(supp III):206–212.
112.Pigula FA, Khalil PN, Mayer JE, del Nido PJ, Jonas RA. Repair of tetralogy of Fallot in neonates and young infants. Circulation 1999; 100(Suppl II): 11157–161.
113.Hennein HA, Mosca RS, Urcelay G, Crowley DC, Bove EL. Intermediate results after complete repair of tetralogy of FalIot in neonates. J Thorac CordiovascSurg 1995; 109 :332–344.
114.Sousa Uva M, Lacour Gayet F, Komiya I et al. Surgery for tetralogy of Fallot at less than six months of age. J Thorac CordiovascSurg 1994; 107:1291–1300.
115.Karl TR, Sano S. Pornviliwan S, Mee RB. Tetralogy of Fallot: favorable outcome of nonneonatal transatrial, transpulmonary repair. Ann Thorac Surg 1992; 54:903–907.
116.Gladman G, McCrindle BW, Williams WG, Freedom RM, Benson LM. The modified Blalock–Taussig shunt: Clinical impact and morbidity in Fallot's tetralogy in the current era. J Tharac Cardiovasc Surg 1997; 115:25–30.
117.Lillehei CW,Varco RL, Cohen Met al.The first open heart corrections of tetralogy of Fallot. A 26–31 year follow up of 106 patients. Ann Surg 1986; 204: 490–592.
118.Kirklin JW, Wallace RB, McGoon DC et al. Early and late results after intracardiac repair of tetralogy of Fallot. 5 year review of 337 patients. Ann Surg 1965; 162: 578–89.
119.Murphy JG, Gersh BJ, Mair DD et al. Long term outcome in patients undergoing surgical repair of tetralogy of Fallot. N Engi J Med 1993; 329: 593–9.
120.Nollert G, Fischlein T, Bouterwek S et al. Long term survival in patients with repair of tetralogy of Fallot: 36 year follow up of 490 survivors of the first year after surgical repair. J Am Coll Cardiol 1997; 30: 1374–83.
121.Kobayashi J, Kawashima Y, Matsuda H et al. Prevalence and risk fac tors of tricuspid regurgitation after correction of tetralogy of Fallot. J Thorac Cardiovasc Surg 1991; 102: 611–16.
122.Hokanson JS, Moller JH. Adults with tetralogy of Fallot. Long term follow up. Cardiol Rev 1999; 7: 149–55.
123.Niwa K, Perloff JK, Bhuta SM et al. Structural abnormalities of great arterial walls in congenital heart disease: light and microscopic find ings. Circulation 2001; 103: 393–400.
124.Niwa K, Siu SC, Webb GD et al. Progressive aortic root dilatation in adults late after repair of tetralogy of Fallot. Circulation 2002; 106: 1374–8.
125.Warnes CA, Child JS. Aortic root dilatation after repair of tetralogy of Fallot. Pathology of the past? Circulation 2002; 106: 1310–11.
126.Kirklin JW, Barratt–Boyes BG. Cardiac Surgery, 2nd edn. New York: Churchill Livingstone, 1993; 861–1012.
127.Bilfinger TV, Seifert FC, Vallone AM, Biancaniello TM. Aortic valve injury 10 years after tetralogy of Fallot repair. Pediatr Cardiol 1994; 15: 100–2.
128.Smolinsky A, Tamarkin M, Goor DA. Fractional gradients along the outflow tract of the right ventricle in tetralogy of Fallot. Anatomic and hemodynamic correlative study. J Thorac Cardiovasc Surg 1981; 81: 774–80.
129.Kaushal SK, Radhakrishanan I, Dagar KS et al. Significant intraoper ative right ventricular outflow gradients after repair for tetralogy of Fallot: to revise or not to revise? Ann Thorac Surg 1999; 68: 1705–12.
130.Ascuitto RJ, Ross Ascuitto NT, Markowitz RI et al. Aneurysms of the right ventricular outflow tract after tetratogy of Fallot repair: role of radiology. Radiology 1988; 167: 115–19.
131.Seybold Epting W, Chiariello L, Hallman GL, Cooley DA. Aneurysm of pericardial right ventricular outflow tract patches. Ann Thorac Surg 1977; 24: 237–40.
132.Uretzky G, Puga FJ, Danielson GK, Hagler DJ, McGoon DC. Reoperation after correction of tetralogy of Fallot. Circulation 1982; 66: 202–8.
133.Miller DC, Rossiter SJ, Stinson EB, Oyer PE, Reitz BA, Shumway NE. Late right heart reconstruction following repair of tetralogy of Fallot. Ann Thorac Surg 1979; 28: 239–51.
134.Bacha EA, Scheule AM, Zurakowski D et al. Long term results after early primary repair of tetralogy of Fallot. J Thorac Cardiovasc Surg 2001; 122:154–161.
135.Chen D, Mailer JH. Comparison of late clinical status between patients with different hemodynamic findings after repair of tetralogy of Fallot. Am Heart J 1987; 113:767–772.
136.Sadiq M, Fenton AC, Firmin RK. False aneurysm of the right ventric ular outflow tract after total correction of tetralogy of Fallot: diagnosis by echocardiography and successful repair by neck cannulation for cardiopulmonary bypass. Br Heart J 1994; 71: 566–8.
137.Oechslin EN, Harrison DA, Harris L et al. Reoperation in adults with repair of tetralogy of Fallot: indications and out comes. J Thorac Cardiovasc Surg 1999; 118: 245–51.
138.Shinebourne EA, Anderson RH. Fallot's tetralogy. In: Paedi atric Cardiology, 2nd edn. Anderson RH, Baker EJ, Macartney FJ et al, eds. London: Churchill Livingstone, 2002; 1213–50.
139.Singh GK, Greenberg SB, Yap YS et al. Right ventricular function and exercise performance late after primary repair of tetralogy of Fallot with the transannular patch in infancy. Am J Cardiol 1998; 81: 1378–82.
140.Eyskens B, Reybrouck T, Bogaert J et al. Homograft insertion for pul monary regurgitation after repair of tetralogy of Fallot improves car diorespiratory exercise performance. Am J Cardiol 2000; 85: 221–5.
141.Rowe SA, Zahka KG, Manolio TA, Horneffer PJ, Kidd L. Lung function and pulmonary regurgitation limit exercise capacity in postoperative tetralogy of Fallot. J Am Coll Cardiol 1991; 17:461–6.
142.Mulla N, Simpson P, Sullivan NM, Paridon S. Determinants ofaerobic capacity during exercise following complete repair of tetralogy of Fallot with a transannular patch. Pediatr Cardiol 1997; 18: 350–6.
143.Shimazaki Y, Blackstone EH, Kirklin JW. The natural history of isolat ed congenital pulmonary valve incompetence: surgical implications. Thorac Cardiovasc Surg 1984; 32: 257–9.
144.Ilbawi MN, Idriss ES, DeLeon SY, Muster AJ, Berry IE, Paul MH. Long term results of porcine valve insertion for pulmonary regurgita tion following repair of tetralogy of Fallot. Ann Thorac Surg 1986; 41:478–482.
145.Warner KG, Anderson JE, Fulton DR. Payne DD, Geggel FL, MarxGR. Restoration of the pulmonary valve reduces right ventricular volume overload after previous repair of tetralogy of Fallot. Circulation 1993; 88:11189–197.
146.Finck SJ, Puga FJ, Danielson GK. Pulmonary valve insertion during reoperation for tetralogy of Fallot. Ann Thorac Surg 1988; 45:610–613.
147.Pacifico AD, Kirklin JK, Colvin EV, et al. Tetralogy of Fallot: late results and reoperations. Semin Thorac Cardiovasc Surg 1990;2:108–116.
148.Ilbawi MN, Idriss FS, DeLeon SY, et al. Factors that exaggerate the deleterious effects of pulmonary insufficiency on the right ventricle after tetralogy repair. J Thorac Cardiovasc Surg 1987;93: 36–44.
Глава 47. ТЕТРАДА ФАЛЛО |
675 |
|
|
|
|
149.Yemets IM, Williams WG, Webb GD et al. Pulmonary valve replace ment late after repair of tetralogy of Fallot. Ann Thorac Surg 1997; 64: 526–30.
150.Therrien J, Siu S, McLaughlin PR et al. Pulmonary valve replacement in adults late after repair of tetralogy of Fallot: Are we operating too late? J Am Coll Cardiol 2000; 36: 1670–5.
151.Bonhoeffer P, Boudjemline Y, Qureshi SA et al. Percutaneous inser tion of the pulmonary valve. J Am Coll Cardiol 2002; 39: 1664–9.
152.Redington AN, Oldershaw PJ, Shinebourne EA et al. A new technique for the assessment of pulmonary regurgitation and its application to the assessment of right ventricular function before and after repair of tetralogy of Fallot. Br Heart J 1988; 60: 57–65.
153.Gatzoulis MA, Clark AL, Cullen S, Newman CG, Redington AN. Right ventricular diastolic function 15 to 35 years after repair of tetralogy of Fallot. Restrictive physiology predicts superior exercise performance. Circulation 1995; 91: 1775–81.
154.Chaturvedi RR, Shore DF, Lincoln C et al. Acute right ventricular restrictive physiology after repair of tetralogy of Fallot: association with myocardial injury and oxidative stress. Circulation 1999; 100: 1540–7.
155.Bigras JL, Boutin C, McCrindle BW, Rebeyka IM. Shortterm effect of monocuspid valves of pulmonary insufficiency and clinical outcome after surgical repair of tetralogy of Fallot. J Thorac Cardiovasc Surg 1996; 112:33–37.
156.Gundry SR. Razzouk AJ, Boskind IF, Bansal R, Bailey LL. Fate of the, pericardial monocusp pulmonary valve for right ventricular outflow tract reconstruction. J Thorac Cardiovasc Surg 1994; 107:908–912.
157.Cobanoglu A, Schultz JM. Total correction of tetralogy of Fallot in the first year of life: late results. Ann Thorac Surg 2002; 74: 133–8.
158.Silka MJ, Hardy BG, Menashe VD et al. A population based prospec tive evaluation of risk of sudden cardiac death after operation for com mon congenital heart defects. J Am Coll Cardiol 1998; 32: 245–51.
159.Sullivan ID, Presbitero P, Gooch VM, Aruta E, Deanfield JE. Is ventric ular arrhythmia in repaired tetralogy of Fallot an effect of operation or a consequence of the course of the disease? A prospective study. Br Heart J 1987; 58: 40–44.
160.Deanfield JE, McKenna WJ, Presbitero P et al. Ventricular arrhythmia in unrepaired and repaired tetralogy of Fallot. Relation to age, timing of repair, and haemodynamic status. Br Heart J 1984; 52: 77–81.
161.Joffe H, Georgakopulos D, Celermajer DS et al. Late ventricular arrhythmia is rare after early repair of tetralogy of Fallot. J Am Coll Cardiol 1994; 23: 1146–50.
162.Carson A, Gillette PC, Gutgesell HP, et al. Stress induced ventricular arrhythmia after repair of tetralogy. Am J Cardiol 1980;46:1006–1012.
163.Jones M, Ferrans VJ. Myocardial degeneration in congenital heart disease: comparison of morphologic findings in young and old patients with congenital heart disease associated with muscular obstruction to right ventricular outflow. Am J Cardiol 1977;39:1051–1063.
164.Walsh EP, Rockenmacher S, Keane JF, et al. Late results in patients with tetralogy of Fallot repaired during infancy. Circulalion 1988;77:1062–1067.
165.Vaksmann C, Fournier A, Davignon A, et al. Frequency and prognosis of arrhythmias after operative "correction" of tetralogy of Fallot. Am J Cardiol 1990;66: 346–349.
166.Chandar JS, Wolff CS, Carson A, et al. Ventricular arrhythmias in post operative tetralogy of Fallot. Am J Cardiol 1990;65:655–661.
167.Danfield JE. Late ventricular arrhythmias occurring after repair of tetralogy of Fallot: do they matter? Am J Cardiol 1991;30:143–150.
168.Kobayashi J, Hirose H, Nakano S et al. Ambulatory electrocardio graphic study of the frequency and cause of ventricular arrhythmia after correction of tetralogy of Fallot. Am J Cardiol 1984; 54: 1310–13.
169.Gatzoulis MA, Till JA, Somerville J, Redington AN. Mechanoelectrical interaction in tetralogy of Fallot. QRS prolongation relates to right ven tricular size and predicts malignant ventricular arrhythmias and sud den death. Circulation 1995; 92: 231–7.
170.Sarubbi B, Li W, Somerville J. QRS width in right bundle branch block. Accuracy and reproducibility of manual measurement. Am J Cardiol 2000; 75: 71–4.
171.Gatzoulis MA, Till JA, Redington AN. Depolarization repolarization inhomogeneity after repair of tetralogy of Fallot. The substrate for malignant ventricular tachycardia? Circulation 1997; 95: 401–4.
172.Vogel M, Sponring J, Culien S et al. Regional wall motion and abnor malities of electrical depolarization and repolarization in patients after surgical repair of tetralogy of Fallot. Circulation 2001; 103: 1669–73.
173.Saul JP, Alexander ME. Preventing sudden death after repair of tetral ogy of Fallot: complex therapy for complex patients. J Cardiovasc Electrophysiol 1999; 10: 1271–87.
174.Daliento L, Folino AF, Menti L et al. Adrenergic nervous activity in patients after surgical correction of tetralogy of Fallot. J Am Coll Cardiol 2001; 38:2043–7.
175.Davos CH, Davlouros PA, Wensel R et al. Global impairment of cardiac autonomic nervous activity late after repair of tetralogy of Fallot. J Thorac Cardiovasc Surg 2002; 106(Suppl.): 1–69 1–75.
176.Ghai A, Silversides C, Harris L et al. Left ventricular dysfunction is a risk factor for sudden death in adults late after repair of tetralogy of Fallot. J Am Coll Cardiol 2002; 40: 1675–80.
177.Gatzoulis MA, Elliott JT, Guru V et al. Right and left ventricular sys tolic function late after repair of tetralogy of Fallot. Am J Cardiol 2000; 86: 1352–7.
178.Schamberger MS, Hurwitz RA. Course of right and left ventricular function in patients with pulmonary insufficiency after repair of tetral ogy of Fallot. Pediatr Cardiol 2000; 21: 244–8.
179.Niezen RA, Helbing WA, van Der Wall EE et al. Left ventricular func tion in adults with mild pulmonary insufficiency late after Fallot repair. Heart 1999; 82: 697–703.
180.Niezen RA, Helbing WA, van der Wall EE et al. Biventricular systolic function and mass studied with MR imaging in children with pul monary regurgitation after repair for tetralogy of Fallot. Radiology 1996; 201: 135–40.
181.Kondo C, Nakazawa M, Kusakabe K et al. Left ventricular dysfunction on exercise long term after repair of tetralogy of Fallot. Circulation 1995; 92: 250–5.
182.Abd EJ, Rahman MY, Abdul–Khaliq H, Vogel M et al. Relation between right ventricular enlargement, ORS duration, and right ventricular func tion in patients with tetralogy of Fallot and pulmonary regurgitation after surgical repair. Heart 2000; 84: 416–20.
183.Cullen I, Shore D, Redington A. Characterization of right ventricular diastolic performance after complete repair of tetralogy of Fallot. Restrictive physiology predicts slow post operative recovery. Circulation 1995; 91: 1782–9.
184.Helbing WA, Niezen RA, Le Cessie S et al. Right ventricular diastolic function in children with pulmonary regurgitation after repair of tetralo gy of Fallot: volumetric evaluation by magnetic resonance velocity map ping. J Am Coll Cardiol 1996; 28: 1827–35.
185.Norgard G, Gatzoulis MA, Moraes F et al. Relationship between type of outflow tract repair and postoperative right ventricular diastolic physiology in tetralogy of Fallot. Implications for long term outcome. Circulation 1996; 94: 3276–80.
186.Bove EL, Kavey RE, Byrum C et al. Improved right ventricular function following late pulmonary valve replacement for residual pulmonary insufficiency or stenosis. J Thorac Cardiovasc Surg 1985; 90: 50–5.
187.Carvalho JS, Shinebourne EA, Busst C, Rigby ML, Redington AN. Exercise capacity after complete repair of tetralogy of Fallot: deleteri ous effects of residual pulmonary regurgitation. Br Heart J 1992; 67: 470–3.
188.Yetman AT, Lee KJ, Hamilton R et al. Exercise capacity after reapir of tetralogy of Fallot in infancy. Am J Cardiol 2001; 87: 1021–3.
189.Wessel HU, Cunningham WJ, Paul MH, et al. Exercise performance in tetralogy of Fallot after intracardiac repair. J Thorac Cardiovasc Surg 1980;80:582–593.
190.Tomassoni IL, Galioto FM; Vaccaro P. Cardiopulmonary exercise test ing in children following surgery for tetralogy of Fallot. Am J Qis Child 1991;145: 1290–1293.
191.Rosenthal A. Adults with tetralogy of Fallot: repaired, y cured, no [N EngI J Med 1993;329:355–356.
192.Jonsson H, Ivert T, Jonasson R, Holmgren A, Bjork VO. Work capac ity and central hemodynamics thirteen to twenty six years after repair of tetralogy of Fallot. J Thorac Cardiovasc Surg 1995; 110: 416–26.
193.Hirsch JC, Mosca RS, Bove EL. Complete repair of tetralogy of Fallot in the neonate: results in the modern era. Ann Surg 2000; 232:508–514.
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
676 |
Часть 8. ПОРОКИ ВЫВОДНОГО ТРАКТА ПРАВОГО ЖЕЛУДОЧКА |
|
|
|
|
194.Karpawich PP, Jackson WL, Cavitt DL, Perry BL. Late onset unprecedent ed complete atrioventricular block after tetralogy of Fallot repair: electrophys iologic findings. Am Heart J 1987; 114: 654 6.
195.Wolff GS, Rowland TW, Ellison RC. Surgically induced right bundle–branch block with left anterior hemiblock. An ominous sign in postoperative tetralogy of Fallot. Circulation 1972; 46: 587–94.
196.Cairns JA, Dobell AR, Gibbons JE, Tessler I. Prognosis of right bun dle branch block and left anterior hemiblock after intracardiac repair of tetralogy of Fallot. Am Heart J 1975; 90: 549–54.
197.Hokanson JS, Moller JH. Significance of early transient complete heart block as a predictor of sudden death late after operative correc tion of tetralogy of Fallot. Am J Cardiol 2001; 87: 1271 7.
198.Morris CD, Reller MD, Menashe VD. Thirty year incidence of infective endocarditis after surgery for congenital heart defect. JAMA 1998; 279: 599–603.
199.Dodds GA, Warnes CA, Danielson GK. Aortic valve replace ment after repair of pulmonary atresia and ventricular eptal defect or tetralogy of Fallot. J Thorac Cardiovasc Surg 1997; 113: 736 41.
200.Emanuel R, Somerville J, Prusty S, Ross DN. Aortic regurgitation from infective endocarditis in Fallot's tetralogy and pulmonary atresia. Br Heart J 1975; 37: 365–70.
201.Whittemore R, Hobbins JC, Engle MA. Pregnancy and its outcome in women with and without surgical treatment of congenital heart dis ease. Am J Cardiol 1982;50:641–651.
202.Swensson RE, Sahn DJ, Valdes Cruz LM et al. Left coronary artery to right ventricular fistula after total repair for tetralogy of Fallot. Am J Cardiol 1987; 59: 713–14.
203.Schachner A, Zahavi I, Rosenfeld JB, Levy MJ. Cardiopulmonary fis tula as a late complication following repair of tetralogy of Fallot. Ann Thorac Surg 1972; 14: 69–74.
204.Urcelay G, Ludomirsky A, Vermilion RP et al. Acquired coronary artery fistulae after right ventricular myotomy and/or myomectomy for congenital heart disease. Am J Cardiol 1995; 75: 408–11.
205.Kadokami T, Shimokawa H, Ito A, Mohri M, Takeshita A. Disappearance of coronary artery ventricular fistulas after a radical operation for tetralogy of Fallot. Jpn Circ J 1996; 60: 624–7.
206.Lund JT. Large systemic collateral arteries developing late after total repair of tetralogy of Fallot. EurJ Cardiothorac Surg 1992; 6: 452–4.
207.Moran AM, Hornberger LK, Jonas RA et al. Development of a double chambered right ventricle after repair of tetralogy of Fallot. J Am Coll Cardiol 1998; 31: 1127–33.
208.Zuberbuhler JR. Tetralogy of Fallot. In: Emmanouilides GC, Allen HD, Riemenschneider TA, Gutgesell HP, eds. Moss and Adams' Heart Disease in Infants, Children, and Adolescents, Including the Fetus and Young Adult. Baltimore: Williams & Wilkins, 1995; 998–1018.
209.Thomas L, Foster E. Membranous subaortic stenosis presenting decades after surgical correction for tetralogy of Fallot. J Am Soc Echocardiogr 1998; 11: 206–8.
210.Grech V, Mifsud A. Early onset of progressive subaortic stenosis after complete repair of tetralogy of Fallot. Cardiol Young 2000; 10: 57–9.
211.Scott WC, Zhao HX, Allen M, Kim D, Miller DC. Aneurysmal degener ation of Blalock–Taussig shunts: identification and sur gical treatment options. J Am Coll Cardiol 1984; 3: 1277–81.
212.Donohue BC, Binder SW, Perloff JK, Child JS. Rupture of an aneurys mal pulmonary trunk 40 years after Blalock–Taussig anastomosis. Am J Cardiol 1988; 61: 477–8.
213.McGahan JP, Bogren HG, Foerster JM, Mason DT. Subclavian artery aneurysm: unique late complication of Blalock–Taussig anastomosis. AJR Am J Roentgenoi 1978; 130: 1181–3.
214.Demyanchuk VB, Dykucha SE, Dovgan AM, Lazorishinets VV. Pseudo aneurysm of subclavian artery 21 years after staged repair of tetralogy of Fallot. Eur J Cardiothorac Surg 2002; 21: 114–16.
215.Gladman G, McCrindle BW, Williams WG, Freedom RM, Benson LN. The modified Blalock–Taussig shunt: clinical impact and morbidity in Fallot's tetralogy in the current era. J Thorac Cardiovasc Surg 1997;114,25–30.
216.Chen Q, Monro JL. Division of modified Blalock–Taussig shunt at cor rection avoids distortion of the pulmonary arteri. Ann Thorac Surg 2001, 71,1265–1266.
Публикации автора
1.Зиньковский М.Ф., Бучнев А.И., Говенко А.В., Гончаров А.И. Реконструкция путей оттока из правого желудочка при радикальной коррекции тетрады Фалло // Грудная хирургия. – 1980. – N 3, C.5–10.
2.Зиньковский М.Ф., Бучнев А.И., Говенко А.В. Гончаренко А.И. Радикальная коррекция тетрады Фалло у взрослых // Грудная хирургия. – 1980. – N 5, C.20–22.
3.Зиньковский М.Ф., Гончаренко А.И., Бучнев А.И. Радикальная коррекция тетрады Фалло после паллиативных операций // Кардиология. – 1980. – N 2, C.51–54.
4.Зиньковский М.Ф., Паничкин Ю.В., Бучнев А.И., Перепека А.Н. Радикальная коррекция сложных анатомических форм тетрады Фалло // Клиническая хирургия. – 1980. – N 4, C.98–99.
5.Зиньковский М.Ф., Осмонов Э.Э. Хирургическое лечение триады Фалло // Клиническая хирургия. – 1981. – N 7, C.54–56.
6.Зиньковский М.Ф., Гончаренко А.М., Говенко А.В. Результаты радикальной коррекции тетрады Фалло после шунтирующих операций // Грудная хирургия. – 1981. – N 2, C.10–13.
7.Зиньковский М.Ф., Осмонов Э.Э. Проблемы хирургического лечения триады Фалло // Кардиология. – 1982. – N 2, C.95–97.
8.Амосов Н.М., Зиньковский М.Ф., Хирургическое лечение тетрады Фалло // К.: Здоровье, 1982.
9.Зиньковский М.Ф., Паничкин Ю.В., Перепека А.Н. Патология лёгочных артерий при тетраде Фалло в свете хирургического лечения // Материалы IX Всемирного конгресса кардиологов – М. – 1982. – N 1, C.95.
10.Зиньковский М.Ф., Цыганий А.А., Синельников В.Н., Малиновский О.П., Козяр В.В. Гемодинамика у больных тетрадой Фалло при хирургическом лечении // Грудная хирургия. – 1982, N 6, C.59–64.
11.Зиньковский М.Ф. Радикальная коррекция тетрады Фалло при аномалиях ветвления коронарных артерий // Грудная хирургия. – 1983. – N 6, C.5–8.
12.Зиньковский М.Ф., Перепека А.Н., Паничкин Ю.В. Хирургическая тактика при гипоплазии ветвей лёгочной артерии у больных с тетрадой Фалло // Кардиология. – 1983. – N 8, C.59–62.
13.Зиньковский М.Ф., Перепека А.Н. Расширение ветвей лёгочной артерии после паллиативных шунтирующих операций по поводу тетрады Фалло // Актуальные вопросы фтизиопульмонологии сердечной хирургии. – К. – 1983. – C.192–193.
14.Зиньковский М.Ф., Осмонов Э.Э. Патофизиологические механизмы нарушения гемодинамики при триаде Фалло // Фізіологічний журнал. – 1983.– N 3, C.300–303.
15.Зиньковский М.Ф., Довгань А.М., Дыкуха С.Е., Перепека О.М. Аорто легочные анастамозы в этапном хирургическом лечении тетрады Фалло // Клиническая хирургия. – 1986.– N10, C.14–17.
16.Зиньковский М.Ф., Чепкая И.Л., Базыка О.Е., Стычинский А.С., Лазоришинец В.В. Факторы, влияющие на частоту нарушений ритма сердца после радикальной коррекции тетрады Фалло // Врачебное дело. – 1992. – N 7, C.24–27.
17.Zinkovski M.F., Lasorichinets V.V., Dovgan A.M. Total correction of Fallot tetralogy with minimal or no ventriculotomy // World Congres of paediatric Cardiology a Cardiac Surgery. Paris, 1993. pp. 66
18.Зиньковський М.Ф., Довгань О.М., Дикуха С.О., Лазоришинець В.В та ін. Pseudoaneurysm of suhelavian artery 21 yars after of Tetralogy of Fallot // Europian Journal of cardio thoracic Surgery. 2002. Vol. 21– N1.– P.114–1
19.Зиньковский М.Ф., Аксьонов Е.В., Довгань А.М., ЛазоришинецьВ.В. Ложная аневризма подключичной артерии после двухэтапной коррекции тетрады Фалло // Серцево судинна хірургія. – К. – 2003.
– Випуск 11. – С.132–134
20.Зиньковский М.Ф., Довгань О.М., Дикуха С.О., Лекан Р.Й. Этапное лечение тетрады Фалло с атрезией легочной артерии и большими аорто легочными коллатералями // Серцево судинна хірургія. – К. – 2005. – Випуск 13. – С. 25–26
21.Зиньковский М.Ф., Загайнов Н.Ю. Аортальная регургитация у взрослых пациентов с тетрадой Фалло // Серцево судинна хірургія. – К. – 2006. – Випуск 14. – С. 313–316
Глава 48
ВРОЖДЕННОЕ ОТСУТСТВИЕ
КЛАПАНА ЛЕГОЧНОЙ АРТЕРИИ
Врожденное отсутствие легочного клапана яв ляется относительно редкой патологией. Синдром тетрады Фалло с отсутствующим клапаном легоч ной артерии встречается у 2–6% пациентов с тетра дой Фалло (1–5). В большинстве случаев эта ано малия сопровождается ДМЖП, сужением кольца легочного клапана и резкой дилатацией легочных артерий. Эту комбинацию аномалий часто называ ют «тетрадой Фалло с отсутствующим легочным клапаном». Существует также изолированное от сутствие легочного клапана с интактной межжелу дочковой перегородкой, которое встречается еще реже. После первого описания этого порока в 1847 г. Chevers (6) опубликовано более 300 подобных наблюдений, в том числе 15 — с интактной межже лудочковой перегородкой. Отличительными осо бенностями этого синдрома являются:
•отсутствующие или рудиментарные створки клапана;
•аневризматическая дилатация одной или обеих легочных артерий, сдавливающих бронхи;
•врожденная агенезия артериального протока, при сливающихся легочных артериях.
ЭМБРИОЛОГИЯ И ГЕНЕТИКА
При этом синдроме часто обнаруживали деле цию хромосомы 22 (7–9). Таким образом, сущест вует специфический эмбриональный механизм, включающий взаимодействие неврального гре бешка и примитивных аортальных дуг.
Существует предположение, что резкая дилата ция легочных артерий у плода патогенетически свя зана с агенезией артериального протока (10). Это сочетание было воспроизведено в эксперименте у плодов крыс путем введения тератогена бис диами на (11). Отсутствие легочного клапана было описа но у больного с интерстициальной делецией длин ной ветви хромосомы 6 (12). Отсутствие легочного клапана наблюдается при cиндроме Di George (13).
АНАТОМИЯ
В большинстве случаев отсутствует зрелый ле гочный клапан. Рудиментарный легочный клапан состоит из бессосудистых масс, выдающихся в просвет легочной артерии. На месте предполагае мого клапана обнаруживаются участки тонкой не выраженной примитивной узловатой желатино образной соединительной ткани. У некоторых больных имеется неполная и несовершенная, но зрелая ткань клапана. Прогноз в этих случаях от носительно хороший. Пациенты часто пережива ют период новорожденности, однако многие мла денцы с тяжелой формой этого синдрома умирают рано от дыхательной и толерантной к лечению сердечной недостаточности (10).
Сердце обычно сильно увеличено за счет пра вого желудочка и его инфундибулярного отдела. Легочная артерия аневризматически дилатирова на. Кольцо клапана гипоплазировано, инфунди булум узкий, длинный и извитой.
При наличии ДМЖП и инфундибулярного сте ноза внутренняя анатомия сердца соответствует таковой при тетраде Фалло. У этих пациентов име ются все анатомические признаки тетрады Фалло, в том числе у 25% — правосторонняя дуга аорты. В данном варианте тетрады Фалло встречаются ти пичные аномалии коронарных артерий (5, 14). Ле гочные артерии могут быть не связанными между собой и кровоснабжаться через боталлов проток или отходить непосредственно от восходящей аор ты (15, 16). Дефект межжелудочковой перегородки большой, расположен в области мембранозной пе регородки ниже аортального клапана. Восходящая аорта расширена.
Стенка дилатированной легочной артерии па тологически изменена (17, 18) и в отдельных слу чаях гистологически напоминает таковую при синдроме Марфана (цистомедианекроз), однако у большинства пациентов не обнаружены анома лии ее архитектуры (19–21).
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/

678 |
Часть 8. ПОРОКИ ВЫХОДНОГО ТРАКТА ПРАВОГО ЖЕЛУДОЧКА |
|
|
|
|
Существует взаимосвязь между ориентацией |
Порок сочетается с ОАП (28–31), ДМПП (32, |
||
инфундибулума и степенью дилатации легочной |
33), отхождением магистральных артерий от пра |
||
артерии. Если конус правого желудочка ориенти |
вого желудочка (29, 34, 35), синдромом Марфана |
||
рован вправо, правая легочная артерия аневризма |
(36), ДМЖП без стеноза клапанного кольца |
||
тически расшрена, в то время как вертикальная и |
(37–39), АТК (40), ТМА (24, 41), аномалией Uhl |
||
левосторонняя ориентация инфундибулума соп |
(42), отхождением правой или левой легочной ар |
||
ровождается двусторонней дилатацией или рас |
терии от восходящей аорты (43, 44), коарктацией |
||
ширением левой легочной артерии (22). В патоге |
аорты (45). Данный синдром могут сопровождать |
||
незе дилатации легочной артерии определенную |
также аортальный стеноз, полный или частичный |
||
роль играет гипоплазия легочного кольца, приво |
АВСД, ТАДЛВ, azygos продолжение нижней полой |
||
дящая к постстенотическому расширению (10, 23). |
вены и др. (2, 14, 46–50). |
||
Легочные проблемы обусловлены сдавлением |
КЛИНИКА |
||
трахеобронхиального дерева дилатированными |
|||
легочными артериями и аномально отходящими |
|
|
|
мелкими легочными артериальными сосудами, |
Отсутствие клапана легочной артерии можно за |
||
которые образуют сосудистые пучки, обвивающие |
подозрить по клиническим признакам. Грубый |
||
и сдавливающие мелкие внутрилегочные бронхи |
систолодиастолический шум у цианотичного ново |
||
(рис. 1). В некоторых случаях количество альвео |
рожденного с сопутствующей дыхательной недос |
||
лярных разветвлений бронхов значительно умень |
татчностью обычно указывает на наличие тетрады |
||
шено, в связи с чем у пациентов с тяжелой формой |
Фалло с отсутствующим легочным клапаном (1). |
||
синдрома хирургическое устранение компрессии |
У большинства пациентов с тяжелой формой |
||
главных бронхов не всегда облегчает состояние и |
порока сразу после рождения развивается респи |
||
не избавляет от вероятности рецидива обструкции |
раторный дистресс синдром. Цианоз отсутствует, |
||
дыхательных путей (24, 25). |
за исключением раннего неонатального периода. |
||
Могут иметь место аортолегочные коллатерали |
Дыхательная недостаточность обусловлена час |
||
различных размеров (26, 27). Чаще они малые и |
тичным сдавлением бронхов резко расширенны |
||
непрямые, реже бывают большими и прямыми. |
ми легочными артериями и компрессией внутри |
||
Коллатерали отходят от нисходящей грудной аор |
легочных бронхов аномально ветвящимися дис |
||
ты и входят в корень легкого. Они осложняют хи |
тальными ветвями легочных артерий. Дыхание |
||
рургическое вмешательство, если не обработаны |
улучшается, когда ребенка кладут навзничь. Тяже |
||
перед коррекцией. |
лая сердечная недостаточность скоро приводит к |
||
|
|
смерти (22). При аускультации обна |
|
|
|
руживается характерный систолодиас |
|
|
|
толический шум «шум хрустящего под |
|
|
|
ногами снега». При наличии ДМЖП |
|
|
|
наблюдается умеренный цианоз, час |
|
|
|
тое абдоминальное и глубокое грудное |
|
|
|
дыхание с втяжением межреберных |
|
|
|
промежутков. Часто отмечается стри |
|
|
|
дор на вдохе и выдохе. По левому краю |
|
|
|
грудины определяется систолическое |
|
|
|
и иногда диастолическое дрожание. |
|
|
|
Систолодиастолический шум лучше |
|
|
|
слышен сверху по левому краю груди |
|
|
|
ны и широко распространяется над |
|
|
|
всей предсердечной областью. Шум |
|
|
|
состоит из грубого систолического |
|
|
|
компонента, обусловленного сужени |
|
|
|
ем кольца легочного клапана, и грубо |
|
Рис. 1. Схематическое изображение нормального ветвления легочных ар |
го убывающего диастолического ком |
||
понента. Шум прерывается нерасщеп |
|||
терий (слева) и аномальное ветвление при отсутствии клапана легочной |
|||
ленным II тоном, который лучше слы |
|||
артерии (справа) — пучки сосудов на уровне сегментарных артерий обви |
|||
|
|||
вают бронхи. Стрелки отмечают большие правые легочные артерии, сдав |
шен внизу по нижнему краю грудины |
ливающие главный бронх |
и на верхушке. Он генерируется зак |
Глава 48. ВРОЖДЕННОЕ ОТСУТСТВИЕ КЛАПАНА ЛЕГОЧНОЙ АРТЕРИИ |
679 |
|
|
|
|
рывающимся аортальным клапаном. Прерывис тость систолодиастолического шума отличает его от типичного непрерывного шума ОАП.
Вследствие обструктивной природы дыхатель ной недостаточности увеличение печени наблю дается редко. Однако у некоторых пациентов с вы раженной сердечной недостаточностью печень может быть значительно увеличенной. У больных без явной сиптоматики II сердечный тон может быть расщеплен, что указывает на наличие функ ционирующего клапана. В этих случаях на вскры тии обнаруживают двустворчатый легочный кла пан. У пациентов, переживших первый год жизни, симптомы дыхательной недостаточности спон танно уменьшаются, исчезает цианоз. Синюш ность исчезает при реверсии шунта вследствие снижения ЛСС, что обычно происходит в неона тальном периоде. При снижении сосудистого соп ротивления уменьшаются недостаточность клапа на легочной артерии, диастолическая перегрузка правого желудочка и право левый сброс на желу дочковом уровне во время диастолы. Небольшой шунт крови справа налево во время диастолы мо жет сохраняться даже при умеренном систоличес ком сбросе слева направо.
Электрокардиография. Для тетрады Фалло и от сутствия клапана легочной артерии характерна ги пертрофия правого желудочка. При наличии ДМЖП, перекрестного или лево правого шунта может регистрироваться гипертрофия обоих желу дочков. Изолированная недостаточность клапана на ЭКГ проявляется невыраженной гипертрофией правого желудочка, которую можно заподозрить по rsR' в правых отведениях.
Рентгенография. На обзорной рентгенограмме умеренно увеличенное сердце с резко расширен ными стволом и ветвями легочной артерии (рис. 2). Однако при правосторонней дуге, сильно раз дутом легком со смещением сердца влево анев ризматическая дилатация легочных артерий мо жет не быть очевидной. Легочные артерии могут быть расположены медиально и скрыты в тени средостения. Плотные корни напоминают опу холь, но легко идентифицируются на флюороско пии по пульсации, синхронной с сердечными сок ращениями. Выбухающая тень по левому верхне му краю сердца образована дилатированным вы водным трактом правого желудочка. Это объясня ется ротацией сердца влево. Периферический ле гочный рисунок обычно нормальный и может
быть усиленным у старших младенцев и детей с преимущественным лево правым сбросом. Нередко отмечаются односторонняя обструктивная эмфи зема и ателектаз отдельных сегментов со смещением сердца в противопо ложную сторону.
При изолированной врожденной недостаточности клапана легочной ар терии рентгенологическая картина может быть почти нормальной, тем не менее можно обнаружить усиленную пульсацию артерий и «пляску» кор ней. При этом дилатация легочных ар терий не достигает аневризматических пропорций, типичных для тетрады Фалло с отсутствующим легочным клапаном.
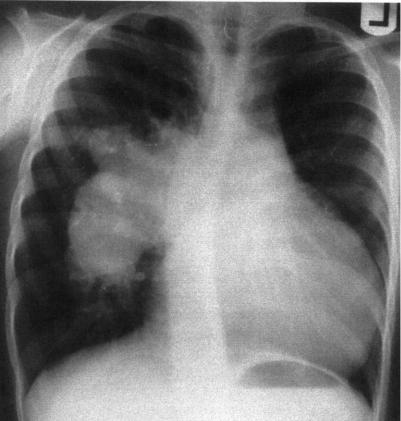
Рис. 2. Рентгенограмма грудной клетки в переднезадней проекции у па циента с отсутствующим клапаном легочной артерии при тетраде Фалло. Видна резко расширенная правая ветвь легочной артерии
Эхокардиография. Так же, как и при классической форме тетрады Фалло, парастернальный доступ по длинной оси, а также четырехкамерный доступ позволяют увидеть большой ДМЖП и праводеленность аорты. Правый же лудочек значительно дилатирован, и часто парадоксальное движение меж желудочковой перегородки является признаком недостаточности легочно го клапана. В большинстве случаев
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
680 |
Часть 8. ПОРОКИ ВЫХОДНОГО ТРАКТА ПРАВОГО ЖЕЛУДОЧКА |
|
|
|
|
можно определить малоподвижный рудиментар ный легочный клапан в стенозированном кольце. При парастернальном доступе по короткой оси можно увидеть дилатацию легочного ствола и обе их легочных артерий.
ДопплерЭхоКГ выявляет скоростной антеград ный систолический ток через суженное легочное кольцо и ретроградный диастолический ток не достаточности клапана в легочной артерии и вы водном тракте правого желудочка. Характер тока крови в легочной артерии может имитировать ОАП, однако ретроградный диастолический кро воток в выводном тракте свидетельствует в пользу недостаточности клапана.
Точному диагнозу мешают смещение средосте ния из за перерастяжения легких и искажение анатомии сердца при резкой дилатации легочных артерий, поэтому необходимо найти атипичное положение датчика, чтобы получить надлежащее изображение. Эхокардиографический диагноз этого порока можно поставить до родов. Имеются сообщения, что аномалия может быть причиной водянки плода.
Катетеризация сердца. При наличии дефекта межжелудочковой перегородки и стеноза легоч ной артерии давление в правом желудочке равно системному с преимущественным право левым сбросом на желудочковом уровне. При отсутствии значительного сужения в неонатальном периоде ЛСС снижается, падает давление в правом желу дочке и шунт приобретает лево правое направле ние, хотя систолический градиент давления между правым желудочком и легочной артерией всегда имеется. Диастолическое давление в легочной ар терии обычно равно таковому в правом желудочке. Только после многочисленных попыток удается получить точное давление в легочной артерии из за артефактов, вызванных турбулентностью и тя желым затруднением дыхания у младенцев. Си нюшным детям с дыхательной недостаточностью во время катетеризации введение седативных средств противопоказано из за опасности оста новки дыхания. В этих случаях рекомендуется ме ханическая вентиляция легких.
При изолированной недостаточности легочно го клапана давление в правом желудочке и легоч ной артерии нормальное. Отмечаются небольшой систолический градиент на клапане вследствие высокой скорости кровотока через нормальное легочное кольцо и увеличенный ударный объём правого желудочка. В редких случаях встречается истинный стеноз клапана разной степени выра женности.
Ангиокардиография демонстрирует локализа
цию и выраженность сужения легочного кольца, ориентацию инфундибулума и дилатацию легоч ных артерий. Створки клапана не идентифициру ются, но на уровне стеноза клапанного кольца можно увидеть дискретный гребень рудиментар ного клапана. Инфундибулум и правый желудочек обычно дилатированы. При выраженном стенозе виден сброс контрастного вещества справа налево. Контраст дольше задерживается в правом желу дочке из за недостаточности клапана. Контрасти рование легочной артерии позволяет увидеть на личие недостаточности клапана и выраженную дилатацию легочных артерий. В редких случаях одна из ветвей отходит от восходящей аорты.
Конечно диастолический объём правого желу дочка у тяжелых детей с плохим прогнозом суще ственно больше, чем у детей, переживших неона тальный период. Относительные размеры дилати рованной правой легочной артерии коррелируют с частотой осложнений и летальности: чем шире правая легочная артерия, тем хуже исходы естест венного течения.
Киноангиография позволяет оценить выра женность аномалии ветвления легочных артерий в корнях легких.
Естественное течение
В мире накоплен большой опыт пренатальной диагностики аномалий конотрункуса (51), в том числе тетрады Фалло. Представляют интерес исхо ды фетальных случаев тетрады Фалло с отсутству ющим клапаном легочной артерии. Так, из 18 слу чаев, диагностированных в пренатальном периоде (52), в 7 случаях семьи приняли решение о преры вании беременности, у 4 плодов наступила спон танная внутриутробная смерть, 3 детей умерли в неонатальном периоде и 2 — умерли в младенчес ком возрасте. Таким образом, только 2 детей вы жили (18%) при сохраненной беременности. В не которых из этих случаев была диагностирована во дянка плода и полноводие (53). В другой публика ции (54) диагноз синдрома был поставлен в 20 слу чаях, в 6 из них беременность завершена в срок, в 3 случаях наступила внутриутробная смерть, 5 но ворожденных умерли, 3 ребенка умерли в младен ческом возрасте и 3 пациента остались живыми. Десять из 11, родившихся живыми младенцев нуждались в ранней вентиляции.
Прогноз при этом синдроме зависит от тяжести обструкции трахеобронхиального дерева. Часто причинаи смерти являются банальная респира торная инфекция на фоне обструктивной эмфизе мы и ателектазы. В легких случаях состояние
Глава 48. ВРОЖДЕННОЕ ОТСУТСТВИЕ КЛАПАНА ЛЕГОЧНОЙ АРТЕРИИ |
681 |
|
|
|
|
спонтанно улучшается к 6–9 мес первого года жизни. Это происходит благодаря созреванию структуры бронхов и снижению давления в легоч ных артериях. У новорожденных нормальной осо бенностью трахеобронхиального дерева является слабость хрящевой, мышечной и эластической ткани трахеи и бронхов. В процессе созревания бронхи становятся более жесткими и устойчивы ми к внешнему давлению. Зрелые бронхи стано вятся более широкими, поэтому внешнее давле ние создаёт меньшую обструкцию. Снижение ЛСС и прогрессирование сужения клапана приво дят к уменьшению давления в легочной артерии и к меньшему растяжению дилатированых легочных артерий (55–59).
Только изредка пациенты с этим синдромом обнаруживаются среди взрослых людей (60, 61). У некоторых больных клиническая картина его такая же, как у пациентов с обычной тетрадой Фалло; другие в неонатальном или младенческом возрасте поступают в клинику с дыхательной или сердечной недостаточностью. Сдавление бронхов приводит к гипервентиляции и рецидивирующему неонатальному пневмотораксу с дальнейшим ухудшением состояния. Большинство больных требуют хирургического вмешательства в неона тальном периоде или младенческом возрасте.
Хирургическое лечение
Исторически хирургическое лечение было нап равлено на устранение аневризматического рас ширения легочных артерий, однако на протяже нии многих лет не был выработан однозначный подход к лечению этой патологии. Некоторые хи рурги применяли суживание или перевязку легоч ной артерии для уменьшения их пульсации с нало жением анастомоза по Blalock–Taussig или без не го (62–65). Применялись также ушивание анев ризм (66, 67), аневризмoррафия с подвешиванием легочной артерии к ретростернальной фасции (68). Описан метод транслокации легочной арте рии из заднего средостения в переднее с помощью протеза (64). Некоторые авторы как дополнение к полной коррекции порока предлагают использо вать маневр Lecompte — перемещение легочной артерии кпереди от аорты и далеко от трахеоброн хиального дерева (55).
Ни один из этих паллиативных методов не был достаточно эффективным. Хирургическая леталь ность была достаточно высокой, однако послед ние сообщения об использовании аортальных го мографтов демонстрируют улучшение результатов (69–73). В течение последнего десятилетия по ме
ре накопления опыта коррекции различных поро ков в неонатальном возрасте большинство хирур гов предпочитают одноэтапное лечение. Оно пре дусматривает имплантацию гомоклапана, кондуи та или моностворки в легочную позицию, закры тие заплатой ДМЖП и гофрирование одной или обеих легочных артерий (74–88). Имплантация клапана даёт лучший гемодинамический резуль тат, о чем свидетельствует улучшение физической работоспособности и функционального состоя ния правого желудочка (89). Имеется много сооб щений о полной коррекции порока с имплантаци ей механического клапана и хорошим клиничес ким результатом (43, 69, 90, 91).
Иногда может потребоваться стентирование крупных бронхов при тяжелом сужении. При вы раженном растяжении легкого может возникнуть необходимость удаления пораженного сегмента или лобэктомии. Corno и соавторы (81) устраняли компрессию бронха после коррекции порока пу тем пересечения аневризматически расширенной легочной артерии и её удлинения с помощью кон дуита.
Главным фактором, определяющим леталь ность, является выраженность легочных проявле ний синдрома. Дооперационная ангиографичес кая оценка аномалий ветвления сегментарных ле гочных артерий очень важна для прогнозирования исхода (24). Сосудистые изменения могут оказать ся настолько выраженными, что они не совмести мы с жизнью как после операции, так и без неё.
У пациентов без симптоматики или с невыра женными проявлениями дыхательной недостаточ ности операцию обычно откладывают до старшего возраста, когда хирургическая летальность значи тельно ниже (43, 66, 73, 92–96).
Результаты хирургического лечения
Педиатрический консорциум, занимающийся вопросами лечения заболеваний сердца, предста вил данные об исходах лечения 41 пациента с тет радой Фалло и отсутствующим клапаном легоч ной артерии (88). Двадцать пациентов (48,8%) умерли. Большинство из них были в неонаталь ном или младенческом возрасте, с массой тела ме нее 5 кг. В другом сообщении (80) из 28 опериро ванных в возрасте от 1 дня до 16 лет (в среднем 11 дней) 6 (21,4%) умерли в раннем послеоперацион ном периоде и 1 — в отдаленные сроки. Выживае мость к 1 году составила 77% и к 10 годам — 72%. Трое пациентов подвергнуты повторным опера циям из за сохраняющейся дыхательной недоста точности, которая была устранена после повтор
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
