
4 курс / Общая токсикология (доп.) / Врожденные пороки сердца
.pdf582 |
Часть 8. ПОРОКИ ВЫВОДНОГО ТРАКТА ПРАВОГО ЖЕЛУДОЧКА |
|
|
|
|
28.Wearn JT, Mettier SR, Klumpp TG, Zschiesche U. The nature of the vascular communications between the coronary arteries and the cham bers of the heart. Am Heart J 1933; 9: 143 64.
29.Freedom RM, Harrington DP. Contribution of intra myocardial sinu soids in pulmonary atresia and intact ventricular septum to a right sided circular shunt. Br Heart J 1974; 36: 1061 5.
30.Gittenberger de Groot AC, Tennstedt C, Chaoui R et al. Ventriculo coro nary arterial communications (VCAC) and myocardial sinusoids in hearts with pulmonary atresia with intact ventricular septum: two dif ferent diseases. Progr Pediatr Cardioi 2001; 13: 157 64.
31.Daubeney PE, Sharland GK, Cook AC et al. Pulmonary atresia with intact ventricular septum: impact of fetal echocardiography on inci dence at birth and postnatal outcome. UK and Eire collaborative study of pulmonary atresia with intact ventricular septum. Circulation 1998;
98:562 6.
32.Scognamiglio R, Daliento L, Razolini R, et al. Pulmonary atresia with intact ventricular septum: a quantitative cineven triculographic study of the right and left ventricular function. Pediatr Cardiol 1986;7:183 187.
33.Hanley FL, Sade RM, Blackstone EH et al. Outcomes in neonatal pul monary atresia with intact ventricular septum. J Thorac Cardiovasc Surg 1993; 105: 406 27.
34.Ono M, Otake S, Fukushima N et al. Huge right ventricle right coronary artery fistula compromising right ventricular function in a patient with pulmonary atresia and intact ventricular septum: a case report. J Thorac Cardiovasc Surg 2001; 122: 1030 2.
35.Coles JG, Freedom RM, Lightfoot NE et al. Long term results in neonates with pulmonary atresia and intact ventricular septum. Ann Thorac Surg 1989; 47: 213 37.
36.Freedom RM, Yoo SJ, Javois A. A most peculiar coronary circulation in a patient with pulmonary atresia and intact ventricular septum. Cardiol Young 2000; 10: 60 3.
37.Keane JF, McFaul R, Fellows K. Balloon occlusion angiography in infancy: methods, uses and limitations. Am J Cardiol 1985;56:495 497.
38.Vincent RN, Hawkins LE, Peleck AN, Collins GE. Balloon occlusion angiography Can J Cardiol 1987;3:52 59.
39.Burrows PE, Freedom RM, Benson LN, Moes CAE. Coronary angiog raphy of pulmonary atresia, hypoplastic right ventricle, and ventriculo coronary communications. Am J Roentgenol 1990;154:789 795.
40.Burrows PE, Benson LN, Freedom RM. Coronary angiography in pul monary atresia with intact ventriular septum. In Freedom RM, ed. Pulmonary atresia with intact ventricular septum. Mount Kisco, New York: Futura, 1989:206 228.
41.Allan LD, Cook A. Pulmonary atresia with intact ventricular septum in the fetus. Cardiol Young 1992; 2: 367 76.
42.Arzt W, Thlzer G, Aigner M, Mair R, Hafner E. Invasive intrauterine treat ment of pulmonary atresia/intact ventricular septum with heart failure. Ultrasound Obstet Gynecol 2003; 21:186 8.
43.Patel CR, Dahms BB, Sallee D. Pulmonary atresia with intact ventricu lar septum, right sided aortic arch and ventriculocoronary connection – prenatal echocardiographic diagnosis. Cardiol Young 2001; 11: 352 4.
44.Todros T, Paladini D, Chiappa E et al. Pulmonary stenosis and atresia with intact ventricular septum during prenatal life. Ultrasound Obstet Gynecol 2003; 21: 228 33.
45.Sharland G. Pulmonary valve abnormalities. In: Allan L, Hornberger L, Sharland G, eds. Textbook of Fetal Cardiology. London: Greenwich Medical Media, 2000: 333 47.
46.Maeno YV, Boutin C, Hornberger LK et al. Prenatal diagnosis of right ventricular outflow tract obstruction with intact ventricular septum, and detection of ventriculocoronary connections. Heart 1999; 81: 661 8.
47.Sandor GSS, Cook AC, Sharland G et al. Coronary arterial abnormali ties in pulmonary atresia with intact ventricular septum diagnosed dur ing fetal life. Cardiol Young 2002; 12:436 44.
48.Baschat AA, Love JC, Stewart PA, Gembruch U, Harman CR. Prenatal diagnosis of ventriculocoronary fistula. Ultrasound Obstet Gynecol 2001; 18: 39 43.
49.Roberson DA, Silverman NH. Ebstein's anomaly: echocardiographic and clinical features in the fetus and neonate. J Am Coll Cardiol 1989;
14:1300 7.
50.Lang D, Oberhoffer R, Cook A et al. Pathologic spectrum of malforma
tions of the tricuspid valve in prenatal and neonatal life. J Am Coil Cardiol 1991; 17(5): 1161 7.
51.Hornberger LK, Sahn DJ, Kleinman CS, Copel JA, Reed KL. Tricuspid valve disease with significant tricuspid insufficiency in the fetus: diagno sis and outcome. J Am Coil Cardiol 1991; 17:167 73.
52.Daubeney PE, Sharland GK, Cook AC, Keeton BR, Anderson RH, Webber SA. Pulmonary atresia with intact ventricular septum: impact of fetal echocardiography on incidence at birth and postnatal outcome. UK and Eire Collaborative Study of Pulmonary Atresia with Intact Ventricular Septum. Circulation 1998; 98:562 566.
53.McArthur JD, Munsi SC, Sukumar IP, Cherian G. Pulmonary valve atre sia with intact ventricular septum. Report of a case with long survival and pulmonary blood supply from an anomalous coronary artery. Circulation 1971; 44: 740 5.
54.Robicsek F, Bostoen H, Sanger PW. Atresia of the pulmonary valve with normal pulmonary artery and intact ventricular septum in a 21 year old woman. Angiology 1966; 17: 896 9.
55.Jonas R. Comprehensive surgical management of congenital heart dis ease. Arnold, 2004,460
56.Freedom R (ed). PulmonoryAtresia with Intact Ventricular Septum. Mt Kisco, NY, Futura Publishing Co., 1989.
57.Gibbs JL, Rothman MT, Rees MR et al. Stenting of the arterial duct: a new approach to palliation for pulmonary atresia. Br Heart J 1992; 67: 240 5.
58.Ruiz CE, Bailey LL. Stenting the ductus arteriosus. A "wanna Be" Blalock Taussig. Circulation 1999; 99: 2608 9.
59.Parsons iM, Reese MR, Gibbs JL. Percutaneous laser valvotomy with balloon dilatation of the pulmonary valve as primary treatment for pul monary atresia. BrHearti 1991; 66:36 38.
60.Galindo A, Drant S. Pulmonary atresia with intact ventricular septum (PAIIVS): diagnostic and interventional cardiac catheterization in the neonate. Progr Pediatr Cardiol 2001; 13:177 82.
61.Justo RN, Nykanen DG, Williams WG, Freedom RM, Benson LN. Transcatheter perforation of the right ventricular outflow tract as initial therapy for pulmonary valve atresia and intact ventricular septum in the newborn. Cathet Cardiovasc Diagn 1997; 40(4): 408 13.
62.Cheung YF, Leung MR, Chau AKT. Usefulness of laser assisted valvo tomy with balloon valvuloplasty for pulmonary valve atresia with intact ventricular septum. Am J Cardiol 2002; 90:438 42.
63.Ovaert C, Qureshi SA, Rosenthal E, Baker EJ, Tynan M. Growth of the right ventricle after successful transcatheter pulmonary valvotomy in neonates and infants with pulmonary atresia and intact ventricular sep tum. J Thorac Cardiovasc Surg 1998; 115: 1055 62.
64.Aiwi M, Geetha K, Bilkis AA et al. Pulmonary atresia with intact ventric ular septum percutaneous radiofrequency assisted valvotomy and bal loon dilation versus surgical valvotomy and Blalock Taussig shunt. J Am Coil Cardiol 2000; 35(2):468 76.
65.Freeman JE, DeLeon SY, Lai S et al. Right ventricle to aorta conduit in pulmonary atresia with intact ventricular septum and coronary sinu soids. Ann Thorac Surg 1993; 56: 1393 4.
66.Laks H, Gates RN, Grant PW et al. Aortic to right ventricular shunt for pulmonary atresia and intact ventricular septum. J Thorac Cardiovasc Surg 1995; 59: 342 7.
67.Starnes VA, Pitlick PT, Bernstein D, Grif fin ML, Choy M, Shumway NE. Ebstein's anomaly appearing in the neonate: a new surgical approach. J Thorac Cardiovasc Surg 1991;101:1082 1087.
68.Peacock TB. Malformation of the heart: Atresia of the orifice of the pul monary artery. Trans Pothol SocLondl869; 20:61.
69.Greenwold WE. A Clinico Pathologic Studyof Congenital Tricuspid Atresio and of Pulmonary Stenosis or Pulmonary Atresio with Intact Ventricular Septum. Thesis, University of Minnesota, November 1955.
70.Davignon AL, Greenwoid WE, DuShane JW, Edwards IE. Congenital pulmonary atresia with intact ventricular septum. Clinicopathologme correlation of two anatomic types. Am Hearti 1961; 62 :591.
71.Benton 1W, Elliott LP, Adams P, Anderson RC, Hong CY, Lester RG. Pulmonary atresia and s with intact ventricular septum. Am J Dis Child 1962; 104:83.
72.Bowman FO, Maim JR, Hayes Ci, Gersony WM, Ellis K. Pulmonary atresia with intact ventricular septum. J Thorac CardiovoscSurg 1971; 61:85 95.
Глава 45. АТРЕЗИЯ ЛЕГОЧНОЙ АРТЕРИИ С ИНТАКТНОЙ МЕЖЖЕЛУДОЧКОВОЙ ПЕРЕГОРОДКОЙ |
583 |
|
|
|
|
73.Marino B, Guccione P, Carotti A et е. Ductus arteriosus in pulmonary atresia with and without ventricular septal defect. Scand J Thorac Cardiovasc Surg 1992; 26: 93 6.
74.Pacileo G, Pisacane C, Russo MG, Calabro R. Left ventricular function in pulmonary atresia with intact ventricular septum after systemic to pulmonary arterial shunt. Cardiol Young 1994; 4: 110 16.
75.Starnes VA, Pitlick PT, Bernstein D et al. Ebstein's anomaly appearing in the neonate. A new surgical approach. J Thorac Cardiovasc Surg 1991; 101: 1082 7.
76.Anselmi G, Munoz S. Blanco P, Carbonell L, Puigbo JJ. Anomalous coronary artery connecting with the right ventricle associated with pul monary stenosis and atrial septal defect. Am Heart J 1961; 62: 406 14.
77.Williams RR, Kent GBJ, Edwards JE. Anomalous cardiac blood vessel communicating with the right ventricle. Arch Pathol 1951; 52: 480 7.
78.Gentles IL, Keane JF, Jonas RA, Marx GE, Mayer JE. Surgical alterna tives to the Fontan procedure incorporating a hypoplastic right ventri cle. Circulation 1994; 90 (Suppl 10): 1 6.
79.Jahangiri M, Zurakowski D, Bichell D, MayerJE, del Nido Pi, Jonas RA. Improved results with selective management in pulmonary atresia with intact ventricular septum. J Thorac Cardiovasc Surg 1999; 118:1046 1055.
80.Gentles IL, Colan SD, Giglia TM, Mandeli VS, Mayer IE, Sanders SP. Right ventricular decompression and left ventricular function in pul monary atresia with intact ventricular septum. Circulation 1993; 88:183 188.
81.Powell AJ, Mayer JE, Jahangiri M et al. Improved results with selective management in pulmonary atresia with intact ventricular septum. J Tharac Cordiovasc Surg 1999; 118:1046 1055.
82.Giglia TM, Mandell VS, Connor AR, Mayer JE, Lock JE. Diagnosis and management of right ventricle dependent coronary circulation in pul monary atresia with intact ventricular septum. Circulation 1992; 86:1516 1528.
83.Ashburn DA, Blackstone EH, Wells Wi et al. Determinants of mortality and type of repair in neonates with pulmonary atresia and intact ven tricular septum. J Thorac Cardiovosc Surg, in press.
84.Blackstone EH, Kirklin JW, Hanley FH. What proportion of neonates with pulmonary atresia and intact ventricular septum reach definitive repair abstract. Circulation 1996; 94(Suppl):1 173.
85.Raunikar RA, Stron WB. Pulmonary atresia with intact ventricular sep tum. In: Moller JH, ed. Surgery of Congenital Heart Disease. Pediatric Cardiac Care Consortium 1984 1995. Armonk, NY: Futura, 1998: 257 70.
86.Pawade A, Capuani A, Penny DI, Karl TR, Mee RB. Pulmonary atresia with intact ventricular septum: surgical management based on right ventricular infundibulum. J Card Surg 1993; 8:371 383.
87.Bull C, Kostelka M, Sorensen K, de Leval M. Outcome measures for the neonatal anagement of pulmonary atresia with intact ventricular sep tum. J Thorac Cardiovasc Surg 1994;107 :3 59 3 66.
88.Laks H, Pearl JM, Drinkwater DC et al. Partial biventricular repair of pulmonary atresia with intact ventricular septum. Use of an adjustable atrial septal defect. Circulation 1992; 86(Suppl 5):11159 166.
89.Tulzer G, Arzt W, Franklin RC, Loughna PV, Mair R, Gardiner HM. Fetal pulmonary valvuloplasty for critical pulmonary stenosis or atresia with intact septum. Lancet 2002; 360:1567 1568.
90.Kreutzer C, Mayorquim RC, Kreutzer GO et al. Experience with one and a half ventricle repair. JThoracCardiovoscSurg 1999; 117 :662 668.
91.Stellin G, Vida VL, Milanesi O et al. Surgical treatment of complex car diac anomalies: the one and one half ventricle repair. Eur J Cardiothorac Surg 2002; 22:1043 1049.
92.Agnoletti O, Piechaud JF, Bonhoeffer P et al. Perforation of the atretic pul monary valve. Long term follow up. J Am Coll Cardiol 2003; 41: 1399 1403.
93.AIwi M, Geetha K, Bilkis AA et al. Pulmonary atresia with intact ven tricular septum percutaneous radiofrequency assisted valvotomy and balloon dilation versus surgical valvotomy and Blalock Taussig shunt. J Am Coll Cardial 2000; 35:468 476.
94.Ovaert C, Qureshi SA, Rosenthal E, Baker EJ, Tynan M. Growth of the right ventricle after successful transcatheter pulmonary valvotomy in neonates and infants with pulmonary atresia and intact ventricular sep tum. J Thorac Cordiovasc Surg 1998; 115: 1055 1062.
95.Humpl T, Soderberg B, McCrindle BW et al. Percutaneous balloon valvotomy in pulmonary atresia with intact ventricular septum: the impact on patient care. Circulation 2003; 108:826 32.
96.Stellin G, Vida VI, Milanesi O et al. Surgical treatment of complex car diac anomalies: the one and a half ventricle repair. Eur J Cardiothorac Surg 2002; 22: 1042 50.
97.Mair DD, Julsrud PR, Puga FJ, Danielson GK. The Fontan procedure for pulmonary atresia with intact ventricular septum: operative and late results. J Am Coil Cordial 1997; 29:1359 1364.
98.Najm H, Williams WG, Coles JG, Rebeyka I, Freedom RM. Pulmonary atresia with intact ventricular septum: results of the Fontan procedure. Ann Thorac Surg1997; 63: 669 75.
99.Powell AJ, Mayer JE, Lang P, Lock JE. Outcome in infants with pul monary atresia, intact ventricular septum, and right ventricle depend ent coronary circulation. Am J Cardiol 2000; 86: 1272 4.
100.Akagi T, Benson LN, Williams WG, Trusler GA, Freedom RM. Ventriculo coronary arterial connections in pulmonary atresia with intact ventricular septum, and their influences on ventricular perform ance and clinical course. Am J Cardiol 1993; 72:586 90.
101.Leonard H, Derrick G, O'Sullivan J, Wren C. Natural and unnatural history of pulmonary atresia. Heart 2000; 84: 499 503.
102.Zuberbuhier JR, Anderson RH. Morphological variations in pulmonary atresia with intact ventricular septum. Br Heart J 1979; 41: 281 8.
103.Razzouk AJ, Freedom RM, Cohen AJ et al. The recognition, identifi cation of morphological substrate, and treatment of subaortic stenosis after a Fontan operation: an analysis of 12 patients. J Thorac Cardiovasc Surg 1992; 104: 938 44.
104.van Son JA, Falk V, Black MD, Haas GS, Mohr FW. Conversion of com plex neonatal Ebstein's anomaly into functional tricuspid or pulmonary atresia. Fur J Cardiothorac Surg 1998; 13:280 4; discussion 284 5.
105.DeLeon MA, Gidding SS, Gotteiner N, Backer CL, Mavroudis C. Successful palliation of Ebstcin's malformation on the first day of life following fetal diagnosis. Cardiol Young 2000; 10:384 7.
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/

Глава 46
АТРЕЗИЯ ЛЕГОЧНОЙ АРТЕРИИ
С ДЕФЕКТОМ МЕЖЖЕЛУДОЧКОВОЙ ПЕРЕГОРОДКИ
Атрезия легочной артерии с ДМЖП (АЛА ДМЖП) является сложным пороком сердца и ле гочных артерий, который характеризуется отсут ствием прямого сообщения между правым желу дочком и легочными артериями, аномалиями строения легочного артериального русла и экстра кардиальными источниками легочного кровооб ращения. Жизнь больных зависит от персистен ции артериального протока в неонатальном воз расте и функционирования дискретных аортоле гочных коллатеральных артерий.
В процессе выделения этого порока в самосто ятельную нозологическую форму специалисты пользовались также другими определениями: тет рада Фалло с АЛА, псевдотрункус артериосус, об щий артериальный ствол IV типа. В эту группу не включают пациентов с АЛА и интактной межже лудочковой перегородкой, трикуспидальной атре зией, ТМА, одножелудочковым сердцем, гипопла зией правого желудочка — аномалиями, которые также могут сопровождаться легочной атрезией, поскольку каждая из них имеет особую гемодина мику и представляет собой отдельную проблему с точки зрения ее хирургического решения. На ІІІ
Международной конференции по разработке но менклатуры для ВПС (New Orlean, 1999) оконча тельно утвержден термин «АЛА с ДМЖП» (30, 31).
Всестороннее изучение анатомии и роли боль ших аортолегочных коллатералей впервые провели Macartney и соавторы (1, 2). Они изложили кон цепцию многофокусного кровоснабжения легких через центральные легочные артерии и большие аортолегочные коллатеральные артерии (БАЛКА).
Характерные особенности кровообращения создают прямую угрозу жизни с первых минут собственного газообмена. Выживание больных за висит от двух факторов: функционирования ОАП в неонатальном возрасте и функционирования БАЛКА после инволюции протока. Как ОАП, так и БАЛКА являются временными сосудами мы шечного типа, склонными к спонтанному стено зированию (3), которое при ОАП приводит к быстрому закрытию этого сосуда в течение первых часов или недель после рождения.
Изменения в легочных сосудах и паренхиме происходят в результате сложного взаимодействия альтернативных процессов, обусловленных не преодолимым барьером в виде коротких или расп ространенных сегментов атрезии (агенезии) ле гочных артерий на пути от правого желудочка к мелким внутрилегочным артериям, и компенси рующих механизмов доставки крови в газообмен ные участки легких через ОАП, БАЛКА и гипер плазированную систему бронхиальных артерий.
Разные сегменты, а часто и субсегменты легких оказываются в разных режимах кровоснабжения. Атрезия легочных артерий с ДМЖП выделяется среди других ВПС наибольшим полиморфизмом анатомо гемодинамических вариантов. Подавля ющее большинство этих отличий лежат за преде лами самого сердца.
В тактике хирургического лечения АЛА ДМЖП постепенно утвердился принцип поэтап ной паллиативной коррекции внесердечной пато логии с последующей окончательной операцией. Наибольший вклад в обоснование этой тактики внесли труды Sаwatari и соавторов (4, 5) и Puga (6). Не так давно опубликованы работы авторов из Сан Франциско, в которых они продемонстриро вали возможность ранней одноэтапной коррекции порока.
Наш собственный опыт охватывает 208 хирур гических вмешательств у 128 больных с АЛА ДМЖП.
ЧАСТОТА
Порок встречается с частотой 0,013–0,1 на 1000 детей, родившихся живыми (7–9), и составляет в 1–3% всех ВПС (10,11).
ЭМБРИОГЕНЕЗ
Для изучения сложной природы легочного кро вообращения при этом пороке необходимо понять происхождение легочного сосудистого русла. Ле гочный ствол образуется в результате разделения трункуса и аортального мешка артериальной пере
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/

586 |
Часть 8. ПОРОКИ ВЫВОДНОГО ТРАКТА ПРАВОГО ЖЕЛУДОЧКА |
|
|
|
|
|
|
|
|
|
|
|
риями, берущими начало от нисходящей грудной |
|
|
|
|
|
|
|
|
аорты и не исчезнувшими вследствие инволюци |
|
|
|
|
|
|
|
|
онных процессов. Они увеличиваются и приобре |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
тают вид БАЛКА, осуществляющих почти все ле |
|
|
|
|
|
|
|
|
гочное кровообращение. Вклад бронхиальных ар |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
терий несравнимо меньший. |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
Причины возникновения АЛА ДМЖП носят |
|
|
|
|
|
|
|
|
многофакторный характер. Как и при других по |
|
|
|
|
|
|
|
|
роках конотрункуса, у 20–40 % пациентов с этим |
|
|
|
|
|
|
|
|
пороком отмечается делеция хромосомы 22q11 |
|
|
|
|
|
|
|
|
(12–23). |
|
|
|
|
|
|
|
|
КЛАССИФИКАЦИЯ И АНАТОМИЯ |
|
|
|
|
|
|
|
|
Анатомия сердца |
|
|
|
|
|
|
|
|
Строение сердца при АЛА ДМЖП соответ |
|
|
|
|
|
|
|
|
ствует морфологии тетрады Фалло, из за чего эти |
|
|
|
|
|
|
|
|
два порока объединяли в одну нозологическую |
|
|
|
|
|
|
|
|
единицу. Оба желудочка нормальных размеров, с |
|
|
|
|
|
|
|
|
гипертрофией правого, сообщаются через боль |
|
|
|
|
|
|
|
|
шой перимембранозный ДМЖП несоосного типа. |
|
Рис. 1. Схема эмбрионального развития легочных артерий |
Расположение дефекта обусловлено смещением |
|||||||
(по Freedom, 1997) (ИСА — межсегментарные артерии, ЛС |
инфундибулярной перегородки кпереди (24,25). |
|||||||
— легочный ствол, ПЛА — правая легочная артерия, ЛЛА |
Дефект иногда располагается в других частях меж |
|||||||
— левая легочная артерия) |
||||||||
желудочковой перегородки. Редко наблюдается |
||||||||
|
|
|
|
|
|
|
||
городкой с образованием аорты и легочного ство |
рестриктивный дефект. Механизм образования |
|||||||
ла. Эмбриональный артериальный ствол делится |
рестриктивного ДМЖП связывают с аномальным |
|||||||
на левую и правую вентральные аорты, которые со |
прикреплением септальной створки трехстворча |
|||||||
единяются, образуя дорсальную (нисходящую) |
того клапана. Большой дефект наблюдается у 85% |
|||||||
аорту. От артериального ствола отходит 6 пар аор |
больных, рестриктивный — у 15% (26), у 15% |
|||||||
тальных дуг. В норме I–V пары запустевают. Из |
пациентов имеется дополнительный мышечный |
|||||||
вентральной части VI пары формируются внутри |
дефект. |
|||||||
перикардиальные правая и левая легочные артерии |
У большинства пациентов положение сердца в |
|||||||
(рис. 1). Внутрилегочные артерии происходят из |
грудной клетке левостороннее, размещение пред |
|||||||
сосудистых сплетений легочных зачатков. В ран |
сердий также нормальное. Несмотря на характер |
|||||||
нем эмбриональном периоде эти сосудистые спле |
ную для порока конкордантность AV соединения, |
|||||||
тения кровоснабжаются межсегментарными арте |
иногда наблюдают дискордантное или неопреде |
|||||||
риями. Когда сосудистые сплетения соединяются с |
ленное AV соединение, которое бывает у больных |
|||||||
VI аортальными дугами, связи межсегментарных |
с незавершенной латерализацией предсердий (25). |
|||||||
артерий с дорсальными аортами запустевают. Дис |
Корень аорты несколько отклонен вправо, су |
|||||||
тальные части VI аортальных дуг становятся двус |
ществует большая или меньшая степень декстро |
|||||||
торонними артериальными протоками. |
позиции аорты. Аортальный клапан сохраняет не |
|||||||
В результате нарушения нормального развития |
посредственную фиброзную связь с передней |
|||||||
легочной артериальной системы в течение первых |
створкой митрального клапана. |
|||||||
2 мес происходит задержка роста и перерождение |
Аортальный клапан располагается прямо над |
|||||||
в фиброзную ткань определенных элементов сис |
межжелудочковым дефектом (override), иногда |
|||||||
темы легочной артерии с образованием атрезии. В |
(9,3% ) аорта отходит полностью от правого желу |
|||||||
частности, при нарушении развития VI пары аор |
дочка, как при отхождении обоих магистральных |
|||||||
тальных дуг могут полностью отсутствовать одна |
артерий от правого желудочка (26). В 26–50% слу |
|||||||
или обе центральные легочные артерии или они не |
чаев дуга аорты правосторонняя (27). |
|||||||
сливаются. При этих формах порока легочноое со |
Анатомия и распределение коронарных арте |
|||||||
судистое сплетение кровоснабжается персистиру |
рий имеют такой же спектр и частоту отклонений |
|||||||
ющими примитивными межсегментарными арте |
от нормы, как и у больных с тетрадой Фалло. |
|||||||

Глава 46. АТРЕЗИЯ ЛЕГОЧНОЙ АРТЕРИИ С ДЕФЕКТОМ МЕЖЖЕЛУДОЧКОВОЙ ПЕРЕГОРОДКИ |
587 |
|
|
|
|
Анатомия легочных артерий
Классификация
Анатомия легочных артерий отличается поли морфизмом, исчерпывающая классификация ле гочной артериальной патологии отсутствует, в хи рургической практике преобладает индивидуальная характеристика порока, которая носит описатель ный характер. Приводимые ниже классификации не предусматривают систематизации коллатераль ного кровообращения и поэтому недостаточны для принятия тактических и технических решений.
Среди множества предложенных классифика ций наиболее удобной для клинического приме нения и наиболее распространенной является классификация Somerville (28) (рис. 2), согласно которой выделяется четыре типа порока:
•I — атрезия клапана легочной артерии;
•II — атрезия клапана и ствола легочной артерии;
•III — атрезия клапана, ствола и одной из цент ральных ветвей легочной артерии;
•IV — атрезия клапана, ствола и обеих централь ных ветвей легочных артерий.
Распределение нашего клинического материа
ла согласно классификации Somerville приведено в табл. 1.
Таблица 1. Частота различных типов АЛА'ДМЖП по клас' сификации Somerville (данные Института сердечно'сосу' дистой хирургии им. Н.М. Амосова АМН Украины)
Типы АЛА0ДМЖП |
Количество |
Частота, % |
|
|
|
I |
69 |
53,9 |
|
|
|
II |
34 |
26,6 |
|
|
|
III |
3 |
2,3 |
|
|
|
IV |
22 |
17,2 |
|
|
|
Всего |
128 |
100 |
|
|
|
а |
б |
в |
|
г |
Рис. 2. Классификация АЛА–ДМЖП по Somerville: а — I тип, б — II тип, в — III тип, г — IV тип
|
|
б |
|
в |
|
а |
|||||
|
|
|
|||
|
|
|
|
|
г |
|
д |
Рис. 3. Классификация АЛА с ДМЖП по McGoon: а — ат' резия на уровне инфундибулума; б — атрезия на уровне клапана легочной артерии; в — атрезия на уровне прокси' мального отдела легочного ствола; г — агенезия всего ле' гочного ствола; д — атрезия центральных отделов легочных артерий
Классификация McGoon и соавторов (29) построена на том же принципе, однако с большей детализацией анатомии легочного ствола (рис. 3):
•а — атрезия инфундибулярного отдела правого желудочка;
•б — атрезия клапана легочной артерии;
•в — атрезия проксимальной части легочного ствола;
•г — агенезия всего легочного ствола;
•д — атрезия центральных отделов легочных ар терий, отсутствие их соединения.
Обе приведенные классификации не отражают
всех вариантов патологии легочных артерий. Дальнейшее усовершенствование систематизации вариантов анатомии легочных артерий предпри нято на III Международной конференции по раз
работке номенклатуры для ВПС (New Orleans, 1999)(30). Была предложена трехуровневая систе ма классификации (30–31).
Тип А:
•I уровень — имеются истинные легочные арте рии, БАЛКА отсутствуют. Легочный кровоток осуществляется через ОАП;
•II уровень — наличие сливающихся или несли вающихся центральных легочных артерий;
•III уровень — наличие или отсутствие легочного ствола.
Тип B:
•I уровень — наличие центральных легочных ар терий и БАЛКА;
•II уровень — наличие сливающихся или нес ливающихся центральных легочных артерий;
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/

588 |
Часть 8. ПОРОКИ ВЫВОДНОГО ТРАКТА ПРАВОГО ЖЕЛУДОЧКА |
|
|
|
|
• III уровень — наличие или отсутствие легочного ствола.
Тип C:
I уровень — отсутствие центральных легочных артерий, легочный кровоток осуществляется иск лючительно по БАЛКА;
II и III уровни отсутствуют.
Анатомия
Поскольку порок отличается полиморфизмом, |
Рис. 4. |
ствола. |
|
приведенная выше исчерпывающая классифика |
|||
ция громоздка и непрактична. На наш взгляд, бо |
Обе легочные |
|
|
протоком (тип |
и соавт.) |
||
лее целесообразной является индивидуальная ха |
|||
|
|
||
рактеристика порока на основе классификации |
|
|
|
центральных легочных артерий по Somerville и не |
легочных артерий. Существуют различные анато |
||
которой систематизации критериев описания па |
мические варианты центральных легочных арте |
||
тологической анатомии периферических легоч |
рий, каждый из которых имеет особое хирургичес |
||
ных артерий. |
кое значение. Puga (6) выделяет 7 вариантов цент |
||
В зависимости от локализации атрезии разли |
ральных легочных артерий: |
|
|
чают центральные и периферические варианты. К |
• большие сливающиеся артерии автор наблюдал |
||
центральным относятся инфундибулярная и кла |
чаще всего — у 42 % больных (см. рис. 4); |
||
панная атрезия, а также агенезия ствола, бифурка |
• большие несливающиеся — у 13 % больных (рис. 5); |
||
ции, правой и левой центральных легочных арте |
• гипоплазированные сливающиеся — у 25 % |
||
рий, т.е. внутриперикардиальных отделов. Пери |
больных (рис. 6); |
|
|
ферические формы атрезии связаны с поражением |
• гипоплазированные несливающиеся — в 6 % |
||
внеперикардиальных легочных артерий, среди ко |
случаев; |
|
|
торых выделяют легочноартериальные коллекто |
• только одну большую центральную легочную |
||
ры, располагающиеся билатерально в воротах |
артерию — у 5 % больных (рис. 7); |
|
|
каждого легкого экстрапульмонально. Анатоми |
• только одну гипоплазированную центральную |
||
чески они являются продолжением соответствую |
легочную артерию — у 3 % больных (рис. 8); |
||
щих центральных легочных артерий. Коллекторы |
• полное отсутствие ЦЛА — у 6 % больных (рис. 9). |
||
делятся на истинные внутрилегочные артерии — |
Классификация Puga не предусматривает ха |
||
долевые, сегментарные, субсегментарные. |
рактеристику степени гипоплазии центральных |
||
Обструкция выводного тракта правого желу |
легочных артерий. Для расчетов соответствия су |
||
дочка наблюдается в двух формах: инфундибуляр |
ществующих центральных легочных артерий нор |
||
ная атрезия предусматривает наличие камеры |
мальным размерам Alfieri и соавторы (32) разрабо |
||
между миокардом и клапаном, в то время как при |
тали номограмму и формулу, по которой вычисля |
||
клапанной атрезии инфундибулярные мышцы не |
ли отношение суммы площадей поперечного сече |
||
посредственно срастаются с клапаном (26). |
ния правой и левой центральных ветвей легочной |
||
|
артерии к площади поперечного сечения нисходя |
||
Легочный ствол |
щей аорты на уровне диафрагмы. Диаметры легоч |
||
|
ных артерий измеряли на ангиограммах с учетом |
||
Один из типов АЛА предствлен рудиментарным |
коэффициента увеличения, обусловленного тех |
||
стволом легочной артерии, связанным с аортой ар |
никой киносъемки, и сравнивали эти величины с |
||
териальным протоком. Проксимальный конец |
известным диаметром используемого катетера. |
||
ствола облитерирован. В дистальной части ствола, |
Полученные размеры легочной артерии соотноси |
||
как в норме, бифуркация связывает обе легочноар |
ли с возрастом, массой тела или площадью поверх |
||
териальные системы в единое целое (рис. 4). |
ности пациента. В табл. 2 представлено распреде |
||
|
ление наших пациентов по признаку соответствия |
||
Центральные легочные артерии |
(в процентах) норме суммарного сечения цент |
||
|
ральных легочных артерий. |
|
|
Наибольшее разнообразие вариантов АЛА ка |
Распределение легочных артерий по долям и |
||
сается анатомии, размеров и характера ветвления |
сегментам легких — так называемая периферичес |
||
Глава 46. АТРЕЗИЯ ЛЕГОЧНОЙ АРТЕРИИ С ДЕФЕКТОМ МЕЖЖЕЛУДОЧКОВОЙ ПЕРЕГОРОДКИ |
589 |
|
|
|
|
а |
б |
Рис. 5. Ангиокардиограмма больших несливающихся легочных артерий: а — левая гипертензивная легочная артерия, не свя' занная с правой; б — обе гипертензивные легочные артерии не связаны между собой и отходят от нисходящей аорты
Таблица 2. Распределение больных с АЛА ДМЖП по степени гипоплазии центральных легочных артерий (данные Института сердечно сосудистой хирургии им. Н.М. Амосова АМН Украины)
Степень |
Отношение |
Количество |
Частота, |
|
гипоплазии |
к норме, % |
больных |
% |
|
|
|
|
|
|
Норма |
100–85 |
31 |
24,3 |
|
|
|
|
|
|
Умеренная |
84—65 |
39 |
30,4 |
|
гипоплазия |
||||
|
|
|
||
|
|
|
|
|
Выраженная |
64–30 |
34 |
26,6 |
|
гипоплазия |
||||
|
|
|
||
|
|
|
|
|
Резкая |
< 30 |
24 |
18,7 |
|
гипоплазия |
||||
|
|
|
||
|
|
|
|
|
Всего |
|
128 |
100 |
|
|
|
|
|
кая арборизация — редко бывает полным. Непол ная арборизация не охватывает все бронхолегоч ные сегменты и наблюдается у большинства боль ных с данной патологией. Кроме того, на перифе рии встречаются места дискретного стенозирова ния долевых и сегментарных артерий. Выражен ность патологии арборизации оценивают по коли честву изолированных, т.е. не связанных с цент ральными легочными артериями, бронхолегочных сегментов. Возможность выполнения полной кор рекции порока оценивают, в частности, по коли честву изолированных сегментов. Так, если из 20 имеющихся в норме сегментов более 10 изолиро ваны от легочноартериальной системы, давление в правом желудочке после коррекции может ока заться повышенным до опасных пределов и лече
Рис. 6. Ангиокардиограмма при резко гипоплазированных сливающихся легочных артериях. Они заполнены контраст' ным веществом, введенным ретроградно в легочную вену
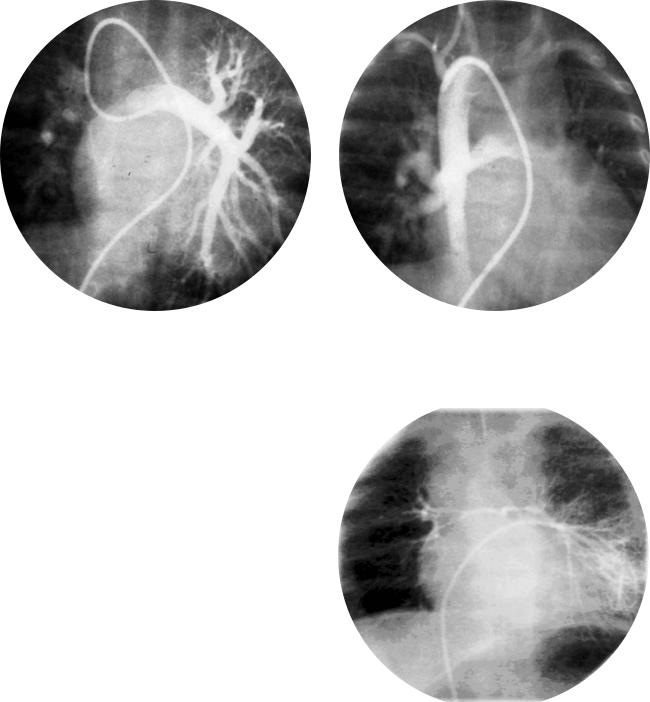
ние целесообразно остановить на паллиативном этапе.
Сливающиеся и несливающиеся легочные артерии
Правая и левая легочные артерии могут иметь анатомическую связь между собой и со слепым стволом легочной артерии, который начинается от желудочковой массы. Однако такой связи может и не быть.
Термин «сливающиеся» означает, что правая и
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/

590 |
Часть 8. ПОРОКИ ВЫВОДНОГО ТРАКТА ПРАВОГО ЖЕЛУДОЧКА |
|
|
|
|
Рис. 9. Ангиокардиограмма больного Х. Полное отсутствие центральных легочных артерий: а — правой, б — левой. Большие аортолегочные коллатерали, отходящие от нисходящей аорты, сужены в месте соединения с истинными легочны' ми артериями
левая легочные артерии соединяются в пределах |
щихся легочных артерий колеблется от 3 до 22% |
средостения и в месте их соединения имеется от |
(6, 32, 35). Каждая из несливающихся централь |
верстие. Центральные легочные артерии опреде |
ных легочных артерий имеет свои источники кро |
ляют как сливающиеся, если сегмент атрезии зах |
воснабжения (см. рис. 5). Так, артерии могут отхо |
ватывает только легочный клапан и ствол, а обе |
дить от восходящей аорты, ОАП, прямых или неп |
ветви сохраняют связь между собой в месте бифур |
рямыхх аортолегочных коллатералей. У некоторых |
кации ствола (см. рис. 4) (26, 33). Сливающиеся |
пациентов медиастинальные отделы центральных |
центральные легочные артерии, по одним дан |
легочных артерий вообще отсутствуют. Бывают |
ным, отмечают у 69% больных с АЛА ДМЖП (34), |
варианты, когда несливающиеся легочные арте |
а по другим — частота встречаемости несливаю |
рии существуют за счет билатеральных ОАП или |
Глава 46. АТРЕЗИЯ ЛЕГОЧНОЙ АРТЕРИИ С ДЕФЕКТОМ МЕЖЖЕЛУДОЧКОВОЙ ПЕРЕГОРОДКИ |
591 |
|
|
|
|
ОАП с одной стороны и аортолегочной колатера ли — с другой, или за счет различных аортолегоч ных коллатералей.
Легочно артериальный коллектор
Легочно артериальный коллектор является специфической для атрезии легочной артерии структурой, которая расположена в корне легкого и позади перикарда. Он является прямым продол жением соответствующей центральной легочной артерии и связывает ее с истинными легочными артериями. У больных с несливающимися цент ральными легочными артериями (III–IV типы) легочно артериальные коллекторы не зависимы от главной ветви и часто сохраняются даже при полном отсутствии последних. В этих случаях в каждый из коллекторов впадает, как правило, свой артериальный проток, если он выполняет функ цию источника легочно артериального кровос набжения. Если кровоснабжение истинных легоч ных артерий осуществляется через коммуникатив ные БАЛКА, то и в этих случаях легочно артери альный коллектор сохраняется и иногда бывает расширенным (см. рис. 9). Наличие коллектора значительно облегчает выполнение унифокализа ционных процедур.
Внутрилегочные артерии
Даже при тяжелых формах легочной атрезии с БАЛКА дистальные легочные артерии остаются хо рошо развитыми и иногда дилатированными ( 3).
Известно, что каждое легкое состоит из 10 бронхолегочных сегментов. Каждый сегмент обес печивается самостоятельным бронхом и отдель ной ветвью легочной артерии. Они параллельно вступают в легочную паренхиму и параллельно де лятся. Особенностью нормального деления этих элементов является дихотомия, которая сохраня ется в системе истинных легочных артерий и при АЛА. Количество разветвлений бронхоальвеоляр ного дерева, а соответственно, и легочно артери альной системы достигает 18–24. В бассейнах изо лированных системных коллатералей могут разви ваться псевдолегочные артерии, деление которых происходит по другим законам и поэтому не имеет характерной дихотомии. Этот признак позволяет отличить истинные легочные артерии от систем ных коллатеральных артерий, что важно для оцен ки объема легочного артериального русла. Прохо димость легочных артерий может нарушаться сте нотическими участками. Стенозы внутрилегоч ных артерий встречаются исключительно у боль ных с системными коллатералями (15).
Согласно предложению Kirklin (36), стеноз ле
гочной артерии определяют как существенный при уменьшении просвета сосуда на 50% и боль ше, а Hofbeck и соавторы (15) рекомендуют коди ровать внутрилегочные стенозы как существенные в случаях, когда в изолированную зону вовлечены три и более сегментов или не менее одной доли легкого. Они рекомендуют выделять стенозы не разветвленной и разветвленной частей легочно артериального бассейна.
Источники кровоснабжения легких
Вследствие отсутствия связи между правым же лудочком и легочными артериями при АЛА кро воснабжение легких осуществляется через экстра кардиальные источники (табл. 3).
Таблица 3. Источники коллатерального кровоснабжения при АЛА ДМЖП (данные Института сердечно сосудис той хирургии им. Н.М. Амосова АМН Украины)
Источник |
Количество |
Частота, % |
|
кровоснабжения |
больных |
||
|
|||
|
|
|
|
ОАП |
37 |
28,9 |
|
|
|
|
|
БАЛКА |
46 |
35,9 |
|
|
|
|
|
ОАП+БАЛКА |
9 |
7,0 |
|
|
|
|
|
Бронхиальные |
36 |
28,2 |
|
артерии |
|||
|
|
||
|
|
|
|
Всего |
128 |
100 |
|
|
|
|
Большие аортолегочные коллатерали представ ляют собой сосуды артериального типа разной длины и диаметра. Однако источник питания у них один — системные артерии. Для характерис тики системно легочных коллатералей целесооб разно предложить следующую схему.
Место отхождения:
•прямые аортальные ветви (БАЛКА);
•непрямые аортальные ветви;
•бронхиальные артерии.
Связь с легочными артериями:
•коммуникативные артерии — внутрилегочные анастомозы — корневые анастомозы — экстра пульмональные анастомозы;
•псевдолегочные артерии.
Гемодинамические характеристики:
•гипертензивные БАЛКА;
•деградация коллатералей (центральные и пери ферические стенозы).
Olyn и соавторы (35) приводят данные клиники Мауо об источниках легочного кровообращения у
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
