
4 курс / Общая токсикология (доп.) / Врожденные пороки сердца
.pdf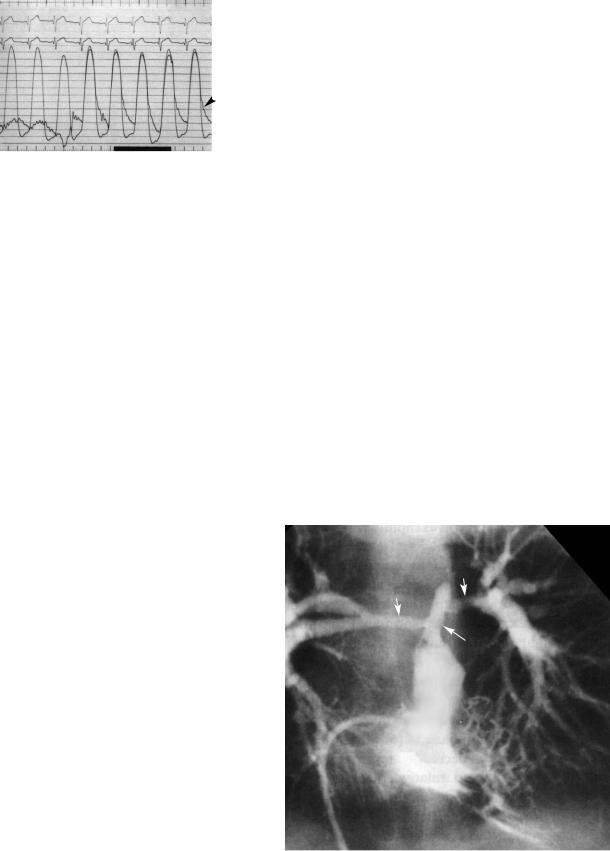
552 |
Часть 8. ПОРОКИ ВЫВОДНОГО ТРАКТА ПРАВОГО ЖЕЛУДОЧКА |
|
|
|
|
150 ДПЖ
100
50 |
Проксимальная |
|
ПЛА |
||
|
||
Дистальная |
|
|
ПЛА |
|
|
0 |
|
Рис. 3. Запись давления при извлечении катетера с отверс% тием на конце из дистальной ПЛА в проксимальную ПЛА у пациента с тяжелым стенозом ПЛА. Видно резкое увеличе% ние давления при прохождении суженного участка, низкое диастолическое давление в проксимальной ПЛА и отсут% ствие градиента между ПЛА и правым желудочком (ПЛА — правая легочная артерия, ДПЖ — давление в правом желу% дочке)
волны. Дикротическая волна низкая, за которой следует низкое диастолическое давление, по вели чине равное диастолическому давлению дисталь нее обструкции. Ширина пульсовой волны в проксимальной легочной артерии увеличивается соответственно тяжести обструкции.
Характер кривой давления проксимальнее сте ноза определяется нарушением функции легочного ствола (81), стенка которого очень утолщена и фиб розирована, с ограниченной эластичностью. Как подчеркивалось выше, престенотическая часть ле гочного ствола становится продолжением вывод ного тракта правого желудочка, и поскольку его функция определяется степенью обструкции, дав ление в легочной артерии отражает скорее измене ния в правом желудочке, чем в дистальном легоч ном кровообращении. Так как давление в дисталь ных отделах легочной артерии ниже, чем в желу дочке, легочной клапан остается открытым. Смы кание створок происходит во время ранней фазы изометрического расслабления желудочка. В ре зультате возникает резкое увеличение емкости ле гочного ствола с соответствующим падением давле ния и образованием дикротической волны. Мед ленное снижение диастолического давления отра жает медленную утечку крови из легочного ствола в дистальные ветви. Замедление диастолического от тока крови происходит вследствие обструкции и нарушенной эластической отдачи утолщенной фиброзированной стенки легочного ствола.
Периферический легочный стеноз часто соче тается с клапанным сужением. Если давление в ле гочном стволе умеренно повышено, это означает, что периферическое сужение является доминиру ющим. Если преобладает клапанный стеноз, дав ление в правом желудочке повышено при нормаль ном или слегка повышенном давлении в легочном
стволе. Тяжесть периферического сужения трудно оценить при надклапанном стенозе, так как выра женность клапанного сужения маскируется. При комбинации сужений на разных уровнях ангиогра фия является решающим методом оценки тяжести надклапанного стеноза.
Ангиокардиография
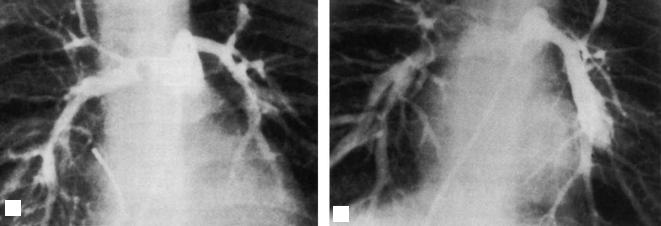
Селективная ангиокардиография является наи более ценным методом диагностики перифери ческого сужения легочной артерии. Она позволяет увидеть точную локализацию, протяженность и распределение поражений (рис. 4). При тяжелой односторонней обструкции можно наблюдать за медленное заполнение контрастным веществом соответствующих легочных вен.
ДИФФЕРЕНЦИАЛЬНЫЙ ДИАГНОЗ
Изолированный стеноз периферических легоч ных артерий может быть заподозрен по характер ному систолическому шуму, который широко проводится в подмышку и спину, отсутствию щелчка выброса, широко расщепленному II тону с нормальными дыхательными изменениями и нор мальной или слегка увеличенной интенсивностью легочного компонента. ЭКГ и ЭхоКГ полезны для оценки тяжести обструкции.
ЛЛА
ПЛА
ЛС
ПЖ
Рис. 4. Селективная ангиокардиография при периферичес% ких стенозах легочной артерии. Сужение ствола и цент% ральных ветвей легочной артерии (ПЛА — правая легочная артерия, ЛЛА — левая легочная артерия, ЛС — легочный ствол, ПЖ — правый желудочек)

Глава 44. ПЕРИФЕРИЧЕСКИЙ СТЕНОЗ ЛЕГОЧНОЙ АРТЕРИИ
Поскольку периферический стеноз легочной артерии часто сопровождается другими внутри сердечными и экстракардиальными аномалиями, диагноз доминирующей патологии можно устано вить по клинической картине.
Анамнез материнской краснухи, семейных ВПС, продолжительная желтуха новорожденных, характерная внешность и другие признаки синд ромов Williams или Noonan дают основание пред положить, что причиной систолического шума может быть стеноз периферических артерий.
ТЕЧЕНИЕ И ПРОГНОЗ
Пациентам с периферическим легочным сте нозом рекомендуется обычная профилактика эн докардита. При естественном течении прогноз зависит от выраженности обструкции и в основ ном такой же, как при клапанном стенозе. Одна ко при множественных тяжелых периферических стенозах он сравним с первичной легочной ги пертензией, когда дилатация и стентирование не эффективны. Возможно прогрессирование обструкции. С другой стороны, во многих случа ях градиент давления, зарегистрированный в младенчестве, может исчезнуть с возрастом (82, 83). Постстенотическое аневризматическое рас ширение мелких эластических артерий осложня ется артериитом, тромбозом или легочным кро вотечением. Тяжелый периферический стеноз может привести к смерти как в раннем младен ческом возрасте, так и в последующей жизни (42). Тяжелые периферические стенозы очень редко встречаются у взрослых.
При синдроме Williams–Beuren в большинстве случаев со временем калибр сосудов увеличивает ся с одновременным снижением давления в пра вом желудочке. Положительная динамика отмеча ется даже при тяжелых стенозах и давлении в пра вом желудочке, равном системному (28, 29, 84, 85). Наиболее впечатляющее улучшение происходит в случаях крайне высокого исходного давления в правом желудочке с поразительным улучшением ангиографической картины легочных артерий. Снижение давления в правом желудочке обуслов лено увеличением систолической растяжимости, а не истинным ростом просвета артерий (85).
Синдрому Alagille присуща полиорганная пато логия. Продолжительность жизни этих больных зависит от наличия ВПС, при котором выживае мость к 20 му году составляет 40%, при отсутствии порока — 80% (33). Десятилетняя выживаемость пациентов с сопутствующей тетрадой Фалло или с легочной атрезией и ДМЖП составляет соответ
553
ственно 66% и 25%, при отсутствии синдрома Alagille — 89% и 58% (33, 86).
ЛЕЧЕНИЕ
Умеренный изолированный одно или двусто ронний стеноз не требует лечения. Однако выра женный периферический стеноз может вызвать необходимость устранения с помощью одного из известных методов. До 1981 г. применялось хирур гическое устранение обструкции (путем рекон струкции сосуда заплатой из перикарда, дакрона или Gore Tex) у ограниченного контингента боль ных с доступными сужениями легочного ствола и центральных ветвей. Однако результаты не были однозначно удовлетворительными (87–95) при наличии неустранимых в то время множественных дистальных сужений.
Баллонная ангиопластика. В 1980 г. Martin и со авторы (96) описали первую попытку чрескожной внутрисосудистой ангиопластики периферических легочных стенозов. Затем Lock и соавторы (97) в эксперименте на новорожденных ягнятах приме нили чрезвенозную ангиопластику при искус ственно созданном стенозе ветвей легочной арте рии. Авторам удалось расширить сужения с по мощью усовершенствованного баллона для дила тации Gruntzig. При гистологических исследова ниях у 4 больных было показано, (98) что расшире ние происходило за счет разрыва интимы и растя жения медиального слоя стенки легочной артерии. Полное заживление интимы наступало ко 2 му ме сяцу после дилатации. При повторном исследова нии через 4–14 мес после дилатации достигнутый диаметр просвета сохранился. Гистологические исследования показали, что разрыв интимы и ме дии заполнился рубцовой тканью. В одной из арте рий дилатированный сегмент дистальнее остаточ ного сужения был с признаками выраженной про лиферации интимы. Гистологические исследова ния сосудов, которые не удалось расширить, были заполнены реактивной фиброзной тканью. Эти ис следования стимулировали широкое клиническое применение баллонной ангиопластики стенозов периферических легочных сосудов (99–105).
Стандартно применяется следующая техника. Баллон катетер располагают в области стеноза. Используют баллон длиной 2–4 см и диаметром 6–20 мм. После ангиографии выбирают подходя щий размер. Он должен быть в 3–4 раза толще су женого сегмента. Баллон раздувают под низким давлением (1–2 атм) разведенным пополам конт растным раствором. "Талия" баллона должна быть в центре. Затем под постоянным флюороскопичес
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
554 |
Часть 8. ПОРОКИ ВЫВОДНОГО ТРАКТА ПРАВОГО ЖЕЛУДОЧКА |
|
|
|
|
An
а |
б |
|
Рис. 5. Ангиограмма легочной артерии у ребенка с синдромом Alagille и множественными стенозами периферических ар% терий: а — до ангиопластики, б — после устранения сужения левой легочной артерии. Развилась мешотчатая аневризма (Аn) левой легочной артерии
ким мониторированием баллон раздувают под вы соким давлением (5–7 атм) в течение 10–60 с, пока не исчезнет талия, и затем быстро сдувают. После дилатации выполняют контрольную ангиографию (104). Эффективность дилатации подтверждается увеличением диаметра суженного участка артерии и сниженим систолического градиента между проксимальным и дистальным участками легоч ной артерии (104, 105). Причинами неудач являют ся неадекватная техника (слишком маленький бал лон, невозможность точно установить в сосуде) и физические свойства сужения. Устойчивые к дила тации сосуды чаще встречаются у детей старше 2 лет и у пациентов при дискретном стенозе. Как правило, не поддаются дилатации сужения в об ласти системно легочного анастомоза и сужения, связанные с операцией артериального переключе ния при полной ТМА (103–106). Описаны случаи, когда баллон катетер не удавалось провести через стенозированный участок артерии во время кате теризации, однако внутриоперационная баллон ная ангиопластика оказалась успешной (100).
Значительными осложнениями чрескожной бал лонной дилатации стенозов периферических легоч ных артерий являются кровотечение из разорван ной легочной артерии, кровохарканье, преходящий отек легких, тромбоз подвздошной вены, аневризма легочной артерии (рис. 5), преходящие аритмии, цианоз и гипотензия (103–105), смерть от останов ки сердца, парадоксальной эмболии и низкого сер дечного выброса. Для остановки фатального крово течения из травмированной легочной артерии ус пешно применяют окклюзирующие пружинки.
Внутрисосудистое стентирование. Расширяемые баллоном стенты разработаны Palmaz и соавторами (107, 108). Mullins и соавторы (109), Benson и соавто ры (110), Rocchini и соавторы (111) на эксперимен
тальной модели стеноза легочной артерии показали техническую возможность установки стентов в нор мальных и суженных сосудах. На основе этих экспе риментальных исследований метод постановки рас ширяемых баллоном внутрисосудистых стентов был внедрен в клиническую практику (112).
Техника постановки стентов хорошо разработа на. Вначале вводится проводник диаметром 10–12 Fr дистальнее места сужения. Размеры стента в ис ходном нерасправленном состоянии: диаметр 3,7 мм, длина 3 мм, толщина 0,076 мм (производство Johnson & Johnson Inc). Стент, укрепленный на баллонном ангиографическом катетере, проводят в дистальную легочную артерию. После ангиоплас тики катетер устанавливают над стенозом, провод ник подтягивают в легочный ствол или правый же лудочек. Затем баллон раздувают под давлением 6–14 атм. После размещения стента катетер, с по мощью которого выполнена ангиопластика, заме няют ангиографическим. Выполняют контроль ную ангиографию и изменяют гемодинамические показатели. Положительные результаты внутрисо судистого стентирования у пациентов с устойчи выми к дилатации сужениями ветвей легочной ар терии улучшают прогноз при этой патологии.
Сужение легочной артерии и одножелудоч< ковая коррекция пороков по Fontan
Нормальные размеры легочных артерий явля ются принципиальным условием физиологически успешной операции Fontan. Искривление, гипоп лазия или сужение легочных артерий являются причиной послеоперационной венозной гипер тензии и малого сердечного выброса. Патология легочных артерий у этих больных может быть врожденного происхождения (вследствие сокра

Глава 44. ПЕРИФЕРИЧЕСКИЙ СТЕНОЗ ЛЕГОЧНОЙ АРТЕРИИ
щения ткани артериального протока) и приобре тенного (вследствие предшествующих вмеша тельств — системно легочных анастомозов, каво пульмонального соединения, суживания легочной артерии — или сдавления их аортой спереди).
Коррекцию этих сужений производят хирурги ческим путем или чрескожной баллонной дилата цией и стентированием (69, 113, 114).
Количественная оценка адекватности легочных артерий предложена Mc Goon (115) и Nakata (116). Наиболее широко используется индекс Nakata — суммарное сечение обеих легочных артерий в мм2, отнесенное к поверхности тела. Этот показатель изучался автором у 40 здоровых людей, 46 больных с тетрадой Фалло, 26 пациентов после операции Rastelli и 15 пациентов после операции Fontan. Раз меры легочных артерий измерялись по ангиограм мам. У здоровых лиц индекс Nakata равен 330±30 мм2/м2 поверхности тела и не зависит от величины поверхности тела во всех возрастных группах, от младенческой до взрослой. После операций часто та синдрома малого сердечного выброса была тем выше, чем меньше значение индекса, особенно ес ли он был < 150 мм2/м2. Зависимость летальности от величины индекса особенно проявилась в груп пе пациентов после операции Fontan. Двое боль ных с индексом < 250 мм2/м2 умерли, в то время как 12 из 13 больных с индексом > 250 выжили. Таким образом, пациентам с индексом Nakata > 250 мм2/м2 показана операция Fontan.
Результаты баллонной дилатации
Периферические стенозы легочной артерии ос таются нерешенной проблемой. Хирургические методы коррекции, как показал ранний опыт вме шательств, технически трудны, малоэффективны и могут привести к деформации сосудов.
Баллонная дилатация дает неполный эффект и может рассматриваться лишь как паллиативное вмешательство, облегчающее состояние у полови ны больных (117). Некоторые авторы приводят данные об увеличении диаметра суженных арте рий более чем на 75%, снижении пикового сис темного давления на 50% и увеличении перфузии легких на 40% (118–120).
Регистр врожденных аномалий, подвергшихся лечению путем вальвулопластики и ангиопластики, представил результаты 182 процедур баллонной ан гиопластики у 156 пациентов из 27 учреждений (121). Диаметр сосуда в месте сужения в среднем увеличился с 5 до 7 мм, пик систолического давле ния снизился в среднем с 49 до 26 мм рт. ст., давле ние в проксимальном сегменте снизилось с 69 до 63
555
мм рт.ст. Использование баллонов высокого давле ния (17–20 атм) увеличивало частоту успешной ди латации с 50 до 81%. Осложнения возникли у 13% пациентов. Такой же вывод сделали Gentles и соав торы (122), выполнившие ангиопластику у 52 паци ентов с тетрадой Фалло, атрезией легочной артерии с ДМЖП, одножелудочковым сердцем и изолиро ванным периферическим стенозом легочной арте рии. Дилатация высоким давлением увеличивала диаметр сосуда более чем в 2 раза, давление в пра вом желудочке снижалось в среднем на 20%. Таким образом, баллонная ангиопластика легочных арте рий обеспечивает значительный непосредствен ный гемодинамический эффект в случаях, когда оперативное лечение неуспешное.
Многие исследователи не могли предсказать факторы, определяющие успех. В отдаленном пери оде описаны рестенозы, однако сведения об их час тоте, характере и сроках возникновения изучены не достаточно. Bush и соавторы (123) сообщили о ресте нозировании успешно дилатированных артерий у 35% пациентов, Hosking и соавторы (114) — у 17%.
Результаты стентирования легочных артерий
Стентирование легочных артерий обеспечивает более эффективное первичное расширение и воз можность повторной дилатации, необходимость в которой возникает с увеличением массы тела и пролиферацией интимы. Стентирование позволя ет производить многократные повторные дилата ции, тем самым избегая реоперации при различ ных пороках (113, 117). Расширяемые баллонном стенты Palmatz вводят не только чрескожным ме тодом, но и во время операций по поводу внутри сердечных пороков в случаях, когда ограничен со судистый доступ. Стентирование применяется при различной патологии — периферических стенозах легочных артерий (124), после операции Fontan (69), при сужении легочных вен, кондуитах (125).
Имплантация стентов более безопасна, чем ди латация, сопровождается меньшим числом ослож нений, в частности, как правило, отсутствуют раз рывы сосудов, кровотечения и эмболии.
Ing и соавторы (126) сообщили о низкой часто те рестенозов (3%) через 3 года после импланта ции и высокой эффективности повторных дилата ций в 94% случаев, без осложнений. Отдаленные результаты, основанные на обширных данных, со общили Mc Mahon и соавторы (127). Были имп лантированы 664 стента у 330 пациентов после коррекции тетрады Фалло, атрезии легочной арте рии с ДМЖП, после операции артериального пе реключения при транспозиции и операции
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
556 |
Часть 8. ПОРОКИ ВЫВОДНОГО ТРАКТА ПРАВОГО ЖЕЛУДОЧКА |
|
|
|
|
Fontan. Средний градиент систолического давле |
132). В отличие от дистальных сужений, которые |
ния после стентирования снизился с 41 до 9 мм рт. |
поддаются баллонной дилатации, центральные |
ст., средний диаметр артерий увеличился с 5 до 11 |
стенозы резистентны к дилатации из за их элас |
мм. В средние сроки через 5 лет средний градиент |
тичности. У пациентов с тяжелой бивентрикуляр |
давления составил 20 мм рт. ст., соотношение дав |
ной системной перегрузкой и генерализованной |
ления ПЖ/ЛЖ — 0,5 и средний диаметр просвета |
артериопатией повышен риск ишемии миокарда |
— 9 мм. Авторы связывают улучшение результатов |
во время искусственного кровообращения (133). |
с применением методики консервативной серии |
После устранения надклапанного стеноза аорты |
дилатаций с исключением чрезмерного расшире |
часто развивается недостаточность правого желу |
ния, использование более коротких стентов, улуч |
дочка (30, 84), поэтому рациональный подход пре |
шенной формы баллона и расширение c начала |
дусматривает комбинацию дооперационного кате |
центральной части стента. |
терного вмешательства с последующей операцией. |
У младенцев и маленьких детей применение |
Результаты транскатетерных вмешательств при |
этого метода ограничено из за недостаточной гиб |
синдроме Williams–Beuren опубликовал — и |
кости стентов, узости сосудов и развития фикси |
Geggel и соавторы (132). Успешная баллонная ди |
рованной обструкции после постановки стентов |
латация (увеличение диаметра легочной артерии |
малого диаметра у растущих пациентов. Малые |
более чем на 50%) получена в 51% случаев. У 25 па |
стенты с максимально достижимым диаметром |
циентов были произведены 124 дилатации во вре |
9–10 мм в будущем подвергают больного необхо |
мя 39 процедур. Диаметр суженых сосудов в ус |
димости операции в целях расширения стентиро |
пешных случаях увеличился на 112 ± 65%. Дилата |
ванной области. Несмотря на это, имплантации |
ция в артериях паренхимы легкого была более эф |
таких стентов являются жизнеспасающими в бли |
фективной, чем в медиастинальных и в более мел |
жайшем послеоперационном периоде (70, 128). |
ких сосудах, при условии, что размер баллона пре |
Стенты большего размера можно имплантировать |
вышал диаметр суженного участка в 3 и более раз. |
в операционной, для уменьшения времени легоч |
Авторы рекомендуют серию дилатаций дисталь |
ной артериопластики и предотвращения наружно |
ных легочных стенозов и последующую хирурги |
го сдавления (129, 130). Стенты большего диамет |
ческую коррекцию проксимальных участков. У |
ра, которые можно дилатировать до взрослых раз |
пациентов высокого риска целесообразно создать |
меров, способствуют упрощению техники коррек |
межпредсердное сообщение. |
ции в сложных случаях (126, 128, 131). |
При синдроме Alagile наличие стенозов пери |
|
ферических легочных артерий не повлияло на ис |
Результаты лечения синдромов |
ходы трансплантации печени (134). Смерть 5 из 17 |
WilliamsñBeuren и Alagille |
оперированных пациентов не была связана с |
|
проблемами сердца. У 12 пациентов, выживших в |
Высокая вероятность обратимости легочной |
сроки 6 лет после трансплантации, периферичес |
артериопатии при синдроме Williams–Beuren тре |
кие стенозы легочных артерий клинически себя не |
бует критического отношения к определению по |
проявляли. Во время операции трансплантации |
казаний для хирургического или катетерного вме |
печени не были обнаружены гемодинамические |
шательства. В настоящее время показаниями для |
нарушения даже при тяжелой форме стеноза (135). |
таких вмешательств являются системное или суп |
Поэтому трансплантация не противопоказана при |
расистемное давление в правом желудочке, выра |
высокой правожелудочковой гипертензии. Хирур |
женная бивентрикулярная обструкция (надкла |
гическое расширение легочных артерий неосуще |
панный стеноз аорты) или наличие симптоматики |
ствимо из за диффузных дистальных сужений, а |
при менее выраженной обструкции. Вмешатель |
баллонная дилатация неэффективна (122, 134, |
ство на легочных артериях при субсистемной пра |
136). Опыт имплантации стентов невелик (137). |
вожелудочковой гипертензии целесообразно как |
Несмотря на несердечные причины летальнос |
дохирургический этап лечения перед коррекцией |
ти после трансплантации печени, при синдроме |
надклапанного стеноза аорты. |
Alagille госпитальная летальность все таки выше |
При тяжелой генерализованной артериопатии, |
(44%), чем у пациентов без синдрома (36%) (138). |
включающей периферические и центральные ле |
По мнению Razavi и соавторов (139), при давле |
гочные артерии, показана дохирургическая кате |
нии в правом желудочке более 50% системного це |
терная дилатация дистальных легочных артерий с |
лесообразно произвести катетерную импланта |
последующим хирургическим вмешательством на |
цию стента для снижения риска недостаточности |
проксимальных легочных артериях и аорте (30, |
трансплантата. |
Глава 44. ПЕРИФЕРИЧЕСКИЙ СТЕНОЗ ЛЕГОЧНОЙ АРТЕРИИ |
557 |
|
|
|
|
Литература
1.Mangars A. Rec period soc med. Paris, 1802:74. Cited by E Schwalbe in ref 154.
2.Schwalbe E. Die morphologie der missbidungen und der tiere. Vol 1. Jena:Fischer, 1909:426.
3.Noonan JA. Hypertension with Turner phenotype: a new syndrome with associated congenital heart disease. Am J Dis Child 1968; 116: 373–380.
4.Vernant P, Corone P, Rossignol AM, Biel man C. Etude de 120 observa tions de syndrome de Williams et Beuren. Arch Mal Coeur 1980;73:661.
5.Alagille D, Odievre M, Gautier M, Dommergues JR. Hepatic ductular hypoplasia associated with characteristic facies, vertebral malforma tions, retarded physical, mental and sexual development, and cardiac murmur. J Pediatr 1975;86:63.
6.Hayden JG, Taler NS, Klaus SM. Cutis laxa associated with pulmonary artery stenosis. J Pediatr 1968;72:506.
7.Keith JD, Rowe RD, Vlad P. Heart disease in infancy and childhood. 3rd ed. New York:Macmillan, 1978.
8.Huntington GS. The morphology of the pulmonary artery in the mam malian. Anat Rec 1919;17:165.
9.Campbell PE. Vascular abnormalities following maternal rubella. Br Heart J 1965;27:134.
10.Gay BB Jr, Franch RH, Shuford WH, Rogers JV Jr. The roen togeno logic features of single and multiple coarctations of the pulmonary artery and branches. AJR 1963; 90: 599–613.
11.Bacha E, Kreutzer J. Comprehensive management of branch pul monary artery stenosis. J Intervent Cardiol 2001; 14: 1–9.
12.Ewart AK, Morris CA, Atkinson D et al. Hemizygosity at the elastin locus in a developmental disorder, Williams syndrome. Nat Genet 1993; 5: 11–6.
13.Towbin JA, Belmont J. Molecular determinants of left and right outflow tract obstruction. Am J Med Genet 2000; 97: 297–303.
14.Crosnier C, Attie–Bitach T, Encha–Razavi F et al. Jaggedi gene expression during human embryogenesis elucidates the wide phenotypic spectrum of Alagille syndrome. Hepatology 2000;32: 574–81.
15.Li L, Krantz ID, Deng Y, Genin A et al. Alagille syndrome is caused by mutations in human Jaggedl,which encodes a ligand for Notchi. Nat Genet 1997; 16: 243–51.
16.Loomes KM, Underkoffler LA, Morabito J et al. The expression of Jaggedi in the developing mammalian heart correlates with cardiovas cular disease in Alagille syndrome. Hum Mol Genet 1999; 8: 2443–9.
17.Oda T, Elkahloun AG, Pike BL et al. Mutations in the human Jaggedi gene are responsible for Alagille syndrome. Nat Genet 1997; 16: 235–42.
18.Towbin JA, Casey B, Belmont J. The molecular basis of vascular dis orders. Am J Hum Genet 1999; 64: 678–84.
19.Munroe PB, Olgunturk RO, Fryns JP et al Mutations in the gene encod ing the human matrix Gla protein cause Keutel syndrome. Nat Genet 1999; 21: 142–4.
20.Ziereisen F, De Munter C, Perlmutter N. The Keutel syndrome. Report of a case and review of the literature. Pediatr Radio! 1993; 23: 314–15.
21.Tartaglia M, Kalidas K, Shaw A et al. PTPN11 mutations in Noonan syn drome: molecular spectrum, genotype phenotype correlation, and phenotypic heterogeneity. Am J Hum Genet 2002; 70: 1555–63.
22.Uzun O, Blackburn ME, Gibbs JL. Congenital total lipodystrophy and peripheral pulmonary artery stenosis. Arch Dis Child 1997; 76: 456–7.
23.Bueren AJ, Apitz J, Harmjanz D. Supravalvular aortic stenosis in asso ciation with mental retardation and a certain facial appearance. Circulation 1962; 26: 1235–40.
24.Alagille D, Estrada A, Hadchouel M et al. Syndromic paucity of inter lobular bile ducts (Alagille syndrome or arteriohepatic dysplasia): review of 80 cases. J Pediatr 1987; 110: 195–200.
25.Williams JCP, Barratt Boyce BJ, Lowe JB. Supravalvular aortic steno sis. Circulation 1961; 24: 1311–18.
26.Donnai D, Karmiloff Smith A. Williams syndrome: from genotype through to the cognitive phenotype.Am J Med Genet 2000; 97: 164–71.
27.Tassabehji M, Metcalfe K, Hurst J et al. An elastin gene mutation pro ducing abnormal tropoelastin and abnormal elastic fibres in a patient with autosomal dominant cutis laxa. Hum Mol Genet 1998; 7: 1021–8.
28.Wessel A, Pankau R, Kececioglu D, Ruschewski W, Bursch JH. Three decades of follow up of aortic and pulmonary vascular lesions in the Williams Beuren syndrome. Am J Med Genet 1994; 52: 297–301.
29.Zalzstein E, Moes CA, Musewe NN, Freedom RM. Spectrum of cardio vascular anomalies in Williams Beuren syndrome. Pediatr Cardiol 1991; 12: 219–23.
30.Stamm C, Friehs I, Moran AM et al. Surgery for bilateral outflow tract obstruction in elastin arteriopathy. J Thorac Cardiovasc Surg 2000;
120:755–63.
31.Hoffenberg EJ, Narkewicz MR, Sondheimer JM et al. Outcome of syn dromic paucity of interlobular bile ducts (Alagille syndrome) with onset of cholestasis in infancy. J Pediatr 1995; 127:220–4.
32.Silberbach M, Lashley D, Reller MD et al. Arteriohepatic dys plasia and cardiovascular malformations. Am Heart J 1994; 127:695–9.
33.Emerick KM, Rand EB, Goldmuntz E et al. Features of Alagille syn drome in 92 patients: frequency and relation to prognosis. Hepatology 1999; 29: 822–9.
34.Gregg NM. Congenital cataract following German measles in the moth er. Trans Ophthalmol Soc Aust 1941;3:35.
35.Gregg NM. Rubella during pregnancy of the mother with its sequelae of congenital defects in the child. Med J Aust 1945;1:313.
36.Anonymous. Rubella symposium. Am Dis Child 1965;110:345.
37.Hanshaw JB, Dudgeon JA. Viral diseases of the fetus and newborn. In: Major problems in clinical pediatrics, vol. 17. Philadelphia: WB Saunders, 1978.
38.Arvidsson H, Carlsson E, Hartmann A Jr, Tsifutis A, Crawford C. Supravalvular stenoses of the pulmonary arteries: report of eleven cases. Acta Radiol 1961;56:466–478.
39.Rowe RD. Maternal rubella and pulmonary stenoses: report of eleven cases. Pediatrics 1963;32:180.
40.Emmanouilides CC, Linde LM, Crittenden LH. Pulmonary artery steno sis associated with ductus arteriosus following maternal rubella. Circulation 1964;29:51.
41.Hastreiter AR, Joorabchi B, Pujatti G, Van der Horst RL, Patersil G, Sever JL. Cardiovascular lesions associated with con genital rubella. J Pediatr 1967;71:59.
42.Lynfield J, Vichitbandha P, Yao AC, Rodriguez Torres R, Karlson KE, Kauffman S. Neonatal heart failure following rubella in utero. Am J Cardiol 1966;17:130.
43.Easterly JR, Oppenheimer EH. Pathological lesions due to congenital rubella. Arch Pathol 1969;87:3S0.
44.Vargheese PJ, Izukawa T, Rowe RD. Supravalvular aortic stenosis as part of rubella syndrome with discussion of pathogenesis. Arch Dis Child 1970; 45:63.
45.Siassi B, Klyman C, Emmanouilides CC. Hypoplasia of the abdominal aorta associated with the rubella syndrome. Am Dis Child 1970; 20: 476.
46.Tondury C, Smith DW. Fetal rubella pathology. J Pediatr 1966;48:867.
47.Arlettaz R, Archer N, Wilkinson AR. Natural history of innocent heart murmurs in newborn babies: controlled echocardiographic study. Arch Dis Child Fetal Neonatal Educ 1998; 78:F166–F170.
48.Chatelain P, Oberhansli I, Friedli B. Physiological pulmonary branch stenosis in newborns: 2D– echocardiographic and Doppler character istics and follow up. Eur J Pediatr4993; 152:559–63.
49.Du ZD, Roguin N, Barak M et al. Doppler echocardiographic study of the pulmonary artery and its branches in 114 normal neonates. Pediatr Cardiol 1997; 18: 38–42.
50.Kiyomatsu Y. Transient heart murmur in the late neonatal period: its origin and relation to the transition from fetal to neonatal circulation. Kurume Med J 2001; 48: 31–5.
51.Miyake T, Yokoyama T. Evaluation of transient heart murmur resem bling pulmonary artery stenosis in term infants by Doppler and M mode echocardiography. Jpn Circ J 1993; 57:77–83.
52.So BH, Watanabe T, Shimizu M, Yanagisawa M. Doppler assessment of physiological stenosis at the bifurcation of the main pulmonary artery: a cause of functional murmur in neonates. Biol Neonate 1996;
69:243–8.
53.Momma K, Takao A, Ando M et al. Juxtaductal left pulmonary artery obstruction in pulmonary atresia. Br Heart J 1986; 55:39–44.
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
558 |
Часть 8. ПОРОКИ ВЫВОДНОГО ТРАКТА ПРАВОГО ЖЕЛУДОЧКА |
|
|
|
|
54.Elzenga NJ, Gittenberger de Groot AC. The ductus arteriosus and stenoses of the pulmonary arteries in pulmonary atresia. mt J Cardiol 1986; 11: 195–208.
55.Elzenga NJ, von Suylen RJ, Frohn Mulder I et al. Juxtaductal pul monary artery coarctation. An underestimated cause of branch pul monary artery stenosis in patients with pulmonary atresia or stenosis and a ventricular septal defect. J Thorac Cardiovasc Surg 1990; 100: 416–24.
56.Luhmer I, Ziemer G. Coarctation of the pulmonary artery in neonates. Prevalence, diagnosis, and surgical treatment. J Thorac Cardiovasc Surg 1993; 106: 889–94.
57.McElhinney DB, Reddy VM, Moore P, Hanley FL. Bilateral branch pul monary artery obstruction due to kinking at insertion sites of bilateral ductus arteriosus. Ann Thorac Surg 1997;64: 537–9.
58.Maroto E, Fouron JC, Ake E et al. Closure of the ductus arteriosus: determinant factor in the appearance of transient peripheral pulmonary stenosis of the neonate. J Pediatr 1991;119: 955–9.
59.Zevallos Giampietri EA, Thelmo WL, Anderson VM. Coarctation of the left pulmonary artery: effects on the pulmonary vasculature of infants. Pediatr Cardiol 1997; 18: 376–80.
60.Sachweh J, Dabritz S, Didilis V, Vazquez Jimenez JF, Bernuth G, Messmer BJ. Pulmonary artery stenosis after systemic to pulmonary shunt operations. Eur J Cardiothorac Surg 1998; 14:229–34.
61.Gladman G, McCrindle BW, Williams WG, Freedom RM, Benson LN. The modified Blalock Taussig shunt: clinical impact and morbidity in Fallot's tetralogy in the current era. J Thorac Cardiovasc Surg 1997; 114: 25–30.
62.Laks H, Odim JN, Sadeghi AM, Allada V. The incisional pul monary artery band. Ann Thorac Surg 1999; 67: 1813–14.
63.Amin Z, Reddy M, McElhinney D, Teitel DF Transcatheter interventions after one stage unifocalization for pulmonary atresia with ventricular septal defects: are stenoses native or anastomotic. Circulation 1998; 98(Suppl I): 62.
64.Gandhi SK, Pigula FA, Siewers RD. Successful late reintervention after the arterial switch procedure. Ann Thorac Surg 2002;73: 88–93.
65.Kuroczynski W, Kampmann C, Choi YH et al. [of supravalvular pul monary stenosis after arterial switch operations (ASO)]. Z Kardiol 2001; 90: 498–502.
66.Losay J, Touchot A, Serraf A et al. Late outcome after arterial switch operation for transposition of the great arteries. Circulation 2001; 104: 1–121–1–126.
67.Massin MM, Nitsch GB, Dabritz S et al. Growth of pulmonary artery after arterial switch operation for simple transposition of the great arteries. Eur J Pediatr 1998; 157: 95–100.
68.Masuda M, Kado H, Shiokawa Y et al. Clinical results of arterial switch operation for double outlet right ventricle with sub pulmonary VSD. Eur J Cardiothorac Surg 1999; 15:283–8.
69.Moore JW, Spicer RL, Perry JC et al. Percutaneous use of stents to correct pulmonary artery stenosis in young children after cavopul monary anastomosis. Am Heart J 1995; 130(6): 1245–9.
70.Trivedi KR, Azakie A, Benson LN. Collaborative interventional and sur gical strategies in the management of congenital heart lesions. Semin Thorac Cardiovasc Surg Pediatr Card SurgAnnu 2001; 4: 185–207.
71.Fontaine AB, Borsa JJ, Hoffer EK, Bloch RD, So C. Stent placement in the treatment of pulmonary artery stenosis secondary to fibrosing mediastinitis. J Vasc Interv Radiol 2001; 12:1107–11.
72.Fox R, Panidis IP, Kotler MN, Mintz GS, Ross J. Detection by Doppler echocardiography of acquired pulmonic stenosis due to extrinsic tumor compression. Am J Cardiol 1984; 53:1475–6.
73.Kandzari DE, Warner JJ, O'Laughlin MP, Harrison JK. Percutaneous stenting of right pulmonary artery stenosis in fibrosing mediastinitis. Cathet Cardiovasc Intervent 2000; 49:321–4.
74.Nemoto S, Fujimura M, Nishiya Y et al. [lipoma with stenosis of the left bronchus and pulmonary artery]. Nippon Kyobu Geka Gakkai Zasshi
1992; 40: 273–7.
75 Watts WJ, Rotman HH, Patten GA. Pulmonary artery compression by a bronchogenic cyst simulating congenital pulmonary artery stenosis. Am J Cardiol 1984; 53: 347
76. D'Cmuz IE, Agustsson MH, Bicoff JP, Weinbery M Jr, Arcilla RA. Stenotic lesions of the pulmonary arteries: clinical and hemodynamic findings in 84 cases. Am J Cardiol 1964;13:441–468.
77.Perloff JK, Lebauer EJ. Auscultatory and phonocardiographic manifes tations of isolated stenosis of the pulmonary artery and its branches. Br Heart 1969;33:314.
78.Halloran KH, Sanyal SK, Gardner TH. Superiorly oriented electrocar diographic axis in infants with the rubella syndrome. Am Heart J 1966;72:600.
79.Danilowicz DA, Rudolph AM, Hoffman JIE, Heymann M. Physiologic pressure differences between main and branch pulmonary arteries in infants. Circulation 1972;45:410.
80.Dunkle LM, Rowe RD. Transient murmurs simulating pulmonary artery stenosis in premature infants. Am J Dis Child 1972;124:666.
81.Agustsson MH, Arcilla RA, Casul BM, Biscoff JP, Nassif SI, Lendrum BL. The diagnosis of bilateral stenosis of the primary pulmonary branches based on characteristic pulmonary trunk pressure curves: a hemodynamic and angiocardiographic study. Circulation 1962;26:421–435.
82.Hartmann AF Jr, Elliot L, Goldring D. The course of peripheral pul monary artery stenosis in children. J Pediatr 1968; 73 :2 12
83.Wasserman MP, Varghese PJ, Rowe RD. The evolution of pulmonary arterial stenosis associated with congenital rubella. Am Heart J 1968;76:638.
84.Giddens NG, Finlay JP, Nanaton MA, Roy DL. The natural course of supravalvar aortic stenosis and peripheral pulmonary artery stenosis in Williams's syndrome. Br Heart J 1989; 62:315–19.
85.Wren C, Oslizlok P, Bull C. Natural history of supravalvular aortic stenosis and pulmonary artery stenosis. J Am Coll Cardiol 1990; 15: 1625–30.
86.Vobecky Si, Williams WG, Trusler GA et al. Survival analysis of infants under age 18 months presenting with tetralogy of Fallot. Ann Thorac Surg 1993; 56: 944–9.
87.McGoon DC, Kincaid OW. Stenosis of branches of the pulmonary artery: surgical repair. Med Clin North Am 1964;48:1083.
88.Thrower WB, Abelmann WH, Harken DE. Surgical correction of coarcta tion of the main pulmonary artery. Circulation 1960;21 :672.
89.McGoon MD, Fulton RE, Davis GD, Rit ter DG, Neill CA, White RI Jr. Systemic collateral and pulmonary artery stenosis in patients with con genital pulmonary valve atresia and ventricular septal defect. Circulation 1977;56:473.
90.Cohn LH, Sanders JH, Collins JJ. Surgi cal treatment of congenital uni lateral pulmonary arterial stenosis with contralateral pulmonary hyper tension. Am J Cardiol 1976;38:257.
91.Fuster V, McGoon DC, Kennedy MA, Rit ter RG, Kirklin JW. Long–term evaluation (12–22 years) of open heart surgery for tetralogy of Fallot. Am J Cardiol 1980;46:635.
92.Blackstone EH, Kirklin JW, Bertranou EG, Labrosse CJ, Soto B, Bargeron LM. Preop erative prediction from cineangiograms of postre pair right ventricular pressure in tetralogy of Fallot. J Thorac Cardiovasc Surg 1979;73:542.
93.Gill CC, Moodie DS, McGoon DC. Staged surgical management of pul monary atresia with diminutive pulmonary arteries. J Thorac Cardiovasc Surg 1977;73:436.
94.Haworth SG, Rees PG, Taylor JFN, Mac Cartney FJ, de Lefal M, Stark J. Pulmonary atresia with ventricular septal defect and major aortopul monary collateral arteries: effect of systemic pulmonary anastomosis. Br Heart J 1981;45:133.
95.Freedom RM, Pongiglione G, Williams WG, Trusler GA, Rowe RD. Palliative right ventricular outflow tract construction for patients with pulmonary atresia, ventricular septal defect, and hypoplastic pul monary arteries. J Thorac Cardiovasc Surg 1983;86:24.
96.Martin EC, Diamond NG, Casarella WJ. Percutaneous transluminal angioplasty in non atherosclerotic disease. Radiology 1980; 135: 27–33.
97.Lock JE, Niemi T, Einzig S, Amplatz K, Burke B, Bass JL. Transvenous angioplasty of experimental branch pulmonary artery stenosis in new born lambs. Circulation 1981;64:886.
98.Edwards BS, Lucas RV Jr, Lock JE, Edwards JE. Morphologic changes in the pulmonary arteries after percutaneous balloon angioplasty for pul monary arterial stenosis. Circulation 1985;71: 195–201.
99.Lock JE, Castaneda Zunifga WR, Fuhrman BP, Bass JL. Balloon dila tion angioplasty of hypoplastic and stenotic pulmonary arteries. Circulation 1983;76:962.

Глава 44. ПЕРИФЕРИЧЕСКИЙ СТЕНОЗ ЛЕГОЧНОЙ АРТЕРИИ
100.Foker JE, Turley K, Lock JE, Ring WS, Stanger P Intraoperative bal loon dilation of stenotic and hypoplastic pulmonary arteries. Circulation 1983;68 (suppl):213.
101.Edwards BS, Lucas RV Jr, Lock JE, Edward JE. Morphologic changes in the pulmonary arteries following percutaneous balloon angioplasty for pulmonary arterial stenosis. Circulation 1986;74:135–143.
102.Kveselis D, Rocchini AP. Percutaneous transluminal angioplasty of peripheral pulmonary arterial stenosis, coarctation of the aorta, supe rior vena caval and pulmonary venous stenosis, and other great– artery stenosis. Semin Interventional Radiol 1984;1:201–214.
103.Rocchini AP, Kveselis D, Dick M, Crowley DC, Snider AR, Rosenthal A. Use of balloon angioplasty to treat peripheral pulmonary stenosis. Am J Cardiol 1984;54:1069–1073.
104.Ring JC, Bass JL, Marvin W, et al. Management of congenital steno sis of a branch pulmonary artery with balloon dilation angioplasty: report of 52 proce dures. J Thorac Cardiovasc Surg 1985;90:35–44.
105.Kan JS, Marvin WJ, Bass JL, Muster A, Murphy J. Balloon angioplas ty branch pulmonary artery stenosis: results of the Valvuloplasty and Angioplasty of Con genital Anomalies Registry. Am J Cardiol 1990; 65: 798–801.
106.Zeevi B, Keane JF, Perry SB, Lock JE. Balloon dilation of postoperative right ventricular outflow obstructions. J Am Coll Cardiol 1989; 14: 401.
107.Palmaz JC, Sibbitt RR, Tio FO, et al. Expandable intraluminal vascu lar graft: a feasibility study. Surgery 1986;99: 199.
108.Paimaz JC, Windeler SA, Reuter SR. et al. Expandable intrahepatic portacaval shunt stents: early experience in the dog. Am J Roentgenoi 1987;145:821.
109.Mullins CE, O'Laughlin MP, Vick GW II et al. Implantation of balloon expandable intravascular grafts by catheterization in pulmonary arter ies and systemic veins. Circulation 1988;77: 188.
110.Benson LN, Hamilton F, Dasmahapatra HK, Coles JG. Implantabie stent dilation of the pulmonary artery: early experience. Circulation 1988;78 (suppl II)
111.Rocchini AP, Gundry SR, Beekman RH, et al. A reversible pulmonary artery band: preliminary experience. J Am Coll Cardiol 1988;11:172.
112.O'Laughlin MP, Perry SB, Lock JE, Mulhns CE. Use of endovascular stents in congenital heart disease. Circulation 1991;83:1923–1939.
113.Fogelman R, Nykanen D, Smallhorn JF et al. Endovascular stents in the pulmonary circulation. Clinical impact on management and medi um term follow up. Circulation 1995; 92:881–5.
114.Hosking MC, Thomaidis C, Hamilton R et al. Clinical impact of balloon angioplasty for branch pulmonary arterial stenosis. Am J Cardiol 1992; 69: 1467–70.
115.Nakata S, Imai Y, Takanashi Y et al. A new method for the quantita tive standardization of cross sectional areas of the pulmonary arteries in congenital heart diseases with decreased pulmonary blood flow. J Thorac Cardiovasc Surg 1984; 88:610–19.
116.Piehler JM, Danielson GK, McGoon DC et al. Management of pul monary atresia with ventricular septal defect and hypoplastic pul monary arteries by right ventricular outflow construction. J Thorac Cardiovasc Surg 1980; 80: 552.
117.O'Laughlin MP. Catheterization treatment of stenosis and hypoplasia of pulmonary arteries. Pediatr Cardiol 1998; 19:48–56.
118.Lock JE, Castaneda Zuniga WR, Fuhrman BP, Bass IL. Balloon dila tion angioplasty of hypoplastic and stenotic pulmonary arteries. Circulation 1983; 67: 962–7.
119.Rocchini AP, Kveselis D, Dick M et al. Use of balloon angioplasty to treat peripheral pulmonary stenosis. Am J Cardiol 1984; 54: 1069–73.
559
120.Ring JC, Bass JL, Marvin W et al. Management of congenital steno sis of a branch pulmonary artery with balloon dilation angioplasty. Report of 52 procedures. J Thorac Cardiovasc Surg 1985; 90: 35–44.
121.Kan IS, Marvin WJ JR, Bass JL, Muster AJ, Murphy I. Balloon angio plasty – branch pulmonary artery stenosis: results from the Valvuloplasty and Angioplasty of Congenital Anomalies Registry. Am J Cardiol 1990; 65: 798–801.
122.Gentles TL, Lock JE, Perry SB. High pressure balloon angioplasty for branch pulmonary artery stenosis: early experience. J Am Coll Cardiol 1993; 22: 867–72.
123.Bush DM, Hoffman TM, Del Rosario J, Eiriksson H, Rome JJ. Frequency of restenosis after balloon pulmonary arterioplasty and its causes. Am J Cardiol 2000; 86: 1205–9.
124.Nakanishi T, Kondoh C, Nishikawa T et al. Intravascular stents for management of pulmonary artery and right ventricular outflow obstruction. Heart Vessels 1994; 9: 40–8.
125.O'Laughlin MP, Slack MC, Grifka RG et al. Implantation and interme diate term follow up of stents in congenital heart disease. Circulation 1993; 88: 605–14.
126.Ing FF, Gritka RG, Nihill MR, Mullins CE. Repeat dilation of intravas cular stents in congenital heart defects. Circulation 1995; 92: 893–7.
127.McMahon C, Grifka R, El Said H et al. Refinements in implantation of pulmonary artery stents: impact on morbidity and mortality of the pro cedure over the last decade. Cardiol Young 2001; 11: 268.
128.Mullins CE. Light at the end of the tunnel – but still dim. Cathet Cardiovasc Intervent 2000; 51: 450.
129.Mendelsohn AM, Bove EL, Lupinetti FM et al. Intraoperative and per cutaneous stenting of congenital pulmonary artery and vein stenosis. Circulation 1993; 88: 11–210–11–217.
130.Coles JG, Yemets I, Najm HK et al. Experience with repair of congen ital heart defects using adjunctive endovascular devices. J Thorac Cardiovasc Surg 1995; 110: 1513–19.
131.Turner DR, Rodriguez Cruz E, Ross RD, Forbes TJ. Initial experience using the Palmaz Corinthian stent for right ventricular outflow obstruction in infants and small children. Cat het Cardiovasc Intervent 2000; 51: 444–9.
132.Geggel RL, Gauvreau K, Lock JE. Balloon dilation angioplasty of peripheral pulmonary stenosis associated with Williams syndrome. Circulation 2001; 103: 2165–70.
133.Del Nido PJ, Benson LN, Mickle DA et al. Impaired left ventricular postischemic function and metabolism in chronic right ventricular hypertrophy. Circulation 1987; 76: V168–V173.
134.Ovaert C, Germeau C, Barrea C et al. Elevated right ventricular pres sures are not a contraindication to liver transplantation in Alagille syn drome. Transplantation 2001; 72: 345–7.
135.Png K, Veyckemans F, De Kock M et al. Hemodynamic changes in patients with Alagille's syndrome during orthotopic liver transplanta tion. Anesth Analg 1999; 89: 1137–42.
136.Rothman A, Perry SB, Keane IF, Lock JE. Early results and follow up of balloon angioplasty for branch pulmonary artery stenoses. JAm Coil Cardiol 1990; 15: 1109–17.
137.Saidi AS, Kovalchin iP, Fisher DJ, Ferry GD, Grifka RG. Balloon pul monary valvuloplasty and stent implantation. For peripheral pulmonary artery stenosis in Alagille syndrome. Tex Heart Inst J 1998; 25: 79–82.
138.Tzakis AG, Reyes I, Tepetes K et al. Liver transplantation for Alagille's syndrome. Arch Surg 1993; 128: 337–9.
139.Razavi RS, Baker A, Qureshi SA et al. Hemodynamic response to con tinuous infusion of dobutamine in Alagille's syndrome.Transplantation 2001; 72: 823–8.
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/

Глава 45
АТРЕЗИЯ ЛЕГОЧНОЙ АРТЕРИИ
С ИНТАКТНОЙ МЕЖЖЕЛУДОЧКОВОЙ ПЕРЕГОРОДКОЙ
Этот порок составляет 1–1,5 % всех ВПС и при |
У 80 % больных атрезия на уровне клапана име |
|||||||||||||
сутствует почти у 3% больных, находящихся в кри |
ет вид диафрагмы, у 20 % атрезирован инфундибу |
|||||||||||||
тическом состоянии (1). В простейшем определе |
лярный отдел желудочка. Клапанное кольцо и ле |
|||||||||||||
нии аномалия характеризуется мембранозной или |
гочный ствол обычно нормальных размеров. Пра |
|||||||||||||
мышечной атрезией выхода из правого желудочка |
вый желудочек гипоплазирован в различной сте |
|||||||||||||
при интактной межжелудочковой перегородке, |
пени и резко гипертрофирован. Bull и соавторы в |
|||||||||||||
однако она является чрезвычайно тяжелым поро |
1982 г. кассифицировали степень гипоплазии пра |
|||||||||||||
ком с выраженной морфологической гетероген |
вого желудочка в зависимости от наличия или от |
|||||||||||||
ностью (рис. 1, 2). |
сутствия трех его отделов — входного, трабекуляр |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ЛА |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ЛА |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
ПП |
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ПЖ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
ПП |
|
|
||||
|
|
|
ПЖ |
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
Атриализованный |
|
||||
|
|
|
|
|
|
|
|
|
ПЖ |
|
||||
а |
|
|
|
|
|
|
|
б |
||||||
|
|
|
|
|
|
|
||||||||
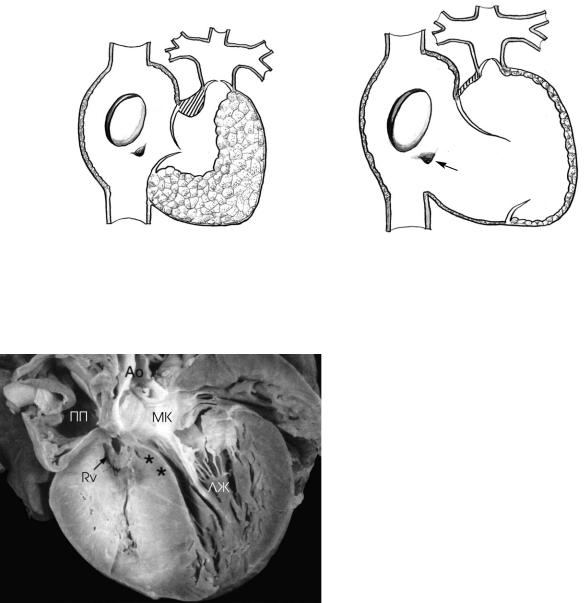
Рис. 1. Две формы атрезии легочной артерии с интактной межжелудочковой перегородкой: а — классическая форма, ха рактеризующаяся гипоплазией и гипертензией правого желудочка. Трехстворчатый клапан мал, с небольшой регургитаци ей. При этой форме могут быть ветрикулокоронарные связи; б — дилатационная форма сопровождается тяжелой трех створчатой регургитацией. Правое предсердие и правый желудочек резко дилатированы. Вентрикулокоронарные соеди нения не встречаются (ПП — правое предсердие, ПЖ — правый желудочек, ЛА — легочная артерия)
Рис. 2. Тяжелая гипоплазия правого желудочка (RV) при ат резии легочной артерии с интактной межжелудочковой пе регородкой. Свободная стенка правого желудочка и межже лудочковая перегородка резко утолщены. Полость правого желудочка щелевидная. Перегородка выбухает в выводной тракт левого желудочка (показано звездочками). (ПП — правое предсердие, МК — митральный клапан, ЛЖ — левый желудочек)
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
