
4 курс / Общая токсикология (доп.) / Toxikologia_ryb_Lukyanenko
.pdfРаздел III
ВОЗРАСТНЫЕ, ВИДОВЫЕ И ЭКОЛОГИЧЕСКИЕ ОСОБЕННОСТИ УСТОЙЧИВОСТИ И ЧУВСТВИТЕЛЬНОСТИ РЫБ К ЯДАМ
СРАВНИТЕЛЬНАЯ ХАРАКТЕРИСТИКА УСТОЙЧИВОСТИ РЫБ К ЯДАМ В ЭМБРИОНАЛЬНЫЙ И РАННИЙ ПОСТЭМБРИОНАЛЬНЫЙ ПЕРИОДЫ ЖИЗНИ
Исследование роли возрастного фактора в определении устойчивости рыб к ядам важно для понимания путей воздействия ядов промышленных сточных вод в естественном водоеме на популяцию вида в целом и отдельные стадии жизненного цикла, а также для правильного решения проблемы биологического нормирования предельно Допустимых и минимальных летальных концентраций ядов различной химической структуры. В данном случае речь идет о правильном выборе тест-объекта с тем, чтобы оценку уровня токсико-резистентности данного вида рыб проводить в период ее максимального снижения и с учетом именно этого «узкого» места в жизненном цикле вида. Имеющиеся литературные сведения весьма малочисленны.
В. Шелфорд (Schelford, 1923), сопоставляя устойчивость разных возрастных групп, пришел к выводу, что на ранних этапах развития рыбы менее устойчивы к ядам, чем взрослые особи. Целесообразность испытания токсичности той или иной группы ядов в период наименьшей устойчивости рыб получила экспериментальное обоснование в исследовании Н. С. Строганова и А. М. Пажиткова (1941). В опытах с икрой, личинками, мальками и взрослыми особями окуня было установлено, что ранние стадии развития менее устойчивы к ионам меди и аммиаку, чем взрослые рыбы. При равном времени воздействия взрослые окуни выживали в растворах меди, концентрация которой в 100 раз превышала летальную концентрацию для мальков. В опытах с аммиаком были получены менее выразительные данные, но достаточно отчетливо свидетельствующие о меньшей устойчивости эмбрионов и личинок окуня, чем взрослых рыб.
B других немногочисленных публикациях нет единого мнения о степени устойчивости рыб на разных этапах онтогенеза. В ряде работ (Sollmann, Scthweiger, 1957; Cairns, Scheir, 1957) с солями тяжелых металлов получено подтверждение того, что устойчивость рыб с возрастом увеличивается.
Значительный интерес представляют данные Г. Г. Поликарпова и В. Н. Иванова (1961, 1962 а, б, в) о влиянии стронция-90 - иттрия-90 активностью 10-14-10-12 до 10-4 кюри/л на развитие икры некоторых черноморских рыб (хамса, барабуля, зеленушка, ставрида, каменный окунь). Авторы отметили гибель икринок, задержку выклева и увеличение процента аномальных личинок в растворах стронция-90 - иттрия-90 концентрацией 10-12 – 10-10 кюри/л. На основе полученных материалов Г. Г. Поликарпов (1964) приходит к выводу, что рыбы наименее устойчивы к повреждающему действию ионизирующих излучений на ранних стадиях развития.
По данным Е. Хопкинса (Hopkins, 1928), форель 4-6-месячного возраста нормально живет в воде с рН 7,9- 8,9, в то время как икра и личинки форели и окуня погибают в растворе с концентрацией водородных ионов около 8,0. В работе Н. Бишая (Bishai, 1962) показано, что реакция личинок и мальков лосося (Salmo salar) и форели (S. trutta morpha fario) на воду с различной величиной рН определяется возрастными особенностями рыб. Личинки в возрасте до 3-4 недель индифферентны к слабокислой воде (рН 6,0-6,2), а с пятой недели проявляют негативную реакцию.
Наряду с этим получены данные (Hall, 1925; Surber, 1935; Kelley, 1946), свидетельствующие об отсутствии такой зависимости по отношению к высоким концентрациям СO2. Е. Сурбер (1935) отметил, что концентрации углекислоты между 55 и 78,5 мг/л в жесткой воде при рН 6,9-7,0 вызывают сокращение числа оплодотворенных икринок и увеличение числа уродливых личинок форели. Снижение концентрации СO2 до 43 мг/л полностью снимает токсический эффект. Сеголетки форели оставались нормальными в растворе с концентрацией 51 мг/л свободной углекислоты. Эти данные совпадают с наблюдениями А. Келлея (1948) по влиянию СO2 на развитие сельди. Эмбрионы сельди не проявляли признаков неблагополучия в широком диапазоне свободной углекислоты.
Имеется еще одна группа работ (Мосевич и др., 1952; Wurtz-Arlet, 1959; Katz a. Wiek, 1961; Вернидуб, 1962), выполненных с ядами органического ряда (фенол, синтетические детергенты, инсектициды). Установлено, что устойчивость рыб к этим ядам падает с увеличением возраста. Согласно данным Н. А. Мосевича и др. (1952) мальки плотвы и леща оказались немногим менее стойкими, чем взрослые особи. Выяснилось, что личинки сига значительно устойчивее мальков леща, плотвы и сеголетков карпа. В опытах с икрой, личинками и годовиками окуня авторы установили, что годовики менее устойчивы к фенолу, чем икра и личинки.
В 1962 г. М. Ф. Вернидуб опубликовала обстоятельное сообщение о токсическом действии смоляных фенолов на личинок балтийского лосося. Она использовала в качестве индикаторов токсического эффекта поведение личинок, состав красной крови и интенсивность дыхания, прирост длины и массы личинок, а также их жизнеспособность в растворах с различным содержанием фенолов. Оказалось, что при отравлении фенолами у личинок лосося появляются специфические и неспецифические изменения каждого из упомянутых показателей. М. Ф. Вернидуб установила, что в растворах смоляных фенолов 3, 12, 25, 50 мг/л личинки погибают в течение 18-20, 8-15, 4-8 и 4 суток соответственно. На основании этих наблюдений она предположила, что концентрация 1
81

мг/л также может оказаться смертельной. К сожалению, автор не приводит данных о величине летальной концентрации для лососей. Известно (Southgate, Pente-low, Bassindale 1933; Sierp, 1940; Wuhrmann, Woker, 1950;
Лукья-ненко и Флеров, 1966), что минимальная летальная концентрация фенолов для взрослых лососевых рыб находится в области 0,5-10 мг/л. Сопоставляя эти данные с результатами, полученными М. Ф.. Вернидуб, становится ясно, что личинки лосося значительно более устойчивы к фенолу, чем взрослые особи. Особенно четко это различие выявляется при сопоставлении их выживаемости. Согласно нашим данным, полученным на двухлетних особях радужной и ручьевой форели, в растворе фенола 10-12 мг/л взрослые особи погибают почти в 100 раз быстрее, чем личинки балтийского лосося (129-154 мин и 8-15 суток, соответственно). В серии опытов, проведенных нами совместно с В. М. Володиным и Б. А. Флеровым, были получены данные, освещающие два принципиально важных вопроса: 1) характеристику степени устойчивости к ядам органического ряда рыб на разных этапах онтогенеза и 2) соотношение между максимально переносимыми и минимально смертельными концентрациями для развивающейся икры, эмбрионов и личинок леща и синца на стадии смешанного питания. Использовались концентрации фенола: 1, 5, 10, 25, 50, 75, 100, 150, 200, 250, 500, 1000 и 5000 мн/л. Токсический эффект каждой концентрации определялся в опытах на 200 икринках. Всего для опытов было взято 4600 икринок и 1150 эмбрионов и личинок. Дважды в сутки сменяли растворы в опытах и контроле. Наблюдения продолжались от двух до восьми суток. Показателями токсического эффекта служила выживаемость икры, эмбрионов и личинок, а также характер и выраженность патоморфологических изменений у эмбрионов. Типичные уродства у эмбрионов были зарисованы с помощью рисовального аппарата.
Максимально переносимая (СМТ) и абсолютно смертельные (CL100) концентрации фенола для развивающейся икры синца и леща. Для определения СМТ и CL100 фенола при эмбриональном развитии порции икры синца на стадии начала дробления (2- 4 бластомера) по 200 икринок в каждой помещали в различные растворы фенола. В растворе фенола 5000 и 1000 мг/л происходит ослизнение и разбухание вторичных оболочек икринок, при дроблении образуются бластомеры разной величины и формы, часть их отрывается от общей массы и расползается по желточному мешку. В течение 1-7 ч икра полностью погибает. Снижение концентрации фенола до 500-250 мг/л также вызывает ряд серьезных нарушений в развитии икры. Шапочка морулы вытягивается вверх и утончается у основания. Во время гаструляции, в среднем через 20 ч после начала опыта, вся икра погибает. В растворе фенола 100 мг/л вся икра погибает через 30 ч тоже на стадии гаструляции. Концентрация 50 мг/л (табл. 35) является предельной, при которой икра синца может развиваться. Количество икринок, погибших при этой концентрации, было невелико, однако среди выклюнувшихся эмбрионов более 60% оказались уродливыми и нежизнеспособными. Концентрации 25, 10, 5 и 1 мг/л видимого токсического эффекта на эмбриональное развитие синца не оказывают. Отход при этих концентрациях был равен отходу икры, развивавшейся в воде без фенола, околох20%. Таким образом, для икры синца максимально переносимой концентрацией фенола является 25 мг/л, а минимально смертельной - 50 мг/л. Учитывая эти данные в опытах с икрой леща, мы значительно сузили диапазон концентрации фенола. Испытыва-лись концентрации 150, 100, 75, 50, 25 и 10 мг/л. Условия опыта были такие же, как с икрой синца. Через 24 ч после начала опыта, когда в контроле гаструляция уже заканчивалась, у икринок в растворах фенола 150 и 100 мг/л обрастание желтка бластодермой охватило лишь около 50% поверхности желточного мешка. К этому времени в растворе 150 мг/л погибло 90% икринок. В остальных растворах отход не превышал 5%.
|
|
|
|
Таблица 35 |
|
Выживаемость икры синца в растворах фенола различной концентрации |
|||
|
|
|
|
|
Номер опыта |
Концентрация, |
Количество |
Количество уродливых |
Общий отход, % |
|
мг/л |
погибшей икры, % |
эмбрионов, % |
|
|
|
|
|
|
Контроль |
0 |
14,0 |
6,5 |
20,5 |
1 |
1 |
11,5 |
4,0 |
16,5 |
2 |
5 |
15,5 |
3,0 |
18,5 |
3 |
10 |
11,5 |
5,5 |
17,0 |
4 |
25 |
12,0 |
4,5 |
16,5 |
5 |
50 |
22,0 |
64,5 |
86,5 |
6 |
100 |
100,0 |
- |
100,0 |
7 |
250 |
100,0 |
- |
100,0 |
8 |
500 |
100,0 |
- |
100,0 |
9 |
1000 |
100,0 |
- |
100,0 |
10 |
5000 |
100,0 |
- |
100,0 |
Через 48 ч контрольные эмбрионы стали двигать хвостом, у них начало пульсировать сердце, погибло всего 9% икринок, а в растворах фенола 150, 100 и 75 мг/л погибла вся икра. Отход икры в других концентрациях
82
фенола был меньше 1%. Спустя 96ч в растворе фенола 150 мг/л погибло около 31% икринок. К этому времени начался выклев эмбрионов из оболочек. Контрольные эмбрионы выклюнулись в течение суток, а подопытные в течение двух суток, причем в растворе фенола 50 мг/л часть эмбрионов погибла не выклевываясь (табл. 36).
|
|
|
|
Таблица 36 |
|
Выживаемость икры леща (в %) в растворах фенола |
|
||
|
|
|
|
|
Номер опыта |
Концентрация, |
Количество |
Количество уродливых |
Общий отход, % |
|
мг/л |
погибшей икры, % |
эмбрионов, % |
|
|
|
|
|
|
Контроль |
0 |
16 |
11 |
27 |
1 |
10 |
8 |
1 |
9 |
2 |
25 |
4 |
18 |
22 |
3 |
50 |
67 |
33 |
100 |
4 |
75 |
100 |
- |
100 |
5 |
100 |
100 |
- |
100 |
6 |
150 |
100 |
- |
100 |
При сравнений результатов опытов с икрой леща и синца выявились некоторые различия в их устойчивости к фенолу. Так, выклев эмбрионов у них тормозился при разных концентрациях фенола. Выклев эмбрионов леща задержался по сравнению с контролем на сутки уже при 25 мг/л фенола, а при 50 мг/л большая часть эмбрионов погибла, не выклевываясь. Выклев же эмбрионов синца тормозился лишь в растворах фенола 250 мг/л. Не исключено, что при более детальном изучении могут быть выявлены и другие различия в устойчивости икры двух рассматриваемых видов. Как и в опытах с икрой синца, максимально переносимая концентрация фенола для развивающейся икры леща оказалась равной 25 мг/л, а минимальная смертельная - 50 мг/л.
Устойчивость синца на ранних этапах онтогенеза. В первой части исследования мы определили пограничные концентрации фенола в воде, при которых возможен нормальный ход эмбриогенеза синца и леща. Чтобы определить устойчивость к фенолу синца в разные периоды развития, были поставлены опыты на икре (от начала пульсации сердца до выклева), выклюнувшихся эмбрионах и личинках (на этапе смешанного питания).
Эмбрионы от начала пульсации сердца до выклева. При изучении устойчивости к фенолу эмбрионов мы использовали сравнительно высокие концентрации яда: 100, 250 и 500 мг/л. Уже через 1,5 ч после начала опытов в растворе фенола 100 мг/л эмбрионы стали двигаться очень слабо, а в растворах 250 и 500 мг/л перестали двигаться. Перед выклевом, начавшимся в контроле через двое суток после начала опыта, в растворе фенола 500 мг/л погибла вся икра, причем эмбрионы под оболочками икринок были все уродливые. За этот же период в растворах 100 и 250 мг/л отход не превышал 5%. Однако при концентрации 250 мг/л все эмбрионы были уродливыми. В отличие от контрольных, они не двигались под оболочками, глаза у них были без пигмента, сердце пульсировало очень слабо, а в крови отсутствовали форменные элементы. Через четверо суток после начала опыта все они погибли, не выклевываясь из оболочек. Выклев эмбрионов из икры, помещенной в раствор фенола 100 мг/л, начался и закончился одновременно с контролем, но среди находившихся в феноле эмбрионов 54,3% были уродливые, т. е. в девять раз больше, чем в контроле. Нормальные по строению эмбрионы, подвергавшиеся действию фенола, в отличие от контрольных, были почти неподвижны и даже не реагировали на механическое раздражение. На девятые сутки после оплодотворения контрольные эмбрионы перешли на этап смешанного питания. Они активно плавали, туловище было интенсивно пигментировано, в глазах помимо гуаниновых пигментов появились меланиновые. В растворе фенола 100 мг/л развитие эмбрионов сильно задержалось. Пигментация отсутствовала, глаза были окрашены только гуаниновыми пигментами, а тело саблевидно изогнуто. У всех эмбрионов развилась водянка околосердечной сумки, наблюдалось вздутие перикарда, сердце вытянулось в трубку, сокращения сердечных мышц были очень слабые, а пульсация редкая. Подобная недостаточность кровообращения в дальнейшем приводит эмбрионов к быстрой гибели.
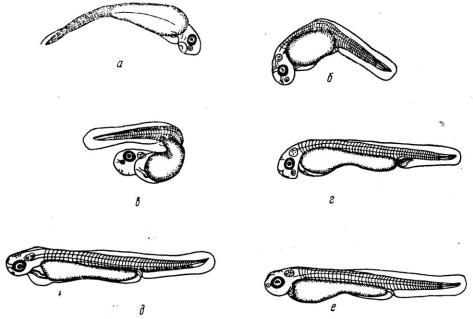
Кроме этих основных типов уродств, у некоторых эмбрионов желточный мешок был без вытянутой задней области, а у других форменные элементы крови скапливались в различных участках тела, чаще у перехода хвостовой вены в подкишечную или в области венозного синуса (рис. 29).
Выклюнувшиеся эмбрионы. Через сутки после вылупления 800 эмбрионов были помещены в растворы фенола 250, 200, 100, 75, 50 и 25 мг/л. Через двое суток после начала опытов у эмбрионов в контроле и в растворе фенола 25 мг/л желточный мешок принял продолговатую форму, началась пигментация туловища. Но в растворе фенола 50 мг/л развитие эмбрионов задержалось, у них образовались пигментные клетки.
В растворе фенола 75 мг/л у части эмбрионов туловище изогнулось, а в растворе фенола 100 мг/л, кроме того, желточный мешок сохранил отчетливое деление на два отдела. На четвертые сутки после вылупления у эмбрионов контроля плавательный пузырь наполнился воздухом и они перешли на смешанное питание. Личинки
83
активно плавали в вертикальной и в горизонтальной плоскостях. У эмбрионов всех экспериментальных серий плавательный пузырь был без воздуха, эмбрионы хотя и активны, но могли плавать лишь в вертикальной плоскости. Они были бледней контрольных, так как их пигментные клетки были сильно сжаты. У эмбрионов из растворов 75, 100 и 150 мг/л было изогнуто тело и увеличен перикард. В растворе фенола 200 мг/л погибло два эмбриона, а у остальных развилась водянка. В опытах с концентрацией яда 250 мг/л погибло семь эмбрионов, а оставшиеся неподвижно лежали на дне, у всех развилась водянка. На пятые сутки после вылупления у контрольных личинок полностью всосался желточный мешок. У личинок, содержавшихся в растворе фенола 25 мг/л, плавательный пузырь наполнился воздухом, их строение было нормальное, но пигментные клетки попрежнему сжаты. В опытах с раствором 50 и 75 мг/л плавательный пузырь личинок был еще без воздуха. В расстворах с более высокими концентрациями яда - 100, 150, 200 и 250 мг/л - эмбрионы погибли, причем в растворах 100 и 150 мг/л-« в среднем за 90 ч, а в двух последних - за 42 ч.
Рис. 29. Уродства эмбрионов синца, вызванные токсическим действием фенола: а, б, в - эмбрионы с изогнутым телом;
г- застой крови в месте перехода хвостовой вены в подкишечную;
д- эмбрионы с водянкой; е – нормальный эмбрион.
Личинки на Этапе смешанного питания. На этом этапе мы изучали действие трех концентраций фенола: 150, 100 и 50 мг/л. Так как во время экспериментов личинок не кормили, наблюдения продолжались всего в течение двух суток. В растворе фенола 150 мг/л через 24 ч погибло 74% личинок. Живые утратили подвижность, сердце у них стало сокращаться очень слабо и ток крови в сосудах резко замедлился. Пигментные клетки туловища сократились и личинки «побледнели». Все они погибли в течение последующих 12 ч. В растворе 100 мг/л все личинки без особых анатомических изменений, кроме сокращения пигментных клеток, погибли через 48 ч после начала опыта. За этот же период в растворе 50 мг/л гибели не наблюдалось и личинки ничем не отличались от контрольных.
Обобщая данные опытов, отмечаем следующее: фенол оказывает токсическое действие на все рассмотренные этапы онтогенеза. Сила и выраженность его действия зависит как от концентрации яда, так и от стадии развития рыбы. Токсический эффект фенола проявляется в существенных сдвигах нормального хода эмбриогенеза, вызывающих гибель икры, эмбрионов и личинок, а также в образовании различных уродств.
Сходный характер патоморфологических изменений наблюдается и при резких колебаниях температуры. Следовательно, выявленные сдвиги имеют неспецифический характер и наблюдаются при разнообразных неблагоприятных воздействиях на эмбриональное развитие рыб.
Резистентность рыб к фенолу на ранних этапах онтогенеза весьма различна, что проявляется как в величинах СМТ и Сl100 на каждом, из этапов, так и в средней продолжительности жизни при одинаковых концентрациях фенола. Наименее устойчивым периодом эмбриогенеза является самый ранний - от начала дробления до формирования эмбриона, особенно стадия гаструляции. Это отчетливо видно в табл. 37. С началом формирования эмбриона устойчивость к фенолу значительно повышается.
84
|
|
|
Таблица 37 |
Гибель икры сиywа на стадии гаструляции и за весь период развития |
|||
|
|
|
|
Номер опыта |
Концентрация, мг/л |
Гибель икры на стадии |
Гибель икры за весь |
|
|
га: труляции, % |
период развития, % |
1 |
1 |
74 |
100 |
2 |
5 |
87 |
100 |
3 |
10 |
100 |
100 |
4 |
25 |
89 |
100 |
5 |
50 |
73 |
100 |
Как следует из данных табл. 38, при концентрации фенола 100 мг/л икра на ранних стадиях развития погибает в восемь раз быстрее, чем на стадии сформировавшегося эмбриона. После вы-лупления из оболочек сопротивляемость эмбрионов резко снижается. Эмбрионы без оболочек погибают более чем в два раза' быстрее, чем находившиеся в оболочках.
|
|
Таблица 38 |
|
Резистентность синца к фенолу на ранних этапах онтогенеза |
|||
|
|
|
|
Стадии развития |
Концентрация, |
Средняя продолжительность |
|
|
мг/л |
жизни, ч |
|
|
|
|
|
Ранние |
100 |
30 |
|
|
250 |
20 |
|
|
500 |
20 |
|
Начало пульсации сердца до выклева |
100 |
108 |
|
эмбрионов |
250 |
240 |
|
|
500 |
48 |
|
Эмбрионы при выклеве |
100 |
90 |
|
|
250 |
42 |
|
Личинки на этапе смешанного |
100 |
48 |
|
питания |
250 |
30 |
|
Оболочка икринки, видимо, в значительной мере препятствует проникновению яда. Мы не смогли провести специальных опытов, чтобы доказать это предположение, однако данные других авторов о свойствах оболочек икры показывают, что это предположение не лишено оснований.
Так, например, Г. Г. Поликарпов (1964) показал, что студенистая оболочка икры аккумулирует огромные количества растворенных радиоактивных веществ, препятствуя тем самым их проникновению в икринку.
Можно предполагать, что изменения устойчивости рыб к яду определяются как изменением режима проницаемости, так и развитием центральной нервной системы на разных этапах онтогенеза. Значительное понижение устойчивости эмбрионов после выклева из оболочек указывает на важное значение оболочки и перивителли-новой жидкости, препятствующих накоплению ядов в организме и, возможно, смягчающих их действие (Строганов и Пажитков, 1941).
Наименее устойчива икра на стадии гаструляции, наиболее - икра на стадии пульсирующего сердца. Промежуточное положение занимают личинки на этапе смешанного питания и эмбрионы.
На основании наших опытов можно считать, что токсические компоненты промышленных сточных вод, уничтожая икру и молодь на нерестилищах, влияют на запасы рыб. Еще в 1913 г. Кларк отметил, что ведущей причиной снижения численности сига было разрушение нерестилищ на Великих озерах. 3_агря_знение промышленными сточными водами свело на нет нерестовое значение для осетровых Иртыша и Томи (Кожин, 1965). Загрязнение верхнего и среднего течения Волги и Оки, начавшееся еще в 30-х годах, привело к сокращению арела размножения осетровых на Волге и полному истощению запасов стерляди, улов которой достигал 15 тыс. ц в год.
Под угрозой находятся последние нерестилища осетровых на Нижней'Волге, вследствие постоянного загрязнения реки. Во время аварийных сбросов промышленных сточных вод гибнет икра осетровых и других ценных видов рыб.
85

ИЗМЕНЕНИЕ УСТОЙЧИВОСТИ К ЯДАМ ЛИЧИНОК, МАЛЬКОВ И СЕГОЛЕТКОВ РЫБ
Чтобы иметь представление о наиболее устойчивой стадии в онтогенезе, были поставлены опыты на личинках (этапы С2, D2 и Е) I и мальках леща и синца, а также на сеголетках карася и форели. Первая серия опытов проведена с Д. А. Пановым на 875 личинках и 154 мальках леща и синца. Выявлено, что токсикорезистентность рыб претерпевает существенные изменения на протяжении личиночного периода развития и что существуют значительные различия в устойчивости леща'и синца на каждом из исследованных этапов. В опытах использовали семь концентраций фенола: 15, 25, 50, 75, 100, 125 и 150 мг/л. Действие каждой концентрации испытывали на 50-30 личинках и 10 мальках синца и на 30-15 личинках и 12 мальках леща (табл. 39). В опытах с относительно низкими концентрациями фенола (15-50 мг/л) наблюдения велись на протяжении пяти суток. Токсический раствор меняли каждые 24 ч и дополнительно аэрировали. В течение всего периода наблюдений личинок и мальков подкармливали босминами. В качестве показателей устойчивости рыб использовали время и процент гибели.
|
|
|
|
|
Таблица 39 |
|
Масса и размеры подопытных личинок и мальков леща и синца |
|
|||
|
|
|
|
|
|
Вид |
Этап развития |
Средняя |
Амплитуда |
Средняя масса |
Амплитуда |
|
|
длинна, мм |
длиня, мм |
рыб, мг |
массы, мг |
Лещ |
С2 |
9,6 |
8,8-10,1 |
7,8 |
5-9 |
|
D2 |
11,7 |
11,0-12,0 |
17 |
12-20 |
Синец |
С2 |
10,0 |
9,5-10,2 |
60 |
5-7 |
|
Е |
14,6 |
14,0-15,1 |
31 |
27-36 |
|
Мальки |
18,4 |
17,0-20,0 |
80 |
61-103 |
Устойчивость личинок, леща и синца на этапе С2. В опытах, проведенных на 350 личинках синца и 210 личинках леща, было установлено, что личинки леща менее устойчивы к фенолу, чем личинки синца (рис. 30). Время выживания личинок синца было значительно больше, чем личинок леща во всех шести токсических растворах. Наибольшей выразительности эти различия достигли в опытах с высокими концентрациями фенола (150 и 100 мг/л), в растворах которых время выживания синца было в 4, 7 и 11 раз (соответственно) больше времени выживания личинок леща. Интересно, что более высокая (по времени выживания) устойчивость личинок леща была к токсическому действию концентрации фенола 125 мг/л по сравнению с меньшими концентрациями яда: 75 и 50 мг/л. В прежних наших опытах (Лукьяненко и Флеров, 1963а), выполненных на карасях (2+), устойчивость рыб в растворе фенола 100 мг/л оказалась ниже, чем в растворах с более высоким содержанием яда - 200 и 400 мг/л.
В области нижних концентраций фенола более устойчивыми оказались личинки леща, пороговая концентрация яда, не вызывающая гибель за 120 ч, оказалась для личинок леща равной 25 мг/л, а для личинок синца 15 мг/л. Это еще раз показывает, как важно для оценки устойчивости рыб к тому или иному компоненту промышленных сточных вод использовать широкий спектр токсических концентраций исследуемого вещества.
Рис. 30. Динамика гибели личинок леща и синца на этапе С2: a - синец: б - лещ.
86

Устойчивость личинок синца на этапе Е и личинок леща на этапе D2. Эта серия опытов выполнена на
210 личинках синца и 105 личинках леща. Снова подтвердилось наличие существенных различий в токсикорезистентности двух систематически близких видов рыб. На рис. 31 видно, что в пяти из семи использованных растворах фенола(от 50 до 150 мг/л) время выживания личинок леща было значительно короче, чем у личинок синца. Следовательно, наиболее существенные различия в устойчивости личинок леща и синца отмечены в растворах с высоким содержанием фенола. Время выживания личинок указанных видов в растворах фенола 25 и 15 мг/л практически было одинаковым. К концу личиночного периода развития устойчивость личинок заметно понизилась и концентрация 15 мг/л вызывала гибель личинок обоих видов за равный промежуток времени - 9697 ч. Вероятно более легкая ранимость леща и синца в конце личиночного периода развития связана с более высоким уровнем обмена в этот период.
Рис. 31. Динамика гибели личинок леща (этап D2) и синца (этап Е). Обозначения те же, что и на рис. 30.
Устойчивость мальков леща и синца. Опыты, поставленные на 70 мальках синца и 84 мальках леща, выявили резкое снижение устойчивости рыб на этом этапе онтогенеза по сравнению с /двумя предыдущими этапами. Время выживания мальков синца в каждом из шести растворов фенола (от 25 до 150 мг/л) было в 4-11 раз меньше, чем в опытах с синцом на этапе Е. Примерно такая же картина получена и в опытах с мальками леща, время выживания которых оказалось в 3-10 раз короче, чем у личинок на этапе D2.
Как и в предыдущих двух сериях опытов, уменьшение устойчивости наиболее выразительно в растворах с высокими концентрациями яда, устойчивость к которым падает в первую очередь. Время выживания мальков леща оказалось в 2-5 раз короче, чем мальков синца (рис. 32).
Рис. 32. Динамика гибели мальков леща и свинца. Обозначения те же, что и на рис. 30.
87
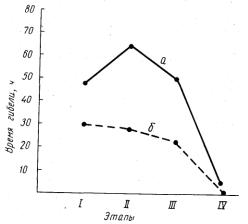
Было показано, что время выживания личинок синца на этапе смешанного питания (этап В в растворах фенола 100 и 150 мг/л оказалось равным 48 и 30 ч (соответственно). Это в пять раз меньше времени выживания эмбрионов на стадии начала пульсации сердца (240 к). Устойчивость личинок синца на этапе С2 и Е, т. е. середины и конца личиночного периода развития, примерно одинакова и мало отличается от устойчивости на этапе В. Время выживания личинок на этапе С2 в растворе фенола 100 мг/л - 67 ч, а в растворе 150 мг/л - 28 ч. Соответствующие показатели на этапе Е: в растворе фенола 100 мг/л - 50 ч и в растворе 150 мг/л - 22 ч. Это величины одного порядка и можно говорить о примерно одинаковом уровне устойчивости синца на каждом из трех различных этапов личиночного периода жизни. В начале малькового периода развития устойчивость синца резко падает (рис. 33). Время выживания мальков синца в растворах фенола 150 и 100 мг/л, исчисляемое 2-3 ч, более чем в 10 раз меньше времени выживания синца на каждом этапе личиночного периода развития.
Рис. 33. Динамика изменений устойчивости леща и синца на различных этапах личиночного периода развития:
а - концентрация фенола 100 мг/л; б-150 мг/л;
I - этап В; IIэтап С2;
III - этап Е; IV - мальки.
Мальки леща также значительно менее устойчивы, чем личинки на этапе С2 и D2.
Чтобы сопоставить уровень устойчивости мальков леща и синца со взрослыми особями этих видов рыб, была поставлена специальная серия опытов с 3-4-летними рыбами. Лещ и синец содержались в 150-литровых плексигласовых аквариумах с концентрациями фенола 5, 10, 15, 20 и 25 мг/л. Опыты продолжались 24 ч при температуре 6-9°С, содержании кислорода 8-10 мг/л, рН 6,9-7,2. Вода в аквариумах непрерывно аэрировалась. Токсический эффект каждой концентрации фенола определяли в двух повторных сериях опытов.
Устойчивость взрослых рыб этих видов оказалась также несколько различной, причем, в отличие от икры, у леща она несколько выше, чем у синца (табл. 40).
Таблица 40
Выживаемость взрослых синца и леща в разных растворах фенола
Вид рыб |
|
Концентрация фенола, мг/л |
|
|
|
||
|
5 |
10 |
15 |
20 |
|
25 |
|
Синец |
Выжили |
Выжили |
Выжили |
Погибло58% |
Погибли |
все |
|
|
|
|
|
через 13 ч |
через 5 |
ч 47 мин |
|
Лещ |
Выжили |
Погибло 20% |
Погибло 20% |
Погибло 25% |
Погибло 66% |
|
|
|
|
через 14 ч |
через 15 ч |
через 9,5 ч |
через 7 |
ч |
|
Концентрация фенола 25 мг/л вызывала гибель всех подопытных синцов. Лещей при этой концентрации погибло только 70%, но опыты по обратимости фенольной интоксикации показали, что пребывание рыб в течение 24 ч в растворе фенола с этой концентрацией приводит к тяжелой и, в большинстве случаев, необратимой интоксикации. При продлении контакта рыб с фенолом до 48 ч погибают все. Эта же концентрация фенола (25 мг/л) обусловила гибель мальков синца за 33 ч и мальков леща за 11ч.
При концентрации фенола 15 мг/л взрослые синцы выживали все и гибло только 20% подопытных лещей,
88
в то время как минимальная летальная концентрация фенола для мальков синца, рав-, ная 15 мг/л, вызывала гибель за 60 ч, а мальков леща - за 25 ч. Таким образом, наши опыты показали, что устойчивость рыб к одному из типичных ядов органического ряда - фенолу различна на разных стадиях онтогенеза.
Мы рассмотрели также устойчивость к ядам сеголетков и неполовозрелых рыб. Опыты (с участием Б. А. Флерова) были проведены на радужной форели (Salmo irrideus) - одном из наименее устойчивых видов рыб. В опытах использовано 205 рыб (сеголетки и 2 +) при различных концентрациях фенола: 5; 7,5; 10; 12,5; 20 и 25 мг/л. Действие каждой концентрации яда испытывалось на 1220 форелях в 300-литровых аквариумах. В опытах с низкими концентрациями фенола (5-10 мг/л) наблюдения вели на протяжении 24 ч. Растворы меняли каждые 4 ч. Опыты проводились при стабильных условиях: температура 12-14° С, рН 6,8-7,2, кислород - 9,6-10,2 мг/л.
Полученные результаты показаны в табл. 41.
|
|
|
|
|
Таблица 41 |
Время выживания сеголетков форели в растворах фенола разной концентрации |
|||||
|
|
|
|
|
|
Концентрация, |
Число |
Средняя |
Средняя масса, |
Среднее время |
Амплитуда |
мг/л |
испытуемых |
длинна, см |
г |
выживания, |
времени жизни, |
|
рыб |
|
|
мин |
мин |
5 |
15 |
8,0 |
5,6 |
Выжили |
- |
7,5 |
15 |
8,3 |
5,9 |
То же |
- |
10 |
15 |
7,6 |
4,7 |
630* |
510-750 |
12,5 |
15 |
8,8 |
7,1 |
336** |
20-1020 |
15 |
20 |
8,1 |
5,3 |
272 |
15-240 |
25 |
15 |
8,2 |
5,8 |
25 |
15-65 |
* Погибло 25%. ** Погибло 75%.
Оказалось, что при концентрации фенола 5 и 7,5 мг/л испытуемые рыбы за 24 ч не гибли. Поведение рыб в растворе фенола 10 мг/л заметно отличалось от контроля. Отмечалась резкая двигательная возбудимость и кратковременная потеря рефлекса равновесия у большинства рыб с последующим восстановлением. За время наблюдения погибло лишь 25% испытуемых рыб в течение 10 ч 30 мин. Остальные рыбы выжили. При концентрации фенола 12,5 мг/л погибло 75% испытуемых рыб за 5 ч 36 мин. Только концентрация фенола 15 мг/л вызвала 100%-ную гибель сеголетков в среднем за 4 ч 32 мин.
Результаты опытов с трехлетками форели (табл. 42) показывают, что концентрация фенола 5 мг/л не вызывает видимого токсического эффекта в течение 24 ч, но увеличение концентрации всего лишь на 2,5 мг/л (с 5 до 7,5 мг/л) приводит к возрастанию токсичности и гибели 50% испытуемых рыб за 162 мин.
Таблица 42
Время выживания трехлетков форели в растворах фенола
Концентрация, |
Средняя |
Средняя масса, |
Среднее время |
Амплитуда времени |
мг/л |
длинна, см |
г |
выживания, мин |
жизни, мин |
|
|
|
|
|
5 |
21,2 |
98 |
Выжили |
- |
7,5 |
21,8 |
104 |
162 |
120-225 |
10 |
21,9 |
95 |
129 |
50-240 |
12,5 |
22,0 |
111 |
95 |
35-205 |
15 |
20,6 |
88,1 |
40,4 |
15-75 |
25 |
18,8 |
70,3 |
16 |
10-30 |
Примечание. Во всех опытах использовали 12 рыб.
Оставшиеся рыбы выжили в течение 24 ч, причем у них был сохранен рефлекс равновесия. При концентрации фенола 10 мг/л погибли все испытуемые рыбы за 129 мин. Сопоставляя полученные данные,
видно, что CL100 для форели трехлетнего возраста равна 10 мг/л, CL50 - 7,5 мг/л, СМТ - 5 мг/л. Полученная нами величина летальной концентрации фенола (в течение 24 ч) 10 мг/л совпадает с литературными данными
89
(Steimann, 1927; Sierp, 1940; Wuhrmann, Woker, 1950), согласно которым она находится в области 9-10 мг/л.
Для сеголетков форели Сl100 равна 15 мг/л, CL50 - 11 мг/л и СМТ - 7,5 мг/л. Сопоставляя эти величины с аналогичными данными для форели трехлетнего возраста, можно говорить о более высокой
токсикорезистентности сеголетков форели. Это подтверждается также и продолжительностью жизни в растворах с различным содержанием фенола.
Аналогичные исследования мы провели на высокоустойчивом виде - карасе (Carassius carassius). Опыты проведены на 355 рыбах четырех возрастных групп (сеголетки, 1 + , 2+ и 3+). В качестве критерия устойчивости использовали продолжительность жизни. Применяли следующую шкалу смертельных концентраций: 15, 25, 50, 100, 200, 400 и 800 мг/л. Действие каждой концентрации испытывали на 20 карасях (по 10 рыб в опыте). Рыб содержали в 20-литровых плексигласовых аквариумах. При исследовании токсичности низких концентраций фенола (15-50 мг/л) наблюдения проводили в течение 10 суток, растворы фенола заменяли каждые 24 ч. Опыты проводили при 13-15° С, рН 7,3-7,6, содержании кислорода 5-6,6 мг/л. Результаты измерений продолжительности жизни подвергали статистической обработке.
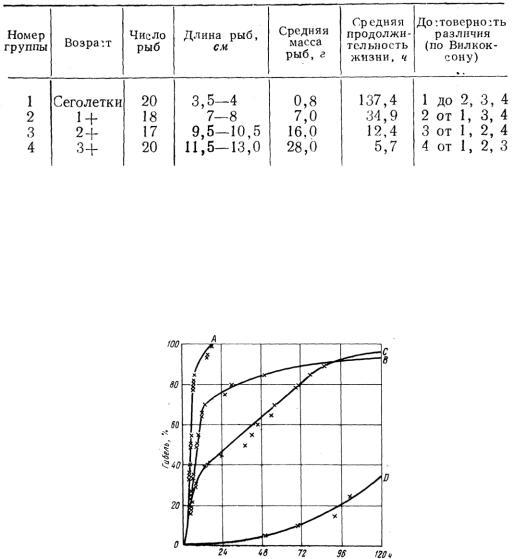
В первой части этой серии опытов сопоставляли устойчивость четырех указанных возрастных групп рыб в растворе фенола 50 мг/л (табл. 43).
Таблица 43
Сравнительная характеристика устойчивости карасей различного возраста к концентрации фенола 50 мг/л
Наиболее устойчивыми оказались сеголетки, но установить какую-либо определенную зависимость между возрастом и степенью резистентности в настоящее время невозможно. Время выживания сеголетков по сравнению с карасями 14 - больше в 3,9 раза, а карасей 1+ по сравнению с карасями 2 + только в 2,8 раза. Различие между следующими двумя возрастными группами (2+ и 3 + ) еще меньше - 2 раза. Создается впечатление, что по мере увеличения возраста резистентность рыб, достигнув определенного уровня, претерпевает лишь незначительные изменения, отчасти обусловленные высокой индивидуальной изменчивостью к ядам. Несомненно, однако, что рыбы ранних возрастных групп более устойчивы к действию фенола по сравнению со старшими возрастными группами (рис. 34). Эти кривые показывают, что возрастные различия устойчивости рыб накладывают свой отпечаток и на размах индивидуальных вариаций резистентности, определяя тем самым время гибели группы в целом.
Рис. 34. Динамика гибели карасей различных возрастных групп в растворе фенола 50. мг/л:
A - -3 +; В -2+; С - 1+ ; D - сеголетки
90
