
5 курс / Пульмонология и фтизиатрия / Чучалин_А_Г_Респираторная_медицина_т_1_2017
.pdf
Раздел 6
Поскольку пробы артериальной и смешанной венозной крови могут быть получены и проанализированы, то CaO2 и CvO2 могут быть рассчитаны. Количество крови, протекающей через шунт, может быть определено у пациентов, вдыхающих чистый кислород в течение времени, достаточного для вымывания всего N2 из альвеол. Альвеолярное парциальное напряжение O2 в этих условиях приблизительно составляет 673 мм рт.ст. (760 — альвеолярное PH2O — альвеолярное PCO2). В этих условиях не существует различия между альвеолами и конечным отделом легочных капилляров. Можно предположить, что кровь в конечном отделе легочных капилляров содержит кислород в количестве, равном кислородной емкости гемоглобина плюс 2,0 мл растворенного кислорода на 100 мл крови. Нормальный объем крови, протекающей через анатомический шунт (2% сердечного выброса), приводит к снижению содержания кислорода на 0,1 мл на 100 мл крови и к снижению парциального напряжения O2 на 35 мм рт.ст. от уровня теоретически максимально возможного уровня парциального артериального напряжения O2 при вдыхании чистого кислорода.
«Венозная примесь» или «физиологический шунт» могут быть оценены методом, разработанным J.L. Lilienthal и соавт. [6]. «Шунт» означает снижение вентиляционно-перфузионных отношений и включает перфузируемые альвеолы без вентиляции; гиповентилируемые альвеолы с нормальной, увеличенной или слегка сниженной перфузией; и вентилируемые альвеолы со значительно увеличенной перфузией. С этой точки зрения исследователь делает предположение о наличии двух отделов: с полным шунтом и без шунта [7].
Если пациент вдыхает чистый кислород, то это позволяет отличить шунт справа налево от нарушения вентиляционно-перфузионных отношений. Ожидаемые парциальные напряжения O2 в альвеолярном газе и артериальной крови в «идеальном легком», при вентиляционно-перфузионном дисбалансе и при наличии шунта представлены в табл. 6.1.
Вдыхаемый чистый O2 вымывает N2 из всех альвеол, имеющихся у обследуемого, даже у больных с тяжелыми обструктивными и рестриктив-
ными нарушениями. В альвеолах остаются O2, CO2 и водяные пары. В этих условиях:
PAO2 = PATOTAL – PACO2 – PAH2O,
где PATOTAL и PAH2O одинаковы во всех потенциально существующих единицах газообмена. Таким образом, разница в альвеолярном парциальном напряжении O2 между единицами газообмена существует только тогда, когда есть разница в парциальном напряжении CO2. В легких с «идеальным» газообменом или при вентиля- ционно-перфузионном дисбалансе увеличенное альвеолярное PO2 корректирует нарушение вен- тиляционно-перфузионных нарушений, приводя к высокому уровню артериального PO2.
Наиболее значимый легочный шунт у больных с легочной патологией обусловлен перфузией невентилируемых альвеол. Для клинических целей шунт справа налево может быть оценен как снижение артериального PO2 менее ожидаемой величины 673 мм рт.ст. На каждые 2% шунта приходится снижение PO2 на 35 мм рт.ст.
Измерение вентиляционно-перфузионных отношений
Одним из тестов оценки неравномерности вентиляции является тест на вымывание азота при одиночном вдохе кислорода. При проведении теста обследуемый после глубокого выдоха до уровня ОО делает максимальный вдох чистого кислорода, объем которого будет равен объему ЖЕЛ. Затем обследуемый делает медленный выдох до уровня ОО и проводится регистрация концентрации азота в выдыхаемом воздухе. На кривой вымывания азота выделяют четыре фазы.
В первую фазу выдоха выводится воздух из верхних дыхательных путей. Поскольку эта область содержит чистый кислород, содержание азота равно нулю. Во вторую фазу концентрация азота резко возрастает, так как газ анатомического мертвого пространства, содержащий азот, вымывается по мере опорожнения альвеол. Третья фаза представляет собой альвеолярное плато, поскольку выдыхается альвеолярный газ. У людей с неравномерностью вентиляции (например, при болезнях легочной паренхимы и воздухоносных путей) третья фаза не плоская, причем наклон в
Таблица 6.1. Влияние вдыхания 21 и 100% кислорода на среднее парциальное напряжение кислорода в альвеолярном газе, артериальной и смешанной венозной крови в легких с «идеальным» газообменом, при вентиляционно-перфузионном дисбалансе, при наличии шунта справа налево
|
Идеальный газообмен |
Вентиляционно- |
Шунт справа налево |
||||
Параметры |
перфузионный дисбаланс |
||||||
|
|
|
|
||||
|
21% |
100% |
21% |
100% |
21% |
100% |
|
|
|
|
|
|
|
|
|
PAO2 |
101 |
673 |
106 |
675 |
114 |
677 |
|
PaO2 |
101 |
673 |
89 |
673 |
59 |
125 |
|
P(A-a)O2 |
0 |
0 |
17 |
2 |
55 |
552 |
|
PvO2 |
40 |
51 |
40 |
51 |
40 |
42 |
|
350

Функциональные исследования
эту фазу фактически является мерой неоднородности вентиляции. Плохо вентилируемые зоны легких получают мало вдыхаемого кислорода и, следовательно, имеют высокую альвеолярную концентрацию азота, т.е. наблюдается меньшее разведение азота по сравнению с нормально вентилируемыми областями. Плохо вентилируемые области освобождаются в последнюю очередь, это обусловливает повышение концентрации азота во время 3-й фазы. После альвеолярного плато отмечается еще один заметный подъем концентрации азота (4-я фаза). По мере завершения выдоха происходит закрытие мелких воздухоносных путей базальных отделов, из богатых азотом апикальных легочных зон поступает пропорционально больше газа, формируя 4-ю фазу на кривой вымывания азота. Объем легких, оставшийся невыдохнутым
кначалу 4-й фазы, называется объемом закрытия. При обструктивных нарушениях вентиляции можно обнаружить значительное увеличение объема закрытия.
Метод множественных выдохов основан на измерении скорости вымывания азота. Обследуемый дышит из емкости с чистым кислородом, в выдыхаемом воздухе регистрируется концентрация азота. При равномерной вентиляции при каждом выдохе концентрация азота снижается в одинаковой степени. При наличии неравномерности вентиляции скорость разведения азота в разных участках легких различна. Сначала происходит разведение азота в хорошо вентилируемых альвеолах, и его содержание быстро падает. Затем азот медленно вымывается из плохо вентилируемых отделов.
Регионарное распределение вентиляции исследуется также при вдыхании радиоактивных газов, например ксенона (Xe). При вдыхании Xe-133 может быть измерена регионарная вентиляция на единицу легочного объема.
При внутривенном введении растворенного в физиологическом растворе Xe-133 может быть измерен регионарный кровоток [10]. Плато, получаемое при повторном дыхании в закрытом контуре, отражает легочный объем, определяемый количеством Xe-133. Для этого обследуемый подключается к закрытому контуру в конце внутривенного введения Xe-133. Пик радиоактивности отражает появление изотопа, распределенного в отношении
клегочному кровотоку. Около 85% изотопа поступает в альвеолярный газ, где он сохраняется до тех пор, пока обследуемый задерживает дыхание. При возобновлении дыхания распределение изотопа отражает вентиляцию перфузируемых участков легких. Медленное вымывание предполагает наличие зон с относительно низким вентиляцион- но-перфузионным отношением. Функциональное определение вентиляционно-перфузионных отношений с помощью этого метода является более близким по отношению к легочному газообмену, чем оценка данной характеристики, полученная
делением измеренной регионарной вентиляции на отдельно измеренную регионарную перфузию.
Наиболее широко используемым радиоизотопным методом исследования легких является исследование легочной перфузии после внутривенного введения альбумина, меченного техне- цием-99m (Tc-99m) [11]. Частицы диаметром от 20 до 50 мм попадают в мелкие легочные сосуды пропорционально объему перфузии. Риск при проведении данного исследования минимален. Попадание меченых частиц в системный кровоток через внутрилегочный шунт справа налево или через внутрисердечный шунт, вероятно, не сопровождается побочными эффектами. Доза радиации при изотопном исследовании легких невелика, и накопление изотопа ограничено преимущественно легкими. При стандартном исследовании с использованием Xe-133 и Tc-99m доза радиации ниже в 12–25 раз ежегодно допустимой.
Распределение вентиляционно-перфузионных отношений
Распределение кровотока по отношению к вентиляции, как говорилось выше, можно рассматривать с точки зрения физиологического мертвого пространства. Wagner и соавт. [12] предложили представить легкое состоящим из большого количества гомогенных единиц. Каждая единица легкого имеет свои собственные вентиляцию, кровоток и соответствующий газовый состав. Исследование проводится с шестью инертными газами, имеющими различную растворимость. Эти газы растворяются в физиологическом растворе и вводятся внутривенно. Для каждой единицы легкого количество газа представляет собой функцию от венти- ляционно-перфузионных отношений. Для легких в целом смешанная артериальная концентрация газов является средним взвешенным кровотоком, а уровень газов в выдыхаемом воздухе представляет средневзвешенную вентиляцию. Эти параметры измеряются совместно с сердечным выбросом и минутным объемом вентиляции. Полученные величины используются для того, чтобы рассчитать соответствующие концентрации в смешанной венозной крови и в альвеолярном воздухе, а затем оценить распределение вентиляции и кровотока.
Рассмотренные методы широко используются для диагностики и динамического наблюдения больных с различными заболеваниями легких. Так, измерение физиологического мертвого пространства и альвеолярной вентиляции является обычной процедурой в блоках интенсивной терапии. Для оценки внутрилегочного шунтирования проводят исследования при вдыхании 100% кислорода.
Оценка распределения вентиляционно-перфу- зионных отношений дает большую информацию о патофизиологии вентиляционно-перфузионных распределений при заболеваниях легких. Однако эти методы не имеют широкого распространения
351

Раздел 6
в клинической практике. Тем не менее методы радиоизотопного исследования важны у больных с изменениями легочного кровотока, а также у больных после пересадки одного легкого.
Измерение газов артериальной крови
Инвазивные методы измерения pH
Измерение pH крови проводится с помощью pH-электрода. Разность потенциалов по обе стороны стеклянной мембраны представляет собой линейную функцию pH. Необходимо проводить калибровку электрода с двумя буферными растворами с известными pH, которые охватывают существенную часть диапазона предполагаемых измерений. Нормальный диапазон pH артериальной крови — 7,35–7,45.
Современные pH-электроды являются надежными средствами измерения [1], так, при повторном измерении одного и того же образца разброс значений составляет ±0,02 единицы. При повреждении стеклянной мембраны электрода точность измерения значительно снижается. Для контроля качества измерений калибровка pH-электрода должна проводиться по одной точке перед каждой серией измерений и по двум точкам — каждые 4 ч.
Углекислый газ
Ранее существовавшие методы измерения концентрации газов в крови были слишком трудоемки. В настоящее время разработан и широко используется электрод для измерения CO2, основанный на тех же принципах, что и pH-электрод, и на взаимоотношении между PCO2 и pH в буферном растворе. Этот электрод имеет достаточную точность. При проведении повторных измерений одного и того же образца разброс составляет ±3,0 мм рт.ст. при измерении PCO2 в диапазоне от 20 до 60 мм рт.ст. Для контроля соответствующего качества измерений калибровка должна проводиться по одной точке перед каждой серией измерений и по двум точкам — каждые 4–8 ч. Если разброс при калибровке превышает 2 мм рт.ст. по сравнению с калибровочным образцом, то калибровку также необходимо повторить по двум точкам.
Нормальные значения PCO2 в артериальной крови зависят от высоты над уровнем моря. Так, на уровне моря этот показатель находится в диапазоне от 36 до 44 мм рт.ст. [2], на высоте 1340– 1520 м — в диапазоне от 30 до 40 мм рт.ст. [3].
Кислород
Парциальное напряжение кислорода
Принцип работы O2-электрода отличается от pH- и PCO2-электродов. Работа данного электрода основана на измерении потока электронов, а не на разности потенциалов. Поток электронов
пропорционален концентрации кислорода на платиновом электроде.
Если для калибровки электрода используются газы, то необходимо вводить поправочный коэффициент в определяемое значение PO2. Однако этот коэффициент не имеет линейной связи с PO2, поэтому вносится существенная ошибка при измерении высоких значений PO2 (например, при вдыхании больным 100% кислорода для оценки шунтируемого объема крови). При повторном измерении PO2 в крови с использованием одного и того же электрода допустимый разброс измерений может составлять ±3,0 мм рт.ст. для PO2 от 20 до 150 мм рт.ст. [2].
Нормальное значение PO2 может быть рассчитано из следующего уравнения [4]:
PO2 = 104,2 – 0,27 × возраст (годы).
Содержание кислорода
Содержание кислорода в крови может быть измерено с помощью химического и гальванического методов или определено из PO2, общей концентрации гемоглобина и процентного содержания оксигемоглобина.
Наиболее часто используемым методом является метод, при котором общая концентрация гемоглобина измеряется с помощью цианметгемоглобина [5], процент оксигемоглобина определяется спектрофотометрически, количество растворенного кислорода получается из PO2 и коэффициента растворимости кислорода (0,0031 мл на 100 мл крови).
CaO2 = (1,34 × Hb × SaO2) + (PaO2 × 0,0031).
При заборе крови для анализа необходимо избегать контакта образца крови с комнатным воздухом и чрезмерного количества антикоагулянта. Для этих целей лучше использовать стерильные стеклянные шприцы, забор крови предпочтительно производить из лучевой артерии у взрослых или из артерий пуповины у новорожденных. Иногда используют артериализированную капиллярную кровь. Для этого на кожу наносят специальный состав, расширяющий сосуды, либо нагревают то место, из которого будет произведен забор капиллярной крови. Показаны хорошие корреляционные связи между pH, газами артериальной крови и этими же параметрами, измеренными в артериализированной капиллярной крови [6], за исключением тех случаев, когда исследование проводится у больных артериальной гипотензией, тяжелой гипоксемией или у больных с высоким PO2 на фоне вдыхания газовых смесей с высоким содержанием кислорода.
Неинвазивные методы измерения
В качестве неинвазивных и в то же время достаточно точных методов оценки артериальных газов были разработаны устройства для транскутанного измерения насыщения крови кислородом и давления.
352

Функциональные исследования
Кислород
Оксиметрия
Принцип метода основан на том, что количество света, поглощенного раствором, связано с концентрацией изучаемого раствора.
Метод пульсоксиметрии достаточно точен, если насыщение крови кислородом находится в диапазоне от 70 до 100% [7]. В присутствии метгемоглобина, карбоксигемоглобина или фетального гемоглобина, а также при увеличении концентрации билирубина в крови, снижении тканевого кровотока, анемии или при увеличении венозной пульсации использование данного метода вносит достаточную погрешность в измерение насыщения крови кислородом [8]. Кроме того, этот метод имеет ограничение, которое связано с формой кривой диссоциации оксигемоглобина. При высоких значениях PO2 значительным изменениям этого показателя соответствуют незначительные изменения SO2.
Этот метод нашел широкое применение в блоках интенсивной терапии, рекомендуется использовать пульсоксиметрию при проведении бронхоскопии, для наблюдения за больными с ночным апноэ, при кислородотерапии и т.д. [9].
В настоящее время разработаны транскутанные электроды, которые позволяют оценивать PO2. Для проведения этого исследования необходима местная вазодилатация, которая может быть достигнута нагреванием участка кожи обследуемого до температуры тела 42 °С. Метод оказался достаточно точным при проведении исследования у новорожденных. Однако он не дает таких же точных результатов у взрослых обследуемых. Этот метод зависит от местного кровотока, и поэтому измерение PO2 имеет погрешность при исследовании больных гипотензией.
Углекислый газ
Капнография
Неинвазивная оценка PCO2 так же важна, как измерение PO2. Капнография — измерение углекислого газа во время дыхательного цикла. Капнограмма — это графическое или аналоговое представление изменений PO2 в выдыхаемом воздухе. Измерение проводится с помощью инфракрасного спектрометра.
Масс-спектрометрия — метод, позволяющий измерять все газы, содержащиеся в выдыхаемом воздухе (CO2, O2, N2), однако он достаточно дорогостоящий.
Капнограмма представляет собой кривую, на которой можно выделить три фазы: 1-я фаза — от момента начала выдоха некоторое время PCO2 остается равным нулю, поскольку анализируемая порция выдыхаемого газа выводится из мертвого пространства; 2-я фаза — от начала подъема или увеличения PCO2 до уровня достижения плато эта фаза соответствует примешиванию альвеолярного газа к газу мертвого пространства; 3-я фаза — пла-
то, данная фаза обусловлена поступлением газа из альвеолярного пространства.
При нарушении распределения вентиляции и соответствия кровотока вентиляции отмечается увеличение наклона 3-й фазы (плато) на капнографической кривой.
Транскутанное измерение PCO2 — метод измерения CO2 фотометрическим анализатором (в инфракрасном диапазоне) [10]. При уменьшении кровотока в коже, при отеках или при ожирении обследуемых данный метод имеет большие погрешности [11].
Заключение
Исследование сложных респираторных физиологических процессов требует применения большого количества функциональных тестов. Нет какого-либо отдельного теста исследования респираторной функции, предоставляющего желаемую информацию по отдельному пациенту. В то же время не нужно использовать все имеющиеся тесты в программе исследования единичного пациента. Некоторые тесты очень просты и должны проводиться каждому пациенту с подозреваемой или установленной сердечно-легочной патологией (спирометрия), так же как выполняются исследования АД, ЭКГ и др.
Легочные функциональные тесты позволяют оценить влияние заболевания на респираторную функцию и не дают возможности поставить точный диагноз, тем не менее они являются важной и необходимой частью клинического обследования пациентов.
Список литературы
См. 
6.2. Нагрузочное тестирование в клинической практике
А.В. Черняк, З.Р. Айсанов, С.Ю. Чикина, Е.Н. Калманова
Физическая нагрузка является идеальным и наиболее физиологичным видом провокации, позволяющим оценить состояние компенсатор- но-приспособительных механизмов организма, а при наличии явной или скрытой патологии — степень функциональной неполноценности кардиореспираторной системы. Способность организма адекватно реагировать на нагрузку является показателем физиологического здоровья и функциональной полноценности. В клинической практике важно оценить функциональное состояние системы транспорта газов, необходимое для поддержания тканевого (клеточного) дыхания, так как при многих патологических состояниях функционирование этой системы нарушается. Таким обра-
353

Раздел 6
зом, тест с физической нагрузкой (НТ) является универсальным средством оценки физической работоспособности и определения механизмов нарушения толерантности к физической нагрузке.
В зависимости от технического оснащения НТ можно разделить на две группы: высокотехнологичные, или кардиореспираторные, нагрузочные тесты (КРНТ), для проведения которых необходимо дорогостоящее оборудование, и НТ, не требующие специального оборудования, — так называемые внелабораторные, или «полевые», НТ.
Физиология мышечной деятельности
Значительное возрастание метаболических потребностей во время нагрузки требует существенного повышения количества доставляемого к мышцам кислорода. Одновременно для предотвращения тканевого ацидоза, способного оказать неблагоприятное воздействие на функцию клеток, из интенсивно работающих мышц должно быть удалено повышенное количество углекислоты (CO2). Для удовлетворения возросших энергетических потребностей мышечной клетки во время нагрузки необходима тесная взаимосвязь физиологических компенсаторных механизмов на всех уровнях: легких, легочного кровообращения, сердца и системного кровообращения. Схема взаимосвязи всех этих процессов в виде системы зубчатых колес, приводящих в движение друг друга, была предложена К. Wasserman (рис. 6.10) [1]. Тесное и синхронное взаимодействие всех звеньев кислородного транспорта требуется для адекватной доставки кислорода (O2) к тканям, своевременной элиминации CO2 и поддержания газового состава артериальной крови при возрастании скорости метаболизма.
Значительное повышение утилизации O2 мышцами (Q’O2) достигается повышением его экстракции из крови, перфузирующей эти мышцы, селективной дилатацией периферических сосудов, повышением легочного кровотока путем мобилизации и вазодилатации сосудов малого круга и, наконец, повышением уровня вентиляции. O2, поступающий из альвеол через альвеолярно-ка- пиллярную мембрану, соединяется в эритроцитах с гемоглобином пропорционально скорости кровотока и обратно пропорционально степени насыщения гемоглобина O2. В устойчивом состоянии потребление O2 (V’O2) равно Q’O2. Минутная вентиляция (V’E = ДО×ЧД, где ДО — дыхательный объем, ЧД — частота дыхания) возрастает в зависимости от количества вновь образованной углекислоты (Q’CO2), поступающей в легкие, и центральных механизмов регуляции рН и напряжения CO2 в артериальной крови.
Реакция на физическую нагрузку
Для того чтобы оценить адекватность реакции организма на физическую нагрузку, необходимо
Рис. 6.10. Представленная схема иллюстрирует механизмы газового транспорта и тесной взаимосвязи тканевого (или клеточного) и легочного (или внешнего) дыхания. Зубчатые колеса означают функциональную взаимосвязь отдельных компонентов этой сложной системы [Wasserman K., Hansen J.E., Sue D.Y. et al. Principles of exercise testing and interpretation, ed 5, Philadephia, 2012, Lippincott Williams & Wilkins]. Дыхательная система обеспечивает перемещение O2 из атмосферы в альвеолы, где кислород через альвео- лярно-капиллярную мембрану поступает в кровь и связывается с гемоглобином. Сердечно-сосудистая система доставляет оксигенированную кровь в работающие мышцы, которые потребляют O2. Кислород обеспечивает синтез аденозинтрифосфата и, следовательно, мышечное сокращение. Результатом мышечной деятельности является продукция CO2, который с помощью сердечно-сосудистой системы перемещается к легким, через альвеолярно-капил- лярную мембрану поступает в альвеолы и далее в атмосферный воздух. ДО — дыхательный объем; ЧД — частота дыхания; V’E — минутная вентиляция; УО — ударный объем; ЧСС — частота сердечных сокращений; ПЖ — правый желудочек; ЛЖ — левый желудочек
изучить изменения метаболизма, вентиляционной способности легких, газового обмена и гемодинамики на фоне возрастающей нагрузки.
Метаболизм
Потребление кислорода
V’O2 определяется как потребность клеток в O2 на определенном уровне метаболизма для осуществления максимальной скорости транспорта
O2.
Факторы, обеспечивающие достаточный уровень O2, зависят от способности крови транспортировать O2 (уровень гемоглобина, артериальная сатурация O2 — SpO2), функции сердца (частота сердечных сокращений — ЧСС, ударный объем — УО), перераспределения периферической крови и экстракции тканями O2 (плотность капилляров, митохондрий, адекватность перфузии и диффузия в тканях). V’O2 может быть рассчитано по уравнению Фика:
V’O2 = Q’ × (CaO2 – CvO2), |
(1) |
где Q’ — сердечный выброс, CaO2 и CvO2 — содержание кислорода в артериальной и смешанной
354

Функциональные исследования
венозной крови соответственно. Артериовенозная разница содержания O2 (CaO2 – CvO2) отражает экстракцию O2 тканями.
По мере возрастания нагрузки достигается максимальное потребление O2 (V’O2max). Этот параметр является важным и полезным для оценки реакции сердечно-сосудистой системы на нагрузку. Учитывая, что артериовенозная разница содержания O2 при максимальной нагрузке у здоровых людей является относительно постоянной и величина ее существенно не отличается у пациентов с кардиологическими заболеваниями [2], широкий разброс в V’O2max у разных пациентов в первую очередь определяется изменением Q’. Чем больше V’O2max, тем больше Q’ пациента, и наоборот.
V’O2 также используют для оценки УО при максимальной нагрузке. Q’ представляет собой произведение ЧСС и УО:
Q’ = ЧСС × УО, |
(2) |
следовательно, уравнение (1) можно модифицировать:
V’O2 = ЧСС × УО × (CaO2 – CvO2). (3)
В норме при нагрузке Q’ увеличивается линейно по отношению к V’O2 и ЧСС, и можно записать следующее уравнение:
V’O2/ЧСС = УО × (CaO2 – CvO2). (4)
Поскольку артериовенозная разница содержания O2 при максимальной нагрузке у здоровых людей является постоянной, то V’O2/ЧСС служит суррогатным маркером УО на пике нагрузки; его называют кислородным пульсом, или O2-пульсом.
Потребляемое организмом количество O2 в состоянии покоя составляет 3,5 мл на 1 кг массы тела в минуту (мл/мин·кг), т.е. у человека средней комплекции (около 70 кг) V’O2 равно 250 мл/мин. Часто, особенно при использовании беговой дорожки (тредмила), V’O2 при нагрузке выражают в таких единицах, как метаболический эквивалент (МЕТ), кратных потреблению O2 в условиях покоя (1 МЕТ = 3,5 мл O2 на 1 кг массы тела в минуту). В действительности потребление O2 в состоянии покоя у каждого человека индивидуально, так что 1 МЕТ является усредненной величиной. При нагрузке V’O2 возрастает почти линейно до достижения плато. Отношение V’O2 к заданной нагрузке (ΔV’O2/ΔWR) отражает эффективность перехода потенциальной химической энергии в механическую работу и механическую эффективность мышечно-скелетной системы. При нагрузке ΔV’O2/ΔWR обычно составляет 10 (от 8,5 до 11) мл/мин/Вт. Снижение ΔV’O2/ΔWR в большинстве случаев указывает на неадекватность кислородного транспорта, что может встречаться при некоторых заболеваниях сердца, легких или при нарушении гемодинамики. Кроме того, нарушение процесса утилизации O2, например при митохондриальной миопатии, идиопатическом ле-
гочном фиброзе (ИЛФ), может также проявляться снижением наклона кривой «V’O2–нагрузка» [3]. Для подтверждения этих нарушений необходимы дальнейшие исследования.
Прекращение дальнейшего роста потребления O2 при возрастающей нагрузке означает, что один или несколько факторов достигли своего предела (например, это может быть УО, ЧСС или экстракция O2 из тканей); эта величина определяется как V’O2max. Показатель V’O2max является наилучшим индексом физической работоспособности. Он отражает максимально достижимый уровень метаболизма O2. Однако в конкретных клинических ситуациях истинное плато не достигается изза появления нежелательных симптомов (одышка, усталость). В таком случае используют термин «пиковое потребление O2» (V’O2peak). Это означает, что максимальное потребление O2 определить не удалось. В клинической практике V’O2max и V’O2peak взаимозаменяемы. V’O2max превышает
в10–15 раз показатели покоя и составляет 30– 40 мл/мин на 1 кг массы тела у здоровых людей
вконце тестирования. У спортсменов этот показатель может быть значительно выше и достигать
80–90 мл/мин на 1 кг массы тела. V’O2max зависит от возраста, пола, комплекции, а также от тренированности человека. С помощью интенсивных
физических тренировок V’O2max у нетренированных пациентов можно увеличить на 15–25% [4], однако достичь уровня элитных спортсменов не удастся. Физические тренировки позволяют повысить эффективность работы и выносливость, т.е. способность поддерживать высокую нагрузку.
В клинической практике при НТ V’O2max пациента обычно представляют в процентах должных значений, которые определяют в крупных популяционных исследованиях. Должные значения, как правило, зависят от возраста и пола. Были опубликованы многочисленные исследования по расчету должных значений, однако применение значительной части этих работ ограничено методологией отбора популяции (например, по возрасту) [5]. Рекомендуется выбирать должные значения так, чтобы они отра-
жали исследуемую популяцию, а V’O2max представлять как в абсолютных значениях (л/мин), так и в процентах должных величин.
V’O2max может быть нормализованным по массе тела человека в килограммах. Однако соответствующие нормализованные значения были рассчитаны для здоровых людей и спортсменов и не учитывали существенное увеличение массы тела
впопуляции в последнее десятилетие. Поэтому
V’O2, нормализованное по массе тела (в мл/мин на 1 кг реальной массы тела) не должно использоваться у пациентов с ожирением. Более разумным подходом для этой группы больных является отно-
шение V’O2 к росту (V’O2/рост), что эквивалентно нормализации V’O2max к идеальной массе тела [6]. Необходимы дополнительные исследования в этом направлении.
355

Раздел 6
Снижение V’O2peak может свидетельствовать о проблемах с транспортом O2 (изменения Q’ или способности крови транспортировать O2), о легочных ограничениях (нарушения механических свойств легких, центральной регуляции дыхания, газообмена), о проблемах с экстракцией O2 в тканях (изменения тканевой перфузии и диффузии),
онейромышечных или мышечно-скелетных ограничениях и, конечно, о недостаточном усилии при выполнении НТ. Таким образом, снижение
V’O2max зависит от множества самых различных факторов.
Снижение V’O2max (V’O2peak) свидетельствует
оснижении физической толерантности (способности выполнять физическую нагрузку). Причины, приводящие к ограничению физической работоспособности, проявляются изменением цело-
го ряда показателей, однако снижение V’O2max является главной отправной точкой для определения нарушенной толерантности к физической нагрузке.
Продукция CO2
В покое у человека средней комплекции продукция CO2 (V’CO2) составляет 200 мл/мин. Во время физической нагрузки V’CO2 линейно возрастает примерно с той же скоростью, что и V’O2,
иопределяется факторами, похожими на те, которые определяют V’O2. Это в первую очередь Q’
исвойства крови, обеспечивающие газообмен в тканях. Поскольку растворимость CO2 в тканях
ив крови существенно выше, чем растворимость
O2, то продукция CO2, измеренная во время НТ, в большей степени, чем V’O2, зависит от вентиляции. Кроме того, поскольку растворенный CO2 является слабой кислотой, организм включает механизмы
регуляции уровня CO2 для устранения острого метаболического ацидоза, который влияет на паттерн
V’CO2 при возрастании интенсивности физической нагрузки после достижения точки перехода на анаэробный метаболизм — анаэробного порога (АП) (см. ниже). Анаэробный метаболизм приводит к превращению пирувата в лактат, который забуферивается ионами бикарбоната и ведет к уве-
личению продукции CO2. Рост V’CO2 становится нелинейным и вызывает пропорциональный рост минутной вентиляции (V’E). Такое повышение V’E непропорционально относительно V’O2 [7].
Отношение респираторного обмена
Отношение V’CO2/V’O2 называется также отношением газообмена, или отношением респираторного обмена (RER). В условиях устойчивого равновесия RER равно респираторному коэффициенту (RQ), значение которого определяется субстратом, использующимся для метаболических процессов. Значение RQ, равное 1, указывает на метаболизм преимущественно за счет углеводов, в то время как RQ меньше 1 указывает на преобладание смешанного метаболизма за счет углеводов
и жиров (около 0,7) или протеинов (около 0,8). Термин RQ применяется для обозначения происходящих в тканях процессов, которые трудно измерить и которые не определяются во время НТ. Показатель RER обычно определяется при исследовании газообмена в выдыхаемом воздухе. При истинном состоянии устойчивого равновесия системы транспорта O2 работают синхронно со скоростью метаболизма тканей; таким образом, RER может использоваться как грубый показатель метаболических процессов. При нагрузке легкой и средней интенсивности RER остается достаточно стабильным и равен 0,80–0,95 в зависимости от преобладания в питании жиров или углеводов. В самом начале и на ранних стадиях НТ RER может временно повышаться из-за чрезмерной гипервентиляции, при этом рекомендуется продлить фазу разогрева до тех пор, пока показатель не восстановится. После достижения АП V’CO2 заметно увеличивается и RER превышает 1. После прекращения нагрузки V’O2 падает, тогда как V’CO2 остается повышенным, поскольку продолжается выведение тканевого CO2. Вследствие этого после прекращения нагрузки RER может и далее увеличиваться в течение 1–2 мин и достичь значений 1,3–1,5, прежде чем вернется к исходному уровню. Таким образом, если при НТ RER больше 1, следует предположить, что причиной могут быть молочнокислый ацидоз и гипервентиляция.
Анаэробный порог
АП известен так же как лактатный порог, порог молочной кислоты, газообменный порог, вентиляционный порог. АП — один из ключевых параметров при НТ. Это, конечно же, не порог в буквальном смысле слова, выше которого имеет место только анаэробный механизм, а ниже — только аэробный. АП в целом описывает тот уровень нагрузки или потребления O2, при котором значительная часть энергетических потребностей покрывается за счет анаэробного метаболизма. Если V’O2 ниже АП, физическая нагрузка может выполняться продолжительное время, если выше — выполнение НТ ограничивается рядом факторов.
Показатель АП всегда соотносится с V’O2, при котором происходят эти изменения, и выражается в процентах должных значений V’O2max. У здоровых людей АП наблюдается при V’O2 от 40 до 80% должного значения V’O2max [7]. Этот порог означает решающий момент при проведении теста с прогрессивно возрастающей нагрузкой, когда поток крови в работающих мышцах уже является недостаточным для удовлетворения их метаболических потребностей и происходит переход к нагрузке высокой интенсивности. Термин АП широко используется в клинической практике. Существует также термин «порог молочной кислоты», который предпочтителен в тех случаях, когда уровень лактата измеряется непосредствен-
356

Функциональные исследования
но в крови. Название «вентиляционный порог» подразумевает, что имеет место вентиляционный ответ, который является следствием метаболического ацидоза.
Физиологические механизмы, лежащие в основе возрастания уровня лактата в мышцах и в крови при АП, до конца не изучены [8, 9]. После достижения АП следуют две метаболические фазы.
В первой, изокапнической, фазе избыточные количества лактата забуфериваются ионами бикарбоната, что ведет к увеличению продукции CO2:
[H+] + [HCO3–] ↔ [H2CO3] ↔ [CO2] + [H2O] (5).
Существенный рост V’CO2 приводит к пропорциональному росту V’E. Артериальное и ко- нечно-экспираторное парциальное давления CO2 (PaCO2 и PETCO2 соответственно) остаются неизменными. Снижается эффективность потребления O2, повышаются PO2 и вентиляционный эквивалент для O2 (V’E/V’O2), но не для CO2 (вентиляционный эквивалент для CO2 — V’E/V’CO2 — остается неизменным). Такой резкий рост V’CO2 непропорционален как при нагрузке, так и при V’O2. Это распространенные критерии достижения АП. Наибольшее распространение получил метод определения АП по изменению наклона кривой V’CO2 к V’O2, который называют методом V-slope (рис. 6.11).
Вторая фаза наступает при дальнейшем увеличении нагрузки и является реакцией на возрастание метаболического ацидоза. Прогрессивное снижение рН способствует еще большему увеличению вентиляции посредством стимуляции каротидных телец, вследствие этого PaCO2 и PETCO2 снижаются [10]. Это период дыхательной компенсации, при котором V’E увеличивается непропорционально относительно V’CO2 (V’E/V’CO2 увеличивается), что ведет к респираторному алкалозу [11]. PO2 и V’E/V’O2 продолжают расти. Идентифицировать этот порог у многих пациентов не представляется возможным.
Реакция сердечно-сосудистой системы на нагрузку
Сердечный выброс
Основным ответом сердечно-сосудистой системы на возрастающую нагрузку является увеличение Q’. Это позволяет увеличить приток крови к работающим мышцам. В клинической практике для определения объемной скорости кровотока, или Q’ (мл/мин), широко применяют прямые методы Фика и разведения индикатора [12]. При нагрузке Q’ линейно возрастает до достижения плато на пике нагрузки. Таким образом, у здоровых людей физическая работоспособность ограничивается главным образом способностью сердечно-сосу- дистой системы обеспечивать возрастающую доставку O2 к мышцам. Первоначальное увеличение Q’ достигается за счет нарастания УО и ЧСС, тогда как при дальнейшем повышении интенсивности нагрузки УО уже больше не увеличивается, а поддержание необходимого уровня кровообращения обеспечивается учащением ЧСС [5].
Частота сердечных сокращений
Повышение ЧСС первоначально обусловлено сниженным тонусом блуждающего нерва, а впоследствии почти исключительно увеличением активности симпатической нервной системы [7]. ЧСС (в минуту) возрастает линейно с увеличением V’O2. По мере нарастания ЧСС повышается относительная продолжительность периода, во время которого миокард находится в состоянии систолы. Следовательно, сокращается доля времени внутри каждого сердечного цикла, когда возможна экстракция O2 из коронарного кровотока миокардом. Поэтому существует предельно допустимый уровень ЧСС, выше которого адекватная экстракция O2 становится невозможной, и этот уровень зависит главным образом от возраста человека. Поэтому достижение предельно допустимого ЧСС интерпретируется как исчерпание миокардом своих резервных возможностей и достижение гемодинамического предела. Максимальная ЧСС сни-
Рис. 6.11. Определение анаэробного порога (АП) методом V-slope. До анаэробного порога скорость V’O2 равна скорости V’CO2. После анаэробного порога скорость V’CO2 выше, чем скорость V’O2. Точка перегиба кривой обозначает, что анаэробный порог достигнут
|
|
|
АП |
|
|
3 |
|
|
|
–1 |
|
|
|
|
мин |
2 |
|
|
|
л× |
|
|
|
|
2 |
|
|
|
|
V’CO |
1 |
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
0 |
1 |
2 |
3 |
|
|
|
V’O2 л×мин–1 |
|
357
Раздел 6
жается с возрастом, она может быть вычислена с помощью следующих формул:
максимальная ЧСС = 220 – возраст (годы) (6)
или
максимальная ЧСС = 210 – |
|
– [0,65 × возраст (годы)]. |
(7) |
Эти формулы дают сопоставимые расчетные значения у лиц моложе 40 лет, однако у пожилых людей значения, получаемые по формуле (6), занижены [7]. Связанное с возрастом уменьшение максимальной ЧСС во многом обусловливает уменьшение Q’ и V’O2max [10].
Еще одним важным параметром является резерв ЧСС, который определяется как разность между должной максимальной ЧСС и ЧСС, достигнутой на пике нагрузки. У здоровых людей резерв ЧСС обычно небольшой или вовсе отсутствует (<20 в минуту), но этот параметр сложно использовать в интерпретации НТ из-за значительной вариабельности максимальной ЧСС у здоровых людей [7].
Давление в легочной артерии
В малом круге кровообращения, несмотря на возрастание кровотока во время нагрузки, давление в ЛА повышается незначительно. Это происходит вследствие существенного падения периферического сосудистого сопротивления, главным образом в результате вовлечения в легочный кровоток сосудов, не функционирующих в покое. Малый круг более приспособлен к усилению кровотока без значительного повышения давления. Это позволяет ПЖ проделывать значительно меньший объем работы во время физической нагрузки. Однако при различных заболеваниях эти адаптационные механизмы нарушаются, что может приводить к повышению давления в системе ЛА во время нагрузки и к недостаточной насосной функции ПЖ. Это ведет к ограничению физической работоспособности вследствие сниженного Q’. Кроме того, различные патологические состояния, приводящие к нарушению кровообращения в малом кругу, также вызывают неравномерность вентиляции и легочного кровотока. В результате одновременно увеличивается работа сердца и дыхания, что существенно ограничивает физическую работоспособность.
Ударный объем
Объем крови, изгоняемый каждым желудочком в магистральный сосуд (аорту или ЛА) при одном сокращении сердца, обозначается как систолический или ударный объем крови. Величина УО зависит от возраста, пола, уровня физической подготовки, тренированности, положения тела. В покое объем крови, выбрасываемой из желудочков, составляет 60–80 мл [13]. УО, который при НТ можно оценить по кислородному пульсу (см. выше), в начале нагрузки быстро увеличивается и
доходит при интенсивной нагрузке до стабильного уровня, а на пике нагрузки может даже немного снизиться [14]. У нетренированных людей УО при нагрузке возрастает до 100 мл, у спортсменов — до 200 мл. Начальное увеличение УО обусловлено в основном резервным объемом крови (мобилизацией крови из вен нижних конечностей). По мере усиления нагрузки возможность использования резервного объема крови уменьшается, и прирост УО значительно замедляется из-за повышения силы сердечных сокращений (положительный инотропный эффект). Максимальная величина УО наблюдается при ЧСС 130 в минуту.
Системное артериальное давление
С изменением Q’ и сосудистого сопротивления происходит соответствующее изменение системного АД, оно увеличивается по мере нарастания нагрузки. Дилатация мышечного сосудистого ложа во время нагрузки ограничивает рост диастолического АД, которое остается на уровне покоя или незначительно увеличивается при максимальной нагрузке (примерно на 10 мм рт.ст.). Систолическое АД повышается существенно, особенно после достижения АП, и на пике нагрузки может достигать 200 мм рт.ст. и более.
Изменение вентиляции во время нагрузки
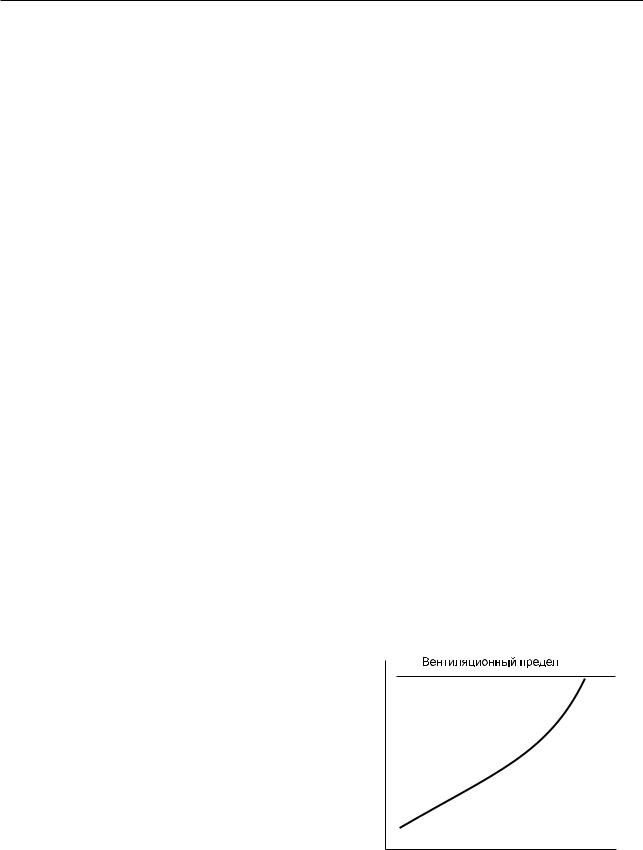
Минутная вентиляция
Основной реакцией системы дыхания на физическую нагрузку является увеличение V’E. До достижения АП V’E возрастает пропорционально увеличению нагрузки, после чего рост V’E происходит с относительно большей скоростью до достижения уровня вентиляционного предела (рис. 6.12) — максимальной вентиляции легких (МВЛ). Этот уровень вентиляции можно определить или непосредственно измерением МВЛ (определяют максимальный объем воздуха, кото-
V’E
Нагрузка, Вт
Рис. 6.12. В норме при увеличении физической нагрузки вентиляция возрастает линейно до достижения анаэробного порога, после чего вентиляция нарастает быстрее, чем физическая нагрузка
358

Функциональные исследования
рый может быть пропущен через легкие за 1 мин, для этого измеряют вентиляцию в течение 10– 15 с, когда пациент дышит максимально глубоко и часто), или вычислением по эмпирическому уравнению [5]:
МВЛ = ОФВ1 × 40, |
(8) |
где ОФВ1 — объем форсированного выдоха за 1-ю секунду.
Во время физической нагрузки ни один человек не в состоянии поддерживать вентиляцию на уровне МВЛ в течение долгого периода времени. У нормального здорового человека на пике нагрузки вентиляция составляет 60–70% МВЛ. Оставшиеся 30–40% МВЛ — резерв дыхания. Наличие такого резерва у здоровых людей указывает на то, что физическая работоспособность ограничена сердечно-сосудистыми факторами, а не вентиляцией.
При низких и средних уровнях нагрузки рост V’E происходит в основном за счет повышения ДО, а не ЧД. Однако после достижения максимальных значений ДО, составляющих 50–60% ЖЕЛ, рост V’E обеспечивается главным образом за счет увеличения ЧД (рис. 6.13) [5].
Вентиляционные эквиваленты для кислорода и углекислого газа
Реакцию системы дыхания на нагрузку можно оценить по вентиляционному эквиваленту
ЧД, мин

ДО (% должной ЖЕЛ)
Рис. 6.13. Увеличение вентиляции в ответ на физическую нагрузку сопровождается ростом дыхательного объема (ДО) и частоты дыхания (ЧД). У здоровых людей в начале нагрузочного теста вентиляция повышается, главным образом, за счет возрастания дыхательного объема (почти до 60% жизненной емкости легких (ЖЕЛ)). При высокой нагрузке вентиляция растет за счет повышения частоты дыхания (до 50–60 в минуту). Смещение кривой вверх и влево (пунктирная линия) означает, что дыхание становится более частым и поверхностным, такой паттерн дыхания обычно встречается у пациентов с рестриктивными процессами в легких
для O2 (это отношение V’E к V’O2 — V’E/V’O2, безразмерная величина) или по вентиляционному эквиваленту для CO2 (это отношение V’E к V’CO2 — V’E/V’CO2, безразмерная величина). Оба отношения остаются относительно стабильными (~22–32), пока вентиляция увеличивается пропорционально V’O2 и V’CO2. Из-за существенного увеличения V’E после достижения АП (см. выше) отмечается рост V’E/V’O2, тогда как V’E/V’CO2 остается стабильным и не превышает 34 [7]. Во вторую фазу АП рост V’E становится непропорциональным не только относительно V’O2, но
иотносительно V’CO2. Отмечаются увеличение V’E/V’CO2 и дальнейший рост V’E/V’O2, которое достигает максимальных значений (35–40) [5]. У хорошо тренированных или эмоциональных людей в начале НТ оба параметра могут быть повышены, но по мере нарастания нагрузки они, как правило, возвращаются в нормальный диапазон
идостигают минимума незадолго до достижения АП. Широкий диапазон нормальных значений обусловлен вариабельностью регуляции дыхания
впопуляции [5].
Изменение распределения вентиляции
Выполнение физической нагрузки сопровождается изменением распределения вентиляции, которое выражается отношением объема мертвого пространства (VD) к ДО (VD/ДО, величина безразмерная). При нагрузке в результате увеличения ДО и перфузии апикальных легочных единиц, для которых характерны высокие значения вен- тиляционно-перфузионного отношения, в легких устанавливается оптимальное соответствие между вентиляцией и перфузией [10]. Кроме того, при нагрузке рост вентиляции анатомического VD незначителен по сравнению с ростом альвеолярной вентиляции. Эти изменения приводят к снижению VD/ДО с 0,25–0,35 (в покое) [6] до 0,20 и ниже. Особенно существенное снижение отмечается у молодых людей [5].
Обмен газов
Артериальное и конечно-экспираторное парциальное давления CO2
Несмотря на увеличение V’CO2, PaCO2 и PETCO2 остаются почти нормальными. Это обусловлено увеличением альвеолярной вентиляции, которая возрастает пропорционально увеличению V’CO2. У здоровых людей в начале НТ значения могут быть низкими из-за гипервентиляции, но в течение первых нескольких минут нагрузки они нормализуются. После достижения АП, когда увеличение минутной и альвеолярной вентиляций больше не соответствует увеличению V’CO2, происходит снижение как PaCO2, так и PETCO2. На уровне V’O2max оба значения почти всегда ниже 40 мм рт.ст. [15].
359
