
5 курс / Пульмонология и фтизиатрия / Тактика_лекарственной_терапии_в_послеоперационном
.pdf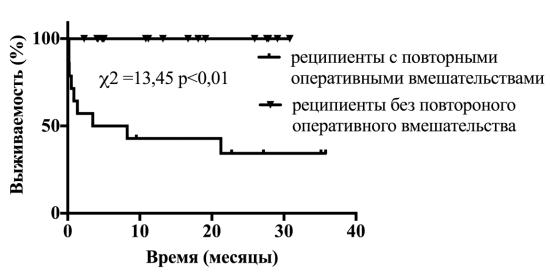
11
Рисунок 2. Выживаемость реципиентов легких с и без повторного
оперативного вмешательства в послеоперационном периоде
Одной из причин хирургических вмешательства у 100% реципиентов, которым потребовались повторные операции, стало использование системы экстракопоральной мембранной оксигенации(ЭКМО): гемоторакс в 11 случаях, тромбоз бедренной артерии в месте установки канюли ЭКМО 6 случаях. При статистическом анализе ЭКМО-ассоциированные осложнения в значительной степени влияют на риск повторного оперативного вмешательства у реципиентов легких(точный критерий Фишера, p<0,01). Общая частота ЭКМО-ассоциированных осложнений составила 45%.
Особенностью применения систем экстракорпоральной мембранной оксигенации в нашем центре является то что, попытка отключения производилась не ранее, чем через сутки после оперативного вмешательства, по этой причине влияние интраоперационного отключения от ЭКМО в данном исследовании, к сожалению, не изучено. Можно предположить, что интраоперационное отключение системы экстракорпоральной мембранной оксигенации, позволит снизить частоту ЭКМО-ассоциированных осложнений в раннем послеоперационном периоде, но данный вопрос требует дополнительного изучения.
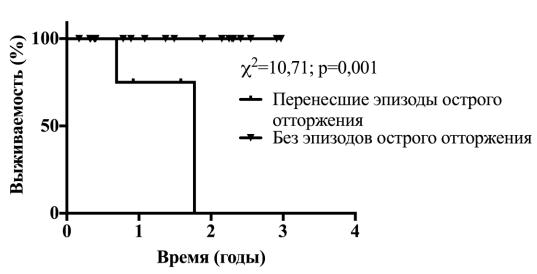
Так же нами отмечено значительное ухудшение прогноза выживаемости у реципиентов, перенесших клинически-проявляемое острое отторжение в раннем послеоперационном периоде, по сравнению с
12
остальными реципиентам (χ2=10,71. р<0,01), при этом медиана выживаемости у таких реципиентов центре составила 21 месяц (рисунок 3).
Рисунок 3. Выживаемость реципиентов в зависимости от наличия эпизодов острого отторжения легочных трансплантатов
При статистическом анализе установлено, что наличие эпизодов клинически проявляемого острого отторжения и их количество не влияют на скорость развития хронической дисфункции трансплантатов (точный критерий Фишера, р=0,17 и р=0,25 соответственно). Однако выборка данного анализа мала и следует считать ее не репрезентативной.
Развитие бронхиальных осложнений, таких как несостоятельность бронхиального анастомоза и стенозы бронхов, у реципиентов легких частые осложнения после трансплантации легких. У 10 реципиентов (32%) развились данные осложнения: в 4 наблюдениях - несостоятельность бронхиального анастомоза и в 6 - стенозы бронхов. При статистическом анализе выявлено что, бронхиальные осложнения не являются фактором риска длительности госпитализации или смертности в раннем послеоперационном периоде (χ2=0,92, р=0,34). Однако стенозы бронхов значительно снижают качество жизни реципиентов легких, из-за потребности частой госпитализации для проведения профилактических мер по предотвращению данного осложнения. Выявлена четкая связь между наличием инфекционно-обусловленных осложнений в виде длительно персистирующего гнойного бронхита (точный критерий Фишера, р=0,04), а
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
13
также продолжительностью искусственной вентиляции легки(t=2,12, p=0,04), в послеоперационном периоде, с частотой развития стенозов бронхов.
Применение адекватной антибактериальной терапии в совокупности с ранней активизацией реципиентов (в том числе уменьшение срока интубации трахеи) приводит к уменьшению риска возникновения инфекционнообусловленных осложнений в раннем послеоперационном периоде, что позволяет снизить частоту их развития вцелом и связанных с ними стенотических поражений бронхов. При этом развитие инфекционнообусловленных осложнений приводит к увеличению общего времени госпитализации реципиентов в послеоперационном периоде (t=2,24, p=0,04), но не влияет на общую выживаемость.
Основываясь на опыте нашего центра, антибактериальная терапия у реципиентов легких должна проводиться не менее 7 дней, что обусловленно особенностями инфекционного фона отделений реанимаций, в которых находился донор. Так же следует отметить, что хроническое инфицирование дыхательных путей B.cepacia complex у реципиентов нозологической группы С, не является достоверным фактором риска длительного нахождения на искусственной вентиляции легких, времени нахождения в отделение реанимации и интенсивной терапии, общего времени госпитализации (t=0,94, p=0,37; t=1,45, p=0,19 и t=1,1, p=0,31, соответственно), а также на совокупную выживаемость данных реципиентов.
Развитие острой почечной недостаточности в раннем послеоперационном периоде четко коррелирует с длительностью искусственной вентиляции легких (t=3,33, p<0,01) и увеличивает время пребывания реципиента в отделении реанимации и интенсивной терапии(t=2,83, p<0,01). При этом у реципиентов, которым потребовалась длительная заместительная почечная терапия (более 30 дней), чаще развивалась нефропатия в позднем послеоперационном периоде (точный критерий Фишера, р=0,02), однако это не влияет на выживаемость у данных реципиентов.
Одной из задач данного исследования была разработка протокола комплексной лекарственной терапии у реципиентов легких, в связи с полным отсутствием современных отечественных рекомендаций или методических пособий по медицинскому сопровождению реципиентов легких в послеоперационном периоде. Нами было предпринято систематическое
14
обзорное исследование мирового опыта последних лет, на основе которого был разработан протокол лекарственной терапии у реципиентов легких, который был внедрен в клиническую практику с 9 апреля 2016 года.
Протокол включает в себя многокомпонентную иммуносупрессивную терапию, состоящую из индукционной и отложенной поддерживающей терапии, комплексную антибактериальную терапию и сопутствующую терапию, основными положениями которой являются:
1.Индукция иммуносупрессивной терапии должна
проводиться двумя препаратами: базиликсимаб (моноклональные антитела к IL-2R) и метилпреднизолон. Первое введение базиликсимаба в дозе 20 мг внутривенно в течение 1 часа производится на вводном наркозе. Повторное введение базиликсимаба в дозировке 20 мг внутривенно в течение 1 часа производится на 4 сутки после операции. Метилпреднизолон используется в дозе 500 мг для реципиентов группы С и 1000мг для остальных, вводится на вводном наркозе.
2.В первые 6 дней после операции поддерживающая
иммуносупрессивная терапия проводится метилпреднизолоном со снижением дозировки и переходом на пероральный прием в течение трех дней, если это позволяет общее состояние реципиента. Снижение происходит по схеме: 1 сутки после операции – 250 мг метилпреднизолона внутривенно, 2 сутки – 125 мг метилпреднизолона внутривенно, 3 сутки – из расчета 1 мг метилпреднизолона на 1 кг массы тела реципиента, но не менее 50 мг метилпреднизолона внутривенно. На 4 сутки после операции, если реципиент может самостоятельно принимать пищу, назначается метилпреднизолон из расчета 0,2 мг/кг массы тела реципиента внутрь утром.
Начало приема такролимуса производится на 6 суток после операции в дозе 2 мг 2 раза в сутки внутрь при условии возможности самостоятельного перорального приема лекарственных препаратов. Целевые уровни концентрации в течение первого года после операции у реципиентов групп A, B и D составляется 10-15 нг/мл, а у реципиентов группы С, а также групп A, B и D по окончанию первого года после операции - 10-12 нг/мл. Назначение 3-го компонента, препаратов микофеноловой кислоты, проводится на 10 день после трансплантации.
3.Реципиентам групп A, B и D интраоперационно, за 1 час до
кожного разреза, назначается пиперациллин+тазобактам в дозе 4,5 г
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
15
внутривенно в течение часа, каждые 6 часов до окончания оперативного вмешательства. В послеоперационном периоде, к антибактериальной терапии добавляется MRSA-антибиотик линезолид в дозе 600мг 2 раза в сутки внутривенно.
В случаях если имеется повышенный инфекционный риск (общее время госпитализации донора более 5 дней или нахождение в ОРИТ более 3 дней, наличие гнойной мокроты по данным фибробронхоскопии, планируемое время работы системы ЭКМО у реципиента более 2 дней, планируемое время нахождения в ОРИТ более 2 дней) к антибактериальной терапии добавлялся третий компонент с антисинегнойной активностью (ципрофлоксацин 400 мг 3 раза в сутки внутривенно). Если на 3-е сутки после операции реципиент не переведен в госпитальное отделение, к антибактериальной терапии также добавляется третий антибактериальный препарат с антисинегнойной активностью (ципрофлоксацин 400 мг 3 раза в сутки внутривенно).
При получении данных микробиологического исследования бронхоальвеолярного лаважа и/или мокроты донора или реципиента, производится коррекция антибактериальной терапии, по результатам данного анализа.
4.Реципиентам в отделении реанимации и интенсивной
терапии назначается дополнительный ингаляционный антибактериальный препарат согласно данным микробиологического исследования и данных предыдущих госпитализаций или гентамицин 160 мг 2 раза в сутки. Отмена ингаляционного антибактериального препарата производится через 2 недели после выписки из стационара.
5.С первых часов после перевода реципиента в ОРИТ
назначается ингаляционная противогрибковая терапия дезоксихолиевым амфотерицином В в дозировке 12,5 мг 4 раза в сутки. При непереносимости дезоксихолиевого амфотерицина В производится коррекция дозировки до 50 мг 1 раз в неделю ингаляционно. Отмена профилактической противогрибковой терапии производится через 90 дней с момента операции.
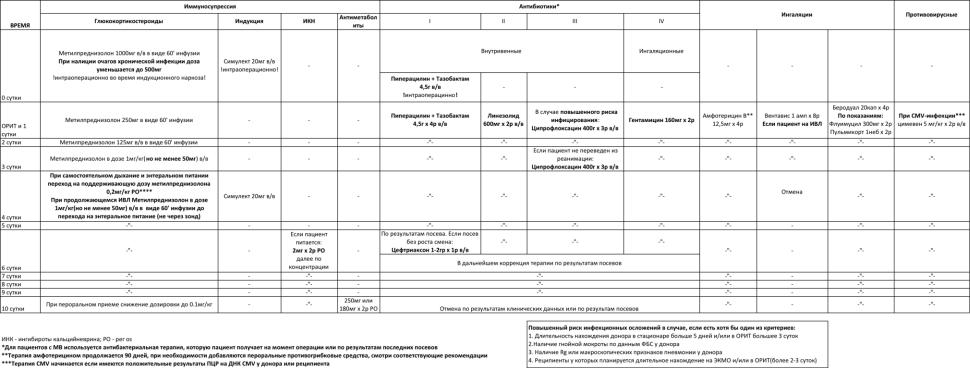
Схематическое представление данного протокола лекарственной терапии у реципиентов легких представлено в таблице 2.
16
Таблица 2. Протокол лекарственной терапии в раннем послеоперационном периоде реципиентов легких
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
17
При оценке эффективности протокола лекарственной терапии у реципиентов легких, установлено отсутствие статистически значимой разницы в осложнениях у реципиентов до и после его внедрения. Одной из причин этого явления малый период наблюдения за реципиентами легких, лечение которых проводилось согласно разработанному протоколу. Однако наблюдается положительная динамика в виде уменьшения частоты развития эпизодов острой почечной недостаточности требующей заместительной почечной терапии в раннем послеоперационном периоде, уменьшения длительности госпитализации и уменьшение количества реципиентов с впервые возникшими стенозами бронхов.
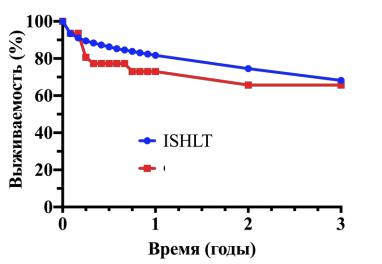
Сравнение выживаемости реестра международного общества трансплантации сердца и легких и ФГБУ «НМИЦ ТИО им. ак. В.И. Шумакова» Минздрава России представлено на рисунке 3.
НМИЦ ТИО
Рисунок 3. Сравнение выживаемости по данным реестра международного общества трансплантации сердца и легких и по данным ФГБУ «НМИЦ ТИО им. ак. В.И. Шумакова» Минздрава России
Разработанный протокол лекарственной терапии реципиентов легких является эффективным стандартизированным методом ведения реципиентов легких в послеоперационном периоде, в результате использования которого общая продолжительная выживаемость реципиентов легких сопоставима с общемировым уровнем.
18
Выводы
1.Факторами риска развития послеоперационных осложнений после трансплантаций легких являются: применение системы экстракорпоральной мембранной оксигенации, выполнение повторного хирургического вмешательства в раннем послеоперационном периоде, длительная искусственная вентиляция легких (более 3 дней), необходимость проведения длительной (более 30 дней) заместительной почечной терапии, ранняя отмена комплексной антибактериальной терапии (до 7 дней).
2.Наиболее важным из факторов риска послеоперационных осложнений после трансплантации легких является применение системы экстракорпоральной мембранной оксигенации, так как это увеличивает риск выполнения повторного оперативного вмешательства в раннем послеоперационном периоде, что является предиктором госпитальной летальности реципиентов легких (90-дневная смертность - 31,5%).
3.Разработан единый протокол комплексной лекарственной терапии у реципиентов легких, включающий многокомпонентную иммуносупрессивную терапию, состоящую из индукционной и отложенной поддерживающей терапии (применение ингибиторов кальциневрина на 6 сутки после операции, препаратов микофеноловой кислоты на 10 сутки после операции), с быстрым снижением (в течение 3 дней) дозировки глюкокортикостероидов до 0,2 мг/кг массы тела реципиента, а также комплексную антибактериальную терапию, имеющую преимущественно нозокомиальный спектр активности.
4.Применение единого протокола комплексной лекарственной терапии позволяет снизить продолжительность нахождения в отделении реанимации и интенсивной терапии, риск развития острой почечной недостаточности в раннем послеоперационном периоде и риск развития бронхиальных осложнений.
5.Единый протокол комплексной лекарственной терапии реципиентов легких в раннем и позднем послеоперационном периоде позволяет обеспечить высокую трехлетнюю выживаемость реципиентов (66,7%) на уровне сопоставимом с мировыми данными (68,2%).
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
19
Практические рекомендации
1.Выполнение трансплантации легких рекомендуется проводить без использования систем экстракорпорального кровообращения, если гемодинамика и оксигенация реципиента легких это позволяет.
2.Перевод реципиентов легких на самостоятельное дыхание должен быть произведен в первые часы после выполнения трансплантации легких, если это позволяет общее состояние реципиента.
3.В качестве индукционной иммуносупрессивной терапии следует использовать базиликсимаб внутривенно на 0 и 4 сутки.
4.Назначать поддерживающую иммуносупрессивную терапию такролимусом реципиентам легких следует на 6 сутки после трансплантации легких.
5.Назначать поддерживающую иммуносупрессивную терапию препаратами микофеноловой кислоты следует на 10 сутки после трансплантации легких.
6.Реципиентам легких, за исключением реципиентов с инфекционно-обусловленными заболеваниями легких, в послеоперационном периоде рекомендуется проведение комплексной антибактериальной терапии, состоящей как минимум из двух препаратов, сроком не менее 7 дней после операции.
7.Реципиентам легких с инфекционно-обусловленными заболеваниями легких во время выполнения оперативного вмешательства рекомендуется продолжение последней эффективной антибактериальной терапии.
8.Всем реципиентам легких помимо внутривенной антибактериальной терапии следует проводить ингаляционную антибактериальную терапию.
9.Всем реципиентам легких рекомендуется проводить коррекцию антибактериальной терапии на основе данных микробиологического исследования смывов бронхов донора и реципиента, а также клинических данных о наличии воспалительного процесса у реципиента (лихорадка, уровень лейкоцитов и С-реактивного белка в крови).
20
10. Всем реципиентам рекомендуется проведение противогрибковой терапии ингаляционным амфотерицином B в дозе 12,5 мг 4 раза в сутки, начиная сразу после перевода пациента из операционного блока в отделение реанимации и интенсивной терапии и в течение 3 месяцев после операции.
11.До начала ингаляционной противомикробной терапии, следует проводить ингаляции бронходилататорами.
12.Всем реципиентам следует проводить мониторинг цитомегаловиросуной инфекции не менее 1 раза в две недели во время госпитализации реципиента и 1 раза в месяц после выписки реципиента, со своевременным началом противовирусной терапии при необходимости.
13.Контроль качества проводимой лекарственной терапии во время госпитализации следует проводить один раз в 3-4 дня и 1 раз в месяц в течение первого года после выписки, оценивая рентгенографические, лабораторные (уровень лейкоцитов при общем анализе крови, уровень С- реактивного белка) и функциональные (функция внешнего дыхания) данные реципиента.
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
