
5 курс / Пульмонология и фтизиатрия / РОЛЬ_НЕЙРОНОВ_ИНТРАМУРАЛЬНЫХ_ГАНГЛИЕВ
.pdfВ центральной нервной системе роль нейротрансмиттера приписывается дофамину и норадреналину, тогда, как мало известно об адреналине в качестве нейротрансмиттера. Дофамин в высоких дозах стимулирует альфа- и бета-адренергический рецепторы, физиологические действия эндогена дофамина в основном связаны с допаминергическими рецепторами (Pequignot et al., 1985). D2, преганглионарный рецептор дофамина, действует как авторецептор, который уменьшает количество норадреналина, высвобождаемого симпатическими нервными окончаниями (Scatton et al., 1990). Ингибирование образования цАМФ через дофаминергический рецептор D2 прямо пропорционально дофаминергическому контролю холинэргической передачи (Rump et al., 1993). Существуют некоторые подгруппы дофаминергических рецепторов, из которых главным образом изучается дофаминергический рецептор D1. Эти подгруппы помещены в постганглионарные соединения, связанные с аденилатциклазной системой. D2 допаминергические рецепторы в основном помещаются в пресинаптические нервные окончания, и их стимуляция не вызывает активацию аденилатциклазы, но приводит к ее ингибированию, что проявляется в снижении производства цАМФ (Stoof, Kebabian, 1984). При нормальном регулировании тонуса гладких мышц в норме имеется и бронхоконстрикторный тонус, который поддерживается посредством холинергических импульсов (Racké et al., 2006). Усиленная бронхиальная реактивность дыхательных путей астматиков обусловлена дисбалансом, который вызван сниженной бета-адренергиче- ской функцией (что приводит к увеличению холинергической реакции) и альфа-адренергическим ответом против различных стимуляторов (Szentivanyi, 1968; Gwilt et al., 2007). Хотя механизм гиперактивности адренергической системы еще не полностью известен (Barnes,1986; Gross, 1988, Jooste et al., 2007), некоторые авторы обнаружили, что сопротивление дыхательных путей у пациентов с астмой увеличивается после применения альфа-адренергического агониста (Patel, Kerr, 1973).
Томсон с соавторами (Thomson et al., 1982) в своих исследованиях доказали, что у пациентов с астмой агонист альфа-1 адренергического рецептора, ингаляционный фенилефрин не влияет на сопротивление дыхательных путей. Многие исследователи отмечают, что если пациенту с астмой ввести альфа-адренергический антагонист без каких-либо других лекарств, это приведет к улучшению функции дыхательных путей (Simonsson et al., 1973; Anzueto et al., 2005).
20
https://t.me/medicina_free
Альфа-адренергические антагонисты (например, индорамин) вызывают бронходилатацию из-за блокировки альфа-адренергических рецепторов и могут быть применены как терапевтическое средство при астматических проявлениях (Black et al., 1978).
Исследование Томсона с соавторами подтвердило, что пациенты с астматическими проявлениями, которые получали ингаляцию фенилэфрином (агонист альфа-адренергического рецептора), не показывали значительного изменения сопротивления дыхательных путей (Thomson et al., 1982). Результаты этого исследования, как и у других авторов, указывают на фармакологическую значимость агонистов бета2 (гексопреналина) и антихолинергических веществ (ипратропина) в улучшении функциональных значений легких у пациентов с астмой и хроническими обструктивными заболеваниями. Эти результаты полностью согласуются с результатами автора Mue et al. (Mue et al., 1983). В дополнение к эффекту бронходилататора Gosens et al. предположили, что антихолинергические вещества, особенно те, которые имеют расширенное действие, например тиотропийбромид, также могут уменьшить констрикцию легких (Gosens et al., 2006).
Daniel и Ileen et al. (Daniel et al., 1982; Gilbert et al., 1988) исследовали, что адренергические рецепторы альфа-1 в гладкой мускулатуре бронхов могут стимулироваться прямым действием катехоламинов при кровообращении, в физиологических дозах, так как симпатическая иннервация в бронхиальном дереве встречается редко. Обнаружено, что норадреналин ингибирует расслабляющие эффекты йохимбина в изолированных препаратах трахеи (Russell, 1987).
1.3.3.НАНХ-СИСТЕМА
Всовременных научных данных выявлена роль неадренергической нехолинергической (НАНХ) — системы в регуляции работы органов нижних респираторных путей. НАНХ-система может оказывать и активирующее, и тормозное действие на гладкую мускулатуру трахеи
ибронхов. Нервные волокна НАНХ-системы — это афферентные капсаицин-чувствительные волокна типа С; они являются отростками нейронов сенсорных ганглиев блуждающего нерва и ганглиев дорсальных корешков (Jacoby, 2003). Капсаицин-чувствительные С-волокна проходят через нейроны интрамуральных ганглиев и оканчиваются в эпителиальном слое трахеи и бронхов (так называемые чувствительные нервные окончания С-волокон) (Undem et al., 1990, Lundberg et al., 1984).
21
https://t.me/medicina_free
Возбуждающее влияние НАНХ-системы может реализовываться прямым действием на гладкомышечные клетки посредством выделения тахикининов в интерстициальное пространство. Сократительное действие на гладкомышечную клетку происходит через активацию НК1 и НК2-рецепторов на мембране клетки (Widdicombe, 2006). Кроме того, активирующее действие НАНХ-системы может происходить с участием нейронов интрамуральных ганглиев, которые имеют рецепторы к возбуждающему медиатору НАНХ-системы — субстанции Р (SP). Субстанция Р регулирует тонус гладкой мускулатуры респираторного тракта, который проявляется в сокращении бронхов, введение атропина снимает констрикцию бронхов (Ghatei et al., 1982). Доказана роль нейрокининов А и В в патогенезе астмы. Они выделяются из афферентных нервных окончаний в результате рефлекторных механизмов сокращений бронхов (Barnes, 1987).
Основными тормозными медиаторами ингибирующей НАНХсистемы являются вазоактивный интестинальный пептид (ВИП) и оксид азота (NO). Известно, что эндогенные NO и ВИП могут модулировать холинергическую нейропередачу на уровне гладкой мускулатуры или через пресинаптическое торможение выделения АХ (Belvisi, 1993). Низкие концентрации ВИП (0,001—1,0 мкМ) уменьшают сокращения гладкой мускулатуры трахеи кошки и морской свинки, вызванные серотонином (Ito et al., 1982), но не влияют на тормозные ответы при электрической стимуляции. Вероятно, ВИП может являться тормозным медиатором в постганглионарных автономных нейронах (Федин и др., 1997).
Действие ГАМК в легком, по-видимому, проявляется через модулирующее действие на неадренергические нехолинергические нервы. Одним из участков действия, вероятно, является нечувствительный к бикукуллину ГАМК-рецептор, который может находиться на сенсорных нервных окончаниях, поскольку ГАМК и баклофен ингибируют реакцию НАНХ-бронхоконстриктора, но THIP (агонист γ-амино- масляной кислоты (ГАМК) тип А-рецепторов) является слабоэффективным. Tamaoki с соавторами (1987) в своих исследованиях выяснили, что ГАМК уменьшает сократительную способность гладкой мускулатуры респираторных путей на стимуляцию холинергических нервов путем ингибирования и высвобождения ацетилхолина (Giotti et al., 1983). ГАМК и его декарбоксилаза из синтетического фермента глутаминовой кислоты, по-видимому, присутствуют в периферической
22
https://t.me/medicina_free
вегетативной нервной системе, предполагая, что ГАМК может функционировать как периферический нейротрансмиттер или нейромодулятор (Jessen et al., 1979). Иннервация респираторных путей имеет общее эмбриональное происхождение с желудочно-кишечным трактом, представляется вероятным, что в дыхательных путях также могут присутствовать ГАМК-эргические нервы. Если это так, то ГАМК может иметь нейромодулирующую роль при нейрогенном бронхостенозе. Сенсорные нервы могут играть важную роль в нейрогенном воспалении респираторных путей и участвовать в воспалительном процессе респираторных путей при астме (Barnes, 1986).
1.4. ГИСТАМИНЕРГИЧЕСКАЯ СИСТЕМА
Гистаминергическая регуляция нижних дыхательных путей осуществляется на местном уровне по локальным рефлекторным дугам и при его взаимодействии с центральными механизмами регуляции — холинергическим, адренергическим и НАНХ-системой.
1.4.1. ГИСТАМИН
Изначально гистамин был идентифицирован как аутокоид, обладающий мощными вазоактивными свойствами. Гистамин — это низкомолекулярный амин, синтезированный из L-гистидина исключительно L-гистидиндекарбоксилазой (HDC). Гистидиндекарбоксилаза (HDC) представляет собой фермент, который экспрессируется в различных клетках организма, включая центральную нервную систему, нейроны, слизистую оболочку желудка, теменные клетки, тучные клетки (~ 3 мкг/ клеточный гистамин) и базофилы (~ 1 пг/клеточный гистамин). Гистамин играет важную роль в здоровье человека и оказывает разнообразные биологические эффекты на 4 типа рецепторов. Гистамин также продуцируется энтерохромаффиноподобными клетками (ECL) в желудке и играет важную роль в секреции желудочной кислоты (Dy, Schneider, 2004).
Только базофилы и тучные клетки могут хранить амин в определенных гранулах, в гемопоэтической системе, где гистамин тесно связан с анионными протеогликанами гепарином (в тучных клетках) и хондроитин-4-сульфатом (в базофилах). В этой специфической форме гистамин может выделяться в больших количествах во время дегрануляции в ответ на различные иммунологические (иммуноглобу-
23
https://t.me/medicina_free
лин E или цитокины) или неиммунологические реакции (соединение 48/80, ионофор кальция, мастопарин, вещество Р, опиоиды или гипоосмолярные растворы) (Dy, Schneider, 2004). Синтез гистамина в аппарате Гольджи может быть ингибирован фторметилгистидином (Hill et al., 1997)
Гистамин — химическое вещество, нейромедиатор, вырабатываемый организмом во время аллергической реакции. Эти реакции являются частью воспалительной реакции, общим иммунным ответом организма на экзогенные или эндогенные влияния. Гистамин вызывает иммуномодулирующие и провоспалительные эффекты посредством дифференциальной экспрессии рецепторов (H1R, H2R, H3R и H4R), которые легко модулируют разнообразные эффекты гистамина на иммунную регуляцию и отдельные внутриклеточные сигналы. Все эти четыре рецептора являются членами 7-трансмембранного (гептахелического) охватывающего семейства рецепторов с G-белковыми связями (GPCR), экспрессируются в различных тканях и клетках, чувствительных к гистаминам, и указывают на важную роль гистамина в иммуномодуляции и аллергических реакциях. У млекопитающих гистамин содержится в лаброцитах и базофилах, однако в следовых концентрациях этот медиатор обнаруживается практически во всех тканях — плазме крови, мозге, слизистых оболочках желудочнокишечного тракта, дыхательной системы и мочеполового тракта. В гранулах лаброцитов и базофилов гистамин находится в связанном состоянии с белковым и протеогликановым матриксом. Высвобождаясь из гранул, гистамин быстро диффундирует в окружающие ткани и проникает в системный кровоток уже через 2—2,5 мин, достигая пиковых значений через 5 мин. Время полураспада синтезированного нейронного гистамина составляет около 30 мин и через 15—30 мин его концентрация в крови возвращается к исходному базальному уровню. Выход гистамина из депо подвержен циркадным ритмам и наиболее активное его высвобождение наблюдается в утренние часы. Свободно циркулирующий гистамин инактивируется с помощью фермента гистамин N-метилтрансферазы с последующим окислением и дезаминированием метилгистамина до имидазолуксусной кислоты при помощи моноаминооксидазы В, выводится преимущественно с мочой, и лишь около 3 % его экскретируется в неизменном виде. У человека, не имеющего патологий, в 1 мл плазмы содержится до 300 пг гистамина (Северин, 2003).
24
https://t.me/medicina_free
В организме гистамин продуцируется гистаминергическими нервными окончаниями центральной нервной системы; синтез собственно нейронального гистамина происходит лишь в туберомамиллярных ядрах гипоталамуса, где обнаруживается его синтезирующий фермент гистидиндекарбоксилаза и соответствующая матричная РНК (Ашмарин, Стукалов, 1996). Основным депо эндогенного гистамина являются тучные клетки (лаброциты). В респираторных путях человека и животных присутствуют как мукозальные, так и серозные лаброциты. Механизмы активации лаброцитов, расположенных в разных тканях и органах, могут быть различны, однако в исследованиях на животных
ичеловеке отмечено, что на многие воздействия лаброциты отвечают стереотипной реакцией — изменением количества клеток, выбросом медиаторов из гранул, снижением содержания в них гепарина, а определяющими факторами являются сила, характер и длительность воздействия, а также индивидуальные, видовые и возрастные особенности организма (Кукес, 2009; Блинков, Хазина, 2012).
Гистамин синтезируется в цитозоле и требует специфического переноса в секреторные везикулы, где он и секвестрируется. Везикулярные переносчики моноаминов (VMAT) представляют собой белки, которые выполняют эту специфическую функцию для нескольких нейротрансмиттеров (Erickson, Varoqui, 2000). Двумя подтипами моноаминовых транспортеров являются VMAT1 и VMAT2. Везикулярный транспортер моноаминов 2 (VMAT2) был клонирован из мозга крыс
ичеловека, мозгового слоя надпочечников и линии базофильных лейкозов. Когда биосинтез гистамина усиливается, его экспрессия, как было установлено, регулируется несколькими раздражителями. Повышенную экспрессию VMAT2 в IL-3-зависимых клеточных линиях усиливали с помощью улучшенного синтеза гистамина в ответ на ионофор кальция (Ca2+) (Watson et al., 1999). VMAT2 отвечает за перенос гистамина в секреторные гранулы энтерохромаффиноподобных (ECL) клеток. Было обнаружено, что экспрессия гена VMAT2 модулируется через цитокины положительно (TGFa) или отрицательно (IL-1 и TNF) (Kazumori et al., 2004). Гранулы, удаленные VMAT2, не выделяют гистамин после активации, даже если слияние гранулированных клеток все еще происходит (Travis et al., 2000).
Обеспечение прохождения через плазматическую мембрану
ипересечение везикулярной мембраны осуществляется с помощью двух транспортеров.
25
https://t.me/medicina_free
Первый транспортер еще не идентифицирован, но второй, по-види- мому, является везикулярным транспортером моноаминов 2 (VMAT2). Нейрональные моноамин-транспортеры, которые активно удаляют моноамины из внеклеточного пространства, описаны как транспортер органического катиона 1 (OCT1), OCT2 и экстратрансурональный моноаминовый транспортер (EMT). EMT также обозначался как OCT3. Было обнаружено, что экспрессия OCT1 распространяется в тканях печени, почек и кишечника, OCT2 — в головном мозге и почке, тогда как EMT демонстрирует широкое распределение в тканях. Установлено, что OCT1 не может транспортировать гистамин, а для OCT2 и EMT он является хорошим субстратом (Gründemann et al., 1999). Таким образом, ЕМТ является хорошим переносчиком гистамина в тучных клетках и базофилах, что объясняет их способность принимать медиаторы из окружающей среды.
1.4.2. ГИСТАМИНОВЫЕ РЕЦЕПТОРЫ
Гистамин является важным биогенным амином, имеющим множественные эффекты, которые опосредуются через специфические поверхностные рецепторы на определенных клетках-мишенях. В настоящее время идентифицированы четыре типа рецепторов гистамина. В 1966 году гистаминовые рецепторы дифференцировались как H1 и H2 (Ash, Schild, 1966), сообщалось, что некоторые ответы на гистамин ингибировались низкими дозами мепирамина (пириламин). В 1999 году третий подтип рецептора гистамина клонировали и назвали H3 (Lovenberg et al., 1999). Позже в 2000 году был зарегистрирован четвертый подтип рецептора гистамина, который был назван H4 (Oda et al., 2000).
Специфические влияния гистамина осуществляются с помощью взаимодействия его с гистаминовыми рецепторами (рис. 4).
Рецепторы гистамина принадлежат к метаботропным рецепторам, связанным с G-белками (G protein-coupled receptors — GPCRs). Разные типы рецепторов гистамина сопряжены с разными типами G-белков: Gq, Gs и Gi|0, что позволяет опосредовать разные типы внутриклеточных сигналов:
Н1-рецепторы — представляют собой гликопротеин из 490 аминокислотных остатков, который расположен на мембране постсинаптических клеток. Активация этих рецепторов приводит к увеличению
26
https://t.me/medicina_free
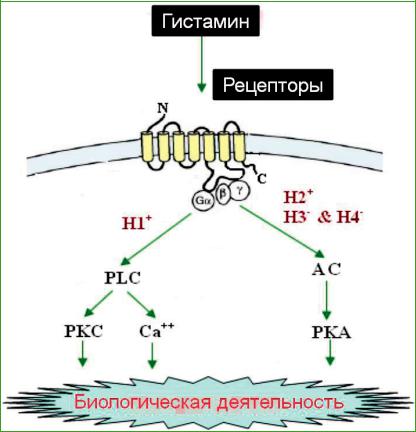
Рис. 4. Связывания гистамина и его основные сигнальные пути,
такие как AC (аденилатциклаза), PKC (протеинкиназа C), PKA (протеинкиназа A), PLC (фосфолипаза C), H1+
или H2+ (стимуляция через H1 или H2-рецептор), H3- & H4- (ингибирование через H3 и H4-рецепторы) (Shahid et al., 2009)
продукции цГМФ и повышению концентрации внутриклеточного кальция (Ашмарин, Стукалов, 1996; Геппе и др., 2002; Кукес, 2009).
Распределения H1-рецепторов гистамина (H1Rs) в различных живых тканях млекопитающих изучается с помощью специфических радиолигандов для этого подтипа. В 1997 году был разработан мепи-
27
https://t.me/medicina_free
рамин — селективный радиолиганд, с тех пор он используется для идентификации рецепторов H1 в широком спектре тканей, таких как желудочно-кишечный тракт, центральная нервная система, а также в дыхательных путях и гладкой мускулатуре, мозге млекопитающих, гепатоцитах, нервных клетках, эндотелиальных клетках, хондроцитах, моноцитах, нейтрофилах, дендритных клетках, Т-лимфоцитах и В-лимфоцитах, сердечно-сосудистой и мочеполовой системах, эндотелиальных клетках и мозговом веществе надпочечников, в которых опосредуется рецептор H1.
Рецепторы Н1 опосредуют бронхоконстрикцию и усиленную сосудистую проницаемость в легких. Другими радиолигандами, которые были продемонстрированы для изучения гистаминовых H1-рецеп- торов, являются [3H]-миансерин, [3H]-доксепин, [125I]-йодолпирамин, [125I]-йодоазидофенпирамин и [3H](1)-N-метил-4-метилдифенгидра- мин.
В гладких мышцах, таких как подвздошная кишка морской свинки, в которых свободно генерируются потенциалы действия мышц, модуляция потенциального разряда при низких концентрациях гистамина является важным механизмом, при котором усиливается напряжение. Имеются данные о том, что сократительный ответ на гистамин продуцируется инозитол 1, 4, 5-трифосфатиндуцированной мобилизацией внутриклеточного кальция (Ca2+). Его дальнейшие эффекты наблюдались вне возбуждаемых гладких мышц, включая дыхательные пути и гладкие мышцы сосудов, а сократительная стимуляция H1R первоначально включала мобилизацию кальция (Ca2+) из внутриклеточных запасов (гидролиз инозитолфолипидов).
Стимуляция H1-рецептора вызывает различные клеточные реакции в сосудистых эндотелиальных клетках. В результате сокращения эндотелиальных клеток наблюдается изменение проницаемости сосудов, спазмы мышц, бронхов и кишечника, а также вазодилатация.
Агонисты H1-рецепторов усиливают появление аллергических патологий. Гистапродифены являются очень мощными агонистами H1R и эффективнее гистамина при активации H1R (Elz et al., 2000). Некоторые противовоспалительные эффекты антагонистов H1R в высоких дозах могут быть неспецифическими из-за гистамина и других воспалительных медиаторов (активаторы лейкотриена и тромбоцитов),
28
https://t.me/medicina_free
которые высвобождаются из базофилов в ответ на определенные антагонисты H1Rs (MacGlashan et al., 2004).
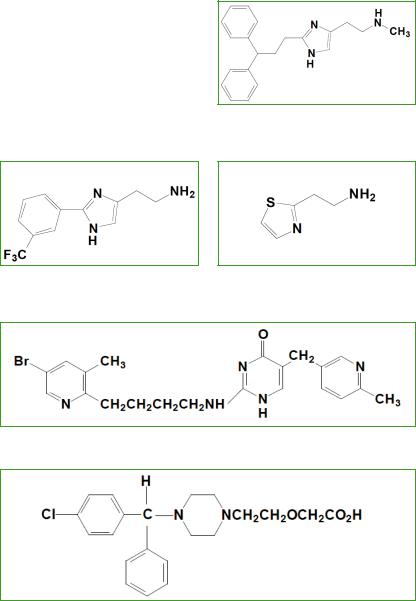
На рисунках 5, 6, 7, 8, 9, 10 изображены химические структуры некоторых гистаминовых H1- рецепторов-агонистов.
Рис. 6. 2- [3- (трифторметил) фенил]
гистамин (Shahid et al., 2009)
Рис. 5. Метилгистапродифен
(Shahid et al., 2009)
Рис. 7. 2- (тиазол-2-ил) этанамин
(Shahid et al., 2009)
Рис. 8. Темеластин (Shahid et al., 2009)
Рис. 9. Цетиризин (Shahid et al., 2009)
29
https://t.me/medicina_free
