
5 курс / Пульмонология и фтизиатрия / Респираторная_медицина_Руководство_в_3_томах_Том_1
.pdf
380
Шаг 1
Шаг 2
Шаг 3
Шаг 4
Шаг 5
Необходимо выполнение экстренной внесердечной операции?
нет
Наличие активных клинических состояний(1)
нет
Операция низкого кардиального риска
нет
Хорошее функциональное состояние (>4 MET)(2)
нет
Нет или неизвестно
да 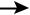
да 
да 
да 
Операция
Временно отложить операцию. Оценка и лечение
по рекомендациям ВНОК
Выполнение запланированной операции
Выполнение запланированной операции
Послеоперационное наблюдение, стратификация послеоперационного риска и контроль факторов риска
Решение вопроса об операции
У пациентов с ИБС и/или клиническими факторами риска может быть назначена терапия статинами и β-адреноблокаторами
|
≥ 3 клинических факторов риска(3) |
|
|
|
|
|
1–2 клинических факторов риска(1) |
|
Нет клинических факторов риска(1) |
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Операция на сосудах |
|
Операция промежуточного риска |
|
Операция на сосудах |
|
Операция промежуточного риска |
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Проведение дополнительного |
|
|
|
|
Выполнение запланированной операции или проведение неинвазивного |
|
|
Выполнение |
|||||||||||||||||
обследования, если это может |
|
|
|
|
дополнительного обследования, если это может изменить стратегию лечения |
|
запланированной операции |
||||||||||||||||||
изменить стратегию лечения |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 6.21. Тактика ведения пациентов 50 лет и старше с ишемической болезнью сердца или наличием клинических факторов риска в периоперационном периоде внесердечных хирургических вмешательств: 1 — инфаркт миокарда давностью менее 30 сут, нестабильная стенокардия, декомпенсированная сердечная недостаточность (хроническая сердечная недостаточность), выраженные нарушения ритма сердца и проводимости, тяжелые сосудистые заболевания; 2 — 1 МЕТ (метаболический эквивалент) эквивалентен потреблению 3,5 мл кислорода на 1 кг/мин, 4 МЕТ — это уровень нагрузки, требуемый, чтобы пройти 4 квартала или подняться на 2 пролета лестницы, неспособность выполнить это указывает на низкую толерантность к физической нагрузке и ассоциируется с повышенным риском сердечно-сосудистых осложнений после операции; 3 — факторы индекса сердечного риска, предложенного Lee и соавт.: ишемическая болезнь сердца, компенсированная хроническая сердечная недостаточность, сахарный диабет, требующий инсулинотерапии, почечная недостаточность, цереброваскулярные заболевания [28]
6 Раздел

Функциональные исследования
Ретроспективные исследования показывают, что пациенты, перенесшие чрескожное коронарное шунтирование (с имплантацией стентов как без покрытия, так и с лекарственным покрытием) имеют более высокую частоту кардиологических осложнений после торакального хирургического вмешательства [30–31]. Стратегию лечения онкологического больного, который нуждается как в коронарной реваскуляризации, так и в резекции легкого, следует решать индивидуально. Всероссийское научное общество кардиологов и другие общества рекомендуют отложить планируемое хирургическое вмешательство на период не менее 14 дней после проведенной баллонной ангиопластики без стентирования коронарных артерий, не менее 30–45 дней после имплантации стентов без покрытия и 365 дней после имплантации стентов с лекарственным покрытием [2, 4, 28].
β-Адреноблокаторы
Результаты исследования POISE (PeriOperative ISchemic Evaluation) привели к пересмотру подхода относительно назначения β-адреноблокато- ров [4]. Согласно результатам этого исследования, в котором принял участие 8351 пациент, применение относительно высокой дозы пролонгированного метопролола (200 мг/сут) в течение 30 дней, начиная со 100 мг метопролола за 2–4 ч до процедуры, приводило к снижению частоты ИМ в группе больных, принимавших метопролол, по сравнению с плацебо [32]. Однако в группе метопролола было отмечено увеличение частоты инсультов и общей смертности по сравнению с больными, принимавшими плацебо [32].
Кроме того, в другом метаанализе было показано, что эффективность β-адреноблокаторов зависит от исходного риска сердечно-сосудистых осложнений пациента, так, они достоверно снижали риск у пациентов с индексом RCRI, равным 3, а при значении индекса от 1 до 2 достоверной разницы получено не было, более того, у пациентов с низким риском (индекс 0) смертность даже возросла [33].
Таким образом, согласно рекомендациям 2009 г., пациентам, которые принимали β-адре- ноблокаторы до госпитализации, рекомендовано продолжение терапии с возможной коррекцией доз до достижения целевой ЧСС (класс рекомендаций I, т.е. польза и эффективность лечебного воздействия доказаны и/или общепризнаны), а вот пациентам с высоким риском хирургического вмешательства следует начинать терапию β-адреноблокаторами с низких доз (класс рекомендаций был снижен с I до IIа, т.е. имеющиеся данные свидетельствуют преимущественно о пользе/эффективности лечебного воздействия) с уточнением, что дозу необходимо титровать до достижения целевых ЧСС и АД [4]. Аналогичные
рекомендации применимы и к пациентам, направляемым на торакальное хирургическое вмешательство [6]. Следует избегать назначения высоких доз препаратов в начале лечения без титрования дозы [28].
Другой проблемой является то, что из-за предубеждения врачей пациентам пожилого возраста и пациентам с ХОБЛ β-адреноблокаторы часто не назначают, опасаясь увеличения обструкции дыхательных путей. Однако в многочисленных исследованиях было доказано, что использование β-адреноблокаторов у таких пациентов безопасно и отсутствие необходимой в данном случае терапии может ухудшить результаты лечения [34–36].
Профилактика фибрилляции предсердий
Фибрилляция предсердий (ФП) — наиболее распространенная аритмия после торакального хирургического вмешательства, развивается у 12–40% пациентов после резекции легкого и операций на пищеводе [37]. У пациентов с ФП удлиняется пребывание в стационаре, увеличиваются расходы на медицинское обслуживание, возрастает риск развития инсульта, когнитивной дисфункции и летального исхода [37]. STS рекомендует для профилактики ФП пациентам, которые принимали β-адреноблокаторы до госпитализации, продолжить их прием [38]. Было показано, что отмена пропранолола приводит к возникновению ФП [39]. Эпидуральная анестезия снижает уровень катехоламинов, ЧСС и АД, поэтому доза β-адреноблокаторов у таких пациентов должна быть скорректирована, чтобы избежать риска гипотензии и брадикардии. У пациентов, которые не принимали β-адреноблокаторы до операции, предпочтительным классом препаратов, используемых для профилактики ФП в периоперационном периоде, являются недигидропиридиновые антагонисты кальция (например, дилтиазем) [6, 28]. Амиодарон также эффективен для профилактики ФП [6]. Однако было показано, что у 5% больных применение амиодарона вызывает побочные явления со стороны дыхательной системы, в том числе острый РДС [40]. Летальность таких больных достигает 50% [40]. Рекомендации STS предлагают использовать амиодарон только в крайнем случае
ив тщательно контролируемых дозах [38]. Не следует использовать амиодарон для профилактики ФП у пациентов, перенесших пульмонэктомию [38]. Дигиталис и флекаинид также не должны использоваться для профилактики ФП [6]. Таким образом, современные руководства рекомендуют для профилактики ФП продолжить применение β-адреноблокаторов в течение периоперационного периода, если пациент уже принимал их ранее,
иназначать недигидропиридиновые антагонисты кальция, если пациент не принимал ранее β-адре- ноблокаторы.
381
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/

Раздел 6
Оценка риска развития осложнений со стороны дыхательной системы
Факторы риска развития ПЛО включают факторы, связанные как с пациентом (возраст, табакокурение, ожирение, наличие заболеваний органов дыхания), так и непосредственно с хирургическим вмешательством [6, 41]. Исследование ФВД помогает при диагностике и оценке степени тяжести заболевания [41], однако не позволяет предсказать послеоперационные осложнения. Минимальное изменение легочной функции, выявленное с помощью ФВД, не обладает большей чувствительностью относительно наличия заболевания легких по сравнению с клиническим осмотром и физикальным обследованием [42]. Было показано, что около 40% предоперационных функциональных исследований назначают без необходимости [41]. Применение ФВД для оценки прогноза хирургического вмешательства ограничено в основном пациентами, направляемыми на резекцию легкого. Разработаны критерии изменения функции легких, которые позволяют оценить «операбельность» больного (см. ниже).
В отличие от ФВД, предоперационное измерение газового состава артериальной крови играет важную роль, поскольку было показано, что у пациентов с гиперкапнией ПЛО встречаются достаточно часто [43, 44]. Кроме того, развитие гиперкапнии у пациентов с ХОБЛ сокращает продолжительность жизни вне зависимости от хирургического вмешательства [45]. В исследовании Kearney и соавт. предоперационные нарушения в газовом составе артериальной крови, включая гиперкапнию, не являются существенным фактором для прогноза послеоперационных осложнений [46], тогда как в других исследованиях повышение PaCO2 >45 мм рт.ст. служит фактором риска развития легочных осложнений и летального исхода [43]. Артериальная гипоксемия (PaO2 <50 мм рт.ст.) также считается относительным противопоказанием к проведению хирургического вмешательства [47]. Высокий уровень PaCO2 или низкий уровень PaO2 не является абсолютным противопоказанием для оперативного лечения, но в этом случае на первый план выходит необходимость обеспечения предоперационной интенсивной помощи пациентам с высоким риском.
Предоперационная оценка также включает рентгенограмму грудной клетки. Как и результаты ФВД, данные рентгенографии грудной клетки редко выявляют какие-либо отклонения от нормы у пациентов без факторов риска заболеваний органов дыхания [47]. Проведение рентгенографии грудной клетки показано пациентам с заболеваниями органов дыхания или с высоким риском послеоперационных осложнений.
Факторы, связанные с пациентом
Возраст
С возрастом происходит снижение эластичности легочной ткани, как результат снижаются экспираторные потоки, ОФВ1, отношение ОФВ1 к ЖЕЛ и максимальная вентиляция легких (МВЛ), а значит, снижается вентиляционный резерв. Кроме того, альвеолярно-артериальный градиент кислорода (PAO2 – PaO2) увеличивается приблизительно на 0,4 мм рт.ст. в год [48]. Таким образом, происходит постепенное снижение PaO2 и резерва, необходимого, чтобы увеличить вентиляторное обеспечение в послеоперационный период [49]. Следовательно, с возрастом изменения механики дыхания и насыщения крови кислородом приводят к увеличению риска послеоперационных осложнений.
У пациентов пожилого возраста растет число сопутствующих заболеваний, которые также могут увеличивать вероятность послеоперационных осложнений. Во многих исследованиях было продемонстрировано, что пожилой возраст (обычно старше 60 лет) является фактором риска развития ПЛО [50, 51]. В то же время в исследовании Garibaldi и соавт. было показано, что возраст пациента сам по себе не является независимым фактором риска легочных осложнений [52]. Пожилые пациенты вообще имеют более высокую частоту осложнений, связанных с лечением, таким образом, в этой группе пациентов операционный риск может конкурировать с риском невыполнения операции [53].
Курение
1/3 всех пациентов, которые подвергаются хирургическому вмешательству, — курильщики [54]. Аналогичные данные представлены у больных раком легких — на момент диагностики заболевания только 18% пациентов никогда не курили, а 24–40% являются активными курильщиками [6]. Табакокурение увеличивает летальность во время операции, вероятно, вследствие влияния, оказываемого как на сердечно-сосудистую, так и на дыхательную систему [6, 54]. Курение влияет на противомикробную и противовоспалительную функцию альвеолярных макрофагов, приводя к снижению эффективности иммунного ответа в легких после анестезии и хирургического вмешательства [55], вызывает повреждение эндотелиальной функции, снижает коронарный резерв миокарда, следовательно, увеличивает риск развития тахикардии, гипертензии и ишемии [56]. Кроме того, курение увеличивает риск артериальной десатурации и ларингоспазма во время анестезии [57].
Не представляется возможным выяснить, что же приводит к развитию легочных осложнений: курение само по себе или развитие патологических процессов в результате табакокурения. Повышению
382

Функциональные исследования
частоты осложнений у курильщиков способствуют плохая гигиена полости рта, хронический кашель, снижение функции РЭ, наличие большого числа легочных патогенных микроорганизмов, повышенный уровень карбоксигемоглобина, влияние никотина на сердечно-сосудистую систему. Уровень карбоксигемоглобина у курильщиков обычно находится в диапазоне 3–15%. Это приводит: 1) к снижению количества гемоглобина, доступного для связывания с кислородом, что снижает насыщение артериальной крови кислородом, и 2) к сдвигу кривой диссоциации гемоглобина влево, что облегчает связывание кислорода с гемоглобином, но ухудшает его высвобождение в тканях [53]. У курильщиков было выявлено снижение доставки кислорода и увеличение экстракции кислорода тканями, что приводит к снижению насыщения смешанной венозной крови кислородом.
Данные крупных мультицентровых исследований показали, что курильщики, даже в случаях отсутствия у них легочных или сердечно-сосу- дистых заболеваний (ССЗ), имеют повышенный риск развития послеоперационных осложнений [58, 59]. Проанализировав базу данных Общества торакальных хирургов (почти 8000 пациентов, перенесших резекции по поводу рака легких), Mason и соавт. показали, что у курильщиков риск госпитальной летальности и легочных осложнений значительно выше по сравнению с некурящими больными (госпитальная летальность 1,5 и 0,39% соответственно) [60]. Отказ от курения постепенно снижает риск, правда, они не смогли определить оптимальные сроки [60]. Опубликованные данные метаанализа показали, что прекращение курения снижает относительный риск ПЛО на 41% [61]. Курильщикам, направляемым на хирургическое вмешательство, рекомендовано прекратить курение. Для снижения риска ПЛО оптимальный период прекращения составляет по крайней мере 6–8 нед [62]. Медицинские консультации и фармакотерапия никотиновой зависимости считаются достаточно эффективной мерой лечения табачной зависимости.
Ожирение и синдром обструктивного апноэ сна
Существуют различные взгляды относительно влияния избыточной массы тела (ожирения) на развитие послеоперационных осложнений. Ожирение увеличивает риск развития ателектазов легких в послеоперационном периоде у пациентов, перенесших хирургическое вмешательство в верхнем отделе брюшной полости [63]. В других исследованиях также было показано, что легочные осложнения после абдоминальных операций чаще возникают у пациентов с ИМТ более 25 кг/м2 [50, 64]. Напротив, в исследовании Moulton и соавт. ожирение не оказывало достоверного влияния на частоту легочных осложнений у пациентов, перенесших хирургическое вмешательство с использованием аппарата искусственного крово-
обращения [65]. Точно так же Dales и соавт. не нашли достоверных различий в частоте легочных осложнений у пациентов, перенесших торакальное хирургическое вмешательство, в зависимости от их массы тела [66]. Такие разные результаты могут быть следствием различий локализации проведения операции.
Физиологические изменения, связанные с ожирением, оказывают существенное влияние на насыщение крови кислородом в послеоперационный период. Выраженность гипоксемии значительно увеличивается с повышением массы тела
ис возрастом [7]. Гипоксемия прежде всего является следствием вентиляционно-перфузионного дисбаланса (низкое соотношение VA/Q) в основаниях легкого. Это также может быть следствием нарушения регуляции дыхания, связанного с
задержкой выведения CO2 или с метаболическим алкалозом, и увеличением работы дыхания. Хотя ЖЕЛ может оставаться в пределах нормальных значений при умеренном ожирении, РОвыд снижается, указывая на высокое стояние диафрагмы в покое. При выраженном ожирении ЖЕЛ и МВЛ снижаются даже у пациентов без заболеваний органов дыхания и мышечной слабости [7]. Таким образом, степень гипоксемии, гиперкапнии и легочной гипертензии увеличивается даже у пациентов с умеренным ожирением. Кроме того, у пациентов с избыточной массой тела возникают проблемы, связанные с необходимостью более высоких доз анестезирующих средств из-за их высокой растворимости в жировой ткани, более длительным периодом выведения, удлинением времени проведения операции, увеличением кислотности желудочного сока и увеличением частоты аспирации желудочного содержимого [67].
Среди пациентов с ожирением значительная часть имеет синдром обструктивного апноэ сна, у таких пациентов частота послеоперационных осложнений (главным образом со стороны дыхательной системы) значительно выше по сравнению с пациентами без проблем апноэ [68]. Gupta
исоавт. анализировали данные пациентов после замены тазобедренного или коленного сустава
ипродемонстрировали, что послеоперационные легочные или кардиологические осложнения отмечались у 39% пациентов с синдромом обструктивного апноэ сна по сравнению с 18% пациентов без апноэ, 24% пациентов с синдромом обструктивного апноэ сна были переведены в отделение интенсивной терапии и только 9% пациентов — без апноэ [69]. Считают, что у пациентов с синдромом обструктивного апноэ сна рост риска послеоперационных осложнений связан с легочной гипертензией [6] и может быть снижен при адекватном лечении [70, 71]. Поэтому очень важно своевременно диагностировать (разработаны простые скрининговые методы) и начать лечение синдрома обструктивного апноэ сна, это может улучшить послеоперационные результаты [72].
383
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/

Раздел 6
Заболевания органов дыхания
Хронические заболевания органов дыхания являются одним из наиболее значимых рисков, зависящих не от типа хирургического вмешательства, а от индивидуальных характеристик пациента. Поэтому для снижения риска ПЛО необходимо до операции выявить наличие заболеваний органов дыхания.
Пациенты с обструктивными заболеваниями, при которых снижены экспираторные потоки и способность к удалению секрета из дыхательных путей значительно ниже, чем при рестриктивных заболеваниях, более подвержены риску послеоперационных осложнений [7]. В исследовании Stein и соавт. было показано, что при снижении форсированного экспираторного потока также можно с высокой степенью вероятности предположить развитие ПЛО [44]. У пациентов с выраженными рестриктивными нарушениями, у которых увеличена эластическая отдача легких, скоростные экспираторные показатели и функция выведения секрета из дыхательных путей могут оставаться достаточно хорошими. При прогрессировании как обструктивных, так и рестриктивных нарушений происходит задержка CO2, что приводит к многократному возрастанию риска хирургического вмешательства.
ХОБЛ — заболевание, имеющее легочные и внелегочные проявления и характеризуемое ограничением скорости воздушного потока в бронхах. Большинство пациентов с ХОБЛ являются курильщиками со стажем, курение и ХОБЛ значительно повышают риск развития рака легких [73]. 50–80% пациентов с впервые диагностированным раком легких в анамнезе имели ХОБЛ — наиболее важный фактор риска рака легких, который не зависит от интенсивности курения [74]. В отличие от хорошо контролируемой бронхиальной астмы, наличие ХОБЛ в анамнезе существенно увеличивает вероятность пневмонии или ДН в послеоперационный период [6]. У пациентов с ХОБЛ риск послеоперационных осложнений достаточно высокий и составляет 26–78% [44, 75]. Ведение пациентов с ХОБЛ перед операцией является таким же, как и для пациентов, которых не направили на оперативное лечение. Предоперационная легочная реабилитация может улучшить послеоперационные результаты у этих пациентов [76].
У пациентов с БА существует обратная пропорциональная зависимость между риском послеоперационных осложнений и адекватностью контроля течения заболевания до операции. Наиболее частыми осложнениями являются бронхоспазм и баротравма. Рефлекторная стимуляция во время интубации и высвобождение медиаторов воспаления под действием некоторых анестезирующих средств могут привести к бронхоспазму [7]. Не рекомендуют использование морфина и миорелаксанта периферического действия недеполяри-
зующего типа — тубокурарина хлорида, поскольку они приводят к высвобождению гистамина [77]. В исследовании Warner и соавт. риск развития бронхоспазма был незначительным (1,7%), тогда как в других ранее проведенных исследованиях риск бронхоспазма у пациентов с астмой составил 6–24% [78]. Авторы сделали вывод, что бронхоспазм во время операции у пациентов с хорошо контролируемым течением астмы случается так же редко, как и у пациентов без астмы. Напротив, пациенты с плохо контролируемой астмой имеют более высокий риск осложнений [79]. В случае с плохо контролируемой астмой следует исключить другие патологические состояния (такие как карциноид легкого, стеноз трахеи, эндобронхиальные опухоли), которые имеют схожие симптомы [6].
Не следует ограничивать применение гормональной терапии в послеоперационный период, применение стероидов не увеличивает число послеоперационных осложнений [62, 78]. У пациентов с астмой или ХОБЛ применение бронходилататоров в периоперационный период позволяет улучшить функцию легких [41, 79].
Резекция легкого
Предоперационная оценка пациентов, направляемых на торакальное хирургическое вмешательство, отличается от оценки при проведении других операций. Во-первых, такие пациенты, вероятно, имеют заболевания органов дыхания; во-вторых, в результате таких операций, как лобэктомия или пульмонэктомия, вентиляционная способность легких может быть значительно ухудшена. При подготовке к другим операциям целями предоперационной оценки являются оптимизация анестезиологического пособия и хирургического лечения и подготовка пациента к оперативному лечению, тогда как при резекции легкого оценка определяет, возможно или нет проведение операции.
Анализ регистра больных, которым проводили резекцию легкого (18 000 операций), показал, что достоверными предикторами осложнений и смертности являются низкий дооперационный ОФВ1, почечная недостаточность, плохой физический статус пациента по ASA, применение стероидов, химиолучевая терапия и особенно тип операции (при пульмонэктомии риск значительно выше, чем при лобэктомии) [6].
Исследование функции внешнего дыхания и диффузионной способности легких
Спирометрия должна быть проведена у всех больных, направляемых на хирургическое лечение. Наиболее ценным функциональным показателем является ОФВ1 [80].
Измерение ДСЛ (DLCO) позволяет судить, насколько легкие справляются со своей основной функцией — переносом кислорода из атмосферного воздуха в кровь. Измерение DLCO с помощью метода однократного вдоха газовой смеси,
384

Функциональные исследования
содержащей инертный газ и монооксид углерода (CO), с задержкой дыхания должно быть рутинным исследованием у всех больных, направляемых на хирургическое лечение [80].
Нагрузочное тестирование
Поскольку физическая нагрузка является своего рода стрессом, НТ позволяют оценить координированное функционирование дыхательной, сердечно-сосудистой и мышечной систем и физиологические резервы, которые могут быть доступны после операции. Во время физической нагрузки увеличиваются вентиляция легких, потребление кислорода, выведение углекислого газа и приток крови. Аналогичные изменения наблюдаются во время послеоперационного периода после резекции легкого. Таким образом, НТ может быть использован для оценки физиологических реакций организма после операции.
НТ позволяют стратифицировать послеоперационные осложнения, их можно разделить на две группы: высокотехнологичные, или КРНТ (для их проведения необходимо дорогостоящее оборудование для оценки функции респираторной и сер- дечно-сосудистой систем, газообмена и устройства для дозирования физической нагрузки — эргометра), и НТ, не требующие специального оборудования, так называемые внелабораторные или «полевые» НТ. В отличие от последних, КРНТ — более информативный и специфичный метод, так как позволяет объективно оценить резерв кардиореспираторной системы, а в случае ограничения работоспособности — определить причину и назначить лечение (например, оптимизация лечения ХОБЛ или ИБС). При КРНТ динамика роста потребления кислорода (V’O2) зависит от интенсивности работы, поэтому физическую работоспособность оценивают по пиковому (или максимальному) потреблению кислорода (V’O2max). V’O2max не только представляет максимальное количество O2, доставляемое к тканям во время физической работы, но также служит критерием способности всей системы кислородного обеспечения организма противостоять стрессу и позволяет оценить риск хирургического вмешательства [80]. V’O2max зависит от возраста, пола, массы тела, уровня тренированности, наследственности, исходного состояния сердечно-сосудистой системы. При КРНТ на тредмиле V’O2 обычно представляют в единицах, кратных потреблению кислорода в условиях покоя (в МЕТ).
Если проведение КРНТ невозможно, следует провести внелабораторный НТ: тест с ходьбой [тест с произвольным темпом ходьбы в течение 6–12 мин или тест с возрастающим темпом ходьбы («челночный» тест, или shuttle walk test)] или подъем по лестнице. При проведении внелабораторных НТ работу оценивают по пройденному во время тестирования расстоянию. Расстояние, пройденное в течение 6–12 мин ходьбы, достовер-
но коррелирует с V’O2max у здоровых людей, пациентов с ХОБЛ, кандидатов для трансплантации легких [81, 82]. Однако относительно взаимосвязи результатов НТ и операции после резекции легкого были получены неоднозначные показания. Расстояние, пройденное с возрастающим темпом ходьбы (shuttle-test), достоверно коррелирует с V’O2max. Коэффициент корреляции был более высоким по сравнению с произвольной ходьбой, результаты теста воспроизводимы. Из уравнения регрессии следует, что пройденное расстояние 250 м (25 отрезков пути) указывает на V’O2max 10 мл/кг в 1 мин [83]. Однако пройденное расстояние достоверно не различается у пациентов
сосложнениями после операции и без. Кроме того, тест недооценивает физическую нагрузку в
нижнем диапазоне по сравнению с V’O2max [84]. Подъем по лестнице позволяет выявить пациентов
свысоким риском осложнений после операции. Было показано, что у пациентов, которые не могут подняться более 12 м, частота осложнений и смертности были соответственно в 2 и 13 раз выше, чем у пациентов, высота подъема которых была более 22 м [85].
Измерение насыщения (сатурации) артериальной крови кислородом при физической нагрузке служит полезным инструментом при предоперационной функциональной оценке кандидатов на резекцию легкого. Однако роль десатурации кислорода при физической нагрузке в стратификации риска не определена.
Прогноз послеоперационной функции
При предоперационной оценке необходимо оценить риск послеоперационных осложнений, и если он не очень высокий, то оперативное лечение допустимо. Если риск серьезных операционных осложнений достаточно высок, то лучше воздержаться от операции.
Как уже было сказано ранее, резекция легких может значительно ухудшить вентиляционную способность легких, поэтому были проведены многочисленные исследования по выявлению пороговых значений легочной функции, позволяющих планировать оперативное лечение и обеспечивающих адекватные показатели послеоперационной легочной функции. Чтобы оценить риск операции и выбрать тактику ведения пациента, вычисляют ожидаемую послеоперационную функцию легких.
Для оценки послеоперационной функции применяли следующие методы визуализации: вен- тиляционно-перфузионную сцинтиграфию, КТ, МРТ, однофотонную эмиссионную КТ или простой подсчет резецируемых сегментов.
Наиболее широко используемым и точным методом, который позволяет оценить функцию легких после резекции, является вентиляцион- но-перфузионная сцинтиграфия легких. С помощью этого метода можно на дооперационном
385
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/

Раздел 6
этапе определить границы зоны патологического процесса, количественно оценить вклад удаляемой легочной паренхимы в общую вентиляцию/ перфузию и предсказать послеоперационное значение. В некоторых работах было показано, что при использовании этого метода можно достоверно прогнозировать изменение ФВД в послеоперационном периоде [86, 87]. В то время как в проспективном исследовании, проведенном Varela и соавт., результаты были хуже — послеоперационная функция была значительно ниже прогнозируемой, в первую неделю функция восстанавливалась, но не достигла предсказанного значения [88]. Сцинтиграфия менее широко используется при оценке послеоперационной функции у пациентов, направляемых на лобэктомию, из-за трудностей в интерпретации вклада отдельных долей в общую вентиляцию/кровообращение в легких.
Для вычисления послеоперационной функции (ОФВ1, DLCO или V’O2max) следует использовать следующую формулу [80]:
послеоперационное значение функции = (предоперационное значение функции / T ) × R,
где Т — общее количество функционирующих сегментов легких до операции и Т = 19 – количество обтурированных сегментов (выявленных с помощью методов визуализации и/или бронхоскопии); R — оставшееся количество функционирующих сегментов после операции и R = T – количество удаляемых функционирующих сегментов.
Алгоритм предоперационной оценки пациентов с раком легких
Существует несколько подходов для оценки операбельности пациента для резекции легкого. Наибольшее распространение получили рекомендации Британского торакального общества [89], Европейского респираторного общества/Европейского общества торакальных хирургов (ERS/ ESTS) [80] и Американской коллегии пульмонологов (ACCP) [90, 91].
Согласно рекомендациям Британского торакального общества, ОФВ1 следует измерять всем пациентам, направляемым на резекцию легкого [89]. Пациенты без одышки при физической нагрузке или при отсутствии радиографических признаков ИЗЛ с ОФВ1 более 1,5 л являются подходящими кандидатами для лобэктомии, для пневмонэктомии — с ОФВ1 более 2 л. У пациентов с ОФВ1 ниже этих значений и у пациентов
содышкой при физической нагрузке или радиографическими признаками ИЗЛ (независимо от значений ОФВ1) следует измерить DLCO и SaO2
спомощью пульсоксиметрии [89]. Возраст (старше 70 лет) пациента не является противопоказанием для оперативного лечения. Увеличение риска может быть связано в большей степени с увеличением сопутствующих заболеваний, чем с возрастом как таковым. Не следует отказываться
от проведения лобэктомии только из-за пожилого возраста пациента. Однако когда решается вопрос о проведении пульмонэктомии, Британское торакальное общество рекомендует учитывать возраст пациента [89].
ERS/ESTS опубликовали руководство на основании данных доказательной медицины, в которых указан пошаговый алгоритм предоперационной оценки с уровнем доказательств рекомендаций [80]:
1.Предоперационная оценка должна проводиться многопрофильной командой.
2.Возраст пациента не является противопоказанием для оперативного лечения, и пожилые пациенты (>70 лет) должны пройти предоперационную оценку в соответствии с предложенным алгоритмом.
3.Оценка сердечно-сосудистой системы должна осуществляться в соответствии с предложенным алгоритмом (см. рис. 6.22).
4.Измерения ОФВ1 и DLCO должны быть проведены у всех больных, направляемых на хирургическое лечение. Если оба эти параметра более 80% должного значения, пациент может быть направлен на резекцию легкого (включая пульмонэктомию), дальнейшие обследования не рекомендуются.
5.Если хотя бы один из параметров (ОФВ1 и/или DLCO) менее 80% должного, то необхо-
димо провести КРНТ с определением V’O2max. При V’O2max >20 мл/кг в 1 мин или >75% должного пациент может быть направлен на операцию
(включая пульмонэктомию); при V’O2max <10 мл/ кг в 1 мин или <35% должного риск любого оперативного вмешательства является высоким, cледует рассмотреть другие методы лечения; при V’O2max
=10–20 мл/кг в 1 мин или 35–75% должного необходимы дополнительные исследования.
Если КРНТ провести невозможно, то следует провести стандартизованный тест с подъемом по лестнице. Это скрининговый тест первого выбора для селекции пациентов: если подъем >22 м — операция безопасна, в противном случае для принятия решения необходимо провести КРНТ. Тест с 6-минутной ходьбой (6-МТ) не следует использовать для отбора пациентов для операции. Тест с возрастающим темпом ходьбы также не может быть использован для отбора пациентов для операции, он пригоден только в качестве скринингового теста: расстояние <400 м соответствует V’O2max <15 мл/кг в 1 мин.
6.Необходимо провести вентиляционную/перфузионную сцинтиграфию легких и вычислить послеоперационную функцию легких [прогнози-
руемые послеоперационные значения ОФВ1 (ппоОФВ1) или DLCO (ппо-DLCO)]. Если ппо-ОФВ1 и ппо-DLCO более 30% должного, пациент может быть направлен на резекцию легкого с учетом рассчитанного числа удаляемых сегментов, дальнейшие обследования не рекомендуются.
386

Функциональные исследования
RCRI >2 или:
1)Сердечные нарушения, требующие лечения
2) Подозрение на не выявленные ранее нарушения в работе сердца
3)Неспособность пройти 2 лестничных пролета
Да
Нет
Консультация кардиолога с проведением неинвазивных методов
тестирования в соответствии с АНА/АСС рекомендациями
Продолжение текущего кардиологического лечения.
При необходимости назначение новых препаратов (бета-блокаторов, антикоагулянтов или статинов)
Отсрочка операции на срок ≥ 6 нед
История болезни Медицинский осмотр ЭКГ
Индекс риска RCRI
RCRI:
1.ИБС (ИМ, стенокардия)
2.Сердечная недостаточность
3.Инсульт или ТИА
4.СД, инсулинзависимый
5.Креатинин ≥ 2 мг/дл
6.Операции высокого риска (лобэктомия/пульмонэктомия)
Функциональное исследование легких
Рис. 6.22. Алгоритм оценки сердечно-сосудистой системы перед оперативным лечением у пациентов с раком легких [80]: ТИА — транзиторная ишемическая атака; АКШ — аорто-коронарное шунтирование; ЧКВ — чрескожное коронарное вмешательство; RCRI — пересмотренный индекс сердечно-сосудистого риска Lee [29]; AHA/ACC-рекомендации — рекомендации Американской коллегии кардиологов и Американской ассоциации сердца [4]
7.Если ппо-ОФВ1 или ппо-DLCO менее 30% должного, необходимо оценить прогнозируе-
мое послеоперационное значение V’O2max (ппо- V’O2max). Если ппо-V’O2max более 35% должного или 10 мл/кг в 1 мин, пациент может быть направлен на резекцию легкого с учетом рассчитанно-
го числа удаляемых сегментов. Если ппо-V’O2max менее 35% должного или 10 мл/кг в 1 мин, риск любого оперативного вмешательства является высоким, cледует рассмотреть другие методы лечения.
8.У пациентов с эмфиземой с преимущественным поражением верхних долей и раком легких той же локализации, которые являются кандидатами на ХРОЛ (критерии см. ниже), рекомендовано проведение лобэктомии с дополнительной ХРОЛ или без нее.
9.Всем активно курящим пациентам с раком легких, направляемым на оперативное лечение, следует рекомендовать прекратить курение (за 2–4 нед) перед хирургическим вмешательством.
10.Пациентам с раком легких, направляемым на резекцию легкого, следует пройти пред- и послеоперационные курсы реабилитации.
Хирургическая редукция объема легких
Для пациентов с тяжелой эмфиземой вариантами хирургического лечения являются ХРОЛ и трансплантация легких.
В конце 1950-х годов Brantigan и соавт. впервые предприняли попытку резекции легочной паренхимы у больных с диффузной эмфиземой. Их исследования были основаны на концепции, что при редукции объема легких может быть улучшена механика дыхания за счет восстановления радиальной тракции терминальных бронхиол и улучшения функции диафрагмы и межреберных мышц. Однако высокая операционная летальность (18%) [92] и отсутствие убедительных объективных доказательств улучшения у выживших пациентов привели к тому, что такое хирургическое вмешательство не получило распространения. Интерес к ХРОЛ вернулся после результатов, опубликованных Cooper и соавт. в середине 1990-х годов [93]. В их сообщении были представлены результаты двусторонней редукции объема легких, выполненной через срединную стернотомию. Было показано достоверное улучшение легочной функции, уве-
387
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/

Раздел 6
личение физической работоспособности, уменьшение одышки и улучшение качества жизни [93]. При этом операционная и послеоперационная летальность (период наблюдения от 1 до 15 мес) была равна 0% [93]. Для уточнения показаний и противопоказаний к проведению ХРОЛ, оценки ее влияния на выживаемость и физическую работоспособность пациентов с эмфиземой было разработано большое проспективное мультицентровое рандомизированное исследование NETT (the National Emphysema Treatment Trial, 1218 пациентов). Было показано, что функциональные улучшения пациентов с ОФВ1 <20% должного или с гомогенным распределением эмфиземы или с DLCO <20% должного были минимальными, при этом летальность в ранний послеоперационный период (в течение 30 дней) составила 16%, тогда как летальность пациентов без операции — 0% [94]. ХРОЛ позволяла улучшить легочную функцию, толерантность к физической нагрузке, качество жизни у больных с преимущественным поражением верхних долей и низкой предоперационной физической работоспособностью [95]. В настоящее время для ХРОЛ используются критерии отбора пациентов, разработанные в протоколе NETT. К сожалению, периоперационные осложнения и смертность ограничили широкое применение ХРОЛ.
В попытке минимизировать риск операции были разработаны методы для уменьшения объема легких путем эндоскопической обтурации бронхов наиболее сильно пораженных долей легкого [96– 99]. В крупнейшем проспективном исследовании в настоящее время выявлены незначительные улучшения легочной функции, физической работоспособности (пройденное за 6 мин расстояние) и симптомов, но после имплантации эндобронхиального клапана чаще встречались обострения ХОБЛ, пневмонии и кровохарканье [100]. Роль бронхоскопической редукции объема легких в лечении эмфиземы еще требует изучения, исследования продолжаются и направлены на улучшение дизайна клапана, выбор техники и наиболее подходящей популяции пациентов.
Список литературы
См. 
6.4. Оценка утраты трудоспособности при болезнях органов дыхания
О.Н. Титова, В.А. Волчков, Н.А. Кузубова, Е.Ю. Харитоненко
Введение
Хронические болезни органов дыхания (ХБОД) в настоящее время рассматриваются как одна из основных причин временной нетрудоспособности (ВН), инвалидности и преждевременной смертности среди взрослого населения во всем мире. Ущерб, наносимый ХБОД, связан с их влиянием на качество жизни и утрату трудоспособности. Несмотря на то что на современном этапе при адекватном лечении течение многих ХБОД приобретает контролируемый характер,
вбудущем прогнозируется рост общих потерь, обусловленных этой группой заболеваний [1]. Для оценки вклада смертности и инвалидности, связанных с основным заболеванием, в общий ущерб в международной практике используется комплексная единица измерения «год жизни, измеренный или потерянный в связи с нетрудоспособностью» (Disability-Adjusted life Year, DALY). За период с 1990 по 2013 г. потери DALYs в мире вследствие ХБОД выросли на 55,1%, в том числе
всвязи с БА — на 31,6%, по причине ХОБЛ — на 72,3%. Это подтверждает прогноз, согласно которому ХОБЛ, являясь 12-й причиной потерь DALYs в мире в 1990 г., к 2020 г. переместится на 5-е место [2, 3].
Динамика инвалидности вследствие болезней органов дыхания в Российской Федерации
Тяжелые формы ХБОД часто приводят к инвалидности. Их доля в структуре общей инвалидности в разных странах составляет 5–11% [4]. Основными причинами первичной инвалидности вследствие ХБОД являются БА и ХОБЛ, и удельный вес последней неуклонно растет [5]. Каждый четвертый больной ХОБЛ в течение 10 лет становится инвалидом, время жизни его составляет в среднем 6,5 года [6]. Острота проблемы подчеркивается тем, что 50% пациентов, страдающих ХОБЛ, — люди моложе 65 лет. 20–40% из них вынуждены преждевременно прекратить трудовую деятельность [7]. Уровень первичной инвалидности вследствие болезней органов дыхания в РФ составляет 2,8 на 10 тыс. населения (2013 г.). Динамика интенсивного показателя первичной инвалидности за последнее десятилетие характеризовалась максимальным подъемом, зарегистри-
388

|
|
|
|
|
|
|
|
|
|
|
Функциональные исследования |
|||
6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
26,0 |
|
|
|
|
5 |
|
|
5,2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
23,8 |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
24,0 |
|
|
|
|
4 |
|
4,1 |
|
3,9 |
|
|
|
|
|
|
22,1 |
|
|
|
|
|
|
|
|
|
|
|
|
22,0 |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
2,7 |
|
|
|
|
|
|
19,7 |
|
|
3,1 |
|
|
|
|
|
|
|
|
20,0 |
|
|
|||
|
|
|
|
|
|
2,2 2,1 |
|
|
|
|
|
|
||
2 |
|
|
|
|
|
1,9 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
1,7 |
|
|
|
18,0 |
|||
|
|
|
|
|
|
|
|
|
18,0 |
|
|
|||
|
|
|
|
|
|
|
|
|
1,5 |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
15,9 |
|
|
|
|
|
|
|
|
|
|
16,0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2003 |
2004 |
2005 |
2006 |
2007 |
2008 |
2009 |
2010 |
2011 |
2012 |
14,0 |
|
|
|
|
2009 |
2010 |
2011 |
2012 |
2013 |
||||||||||
Уровень первичной инвалидности в |
Уровень первичной инвалидности в |
|||||||||||||
вследствии БОД взрослого населения РФ |
вследствии БОД взрослого |
|
||||||||||||
(на 10 тыс. населения) |
|
|
|
|
населения РФ (тыс. человек) |
|
||||||||
Линейная [уровень первичной инвалидности в |
|
Линейная [уровень первичной |
|
||
вследствии БОД взрослого населения РФ |
|
инвалидности в вследствии БОД взрослого |
(на 10 тыс. населения)] |
|
населения РФ (тыс. человек)] |
Рис. 6.23. Динамика уровня первичной инвалидности вследствие хронических болезней органов дыхания в Российской Федерации, на 10 тыс. населения и в абсолютных значениях (тыс. человек)
рованным в 2005 г. в связи с изменениями рос- |
Наиболее частыми причинами первичной ин- |
сийского законодательства в сфере социальных |
валидности были ХОБЛ и БА. Их вклад в различ- |
гарантий инвалидам, с последующим прогнози- |
ных регионах варьировал от 68 до 92% [9]. |
руемым его снижением (рис. 6.23). |
Интенсивный показатель повторной инвалид- |
По данным российских ученых, в ближайшие |
ности в связи с ХБОД в РФ за период с 2006 по |
5 лет уровень первичной инвалидности снизится |
2012 г. имел тенденцию к снижению, с одновре- |
на 24% [5]. Основными тенденциями в измене- |
менным структурным увеличением доли граждан |
нии структуры тяжести первичной инвалидно- |
пенсионного возраста. Максимальные значения |
сти вследствие ХБОД стали рост доли инвалидов |
данного показателя в 2006–2007 гг. были обуслов- |
3-й группы и уменьшение — инвалидов 2-й груп- |
лены прекращением 20 февраля 2006 г. действия |
пы. В целом за десятилетие по РФ отмечалось |
порядка обязательного установления инвалидно- |
снижение уровней всех групп инвалидности и |
сти в пенсионном возрасте без срока переосви- |
средний интенсивный показатель первичной ин- |
детельствования (постановление Правительства |
валидности 2-й группы составил 1,4 на 10 тыс. |
Российской Федерации от 13 августа 1996 г. № 965 |
населения. Динамика числа впервые признанных |
«О порядке признания граждан инвалидами») и |
инвалидами среди взрослого населения по груп- |
вступлением в силу постановления Правитель- |
пам тяжести представлена на рис. 6.24. |
ства Российской Федерации от 20 февраля 2006 г. |
В возрастной структуре первичной инвалидно- |
№ 95 «О правилах признания лица инвалидом». |
сти в связи с ХБОД в РФ в последнее десятилетие |
Оно определило правила бессрочного установле- |
преобладают люди пенсионного возраста. Доля |
ния инвалидности вне зависимости от возраста, в |
граждан трудоспособного возраста имеет тенден- |
связи с чем зарегистрирован рост уровня повтор- |
цию к снижению. Например, в Иркутской области |
ной инвалидности среди пенсионеров (рис. 6.25). |
за период с 2003 по 2013 г. число инвалидов мо- |
Общий контингент инвалидов по ХБОД за |
лодого возраста уменьшилось в 2,4 раза [5, 8, 9]. |
прошедшее десятилетие формировался преиму- |
Анализ гендерных особенностей выявил не |
щественно за счет повторно признанных инвали- |
только более высокий интенсивный показатель |
дами, поэтому динамика уровня общей инвалид- |
первичной инвалидности среди мужчин по срав- |
ности соответствовала изменениям аналогичного |
нению с женщинами, но и больший удельный вес |
показателя повторной инвалидности. Основные |
среди них инвалидов 1-й и 2-й группы. |
тенденции характеризовались увеличением доли |
389
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
