
5 курс / Пульмонология и фтизиатрия / Респираторная_медицина_Руководство_в_3_томах_Том_1
.pdf
Раздел 3
Таблица 3.4. Основные представители антимикробных пептидов и их характеристика [10, 6]
Антимикробные пептиды |
Характеристика |
|
|
α-Дефензины |
Выделяются нейтрофилами при развитии воспаления, широкий спектр антимикроб- |
|
ной активности, рекрутирование и активация компонентов иммунной системы, |
|
индуцируют пролиферацию эпителиальных клеток, функция ингибитора протеаз |
|
с провоспалительным (ингибирование регуляторных протеаз) или протективным |
|
(ингибирование протеаз патогенов) эффектом. Возможно, прямые регуляторные |
|
функции (индукция продукции IL-8 эпителиальными клетками) |
|
|
β-Дефензины |
Компоненты слизистого секрета, преимущественная продукция эпителиальными |
|
клетками, широкий спектр антимикробной активности, рекрутирование и активация |
|
компонентов иммунной системы |
|
|
Кателицидин |
Компонент слизистого секрета, продуцируется миелодными и эпителиальными клет- |
|
ками, секретируется при воспалительных стимулах в виде про-соединения, которое |
|
при разделении формирует различные продукты с широким спектром антимикроб- |
|
ной активности. Уменьшает апоптоз нейтрофилов при воспалении, увеличивает |
|
хемотаксис различных иммунных клеток, действует на дифференцировку ДК и Т-лим- |
|
фоцитов, стимулирует ангиогенез |
|
|
Лактоферрин |
Основной компонент слизистого секрета, продуцируется эпителиальными клетками |
|
и инфильтрирующими нейтрофилами. Агглютинирует и уничтожает бактерии, уси- |
|
ливая адгезию и продукцию супероксида нейтрофилами. Связывается с бактериями, |
|
распознавая консервативный карбогидратный участок на поверхности клетки. Раз- |
|
личная антимикробная активность |
|
|
Лизоцим |
Компонент слизистого секрета. Значительное количество в проксимальных возду- |
|
хоносных путях. Продуцируется эпителиальными, железистыми клетками, макрофа- |
|
гами. Связывает и гидролизует пептидогликаны бактериальной стенки. Наиболее |
|
активен в отношении грамположительных организмов. Сниженный уровень ассоции- |
|
рован с предрасположенностью к острому бронхиту |
Секреторный лейкоцитарный |
Основной компонент слизистого секрета. Продуцируется эпителиальными и желези- |
ингибитор протеаз |
стыми клетками. Предотвращает повреждение эпителия легких, ингибируя протеазы, |
|
вырабатываемые клетками иммунной системы. Антибиотическая активность |
|
|
Секреторная фосфолипаза А2 |
Компонент слизистого секрета. Продуцируется в основном макрофагами и ТК. Усили- |
|
вает воспаление, расщепляя ФЛ с образованием предшественников липидных меди- |
|
аторов. Ингибирует протеазы. Активирует макрофаги |
|
|
Лактопероксидаза |
Компонент слизистого секрета. Продуцируется слизистыми железами. Участвует в |
|
функционировании пероксидазы водорода как катализатор, приводя к образованию |
|
окисленных субстратов с бактерицидными свойствами |
|
|
Секреторный протеин клеток |
Компонент сурфактанта. Продуцируется клетками Клара. Иммуномодулирующие |
Клара |
функции. Ингибирует секреторный лейкоцитарный ингибитор протеаз |
|
|
два наиболее важных типов дефензинов легких: α- и β-дефензины. Они осуществляют широкий спектр антимикробной активности против как грамположительных, так и грамотрицательных микроорганизмов. Дефензины увеличивают проницаемость бактериальной стенки, нарушая мембранный потенциал и приводя к высвобождению содержимого клетки. Следует отметить тот важный факт, что дефензины крайне чувствительны к концентрации соли, и они инактивируются при попадании
внефизиологичные условия в легких пациентов с МВ [6]. α-Дефензины DEFA1, DEFA3 и DEFA4
восновном продуцируются инфильтрирующими нейтрофилами и часто характеризуются как нейтрофильные пептиды человека (HNP — human neutrophil peptides). β-Дефензины человека DEFB1, DEFB103A, DEFB4A (которые раньше назывались
β2-, β3- и β4-дефензины соответственно) наиболее хорошо охарактеризованы. DEFB1 экпрессируется конститутивно, а экспрессия других индуцируется при появлении воспалительных стимулов [10].
Кателицидины представляют собой семейство катионных антимикробных пептидов, состоящих из консервативной сигнальной последовательности, кателинподобного региона и активного пептида. Единственный человеческий кателицидин hCAP-18 содержится в виде про-формы в миелоидных и эпителиальных клетках. После секреции про-соединение расщепляется сериновыми протеазами, что приводит к образованию активных соединений с антибактериальной активностью [22].
Следует отметить, что коллектины (сурфактантные протеины A и D, свойства которых описаны выше) также являются яркими представителями антимикробных пептидов.
Таким образом, основная функция антимикробных пептидов — это их прямая антимикробная активность против грамположительных и грамотрицательных бактерий, грибов и вирусов. Некоторые пептиды могут нейтрализовывать микробные токсины, такие как липополисахарид,
140
Механизмы защиты и регуляции иммунного ответа
или приводить к агрегации патогенов, что способствует их элиминации из респираторного тракта. Многие антимикробные пептиды являются хемоаттрактантами для клеток врожденного (моноциты, нейтрофилы и др.) и адаптивного иммунитета (например, Т-клетки памяти), увеличивают экспрессию провоспалительных цитокинов этими клетками, участвуют в пролиферции эпителиальных клеток и в репаративных процессах, обладают ферментативными свойствами или способностью ингибировать некоторые энзимы [10, 23].
Система комплемента. Одним из важнейших элементов врожденного иммунитета являются белки системы комплемента, которая состоит из более чем 30 белков плазмы и некоторых регулирующих белков, представленных на мембранах клеток. Эти компоненты формируют три энзиматических каскада активации: классический путь, альтернативный путь и MBL-путь, которые схематично представлены на рис. 3.30.
Как видно из представленного рисунка, пути активации кардинально различаются особенностями первой фазы, тогда как фаза клеточного лизиса одинакова для всех трех путей. Образование мембраноатакующего комплекса приводит к формированию пор в мембране клетки-мишени
с последующим осмотическим лизисом. Факторы комплемента вырабатываются клетками печени — гепатоцитами (до 90% всех факторов системы комплемента), а также моноцитами и макрофагами, клетками почечного эпителия, эндотелиальными клетками. С7 и фактор D вырабатываются в нейтрофилах и жировой ткани соответственно. При развитии воспаления под влиянием цитокинов (IFN-γ, цитокины семейства IL-1) секреция белков комплемента усиливается. Дефицит этих компонентов ведет к подверженности к инфекциям, например, вызываемым нейссериями (недостаток С3 или компонентов мембраноатакующего комплекса) или пиогенными бактериями (недостаток С3). Дефицит С1, С4 или С2, напротив, может приводить к развитию аутоиммунной патологии вследствие неэффективного удаления иммунных комплексов антиген–антитело [49].
Помимо активационных механизмов существуют несколько ингибиторов системы комплемента, что необходимо для эффективного контроля воспаления и предотвращения неконтролируемой реакции. К таким регуляторам относят C1-ингибитор, фактор H, фактор I и некоторые другие. Дефицит или дисфункция, например, С1-ингибитора приводят к развитию ангионевротических отеков.
Классический |
|
Лектиновый |
Альтернативный |
||||
путь |
|
(MBL) путь |
путь |
||||
|
|
|
|
|
|
|
|
Иммунные |
|
Концевая манноза |
|
Бактерии, грибы, |
|||
комплексы |
|
на микробной |
|
вирусы или опухолевые |
|||
антиген–антитело |
|
поверхности |
|
клетки |
|||
|
|
|
|
|
|
|
|
C1 (C1q, C1r, C1s) |
|
MBL, MASP1, MASP2 |
C3, C3b |
||||
C4 |
|
C4 |
Factor B |
||||
C2 |
|
C2 |
Factor D |
||||
Все пути приводят к образованию С3 конвертазы, которая расщепляет С3, оставляя С3b фиксированным
на микробной поверхности и высвобождая С3а
C5 – C6 – C7 – C8 – C9
|
|
C5b–C9 |
C3a и С5а рекрутируют |
|
мембраноатакующий |
фагоциты к месту |
|
комплекс, |
инфицирования |
Фагоциты с рецепторами |
повреждающий |
и усиливают воспаление |
к C3b поглощают |
мембрану и приводящий |
|
и разрушают патогены |
к лизису клетки |
Рис. 3.30. Основные пути активации системы комплемента: MBL — маннозосвязывающий лектин, MASP — MBL-ассоцииро- ванная сериновая протеаза [по 49, 4 с изм.]
141
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/

Раздел 3
Клеточные компоненты врожденной иммунной системы
На клеточном уровне врожденная защита обеспечивается координированным функционированием эпителиальных клеток, резидентных макрофагов, ДК и их предшественников, рекрутируемых нейтрофилов и моноцитов. Реснитчатые и СК воздухоносных путей также играют очень важную роль в инициальной оценке ингалируемых частиц большого размера, с которыми они вступают в контакт.
Нейтрофилы — фагоциты, служащие основным эффекторным звеном врожденной иммунной системы [62]. Это клетки содержат три класса протеинов в гранулах: первичные (азурофильные) гранулы с миелопероксидазой, кислыми гидролазами, лизоцимом и дефензинами, вторичные (специфические) гранулы с лактоферрином, щелочной фосфатазой и лизоцимом и третичные желатиназные гранулы. Эти гранулы формируются последовательно при дифференцировке нейтрофилов в костном мозге. Наиболее эффективно содержимое гранул повреждает стрептококки, стафилококки и грибы (включая кандиды). Небезынтересным фактом будет то, что именно миелопероксидаза придает зеленый цвет гнойному секрету. Развитие нейтрофилов контролируется цитокинами, из которых главную роль играет G-CSF, а вспомогательную — GM-CSF, IL-3 и IL-6. Повышение содержания нейтрофилов в ус-
ловиях воспаления регулируется цитокинами IL17 и IL-23. IL-23 индуцирует образование IL-17, а он стимулирует выработку G-CSF [3].
Нейтрофилы составляют от 50 до 70% всех циркулирующих лейкоцитов. За сутки в организме человека образуется и поступает в кровоток около 1011 нейтрофилов, что составляет около 100 г. В крови время их циркуляции составляет 7–10 ч, а пребывание в тканях от 3 до 5 сут. Около 20% нейтрофилов, выходящих из кровотока, мигрируют в микроциркуляторное русло легких [3]. Эти лейкоциты реагируют на большое количество хемокинов [67] (особенно на лейкотриен B4 в качестве короткоживущего градиента [65] и IL-8 — длительно существующего [66]), в табл. 3.5 суммирован широкий спектр мембранных молекул нейтрофилов. Каким же образом они попадают в очаг инфекции? Дело в том, что нейтрофилы несут на своей мембране молекулы адгезии, которые распознают соответствующие (CD11/CD18) рецепторы на поверхности активированных эндотелиальных клеток (ICAM1) [68]. При этом развивается адгезия нейтрофилов к венозному эндотелию, роллинг вдоль эндотелиальной поверхности с последующей их остановкой и миграцией между клетками эндотелия в ткани в ответ на хемотаксические градиенты [63, 64]. В легких из-за небольшого диаметра капилляров скорость движения нейтрофилов замедляется с формированием функционального резервуара клеток. В нормальных условиях миграция нейтрофилов из крови в воздухоносные про-
Таблица 3.5. Мембранные молекулы нейтрофилов, эозинофилов и моноцитов [3]
Группа молекул |
Нейтрофилы |
Эозинофилы |
Моноциты |
|
|
|
|
TLR |
TLR-1, TLR-2, TLR-4, TLR-5, |
TLR-1, TLR-4, TLR-7, TLR-10 |
TLR-1, TLR-2, TLR-3, TLR-4, |
|
TLR-6, TLR-7, TLR-8, TLR-9, |
|
TLR-5, TLR-6, TLR-7, TLR-8, |
|
TLR-10 |
|
TLR-9, TLR-10 |
Лектиновые рецепторы |
Дектин-1 |
|
DC-SIGN, дектин-1 |
|
|
|
|
Fc-рецепторы |
FcγRII, FcγRIII, FcαR; при |
FcγRII, FcγRIII, FcεRI, FcεRII, |
FcγRI, FcγRII, FcγRIII; при |
|
активации — FcγRI |
FcαR; при активации — |
активации — FcαR |
|
|
FcγRI |
|
|
|
|
|
Рецепторы комплемента |
CR1, CR3; C3aR, C5aR, C5L2 |
CR1; C3aR |
CR1, CR3, CR4; C3aR, C5aR |
|
|
|
|
Цитокиновые рецепторы |
Для G-CSF, GM-CSF, IL-3, |
Для GM-CSF, IL-3, IL-4, IL-5, |
Для M-CSF, GM-CSF, IFN- |
|
IL-17 |
IL-13 |
γ, IFN-α/β, IL-1, IL-2, IL-3, |
|
|
|
IL-4, IL-6, IL-10, IL-15, IL-21, |
|
|
|
TNF-α и т.д. |
|
|
|
|
Хемокиновые рецепторы |
СXCR1, СXCR2, СXCR3, |
СCR1, СCR2, СCR3, CCR5 |
СCR1, СCR2, СCR3, CCR5, |
|
СXCR4 |
|
CX3CR1 |
Интегрины |
β2 — LFA-α, Mac-1, αDβ2; |
β1 — VLA-4; β2 — αDβ2 |
β1 — VLA-1, VLA-2, VLA-4, |
|
рецептор — ICAM-2 |
|
VLA-5, VLA-6; β2 — LFA-1, |
|
|
|
Mac-1, p150, p45, αDβ2; |
|
|
|
рецепторы — ICAM-2, |
|
|
|
ICAM-3 |
|
|
|
|
Молекулы главного комплекса |
MHC-I; при активации — |
MHC-I; при активации — |
MHC-I, MHC-II (при акти- |
гистосовместимости (MHC) |
MHC-II |
MHC-II |
вации усиливается) |
|
|
|
|
Костимулирующие молекулы |
— |
При активации — CD154 |
СD86 (слабо); при актива- |
|
|
|
ции — CD80, CD86 |
|
|
|
|
Другие молекулы |
CD14, CD13 |
CD9 |
CD14, CD13 |
|
|
|
|
142

Механизмы защиты и регуляции иммунного ответа
странства не сопровождается повреждением эндотелиального или эпителиального барьеров, однако при наличии активационных сигналов нейтрофилы преактивируются в крови и их миграция может сопровождаться повреждением барьеров из-за выброса содержимого их гранул с увеличением проницаемости и развитием отека [69].
Нейтрофилы фагоцитируют бактерии и грибы, опсонизированные иммуноглобулинами или белками системы комплемента, учитывая наличие соответствующих рецепторов на мембране (см. табл. 3.5). Слияние фагосомы с первичными гранулами, содержащими миелопероксидазу и катионные антимикробные белки, приводит к формированию фаголизосомы. Нейтрофилы имеют выраженную микробицидную активность, реализующуюся в основном за счет генерации активных кислородных радикалов. Полиморфноядерные лейкоциты содержат большое количество дефензинов, имеющих антимикробную активность против как грамположительных, так и грамотрицательных микроорганизмов, грибов и некоторых вирусов, а также стимулирующих выработку IL-8 эпителиальными клетками [71, 70]. В нормальных условиях активные компоненты фаголизосом не попадают во внеклеточное пространство, однако при интенсивном воспалении такое высвобождение происходит, что приводит к накоплению активных субстанций в альвеолярном пространстве с повреждением тканей [72].
При описании нейтрофилов необходимо остановиться еще на одном защитном механизме, который получил название «нетоз» [73]. NET (neutrophil extracellular traps — нейтрофильная экстрацеллюлярная ловушка) — это сетеподобные структуры, которые высвобождаются из нейтрофилов и состоят из хроматина, гранулярных и цитоплазматических протеинов, дефензинов, кателицидина и др., обладающие способностью захватывать в эти «сети» и уничтожать бактерии [75]. Нетоз отличается от апоптоза и некроза и изначально представлялось, что этот процесс облигатно приводит к программируемой гибели клетки [74], но позже было установлено, что при определенных условиях формирование NET не приводит к гибели нейтрофилов [76–78]. Формированию NET способствуют провоспалительные стимулы, включая липополисахарид и IL-8, при этом некоторые микроорганизмы (S. aureus, E. coli, P. aeruginosa, C. albicans и M. tuberculosis) могут напрямую стимулировать образование NET нейтрофилами [79, 80]. Нейтрофилы селективно выбрасывают сети при контакте с патогенами большого размера (C. albicans или внеклеточные агрегаты M. bovis) [84]. Формирование таких внеклеточных «сетей» увеличивает плотность секретов в месте воспаления, приводя к формированию вязкого гноя, задерживающего микробы. При этом некоторые микроорганизмы (S. pyogenes и S. pneumoniae) вырабатывают внеклеточные ферменты, позволяющие
им разрушать ДНК, формирующие NET [81, 82]. Только часть нейтрофилов формирует NET [74], при этом пока не совсем ясно, объясняется ли это наличием определенного механизма, определяющего, в каких клетках разовьется нетоз, или тем, что только определенная субпопуляция нейтрофилов может формировать NET [83]. Подобный феномен описан не только для нейтрофилов, но и эозинофилов и ТК [5]. NET образуются не только при инфекционной патологии респираторной системы. Так, согласно последним данным, формирование сетей и их накопление ассоциировано с активацией врожденного иммунного ответа и участвует в патогенезе бронхиальной астмы и ХОБЛ [89], также отмечено повышение формирования NET при механической вентиляции легких [90]. NET фагоцитируются ДК и макрофагами [87].
Дисфункция нейтрофилов или их количественная недостаточность ассоциирована с резким увеличением предрасположенности к инфекциям. Нейтрофилы мигрируют из крови в очаг воспаления значительно быстрее моноцитов. При этом при поступлении активационного сигнала из легких выход нейтрофилов из костного мозга может увеличиться в несколько раз. Скорость мобилизации нейтрофилов дополняется их способностью развивать метаболические процессы («кислородный взрыв») в течение нескольких секунд. Все это делает нейтрофилы оптимально приспособленными для осуществления ранних этапов иммунной защиты в рамках острой воспалительной реакции. Через 3–5 сут пребывания в тканях нейтрофилы подвергаются спонтанному апоптозу, и их фагоцитируют резидентные макрофаги, что предотвращает нанесение ущерба окружающим клеткам [3]. При этом макрофаги, которые фагоцитировали апоптотические нейтрофилы, начинают продукцию TGFβ и IL-10, которые имеют противовоспалительные эффекты, хотя это бывает не во всех случаях [5, 88]. При неэффективности фагоцитоза в нейтрофилах развивается некроз с усилением воспалительного процесса.
Таким образом, нейтрофилы могут подвергаться апоптозу, некрозу и нетозу. При этом важно отметить, что нейтрофилы сами активно участвуют не только в активации, но и разрешении воспалительного процесса, вырабатывая секреторный лейкоцитарный ингибитор протеаз, который инактивирует нейтрофильную эластазу [85]. После миграции в ткани нейтрофилы начинают продукцию липоксинов, ингибирующих рекрутирование полиморфноядерных лейкоцитов, выработку су- пероксид-анион радикала и активацию NF-κB, при этом также увеличивается апоптоз нейтрофилов макрофагами [86].
Важным элементом регуляции иммунного ответа и недопущения неконтролированных воспалительных реакций являются различные варианты программируемой клеточной гибели (в отличие от некроза, когда происходит прямое разрушение
143
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/

Раздел 3
клеточной мембраны). Апоптоз реализуется в ответ на действие физиологических сигналов или в процессе срабатывания генетической программы клетки. Проявлениями апоптоза служат сморщивание клетки, уменьшение ее размеров, уплотнение наружной и внутриклеточных мембран (при сохранении их целостности) с деполяризацией, утратой микроворсинок и формированием вздутий, а также уменьшение размеров, уплотнение и фрагментация ядра с формированием апоптотических телец, которые затем фагоцитируются. Таким образом, в результате продукты распада клеток не поступают в межклеточное пространство и не вызывают воспалительной реакции, в отличие от некроза [3]. Эффективный апоптоз является непременным условием существования организма, так как его нарушения приводят к развитию неконтролируемого воспаления или аутоиммунного ответа. В последнее время также описаны аутофагия и пироптоз. Аутофагия — это процесс, при котором клетка разрушает свои собственные компоненты, при этом формируются аутофаголизосомы с деградацией содержимого. Аутофагию могут активировать сигналы от TLR или NOD-like рецепторов, а также цитокинов TNF-α и IFN-γ [49]. Протеины, вовлеченные в этот процесс, играют важную роль как во врожденном, так и в адаптивном иммунном ответе на широкий спектр патогенов. Например, именно аутофагия способствует трафику микобактерий к лизосомам для деградации [91, 92]. Одним из важных вариантов гибели клеток является пироптоз [25, 58–61]. Данный феномен характеризуется разбуханием клетки, нарушением целостности плазматической мембраны и высвобождением провоспалительных медиаторов. Пироптоз является эффективным механизмом врожденного иммунитета, реализуя защиту против патогенов, которые попадают в цитозоль клетки (например, сальмонелла). При этом активируются инфламмасомы, что приводит к образованию большого количество IL-1β и -18 при участии каспазы-1. Роль этого механизма в патологии легких еще необходимо исследовать.
Система МФ включает циркулирующие клетки, называемые моноцитами, и резидентные клетки тканей, которые называют макрофагами. Макрофаги — осуществляющие антигенпрезентацию фагоцитирующие клетки, которые способны производить широкий спектр цитокинов, смещая иммунный ответ в проили противовоспалительную сторону. Основной функцией макрофагов является поглощение и уничтожение микробов, которая осуществляется благодаря наличию большого количество PRR. В первую очередь TLR. Ни на каких других клетках эти рецепторы не представлены так разнообразно, как на моноцитах и макрофагах. Это обеспечивает макрофагам и моноцитам возможность распознавать фактически все основные группы паттернов. Основные мембранные молекулы моноцитов представлены
в табл. 3.5. Механизм киллинга включает энзиматическую генерацию активных форм кислорода и азотистых соединений, которые токсичны для микробов, а также протеолитическое переваривание. Макрофаги также поглощают погибшие клетки собственного организма, включая нейтрофилы, аккумулированные в месте инфекции, и клетки, поврежденные в результате травмы или нарушения кровоснабжения. Макрофаги распознают и поглощают апоптотические клетки до высвобождения их содержимого, которое может вызвать воспалительный ответ. Важные функции макрофагов — синтез цитокинов и участие в репарации поврежденных тканей посредством стимуляции ангиогенеза и синтеза, богатого коллагеном экстрацеллюлярного матрикса. Макрофаги разделяют на два подтипа: M1-макрофаги, которые смещают ответ в сторону Th1-варианта из-за влияния IL12; и «альтернативно активированные» M2 — макрофаги, индуцируемые продукцией IL-4 и -13, которые промотируют Th2-тип ответа. Выделяют также «M2-подобные» макрофаги, которые активируются иммунными комплексами [49].
Как и на всех ядерных клетках организма, на поверхности макрофагов присутствуют MHC-I. При этом макрофаги относятся к АПК (вместе с B-лимфоцитами и ДК), и, соответственно, они экспрессируют MHC-II. Экспрессия молекул MHC-II усиливается при активации клеток. Презентация антигена является ключевым событием иммунного ответа, которое связывает реакции врожденного и адаптивного иммунитета. В ходе презентации молекула MHC распознается самим TCR и корецепторами — СD8 и СD4, обладающими сродством к молекулам MHC-I и MHC-II соответственно. Молекула CD4 в небольшом количестве экспрессирована на некоторых макрофагах, что делает их чувствительными к инфицированию вирусом иммунодефицита человека (ВИЧ), для которого молекула CD4 служит основным рецептором. Помимо презентации антигена для эффективной активации Т-клеток необходима их костимуляция. Она достигается при взаимодействии пар молекул АПК и Т-лимфоцита. Со стороны АПК (в том числе макрофага) в роли костимулирующих выступают молекулы CD80 и CD86. Спектр секретируемых факторов крайне широк: цитокины семейства IL-1 (IL-1β, -18, -1α)
идругие провоспалительные цитокины — TNF-α, IL-6, -12, -23, -27. Макрофаги продуцируют все 3 разновидности колониестимулирующих факторов (GM-CSF, G-CSF и M-CSF), IFN (IFN-α, -β
и-γ), противовоспалительные цитокины IL-10 и TGFβ, ростовые и ангиогенные факторы (фибробластный — FGF, тромбоцитарный — PDGF и сосудистый эндотелиальный — VEGF). Моноциты/ макрофаги образуют большую часть провоспалительных хемокинов: CXCL8 (IL-8), CCL5 (RANTES), макрофагальные воспалительные белки (ССL3, ССL4, ССL9, ССL10, ССL15, ССL18,
144
|
Механизмы защиты и регуляции иммунного ответа |
|
ССL23), макрофагальные хемотаксические белки |
щаются в лимфатические узлы, где осуществляют |
|
(ССL2, ССL7, ССL8, ССL12, ССL13) [3]. |
антигенпрезентацию наивным Т-клеткам антиге- |
|
Резидентные альвеолярные макрофаги способны |
на в комплексе с собственной молекулой гисто- |
|
мигрировать в просвет альвеол. Их основные функ- |
совместимости (без чего распознавание антигена |
|
ции состоят во взаимодействии с ингалируемыми |
Т-клетками невозможно). Решающим фактором в |
|
патогенами и частицами, очистке сурфактанта |
дальнейшей реакции иммунной системы является |
|
и подавлении развития нежелательного иммун- |
наличие PAMP, которые значительно повышают |
|
ного ответа. Некоторые возбудители (например, |
способность ДК к процессингу и презентации |
|
M. tuberculosis) резистентны к образованию фаго- |
антигена. Активация PRR, расположенных на по- |
|
лизосом макрофагами и остаются внутриклеточно |
верхности клеток или внутриклеточно, усилива- |
|
в течение всей жизни макрофага. Рекрутируемые |
ет экспрессию генов, обеспечивающих врожден- |
|
(воспалительные) макрофаги имеют выраженную |
ный иммунный ответ: CXCL хемокинов (CXCL1, |
|
провоспалительную защитную функцию, вклю- |
CXCL2, CXCL4, CXCL9, CXCL10 и CXCL11), |
|
чающую киллинг микробных клеток (в первую |
CCL хемокинов (CCL1, CCL2, CCL7), цитокинов |
|
очередь с помощью образования активных форм |
(TNF-α, IL-1β, TGFβ, IL-10), TLR (TLR2, TLR4, |
|
кислорода) и амплификацию воспалительного от- |
TLR9), факторов, обеспечивающих выживаемость |
|
вета путем продукции цитокинов, хемокинов и |
клеток (BCL2, cIAP1, cIAP2, BCL10), антими- |
|
липидных медиаторов [5]. |
кробных соединений (β-дефензины и кателици- |
|
ДК образуются из миелоидных или лимфо- |
дины). Эти изменения обеспечивают миграцию |
|
идных предшественников и являются одними из |
полиморфноядерных лейкоцитов и моноцитов в |
|
основных в реализации врожденного иммунного |
воздухоносные пространства, увеличивают про- |
|
ответа. Они также представляют собой важнейшее |
ницаемость эндотелия и эпителия для облегчения |
|
связующее звено между системами, врожденными |
миграции воспалительных клеток, повышается |
|
и приобретенными механизмами защиты. ДК экс- |
микробный киллинг. Активация TLR ДК индуци- |
|
прессируют больше различных типов TLR и ци- |
рует их экспрессировать костимулирующие моле- |
|
топлазматических рецепторов, чем любые другие |
кулы и цитокины, которые необходимы для диф- |
|
клетки, что делает их наиболее универсальными |
ференцировки наивных Т-клеток в эффекторные. |
|
сенсорами для PAMP и DAMP в организме. ДК |
Важнейший элемент, который обеспечивает саму |
|
формируют широкую субэпителиальную сеть на |
возможность дальнейшего адаптивного иммунно- |
|
протяжении всего респираторного тракта. |
го ответа, — антигенпрезентация, и основными |
|
Существуют два основных подтипа ДК: ми- |
клетками, которые ее осуществляют, являются |
|
елоидные и плазмоцитоидные. Миелоидные ДК |
именно ДК. В зависимости от природы фактора, |
|
располагаются в тканях и лимфоидных структурах |
который вызвал активацию врожденного иммуни- |
|
и являются профессиональными АПК, экспресси- |
тета, ДК направляют дифференцировку наивных |
|
рующими CD11c и MHC-II. По эффективности |
Т-клеток в направлении различных типов эффек- |
|
презентации антигена они значительно превос- |
торных клеток, таких как Th1-клетки, продуциру- |
|
ходят макрофаги, что обусловлено прежде всего |
ющие IFN-γ, или Th17-клетки, продуцирующие |
|
более высокой экспрессией на ДК MHC (особен- |
IL-17. Когда же ДК встречаются с аллергенами, |
|
но MHC-II), а также костимулирующих молекул. |
они вызывают экспансию Th2-эффекторных кле- |
|
Важно отметить, что только ДК способны активи- |
ток, которые продуцируют цитокины (IL-4, -5, |
|
ровать наивные Т-лимфоциты. Плазмоцитоидные |
-13), способствующих в дальнейшем продукции |
|
ДК (которые так названы из-за внешнего сход- |
IgЕ и развитию аллергической реакции немедлен- |
|
ства с плазматическими клетками — потомками |
ного типа. |
|
В-лимфоцитов, секретирующими АТ) преиму- |
Если PAMP отсутствуют, то каскадный ме- |
|
щественно располагаются в тканях. Учитывая, |
ханизм реакции развивается принципиально по |
|
что они в значительно меньшей степени экспрес- |
другому сценарию. ДК расценивают захватывае- |
|
сируют MHC-II, то и способность индуцировать |
мые антигены как безопасные для организма, ми- |
|
активацию Т-лимфоцитов ограничена. Роль плаз- |
грируют в регионарные лимфатические узлы, где |
|
моцитоидных ДК во врожденной иммунной за- |
индуцируют развитие толерантности CD4+ и CD8+ |
|
щите связана с тем, что они являются основным |
T-клеток, экспрессируя толерогенные рецепторы |
|
источником противовирусных цитокинов — IFN |
и растворимые медиаторы, которые воздействуют |
|
1-го типа (α, β, ω). Эта способность связана с тем, |
на наивные Т-лимфоциты, промотируя форми- |
|
что клетки экспрессируют значительное количе- |
рование регуляторных Т-клеток. При поступле- |
|
ство эндосомальных TLR (TLR 3, 7, 8, 9), которые |
нии с воздухом мелких частиц (диаметром менее |
|
распознают нуклеиновые кислоты вирусов, интер- |
5 микрон) они поступают в альвеолярный отдел, |
|
нализированных в клетку [49]. |
где фагоцитируются резидентными альвеоляр- |
|
ДК особенно широко представлены в трахее |
ными макрофагами. Этому способствует актив- |
|
и крупных воздухоносных путях, где происходит |
ность, например, сурфактантных протеинов A и |
|
контакт с поступившими с вдыхаемым воздухом |
D, которые являются PRR (как это было описано |
|
крупными частицами. После этого ДК переме- |
выше) и опсонизируют мишени, несущие PAMP, |
|
|
145 |
|
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/

Раздел 3
облегчая фагоцитоз таких частиц альвеолярными макрофагами и интрасептальными ДК, которые попадают в воздухоносные пути и перемещаются по мукоцилиарному эскалатору или мигрируют
врегионарные лимфатические узлы. При отсутствии PAMP альвеолярные макрофаги также осуществляют крайне важную функцию снижения воспалительного ответа и активности адаптивной части иммунной системы, SP-A и SP-В, которые не связались с PAMP, также снижают активность резидентных альвеолярных макрофагов. Таким образом, осуществляется предотвращение избыточного воспалительного ответа на безвредные ингалируемые вещества [3, 5].
Эозинофилы составляют небольшой процент от циркулирующих лейкоцитов. В крови они находятся меньше суток (от 30 мин до 18 ч), после чего мигрируют в ткани и пребывают там в течение 10–12 сут. Эти клетки поступают в воспалительный очаг в ответ на секрецию эотаксина-1 и RANTES. Их активация и выживание зависят от концентрации IL-5, GM-CSF и IL-3. Эозинофилы являются эффекторными клетками при аллергическом ответе и играют важную роль в противопаразитарной защите. Большинство белков эозинофилов повреждают клетки макропаразитов за счет активных белков, некоторые из которых (большой основный протеин, эозинофильный катионный протеин и эозинофильная пероксидаза) могут воздействовать и на нормальные клетки организма. Эозинофилам свойственна слабая фагоцитарная активность (ФА).
ТК и базофилы играют важную роль в IgEопосредованных реакциях гиперчувствительности немедленного типа. Выделяют два основных подтипа ТК — ТК соединительных тканей (находятся
вкоже, и их гранулы содержат триптазу и химазу) и мукозальный тип ТК, который содержит только триптазу. На своей поверхности ТК несут высокоаффинный рецептор к IgE (FcεR1). Связывание с этим рецептором приводит к высвобождению преформированных медиаторов, среди которых гистамин и синтез широкого спектра цитокинов (TNF-α, IL-3, -4, -5, -8, -10, -13 и MCP-1).
NK-клетки, несмотря на то, что они являются клетками лимфоидного ряда, рассматриваются как неотъемлемая часть врожденной иммунной системы (см. рис. 3.29). Являясь цитотоксическими лимфоцитами, они не распознают антиген, так как не имеют антигенраспознающего рецептора. NK-клетки, которые идентифицируют по наличию CD56 и CD16, осуществляют надзор, обнаруживая клетки, инфицированные вирусами. В этом случае активированные NK-клетки быстро вырабатывают большие количества IFN-γ, который ингибирует репликацию вируса. Кроме этого среди функций NK-клеток отмечается цитотоксическая активность в отношении измененных (трансформированных, инфицированных вирусами, подвергшихся действию стресса) клеток
организма. Пирофорен, гранзимы и гранулолизин — основные компоненты гранул NK-клеток, связанные с их цитолитической функцией. Их взаимодействие с АТ при реализации эффективных функций будет описано в части, посвященной адаптивному иммунитету. Они способны распознавать MHC-I в качестве маркера собственных клеток, который ограничивает их активность. При контактном цитолизе, занимающем 1–2 ч, происходит несколько этапов: распознавание естественным киллером клетки-мишени и формирование с ней контакта; активация естественных киллеров; программирование гибели клеток-мишеней; уничтожение клетки-мишени. В настоящее время NK-клеткам отводят важную роль в элиминации видоизмененных клеток, утративших признаки принадлежности данному организму (MHC-I) и приобретших новые признаки, сигнализирующие об опасности (стрессорные молекулы). В наибольшей степени такие изменения проявляются при опухолевой трансформации клеток и инфицировании их вирусами [3, 49].
Таким образом, ключевым элементом врожденной иммунной защиты легких служит распознавание PAMP. Ее эффективность зависит от скоординированного функционирования эпителия воздухоносных путей, играющего важную роль в удалении патогенов, образовании слизи и клеток иммунной системы, вырабатывающих антимикробные пептиды, цитокины, хемокины и липидные медиаторы в ответ на активацию PRR. Функционирование гуморальных и клеточных элементов врожденной защиты в норме приводит к опсонизации патогенов, их фагоцитозу и уничтожению с использованием различных механизмов. При этом осуществляется ограничение чрезмерного воспалительного ответа. ДК являются ключевыми АПК и при отсутствии PAMP обеспечивают толерантность к ингаляционным антигенам. При наличии же патоген-ассоциированных паттернов они участвуют в обеспечении дифференцировки Т-клеток в Th1, Th2, Th17 или Treg-эффекторные клетки, осуществляя связь между врожденными и адаптивными механизмами иммунной защиты [5].
Адаптивный иммунный ответ. Иммуноглобулины
Основным гуморальным компонентом адаптивного иммунного ответа являются АТ, вырабатываемые плазматическими клетками, дифференцирующимися из B2-лимфоцитов. Как уже отмечалось, клеточный и гуморальные компоненты тесно взаимосвязаны между собой, и эффективный иммунный ответ возможен только при согласованном действии всех компонентов адаптивного и врожденного иммунитета.
Иммуноглобулины представляют собой гликопротеины, которые существуют в виде мембранных рецепторов В-клеток или растворимых
146
|
|
|
|
|
Механизмы защиты и регуляции иммунного ответа |
молекул, секретируемых плазматическими клет- |
необходимо отличать от авидности АТ, которая |
||||
ками. Именно контакт антигена с BCR являет- |
описывает силу кооперативных аффинных вза- |
||||
ся одним из необходимых стимулов к активации |
имодействий при наличии высокомолекулярных |
||||
В-лимфоцитов и дифференцировке в плазматиче- |
антигенов, содержащих большое количество эпи- |
||||
ские клетки с продукцией АТ той же специфич- |
топов. Так, низкоаффинные молекулы IgM могут |
||||
ности, что и BCR. Растворимые АТ и мембран- |
реализовывать высокоавидные взаимодействия с |
||||
ные иммуноглобулиновые рецепторы различаются |
поливалентным антигеном, учитывая, что данное |
||||
только строением своей С-концевой части. |
АТ может связать до 10 эпитопов. Таким образом, |
||||
Мономерная молекула иммуноглобулина со- |
на авидность влияют аффинность АТ к антиге- |
||||
стоит из двух тяжелых (H-цепи) и двух легких |
ну, количество антигенсвязывающих центров в |
||||
цепей (L-цепи). Принципиальное строение IgG |
молекуле АТ и пространственной доступностью |
||||
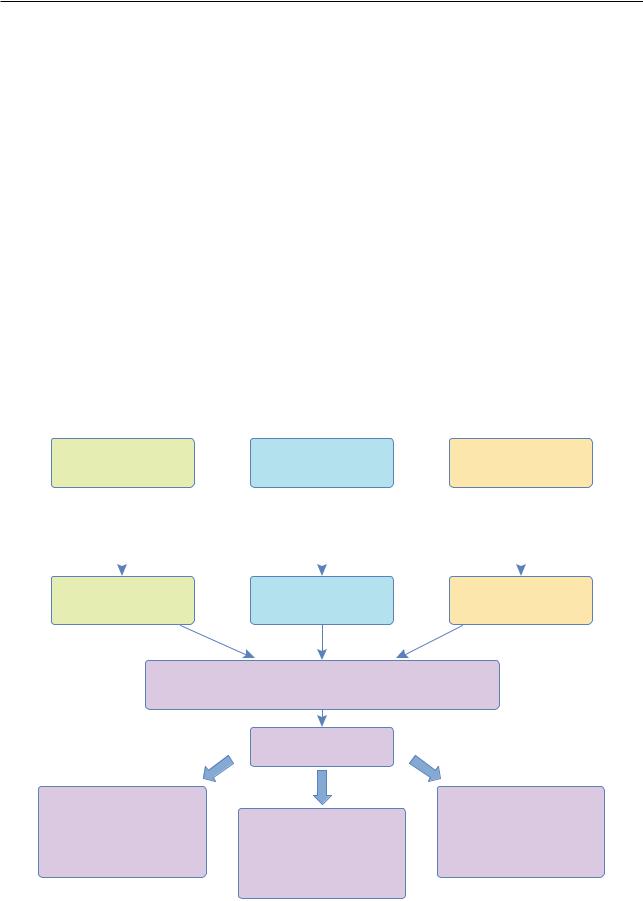
приведено на рис. 3.31. |
|
|
|
антигена для связывания. |
|
Как видно из рис. 3.31, легкие и тяжелые цепи |
С-домены (от constant) АТ имеют постоянную |
||||
соединены дисульфидными связями в единствен- |
структуру и обеспечивают активацию комплемента |
||||
ном месте недалеко от С-конца легкой цепи. |
и взаимодействие с Fc-рецепторами клеток, реа- |
||||
Легкие цепи содержат по 2, а тяжелые по 4–5 |
лизуя, таким образом, эффекторные функции АТ. |
||||
гомологичных сегментов (доменов), стабилизи- |
Выделяют пять основных классов АТ: IgM, |
||||
рованных дисульфидными связями. Важнейшую |
IgG, IgA, IgD и IgE. Данное разделение осущест- |
||||
роль в функционировании АТ играет N-концевой |
вляется по типу тяжелых цепей в составе имму- |
||||
домен, который участвует в распознавании анти- |
ноглобулина, при этом каждый иммуноглобулин |
||||
гена, формируя антигенсвязывающий участок из |
может содержать H-цепи только одного изотипа |
||||
вариабельных (variable) VH- и VL-доменов. Учи- |
(латинские буквы в названии иммуноглобулинов |
||||
тывая тот факт, что пары входящих в состав од- |
соответствуют греческим в обозначении изотипов |
||||
ного иммуноглобулина H- и L-цепей идентичны, |
Н-цепей — μ, γ, α, δ и ε). Иммуноглобулины всех |
||||
формируется два одинаковых антигенсвязываю- |
классов могут содержать также два типа L-це- |
||||
щих участка. В этой связи необходимо определить |
пей — κ- или λ, в соответствии с чем их относят |
||||
понятие «аффинность» АТ — силе связывания |
к К- или L-типам. У человека их соотношение |
||||
между одиночным антигенсвязывающим участком |
составляет 2:1 соответственно. Среди IgG у че- |
||||
и антигеном, что может рассматриваться как по- |
ловека выделяют 4 подкласса IgG1, IgG2, IgG3, |
||||
казатель специфичности АТ к данному эпитопу. |
IgG4 и 2 подкласса IgA — IgA1 и IgA2. Различия |
||||
Аффинность АТ в значительной мере меняется в |
этих подклассов также обусловлены особенностя- |
||||
ходе иммунного ответа, и при повторном попада- |
ми строения H-цепей. Основные свойства имму- |
||||
нии антигена в организм происходит очень суще- |
ноглобулинов суммированы в табл. 3.6. |
||||
ственный рост аффинитета IgG АТ. Этот термин |
IgM — это первые АТ, экспрессирующиеся |
||||
|
|
|
|
|
при дифференцировке B-клеток, что позволяет |
|
|
|
|
|
использовать повышение IgM как диагностиче- |
Тяжелая |
|
Антигенсвязывающий |
ский метод обнаружения недавнего контакта с |
||
цепь |
|
|
участок |
|
патогеном. Мономерная форма имеет достаточно |
|
|
|
|
|
|
|
|
|
|
|
низкую аффинность, причем она не возрастает в |
N |
|
|
VH |
N |
процессе иммунного ответа (отсутствует созрева- |
N |
Шарнирный |
N |
ние аффинитета). В молекуле IgM имеется пять |
||
|
участок |
|
|
субъединиц, которые соединены дисульфидными |
|
|
|
|
|
|
|
|
|
CH1 |
|
VL |
связями и J-цепью (рис. 3.32). Учитывая его раз- |
|
|
|
|
|
мер, IgM не проникает через плаценту. Пентамер |
Легкая |
|
|
CL |
|
IgM активирует систему комплемента и в меньшей |
|
|
|
степени обладает возможностью опсонизации и |
||
цепь |
C |
C |
|
Fab- |
|
|
|
фрагмент |
нейтрализации активных центров. |
||
Участки |
|
|
|
|
Иммуноглобулины D (IgD) в сыворотке присут- |
|
CH2 |
|
|
ствуют в крайне малых количествах вследствие |
|
связывания |
|
|
|
||
Fc-рецептора/ |
|
|
|
|
очень высокой чувствительности к протеолизу. |
комплемента |
|
|
|
|
IgD экспрессируется в составе BCR, роль в сыво- |
|
|
|
|
|
|
|
|
|
Fc- |
|
ротке не установлена. |
|
|
CH3 |
фрагмент |
IgA — преобладающий класс иммуноглобули- |
|
|
|
|
|
|
нов секретов слизистых оболочек респираторного |
|
|
|
|
|
тракта. В высоких концентрациях содержится в |
C-конец |
|
|
|
грудном молоке. Имеется два подкласса IgA1 и |
|
|
|
|
IgA2 в зависимости от особенностей строения |
||
|
C |
C |
|
|
|
|
|
|
|
|
H-цепи. Сывороточный IgA преимущественно мо- |
Рис. 3.31. Строение иммуноглобулина класса G. Пунктир- |
номер (более 90% представлено IgA1), в то время |
||||
ными линиями показаны участки дисульфидных связей |
как секреторный IgА представлен в основном IgA2 |
||||
147
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
Раздел 3
Таблица 3.6. Основные характеристики и свойства иммуноглобулинов [3, 4, 41, 49]
Характеристики |
IgM |
IgD |
IgG1 |
IgG2 |
IgG3 |
IgG4 |
IgA |
IgE |
|
иммуноглобулинов |
|||||||||
|
|
|
|
|
|
|
|
||
Концентрация в сыво- |
1,5 |
0,03 |
9 |
3 |
1 |
0,5 |
2,1 |
0,00005 |
|
ротке крови, мг/мл |
|
|
|
|
|
|
|
|
|
Молекулярная масса, |
970 |
184 |
146 |
146 |
170 |
146 |
160; |
188 |
|
кДа |
|
|
|
|
|
|
димер — |
|
|
|
|
|
|
|
|
|
300 |
|
|
Период полужизни в |
5–10 |
3 |
21 |
20 |
7 |
21 |
6 |
2 |
|
сыворотке, сут |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Тяжелая цепь, строе- |
μ |
δ |
γ1 |
γ2 |
γ3 |
γ4 |
α |
ε |
|
ние Ig |
пентамер |
мономер |
мономер |
мономер |
мономер |
мономер |
мономер |
мономер |
|
|
|
|
|
|
|
|
или димер |
|
|
Транспорт через пла- |
– |
– |
+++ |
+ |
++ |
+/– |
– |
– |
|
центу |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Транспорт через эпи- |
+ |
– |
– |
– |
– |
– |
+++ |
– |
|
телий |
|
|
|
|
|
|
(димер) |
|
|
Активация компле- |
+++ |
– |
++ |
+ |
+++ |
– |
+ |
– |
|
мента |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Нейтрализация |
+ |
– |
++ |
++ |
++ |
++ |
++ |
– |
Опсонизация |
+ |
– |
+++ |
При наличии |
++ |
+ |
+ |
– |
|
|
|
|
FC-рецеп- |
|
|
|
|
|
|
|
|
тора опре- |
|
|
|
|
|
|
|
|
деленного |
|
|
|
|
|
|
|
|
аллотипа |
|
|
|
|
в виде димера. Секреторный компонент служит для транспорта IgA в секреты слизистых оболочек. Секреторный IgA связывается с поверхностью патогенов, блокируя их адгезию на слизистых оболочках и подвижность. В меньшей степени IgA
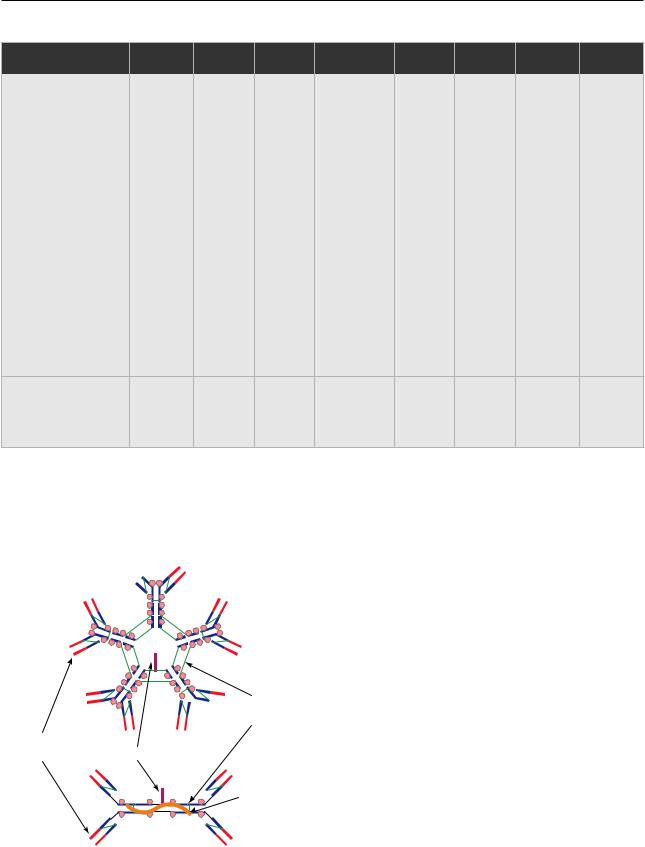
IgM 


 Дисульфидные связи
Дисульфидные связи
Вариабельные
домены J-цепь
Секреторный
компонент
Секреторный IgA
Рис. 3.32. Строение иммуноглобулина М и секреторного иммуноглобулина A [по 3 с изм.]. Синими линиями отмечены константные, красными — вариабельные домены, фиолетовыми — J-цепь, зелеными — дисульфидные связи. Розовые круги обозначают участки гликозилирования
способен к опсонизации и активации комплемента. Селективный дефицит IgA — это наиболее частый первичный иммунодефицит, имеющийся у 1 из 400–700 человек, при этом у большинства протекает бессимптомно.
IgE — содержание в сыворотке очень низкое, но значительно увеличивается при аллергической патологии, реакциях гиперчувствительности или паразитарных инвазиях. Переключение B-клеток на продукцию IgE индуцируется IL-4 и IL-13. IgE имеет высокую аффинность к FcεR1, который экспрессируется на тучных клетках, базофилах, клетках Лангерганса и таким образом может сохраняться в течение месяцев. Связывание аллергеном двух молекул IgE, фиксированных на тучных клетках или базофилах, приводит к выбросу провоспалительных медиаторов, формирующих картину немедленной гиперчувствительности.
IgG имеют самую высокую концентрацию в сыворотке и самую высокую продолжительность жизни среди всех АТ. Обладают высоким аффинитетом. Выделяют четыре подкласса IgG: IgG1, IgG2, IgG3 и IgG4, в зависимости от строения H-цепи. Эти подклассы отличаются по своим эффекторным свойствам: IgG1 и IgG3 эффективны в привлечении фагоцитов и киллерных клеток (эти иммуноглобулины распознаются Fcγ-рецеп- торами различных типов), а также в активации комплемента. IgG1, играющий важную роль при ответе на респираторные вирусы, составляет более половины всех АТ, образующихся при иммун-
148

Механизмы защиты и регуляции иммунного ответа
ном ответе. IgG3 наиболее эффективно активирует комплемент и активно участвует в первичном иммунном ответе на респираторные вирусы. Также IgG3 является основным подклассом иммуноглобулинов при ответе на Moraxella catarrhalis. Защитная активность IgG2- и IgG4-АТ выражена менее значительно в связи со слабым взаимодействием с Fcγ-рецепторами и рецепторами комплемента. Их роль состоит преимущественно в прямой нейтрализации патогенов. IgG2-АТ чаще всего индуцируются полисахаридными антигенами, такими как пневмококковые и менингококковые бактерии. IFN-γ индуцирует переключение на продукцию IgG2. Необходимо отметить, что IgG4 — это единственный подкласс IgG, который не активируют комплемент. Содержание данного подкласса АТ повышается после проведения аллергенспецифической иммунотерапии. Клиническое значение дефицита различных подклассов IgG остается противоречивым, но представляется, что при этом чаще развиваются различные респираторные инфекции. Недостаточность IgG2 — это наиболее часто встречаемый дефицит подклассов IgG иммуноглобулинов у детей, а IgG3 — у взрослых. У некоторых пациентов с дефицитом IgA выявляется также и недостаточность IgG2 и IgG4, что также может быть причиной предрасположенности данных пациентов к инфекционным заболеваниям.
Не вызывает сомнения важность АТ для реализации функции иммунной защиты организма, при этом зачастую нет полного понимания, каким именно образом наличие АТ против, например, стафилококка может способствовать элиминации возбудителя из организма, учитывая, что размер АТ в десятки раз меньше размера клетки-патогена. В этой связи необходимо описать основные функции АТ, которые можно объединить в три большие группы [3, 41].
1.Блокада активных центров патогенов и нейтрализация токсинов. Это происходит при соединении АТ с активным центром, отвечающим за реализацию той или иной функции патогена. Например, пространственная блокада функциональной группы токсина присоединившимся АТ приводит к дезинтоксикации. Именно на этом основана серотерапия и серопрофилактика дифтерии, бешенства и заболеваний, вызываемых анаэробами. Соединение блокирующих АТ с вирусами приводит к снижению инфицирования ими клеток. Нейтрализация антигенов является основной функцией АТ субклассов IgG2 и IgG4, которые слабо связывают комплемент и не взаимодействуют с Fc-рецепторами фагоцитов. Для IgA характерна способность блокировать участки патогенов, необходимые для передвижения или адгезии к эпителиальным поверхностям. Именно такой блокирующий эффект является одним из основных механизмов действия секреторных АТ.
2.Активация комплемента. Соединение АТ с антигенами на поверхности клеток-мишеней приводит к изменению конформации самих АТ, при которой становятся доступными
участки тяжелых цепей (CH2 и CH3) для связывания с C1q-компонентом комплемента. Далее происходит каскадная активация комплемента по классическому пути. Это приводит к опсонизации (облегчению фагоцитоза) вследствие распознавания фагоцитами с помощью С3-рецептора белков системы комплемента на поверхности клеток. Также реализуется прямое цитолитическое действие комплемента при формировании мембраноатакующего комплекса с участием С9-компонента с нарушением целостности клеточной стенки и последующей ее гибелью. Данный механизм характерен в большей степени для IgM, IgG1 и IgG3 АТ, так как они имеют высокое сродство их Fc-доменов к C1q комплемента. В меньшей степени этим свойством обладают IgG2. АТ могут активировать комплемент и по альтернативному пути, но это зависит от плотности расположения эпитопов и соотношения АТ/ антигенов.
3.Активация эффекторных клеток. АТ, связываясь с антигенами на поверхности клеток, могут и без участия комплемента осуществлять опсонизирующее действие. При этом происходит связывание Fc-рецепторов фагоцитов с участками в
доменах CH2 и CH3 тяжелых цепей иммуноглобулинов. Такой же механизм реализуется при элиминации растворимых иммунных комплексов макрофагами. Важен также феномен облегчения контактного цитолиза NK-клетками, что особенно важно, например, при соединении АТ с опухолевыми клетками. Каким же образом обеспечивается избирательность взаимодействия иммуноглобулинов с теми или иными эффекторными клетками? Дело в том, что на различных клетках располагаются разные типы Fc-рецепторов. Так, на моноцитах — преимущественно FcγRI-рецепторы (CD64), с которыми соединяются IgG1, IgG3 и в меньшей степени IgG4-АТ. Если на поверхности макрофагов имеется значительное количество связавшихся с Fc-рецепторами АТ одной специфичности, то такие армированные макрофаги получают возможность распознавать антиген с помощью фиксированных на поверхности АТ, несмотря на то что сами клетки не обладают такой способностью. На нейтрофилах, эозинофилах, макрофагах, NK-клетках, Т-клетках располагаются FcγRIII-рецепторы (CD16), с которыми соединяются преимущественно IgG1 и IgG3, реализуя механизм антителозависимой клеточно-опосредованной цитотоксичности. При связывании IgG с FcγR происходит активация ITAM (Immunoreceptor tyrosine-based activation motif — активационный
149
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
