
5 курс / Пульмонология и фтизиатрия / Бронхиальная_астма_и_хроническая_обструктивная
.pdfвключающих такие медиаторы бронхиальной астмы, как липидные, медиаторы хемокинеза, адгезивные молекулы, эозинофильные белки, которые являются возможными стимуляторами продукции АФК.
Кроме эндогенных источников АФК, существуют факторы окружающей среды, связанные с развитием бронхиальной астмы. Такие поллютанты как озон, диоксид азота, диоксид серы и др., которые также вызывают экстремальное повышение продукции АФК в дыхательных путях [146, 155], с запуском клеточных реакции через продукцию активных вторичных форм радикалов.
При бронхиальной астме отмечается повышенная выработка главного первичного радикала кислорода – супероксид аниона. В физиологических условиях митохондрии являются главным внутриклеточным источником супероксид аниона. Другим возможным источником его является система NADPH–оксидаз, находящихся в эозинофилах, моноцитах, макрофагах, нейтрофилах, которая запускается при активации этих клеток, что имеет место при БА [8, 107, 148, 230]. Эозинофилы обладают более высокой способностью к генерации супероксид аниона и перекиси водорода, чем нейтрофилы, что способствует более длительному и существенному повреждению, вызываемому ими. При недостаточности антиоксидантной защиты in vivo, серьезные повреждения, вызываемые супероксидом и перекисью водорода, обусловлены, во-первых, образованием гидроксильного радикала [140] и активных вторичных форм липидов, которые вызывают повреждение белков, нуклеиновых кислот, инактивацию ферментов, запуск цепной реакции ПОЛ [8]. А во-вторых, супероксид, связываясь с окисью азота, образует мощный оксидант и нитратный радикал – пероксинитрит [8], который также вызывает повреждение белков и липидов клеточных мембран, повреждает сосудистый эндотелий, увеличивает агрегацию тромбоцитов, участвует в процессах эндотоксемии [8, 87]. Путь образования токсичного пероксинитрита актуален для патогенеза БА, учитывая повышенную продукцию окиси азота.
Важную роль в оксидативном стрессе при бронхиальной астме играет монооксид азота (NO·), часто называемый просто окисью азота [198, 202]. Основной путь метаболизма окиси азота (NO·) – реакция, с гемопротеинами. Во-первых, многообразные клеточные эффекты NO· (расслабление гладких миоцитов и т.д.) запускаются при связывании окиси азота с гемсодержащим ферментом гуанилатциклазой. Во-вторых, NO· быстро реагирует с гемоглобином эритроцитов (HBO2), образуя метгемоглобин (Hb3+) и нитрит анион (NO2-), который быстро окисляется до нитрата (NO3-) [118]. При избыточной продукции NO· запускается реакция с супероксидом кислорода (O2•-) с формированием цитотоксичного оксинитрита (OONO•) [8]. Хотя OONO• является относительно стабильным соединением, он может превращаться в
50
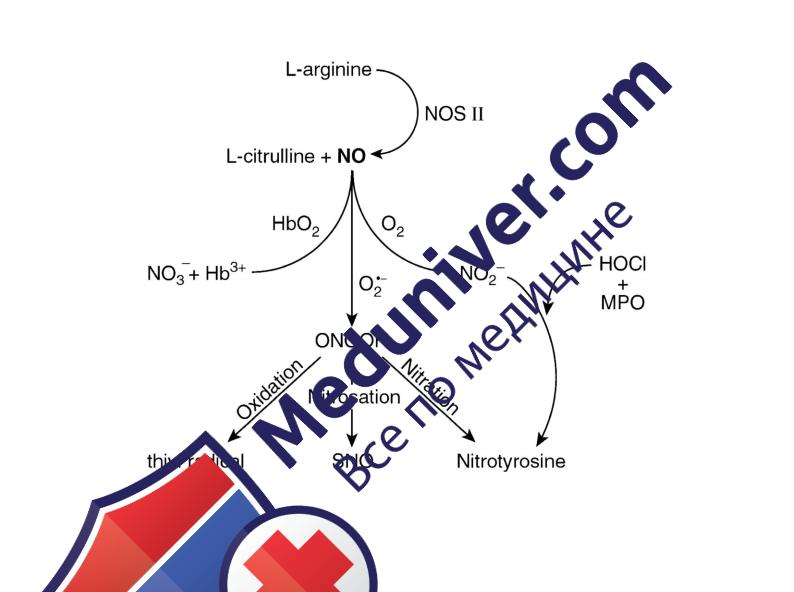
пероксиазотистую кислоту (ONOOH), которая затем разлагается до (NO3-) через промежуточное образование ОН• и NO2-подобных соединений (рис.11). Оба этих вещества – высокоактивные оксиданты [111], вызывающие повреждение тканей воспалительного характера [164].
Рис. 11. Синтез активных форм азота
Где, . NO·– оксид азота, NO3- – нитраты; NO2- – нитриты; HbO2 – оксигемоглобин; Hb3+ – метгемоглобин; ONOOH – пероксиазотистая кислота; МПО – миелопероксидазы, HOCl – хлорноватистая кислота; SNO
– S-нитрозотиолы; NOS II –синтазы II оксид азота.
Таким образом, все АФК и активные формы азота могут вызывать разрушение клетки, путем окисления и нитрирования аминокислотных остатков различных белков, отдельных нуклеотидов, дезоксирибонуклеиновых кислот и некоторых липидов биомембран, запуская процессы неконтролируемого ПОЛ [250].
Оксиданты не только повреждают молекулы (белки, липиды, нуклеиновые кислоты), но также опосредуют множество процессов, благоприятствующих развитию воспалительных изменений в легких: повреждают фибробласты, снижают активность сурфактанта, стимулируют
51
образование тромбоксана, повышают проницаемость эпителия, ухудшают функцию ресничек и т.д. [86], что отрицательно отражается на течении бронхиальной астмы.
В условиях активации ПОЛ в стенках бронхов отмечается нарастание биосинтеза тромбоксана и лейкотриенов, что повреждающе действует на систему мукоцилиарного транспорта и создает условия для застоя бронхиального секрета и обструкции просвета бронхов [79]. Усиление ПОЛ приводит к повреждению основного компонента микросомального окисления – цитохрома Р-450 и тем самым нарушает барьерную функцию бронхов, способствуя проникновению атопических антигенов из просвета бронхов в более глубокие слои их стенки. Это влечет за собой как неспецифическое – ирритативное, так и специфическое
– аллергическое повышение возбудимости рецепторных структур, тучных клеток с высвобождением медиаторов, участвующих в Са-зависимых механизмах бронхоконстрикции, отеке слизистой оболочки бронхов и гиперсекреции слизи.
Реакция бронхоконстрикции и гиперреактивности бронхов в ответ на действие различных оксидантов показана в различных экспериментах на животных in vivo и в тканях дыхательных путей человека in vitro [211]. Эти эксперименты подтверждают, что свободнорадикальные реакции запускают воспалительный и/или иммунологический клеточный ответ, через активацию вторичных посредников [125], играя важную роль в астматическом воспалении и ремоделировании дыхательных путей.
G.G.Xiao et al. [248] была представлена модель реакции клеток на оксидативный стресс, раскрывающая механизмы вовлечения в патологический процесс бронхиального дерева. В частности, протеомные исследования белков-маркеров оксидативного стресса показали, что под влиянием прооксидантов макрофаги и эпителиальные клетки демонстрируют три уровня проявления в системе оксидант-антиоксидант
(рис.12) [160].
Представленная иерархическая модель показывает, каким образом усиливается проявление в системе оксидант-антиоксидант от ее защитного (1 уровень) до повреждающего (3 уровень) эффектов. Так, на первом уровне ОС клетки отвечают увеличением экспрессии антиоксидантных ферментов и ферментов биотрансформации ксенобиотиков (СОД, GPx, CAT, GST, НАДФH-квиноноксидоредуктазы, гемоксигеназы-1) посредством транскрипционной активации ядерного регуляторного фактора 2. Активация этого пути защищает клетки от повреждающего и провоспалительного эффектов токсических веществ. На втором уровне при усилении оксидативного стресса происходит активация некоторых внутриклеточных сигнальных каскадов (в частности, трех главных митоген-активирующих протеинкиназных путей), приводящих к транскрипционной активации генов провоспалительных цитокинов, для
52

многих из которых вовлеченность в патогенез бронхиальной астмы уже доказана. Таким образом, усиливается продукция фактора TNF-α, IL-6, IL- 8, сосудистого эндотелиального ростового фактора и др., вызывающих воспаление дыхательных путей и потенцирующих иммунопатологические эффекты классических Th2-цитокинов (IL-4, IL-5 и IL-13), индукция которых может быть напрямую вызвана сочетанным воздействием токсикантов и аллергенов на эпителиальные клетки бронхиального дерева. Третий уровень оксидативного стресса вовлекает в патологический процесс митохондрии, вызывая их структурное повреждение и приводя к формированию супероксидных анионов, апоптозу и некрозу клеток.
О |
|
|
|
Митохондриальная |
К |
|
|
|
фумаратгидраза |
С |
|
|
|
Вольтаж- |
И |
|
|
|
|
|
|
Гранулоцитарно- |
зависимый |
|
Д |
|
|
||
|
Каталаза |
моноцитарный |
анионный канал 1 |
|
А |
|
|||
|
|
колонистимули- |
типа |
|
Т |
|
Супероксидисмутаза |
||
|
рующий фактор |
|
||
И |
|
Глутатионпероксида- |
FAS-ассоциирован- |
|
|
|
|||
В |
|
Глюкокортиокид- |
ный домен |
|
|
за |
|||
Н |
|
ный рецептор |
апоптоза |
|
|
Гемоксигеназа-1 |
|||
Ы |
|
TNF |
|
|
|
|
|
||
Й |
|
Глицеральдегид- |
|
|
|
IL-6, IL-8 |
|
||
|
|
фосфатдегидрогеназа |
|
|
|
|
|
|
|
С |
|
Металлопротеин |
|
|
Т |
|
|
|
|
|
|
|
|
|
Р |
|
|
|
3 уровень |
Е |
|
|
|
|
|
|
2 уровень |
|
|
С |
|
|
|
|
|
1 уровень |
|
|
|
С |
|
|
|
|
|
|
|
|
|
Норма |
Антиоксидантная |
Воспаление |
Цитотоксичность |
|
|
|
защита |
|
|
|
|
РЕАКЦИЯ КЛЕТОК |
|
|
Рис. 12. |
Иерархическая модель реакции клеток на окислительный стресс |
|||
Представленная модель окислительного стресса наглядно демонстрирует важнейшую защитную роль индукции ферментов антиоксидантной системы (в том числе и глутатионпероксидаз) в предупреждении деструктивно-воспалительных изменений дыхательных путей, занимающих важное место в патогенезе бронхиальной астмы [115, 204, 239].
Большинство методов оценки активности активных форм кислорода
53
и свободных радикалов при БА – косвенные. Поскольку реально оценить оксидативный стресс in vivo затруднительно [125], учитывая высокую реакционную способность СР и АФК [8]. Поэтому, измерения, касающиеся повышения концентрации окиси азота, перекиси водорода, пентана в выдыхаемом воздухе или дыхательном конденсате, анализ ПОЛ, основанный на конъюгации диенов, тиобарбитуровой кислоты или оценка окисляемости субстрата свободными радикалами, проводимыми in vivo, имеют низкую чувствительность и специфичность. Однако, используя эти методики, отмечена повышенная продукция АФК у взрослых и детей независимо от стадии бронхиальной астмы и тяжести ее течения [4].
Однако данные литературы о состоянии системы оксидантантиоксидант при бронхиальной астме противоречивы. Тем не менее многочисленные исследования подтверждают повышение продукции АФК
[92, 169, 238], АФА [136, 169], продуктов ПОЛ [85, 130, 169, 220] и общей оксидативной активности плазмы [55, 139, 169, 220] при бронхиальной астме.
Особенности содержания оксидантов, продуктов ПОЛ в зависимости от фазы заболевания
Большинство исследований оксидативного стресса при бронхиальной астме сосредоточены на изучении содержания оксидантов/антиоксидантов в период ремиссии. Гораздо меньше исследований, которые посвящены изучению состояния окислительновосстановительного статуса на фоне обострений.
В исследовании В.А. Жмурова и соавт. [18] выявлена зависимость содержания продуктов перекисного окисления липидов от фазы заболевания. Так, при атопической и инфекционно-зависимой БА (ИЗБА) в период обострения уровень первичных, промежуточных и конечных продуктов ПОЛ: ДК, ШО, МДА, на фоне накопления Н2О2 в альвеолярных макрофагах (АМ) повышался относительно контроля, тогда как в ремиссию их уровни достоверно снижались.
Повышение продуктов ПОЛ и оксидантов было выявлено и другими исследователями [77, 166, 170, 233, 239]. Так, В.Г. Чернуским и соавт. [77], в период обострения БА, помимо повышения уровня МДА в крови определено и повышение отношения индуцированной хемилюминесценции лейкоцитов к спонтанной, что свидетельствует о снижении антиперекисной активности. В фазе ремиссии обнаружено достоверное снижение показателей интенсивности базальной и стимулированной ХЛ (ПИХЛб, ПИХЛс, соответственно) лейкоцитов, коэффициента активности (Ка – отношение ПИХЛс/ПИХЛб), причем показатели ПИХЛб и Ка в фазе ремиссии выше, чем в группе контроля. В стадии ремиссии содержание МДА в плазме снижается, однако все же остается выше нормы. В то же время происходит незначительное увеличение отношения индуцированной ХЛ плазмы к спонтанной, что
54

свидетельствует об отсутствии существенных изменений антиперекисной активности плазмы в период ремиссии относительно таковой в период обострения заболевания.
У больных атопической БА в период обострения отмечен высокий уровень спонтанной и индуцированной ХЛ [51]. Есть сведения о снижении МДА в плазме больных БА по сравнению с контролем [245].
Ряд исследователей отмечает повышение уровня супероксида [92, 239]. Например, выявлено, что содержание супероксида в макрофагах [169], гранулоцитах [92] больных БА выше, чем в группе контроля.
Есть данные о повышении содержания оксидантов в период обострения заболевания как на системном, так и на местном уровнях. Так, в моче, плазме, мокроте, бронхоальвеолярном лаваже (БАЛ) и легочной ткани больных БА был определен повышенный уровень множества прямых и косвенных маркеров оксидативного стресса (в том числе МДА, тиобарбитуровой кислоты реактивных продуктов (TBARS) и H2O2) [104, 125, 157, 219]. При изучении состава выдыхаемых газов у больных БА выявлено повышение уровня перекиси водорода [129, 249] и уровня окиси азота [148, 169, 214, 249], увеличивающегося во время обострений астмы [122]. Кроме того, содержание некоторых косвенных маркеров окислительного стресса, таких как H2O2 и изопростана, повышено в выдыхаемом воздухе, мокроте и БАЛ не только при обострении БА, но и при экспозиции аллергена [219,177]. Так, I. Boldogh еt al. (2005 г.) было показано, что пыльца амброзии, как и пыльца деревьев, трав и других сорняков, которые вызывают сезонную бронхообструкцию, провоцируют образование повышенного количества супероксида, который в свою очередь превращается в перекись водорода и гидроксил-радикал. Последние активно взаимодействуют с липидами слизистой оболочки бронхов, приводя к повышению содержания продуктов ПОЛ, особенно МДА, которые синергичны с антигенами пыльцы, и еще больше усиливают бронхиальную обструкцию [224].
Особенности содержания оксидантов, продуктов ПОЛ в зависимости от степени тяжести БА
Отмечаются прямые корреляционные взаимосвязи между тяжестью заболевания и содержанием АФК при БА [85, 92, 169, 187, 233, 238].
Уровень маркеров оксидативного стресса, обнаруженных в моче, плазме, мокроте, БАЛ и легочной ткани больных бронхиальной астмой имел прямую связь с тяжестью заболевания и обратную – с уровнем контроля [104, 125, 157, 219]. В исследовании M.K. Narula et al. (2007)
наибольшие значения МДА в плазме крови и содержания железа было
определено при БА средней степени тяжести [233]. |
|
|
Установлено, что |
интенсивность свободнорадикальных процессов |
|
отражает тяжесть клинических проявлений бронхиальной |
астмы, а в |
|
динамике позволяет |
оценить эффективность лечения |
и глубину |
55
наступившей ремиссии [51]. Так, при легком течении заболевания полноте клинической ремиссии соответствуют нормальные показатели ХЛ. При тяжелом течении нестойкости клинического улучшения соответствуют достоверно высокие показатели СХЛ. Высокие значения активированной ХЛ, по-видимому, свидетельствуют о высокой готовности клеток к продукции свободных радикалов.
Также была выявлена связь между показателями перекисного окисления липидов и степенью бронхиальной обструкции.
Корреляционный анализ между показателями ПОЛ и степенью обструкции бронхов по данным спирографии свидетельствовал о существенном влиянии процессов ПОЛ в AM при атопической БА и ИЗБА на выраженность бронхообструктивного синдрома [18].
Выявлено снижение в мокроте содержания пероксинитрита, который обладает свойствами тормозить активность антиоксидантной системы при контролируемом течении БА. Причем выявлено, что его уровень имеет положительную связь с гиперреактивностью бронхиального дерева и отрицательную – с объемом форсированного выдоха за 1 секунду (ОФВ1) и содержанием эозинофилов в мокроте [117]. Тем не менее, достоверной прямой корреляции между ростом оксидантной нагрузки и изменениями легочной функции и/или воспалением дыхательных путей во время обострений не выявлено [219].
Сведения об общей антиоксидантной активности плазмы при бронхиальной астме также противоречивы, так одни исследователи находят повышение антиоксидантов плазмы [55], другие отмечают их снижение [130, 233].
В большинстве контролируемых исследований обнаружен дефицит антиоксидантов, указывающий на активацию антиоксидантной системы в ответ на повышение оксидантов и контакт с триггерами [104, 125, 157, 169, 219], повышение содержания пероксинитрита, тормозящего активность антиоксидантной системы [117].
Так, при изучении активности СОД в крови больных БА показатели варьируют от повышенных значений активности СОД [55, 169, 245], нормальных [187] до сниженных [18, 85, 130, 205, 240]. Возможно, такой разброс данных связан с разными методиками определения, отсутствием дифференцированного подхода к определению изоформ СОД, различной чувствительностью и специфичностью методов.
Показатели активности и уровня других антиоксидантов по данным различных исследований также имели отличия в зависимости от клиникопатогенетического варианта БА и периода патологического процесса.
Особенности содержания антиоксидантов в зависимости от фазы заболевания
Изменения показателей системы ПОЛ и системы антиоксидантной защиты (АОЗ) не всегда происходят параллельно [11]. Так, на начальных
56

стадиях болезни чаще наблюдали однонаправленное возрастание интенсивности ПОЛ и активности ферментов АОЗ, которое в дальнейшем характеризовалось нарушением однонаправленности данных процессов [11]. Отмечалась корреляция интенсивности липопероксидации с тяжестью бронхиальной астмы [11, 23].
При БА система АОЗ под влиянием хронического прооксидантного стресса набирает активность медленно. Активность ферментов АОЗ имела особенности в зависимости от фазы заболевания. В период обострения, а также, между приступами отмечается значительное снижение активности ферментов АОЗ, однако, при полной медикаментозной или спонтанной ремиссии заболевания многие авторы наблюдали неоднородную активность различных ферментов АОЗ [11, 18, 23, 50].
Так, определено: в период обострения при атопической БА снижение концентрации ферментных (СОД, GR, GPx) и неферментного (α- токоферол) антиоксидантов, при ИЗБА – снижение вышеперечисленных антиоксидантов и КАТ; в период ремиссии при атопической БА уровень антиоксидантов не отличался от контроля, а при ИЗБА значения антиоксидантов возросли, но были снижены относительно контроля [18]. Изменения показателей, характеризующих функционирование антиоксидантной защитной системы в AM (СОД, GT, GPx, КАТ, α- токоферол) при атопической БА и ИЗБА носят похожий характер: наиболее низкая активность всех антиоксидантов в периоде обострения заболевания наблюдалась как при ИЗБА, так и атопической БА. Однако у больных ИЗБА депрессия антиоксидантов, в отличие от атопической БА, была продолжительной и стойкой, на что указывало отсутствие существенной динамики этих показателей в периоде ремиссии заболевания. Учитывая полученные результаты, сделан вывод, что при атопической БА и ИЗБА в AM наблюдался значительный и стойкий дисбаланс в системе ПОЛ–антиоксиданты: интенсификация ПОЛ не сопровождалась достаточной активацией эндогенных антиоксидантов ферментного и неферментного действия, что приводило к повреждению мембранных структур и патогенетическим нарушениям в функционировании системы дыхания. Таким образом, для патогенеза бронхиальной астмы характерна интенсификация процессов ПОЛ в AM, сопровождающаяся неадекватной реакцией антиоксидантной защитной системы на свободнорадикальный стресс. По-видимому, на эти процессы оказывают влияние хроническая гипоксия и гипоксемия, которые развиваются у больных БА по мере нарастания бронхиальной обструкции на фоне аллергического и индуцированного инфекцией воспаления в бронхах и окружающей ткани.
Подобные изменения характерны и для содержания CuZn-СОД во время обострения [219] и снижение ее относительно контроля в фазу ремиссии на фоне приема иГКС. Например, заметное снижение в плазме
57
антиоксидантной мощности происходит во время обострений [13]. В ремиссию – CuZn-СОД активность ниже у стероидзависимых больных БА, чем у практически здоровых [116].
При проведении корреляционного анализа между содержанием α- токоферола и степенью обструкции при атопической БА и между активностью СОД в AM и степенью обструкции при ИЗБА получены отрицательные связи [18], что свидетельствует о значительном вкладе антиоксидантных защитных механизмов AM в предотвращение развития синдрома бронхиальной обструкции.
В ряде исследований выявлено повышение активности КАТ [55], GPx [55], ЦП [250], глутатиона [166, 169, 250], в других же – различий в сравнении с группой контроля активности КАТ [169], GPx [187] не выявлено. Однако многочисленными исследованиями подтверждена недостаточность антиоксидантной системы при бронхиальной астме [55, 111, 233] в виде снижения активности не только СОД, но и КАТ [85, 111, 130] и GPx [79, 130, 169, 220, 233]. Большинство исследователей находят снижение внутриклеточной активности СОД, КАТ и GPx, как при обострении, так и в ремиссию заболевания [70, 220], что, возможно, способствует хронизации процесса.
Возрастание активности ферментов, вероятно, носит компенсаторный характер и предназначено для устранения чрезмерного количества свободнорадикальных продуктов и их метаболитов.
Было выявлено помимо снижения уровня α-токоферола в плазме и повышения окисленного глутатиона в слюне корреляционные связи: прямая связь между содержанием α-токоферола и уровнем контроля над бронхиальной астмой, отрицательная между количеством окисленного глутатиона и показателями спирографии [208].
Данные о зависимости окислительно-восстановительного статуса от клинико-патогенетического варианта бронхиальной астмы
единичные и неполные. Поэтому эта сфера исследований нуждается в дальнейшем изучении.
Так у больных атопической бронхиальной астмой выявлена более высокая активность CuZn-СОД и не наблюдалось достоверных отличий в активности этого антиоксиданта по сравнению с больными аспириновой астмой [186]. Есть данные, что у больных атопической БА помимо повышенной продукции свободных радикалов, в период обострения наблюдается дефицит антиоксидантных ферментов: снижение активности СОД, GPx и GR. В ремиссию отмечена нормализация КАТ, GР, GPx и увеличение активности СОД [51].
Сравнение показателей ПОЛ и содержания Н2О2 в AM у больных атопической БА и ИЗБА показало, что выраженная интенсивность процессов пероксидации липидов характерна для обоих клиникопатогенетических вариантов БА, причем указанные изменения
58

характеризовались при ИЗБА более выраженной стойкостью и длительностью [18].
Немногочисленны работы по изучению влияния проводимой терапии на оксидант-антиоксидантный статус больных бронхиальной астмой. Известно, что антиастматический эффект ингаляционных глюкокортикостероидов (иГКС) и β2-агонистов опосредован взаимодействием глюкокортикостероидных рецепторов и провоспалительных транскрипционных факторов, в частности NF-kB и АР-1, которые являются редоксчувствительными [150].
Хотя ГКС не препятствуют образованию оксидантов эозинофилами in vitro [106], тем не менее, их вдыхание приводит к снижению уровня H2O2 в выдыхаемом конденсате у больных БА [177]. Кроме того лечение иГКС приводит к снижению дисбаланса в системе оксидант-антиоксидант в виде уменьшения уровня МЕТ, свободных радикалов и увеличения содержания СОД, КАТ [32, 173]. Лечение низкими дозами иГКС снижает общую концентрацию нитратов и нитритов, как в выдыхаемом конденсате воздуха, так и в мокроте при стабильном течении бронхиальной астмы [174]. Есть данные, что иГКС нормализуют активность CuZn-СОД в эпителиальных клетках бронхов [116].
Выявлена зависимость между показателями ОФВ1 и изменениями уровня супероксида на фоне приема иГКС. Так, у больных БА с ОФВ1 6080% от должных величин после приема иГКС обнаружено снижение уровня супероксида [92, 184], а при ОФВ1 60% – достоверных изменений показателей супероксида не выявлено [92, 147]. Другими же исследователями было показано повышение уровня окиси азота в выдыхаемом конденсате на фоне терапии системными ГКС, при этом увеличение уровня окиси азота сопровождалось увеличением ОФВ1 [136].
Данные о влиянии иГКС на состояние антиоксидантной системы крови неоднозначны. Исследования, проводимые отечественными и зарубежными авторами, не выявили существенного влияния иГКС на антиоксидантный статус больных [245], в том числе на фоне месячной терапии будесонидом [55, 137]. Другими авторами определено повышение уровня КАТ и снижение уровня глутатиона в эритроцитах у больных со среднетяжелой и тяжелой астмой на фоне терапии беклометазоном в течение 6 недель [111].
Выявлена достоверная разница между содержанием антиоксидантов и уровнем контроля при БА. Так, отмечено повышение содержания глутатиона в слюне больных БА относительно контроля, которое оказалось более выраженным при БА средней степени тяжести и плохо контролируемом течении БА. Не отмечено достоверной разницы в содержании глутатиона при контролируемой БА на фоне регулярного приема иГКС относительно контроля [166].
59
