
5 курс / Психиатрия и наркология для детей и взрослых (доп.) / Диагностика_и_лечение_психических_и_наркологических_расстройств
.pdfпоследовательный ряд специально отобранных, апробированных специализированных приложений, настроенных для выполнения конкретных клинико-диагно- стических задач [22–24].
МРТ волюметрия стала первым неинвазивным методом точной оценки объема внутричерепных структур in vivo [26]. Однако большинство методов количественного анализа объемных характеристик МРТ изображений даже сегодня основаны либо на сегментации вручную (то есть осуществляются исследователем путем обрисовки внешнего контура области интереса на каждом срезе), либо на полуавтоматической сегментации, которая также требует непосредственного участия исследователя.
Как ручные, так и полуавтоматические методы требуют больших временных затрат, поэтому являются слишком дорогими и неудобными для использования в клинической практике.
Очевидно, что для внедрения в клиническую практику необходимо иметь инструменты быстрого и надежного автоматического измерения объемов анатомических структур и патологических очагов.
Внастоящее время разработаны и продолжают совершенствоваться различные варианты программного обеспечения сегментации структур головного мозга
вполностью автоматическом режиме [20, 24].
Влитературных источниках сведения об унифицированных методиках, использующих комплексные последовательности различных алгоритмов и позволяющих проводить комплексное морфометрическое исследование анатомических структур и патологических очагов головного мозга у пациентов с неврологическими и психическими заболеваниями, достаточно скудны, а результаты зачастую противоречивы.
2.4. Методы автоматизированной постпроцессинговой обработки МРТ изображений, используемые в морфометрическом анализе
Сегментация здоровых тканей различных типов, а также патологических очагов, является основной частью постпроцессинговой обработки МРТ изображений головного мозга с целью их волюметрической оценки. Принцип сегментации заключается в разделении изображения на различные регионы в соответствии с интенсивностью МР сигнала, которая, в свою очередь, зависит от типа ткани. Выделенные регионы характеризуются общими свойствами и, как правило, связаны функциональными и анатомическими характеристиками. Разделение изображения на регионы осуществляется в соответствии с поставленной задачей. В одних случаях сегментация применяется в качестве последнего шага интерпретации исследования, например, для уточнения границ и объема патологического процесса. В других случаях она служит предварительным шагом для последующего анализа, например, при воксельной морфометрии структур мозга.
Предпочтительно использовать автоматическую сегментацию, т. к. ручные методы требуют значительных трудовых и временных затрат, характеризуются низкой воспроизводимостью [26, 39] и требуют высокой классификации иссле-
180
дователя. Однако для успешного проведения автоматической сегментации не обходимо преодолеть ряд технических ограничений, к которым относится сравнительно невысокое пространственное разрешение, низкая контрастность изображений, нечеткие границы между структурами, шум и артефакты в исходных данных [39].
2.4.1. Ограничения и артефакты сегментации
Причин появления артефактов много, это и следствия протекания биологических процессов — движения тела или жидкости, и технические артефакты [22, 23, 24]. Например, такие артефакты, как шум и эффекты частичного объема, возникают, когда несколько тканей попадают в один воксель. Чтобы компенсировать эти артефакты, в последнее время растет интерес к нестандартным методам сегментации, таким как FCM (Fuzzy C-means clustering algorithm), когда воксели могут быть определены с различной степенью принадлежности [21, 39].
Существует три основных вида технических ограничений, в значительной степени способных повлиять на точность сегментации:
••исходные изображения содержат шумы, влияющие на интенсивность сигнала отдельных вокселей и затрудняющие их классификацию;
••изображения имеют неоднородную интенсивность, которая заключается
втом, что уровень интенсивности сигнала одного класса ткани изменяется
вразных зонах изображения (при этом разница между уровнями сигнала от тканей разных классов для каждой такой зоны сохраняется);
••количество вокселей в изображении ограничено, что приводит к эффекту
частичного объема, когда в результате малого пространственного разрешения происходит наложение различных структур внутри одного вокселя.
Помимо технических ограничений на точность сегментации могут влиять различные артефакты изображения, вызванные, например, движением пациента во время исследования.
Также ключевым фактором для успешного выполнения процесса сегментации является исходная контрастность изображения. Тем не менее, известны различные подходы, позволяющие гибко настраивать параметры сегментации для успешного преодоления данных ограничений. К тому же методы автоматической сегментации изображений постоянно оптимизируются, так как представляют немалый интерес [26].
2.5. Основные методы морфометрии головного мозга
При изучении головного мозга основными диагностическими данными являются данные о состоянии серого вещества (GM), белого вещества (WM) и спинномозговой жидкости (CSF). Пример сегментации изображений представлен на рисунке 1.
Программные пакеты сегментации оснащены функциями, которые помимо вышеперечисленных тканей сегментируют головной мозг на отдельные структуры и их составляющие. Несовершенство программ для сегментации проявляется,
181
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
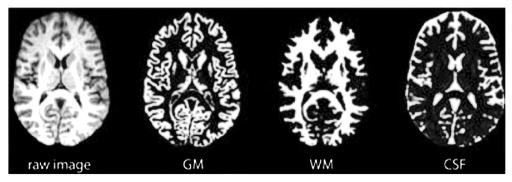
Рис. 1. Сегментация МР изображения на белое вещество (WM), серое вещество (GM) и спинномозговую жидкость (CSF)
прежде всего, в зависимости результатов постобработки от автоматизированного алгоритма и от качества исходных данных [20].
Существует множество различных подходов к сегментации данных, которые делятся на три типа: структурные, стохастические и смешанные методы. Кроме того, все методы сегментации изображений независимо от их типа можно условно разбить на три поколения, каждое из которых представляет новый уровень развития алгоритмов [39].
Структурные методы основаны на информации о структуре объекта и используются только для изображений высокого разрешения. Главное их достоинство — это возможность сегментации отдельной области интереса, а недостаток — зависимость от оператора, который должен выбрать исходные параметры.
Кструктурным методам относятся граничные и морфологические методы, модели активного контура, поток вектора градиента и другие. Стохастические методы базируются на математическом анализе данных и с их помощью возможна автоматическая обработка большого набора данных. К ним относят классификаторы, кластерный анализ, случайное поле Маркова и другие. В сравнении со структурными методами, стохастические выигрывают по удобству обработки МРТ данных. Но при этом опять невозможно полностью отказаться от «ручной» обработки, так как в большом количестве данных оператору приходиться самому находить данные, связанные с областью интереса. Для решения разных задач были разработаны смешанные подходы, которые соединяют в себе вышеописанные методы.
Кним можно отнести: искусственные нейронные сети, методы с опорой на анатомические атласы, наращивание области и другие [20, 39].
Первыми автоматическими нейроанатомическими вычислительными алгоритмами стали методы воксельной морфометрии (VBM) и деформационной морфометрии (DBM), в частности, тензорная морфометрия (TBM) [39].
Воксельная морфометрия основана на вычислении локальных различий ткани головного мозга после нивелирования выраженных различий в анатомическом строении и пространственном положении. Это достигается путем про-
182
странственной нормализации (регистрации) структурных изображений в единое стереотаксическое пространство, дальнейшей сегментации серого и белого вещества, выпрямления кортикальных борозд и извилин и статистического анализа для выявления различия между группами [39].
Морфометрический анализ мозга осложняется существенной вариабельностью размеров черепа и внутричерепных структур в популяции, что требует внедрения дополнительных процедур измерения размеров головы и их учета при сравнительном структурном и функциональном анализе данных, в частности, измерении региональных объемов и темпов развития общей атрофии. Показатели, которые обычно используют для этой цели, включают измерение полного внутричерепного пространства (ВЧП) на основе МРТ и КТ (Total Intracranial Volume — TIV, в некоторых источниках TICV и ICV). Таким образом, нормализация с учетом ВЧП увеличивает надежность морфометрических измерений, например, различий объема серого вещества в процессе старения [21].
2.6. Применение воксельной морфометрии при неврологических и психических заболеваниях
Магнитно-резонансная морфометрия — это изучение изменений объемов структур головного мозга, а также различий в составе его тканей посредством измерения их размеров. В настоящее время распространенность мануальных и полуавтоматических методов количественного анализа объемных характеристик МР-изображений достаточно велика. К недостаткам этих методов относятся затраты времени, зависимость от оператора и низкая воспроизводимость [20]. В связи с этим применение и усовершенствование методов автоматической сегментации представляется крайне актуальным. Единого метода морфометрии головного мозга не существует, поэтому для более точного анализа целесообразно совмещать методы постобработки в соответствии с задачами исследования [21]. Для получения данных об объеме мозга или его частей перед расчетом необходимо выделить зоны, представляющие интерес (ROI — region of interest) на исходных изображениях [21]. В традиционной морфометрии после выделения зон интереса объем всего головного мозга или его разделов измеряется с помощью расчета. Это занимает не только достаточное количество времени, но и в связи с тем, что малые различия в объеме не всегда могут быть учтены, приводит к неточным данным. Более точные показатели удается получить с помощью воксельбазированной морфометрии (VBM) [21].
Описание морфометрии на основе вокселей (VBM-voxel-based morphometry) впервые было опубликовано в 2000 году [39]. Вокселем называется элемент объема, представленный значением (в трехмерном пространстве), которое соответствует пикселю для данной толщины среза. Интенсивность сигнала вокселя пропорциональна интенсивности соответствующих пикселей МРТ [39]. В воксельбазированной морфометрии применяется статистический подход — соотнесение непараметрических данных. Ряд специальных операций обработки в каждом вокселе, предшествующих нахождению абсолютных значений объема, сводит
183
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
кминимуму риск получения недостоверных данных [1, 23]. Для воксельной морфометрии используются томографы с постоянным магнитным полем от 1,5 Т. Благодаря этому становятся хорошо видны объемы однородных тканей и повышается чувствительность к изменениям морфологии головного мозга. Одно из основных преимуществ VBM — возможность определять минимальные значения потери объемов структур головного мозга для конкретного больного, не прибегая
ксравнительному анализу анатомии общей популяции [39].
Уменьшение объема головного мозга, как проявление церебральной атрофии, является общей чертой многих неврологических и психических заболеваний [24]. Выделяют общую (тотальную) и регионарную (локальную) атрофию. Под общей атрофией понимают уменьшение объема мозговой паренхимы и увеличение объема ликворосодержащих полостей — субарахноидальных пространств и желудочков мозга. Уменьшение объема отдельных структур мозга называют регионарной атрофией [25].
2.6.1. Лучевая анатомия субполей и субрегионов гиппокампа
Гиппокамп (hippocampus) – часть переднего мозга, давно привлекающая внимание исследователей в связи с важной ролью, которую она играет в контроле различных форм поведения. Морфологически гиппокамп представлен стереотипно повторяющимися модулями, связанными между собой и с другими структурами [32–34]. Неоспорима роль гиппокампа в механизмах памяти, в частности, пространственной памяти, и контроле пространственного обучения. Исследования гиппокампа имеют большое прикладное значение, так как нарушением функционирования этой структуры сопровождаются такие заболевания как височная эпилепсия, болезнь Альцгеймера, шизофрения и т. д. [34, 40, 41].
Несмотря на длительный период изучения, особенности функционирования гиппокампа постоянно уточняются, и их трактовка часто является предметом дискуссии. Особенно это касается специфических особенностей его полей и суб регионов. В настоящее время имеются многочисленные доказательства функциональной гетерогенности, модульного строения гиппокампа вдоль его оси, от септального по темпорального полюса [31]. Многочисленные связи гиппокампа со структурами как лимбической системы, так и других отделов мозга определяют его многофункциональность [32].
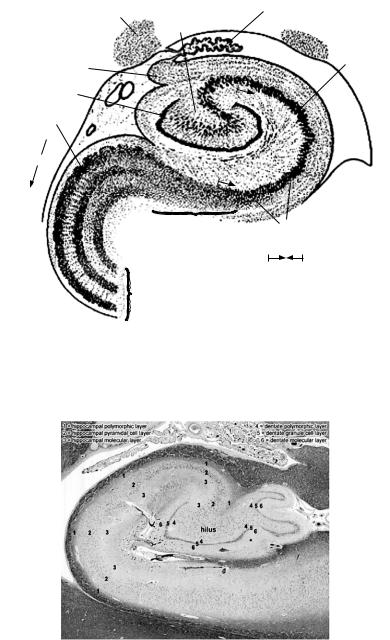
Гиппокамп входит в гиппокампальную формацию, включающую также зубчатую фасцию, субикулум, пресубикулум и энторинальную кору, и является ключевой структурой лимбической системы мозга. Собственно гиппокамп (или аммониев рог) представляет собой плотную ленту клеток, тянущуюся в переднезаднем направлении вдоль медиальной стенки нижнего рога бокового желудочка мозга (рис. 2). Основные нервные клетки гиппокампа представлены пирамидными нейронами и полиморфными клетками. Являясь древней корой, гиппокамп состоит из 3 основных слоев: полиморфного слоя (stratum oriens), слоя пирамидных нейронов (stratum pyramidale) и молекулярного слоя (stratum radiatum и stratum lacunosum moleculare) (рис. 3).
184
1 |
3 |
|
|
|
2 |
4
13
12
11  5
5
10
7 |
6 |
8
6
5
4 9
3
2
1
Рис. 2. Схема строения гиппокампа:
1 — Corpus geniculatum laterale, 2 — концевая пластинка аммониева рога, 3 — Plexus choroidus, 4 — плотная нейрональная пластинка аммониева рога, 5 — Corona inferior, 6 — рыхлая нейрональная полоска аммониева рога, 7 — Subiculum, 8 — Gyrus parahippocampalis, 9 — шестислойная кора обонятельного мозга, 10 — ствол мозга, 11 — Presubiculum, 12 — Gyrus dentatus, 13 — Fimbria hippocampi
Рис. 3. Морфологический разрез гиппокампа (цит. по: Гистология, эмбриология, цитология: учебник / Ю. И. Афанасьев, Н. А. Юрина,
Е. Ф. Котовский и др. 6 е изд., перераб. и доп. М.: ГЭОТАР-Медиа, 2016. 800 с.: ил.)
Слой, лежащий на вентрикулярной поверхности гиппокампа (alveus), состоит в основном из идущих в горизонтальном направлении миелинизированных аксонов пирамидных нейронов гиппокампа. Базальные дендриты и начальные
185
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
сегменты аксонов находятся в полиморфном слое. Далее следует слой пирамидных нейронов, а затем stratum radiatum, содержащий стволы апикальных дендритов и stratum lacunosum moleculare, где располагаются претерминальные и терминальные ветвления апикальных дендритов. Четкая организация цитоархитектоники гиппокампа сохраняется на всем его фронтокаудальном протяжении, что позволяет говорить о его ламинарной организации [16] (рис. 3).
Особенности цитоархитектоники пирамидного слоя гиппокампа послужили основанием для его деления на 4 основных поля, ориентированных в медиолатеральном направлении и обозначаемые как СА1–СА4. Основными полями собственно гиппокампа считаются поля СА1 и СА3. Поле СА1 отличается небольшими, плотно расположенными в 2 слоя пирамидными нейронами, клетки этого слоя в СА3 области имеют очень крупные размеры, расположены не так плотно. Аксоны пирамидных нейронов СА3 дают так называемые коллатерали Шаффера, контактирующие с апикальными дендритами пирамид СА1. Эти связи являются двумя основными ассоциативными путями гиппокампа, соединяющими воедино его основные элементы. Таким образом, гиппокамп можно представить как набор последовательных морфофункциональных сегментов, которые могут функционировать относительно независимо. СА3 поле Бродмана является точкой конвергенции потоков информации от ассоциативной коры и филогенетически древних образований ствола мозга.
2.6.2. Программное обеспечение для автоматизированной сегментации субполей и субрегионов гиппокампа
Для автоматизированной сегментации субполей и субрегионов гиппокампа применяется программный пакет FreeSurfer 6.0. Начиная с версии 6.0 появился дополнительный модуль, обеспечивающий данную функцию.
FreeSurfer — это программный пакет инструментов для автоматизированной реконструкции и анализа структур ГМ. С помощью FreeSurfer можно производить сегментацию белого вещества и серого вещества (кортикального и субкортикального), анализировать различные ткани методом проекции индивидуальных изображений ГМ на сферическую поверхность стандартного размера. Программа FreeSurfer также используется для получения статистических данных о толщине, площади и объеме любой анатомической области ГМ. Кроме алгоритмов реконструкции поверхности, FreeSurfer имеет автоматизированный алгоритм сегментации внутренних анатомических структур. Этот сложный алгоритм базируется на методе объединения информации из разных источников: интенсивности МР-изображения, вероятностного расположения тканей (на основе анатомического атласа) и данных о локальном пространственном расположении структур [24, 36]. Сегментация программы FreeSurfer основана как на субъектно-независи- мом вероятностном атласе, так и на конкретных значениях. Атлас построен из учебного набора объектов ГМ (поверхности или тома), которые были помечены вручную. Эти метки затем отображаются в общее пространство (пространство MNI305 для объемов и сферическое пространство для поверхностей) для дости-
186
жения двухточечного соответствия для всех предметов. «Точка» является вокселем в объеме или вершиной на поверхности. В каждой точке пространства существует метка, которая была назначена каждому субъекту и измеренное значение для каждого объекта. Затем в каждой точке вычисляются три типа вероятностей. Во-первых, вычисляется вероятность того, что точка принадлежит каждому из классов меток. Второй тип вероятности вычисляется из пространственной конфигурации меток, которые существуют в обучающем наборе, который называется функцией окрестности. Функция окрестности — это вероятность того, что данная точка принадлежит метке, заданной классификацией соседних к ней точек. В-третьих, функция распределения вероятности (PDF) измеренного значения оценивается отдельно для каждой метки в каждой точке. Для маркировки на основе объема измеренное значение представляет собой интенсивность в данном вокселе. PDF моделируется как нормальное распределение, поэтому нужно только оценить среднее и дисперсию для каждой метки в каждой точке пространства. Из результатов научных исследований известно, что этот процесс статистически идентичен процедуре оценки «вручную», а также мало чувствителен к изменениям параметров поглощения [39].
1 |
|
|
|
||||
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
• • |
• • |
|||
|
|
|
|
|
• • |
|
|
|
|
|
|||
|
|
|
|
• |
||
|
|
|
|
|
||
|
• ! |
|
|
• |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
Рис. 4. Схема работы программного пакета FreeSurfer
2.6.3. Воксель-базированная морфометрия гиппокампа, его субполей и субрегионов при депрессии, болезни Альцгеймера, возрастном старении
Гиппокамп является наиболее изученной областью головного мозга при аффективных и когнитивных расстройствах. Однозначного мнения о нормальных
187
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
объемах гиппокампа и амигдалы не существует, однако многое авторы сходятся
вданных об уменьшении объемов структур лимбической системы у больных депрессией. Но и эти данные неоднозначны и различаются в мужской и женской популяции, в разных возрастных категориях. Так, в исследованиях ряда авторов, уменьшение объема гиппокампа определялось наиболее часто у пациентов с депрессией [3, 10], хотя некоторые авторы не нашли объемных различий у пациентов с депрессивным расстройством и контрольной группой здоровых лиц [13], другие же в своих работах, наоборот, отмечали тенденцию к увеличению объема этой области при депрессии.
Для уточнения этого положения мы сравнили наличие вариантов строения гиппокампа у здоровых добровольцев и пациентов с депрессиями. Наиболее часто встречающийся вариант с наличием ключевого критерия в виде неполной инверсии гиппокампа в виде изолированно округлой формы и в сочетании округ лой формы с глубокой вертикальной коллатеральной щелью был выявлен у 17,8% здоровых добровольцев и 20% пациентов с депрессией. В нашем исследовании различия в объемах гиппокампа у пациентов с депрессией по сравнению со здоровыми добровольцами также не было выявлено.
Уменьшенный объем гиппокампа обнаруживался у пациентов, перенесших множественные депрессивные эпизоды, в сравнении с пациентами, находящимися в ремиссии или после манифестации заболевания [10]. Таким образом, уменьшение объема гиппокампа может иметь связь с повторными эпизодами развития депрессии [7], и рядом исследователей была обнаружена отрицательная корреляция между объемом гиппокампа и продолжительностью болезни, тяжестью симптомов депрессии [4].
Изменения в гиппокампальной области также зависят от половой принадлежности. T. Frodl et al. (2002) обнаружили тенденцию к увеличению размера гиппокампа у женщин с первым эпизодом депрессии и уменьшение объема у мужчин
всравнении со здоровой контрольной группой. Ранее было обнаружено, что размер гиппокампа уменьшается с возрастом у мужчин больше, чем у женщин, и мужчины в норме имеют больший объем гиппокампа [7]. Эти данные совпадают и с нашими результатами. При обследовании здоровых добровольцев в возрасте от 18 до 54 лет мы также выявили больший размер гиппокампа у мужчин
всравнении с объемом гиппокампа у женщин, что, вероятно, обусловлено гормональными влияниями. В литературе высказывается предположение, что у мужчин депрессия может ускорять нормальное, связанное с естественным старением, уменьшение объема гиппокампа, в то время как у женщин оно может быть обусловлено другими механизмами.
Следует отметить, что в работе T. Frodl et al. (2002) средний возраст первого приступа заболевания ~40 лет, что не позволяет делать выводы о структурных изменениях в гиппокампе при депрессии в популяции в целом, учитывая значимые отличия патофизиологии позднего и раннего начала заболевания [5, 10]. Медикаментозная терапия, по всей видимости, также оказывает влияние на изменения в объеме гиппокампа. Эти результаты показывают, что антидепрессанты,
188
вероятно, могут оказывать протективный эффект в отношении уменьшения объема гиппокампа у женщин-респондеров [14]. К сожалению, проследить влияние терапии в данном исследовании нам не удалось, т. к. все пациенты получали антидепрессанты. Таким образом, сегодня представляется, что течение заболевания (длительность, рецидивирование), половая принадлежность, лекарственная терапия влияют на изменение объема гиппокампа.
При проведении воксельной морфометрии головного мозга в программе постобработки FreeSurfer здоровым добровольцам в возрастной группе 18–50 лет значимой корреляции объемов гиппокампов с возрастом выявлено не было. Но при этом имеется значимая разница объемов гиппокампов по гендерному признаку: у мужчин и правый и левый гиппокамп значительно больше, чем у женщин, с очень высокой достоверностью [11].
Различные варианты строения встречались в 43,5% случаев в следующем соотношении: асимметрия хориоидальных щелей 7,9%; глубокая вертикальная коллатеральная щель — 8,9%; асимметрия полюсов височных рогов боковых желудочков 8,9%; округлая форма гиппокампа — 8,9% (9) изолированно; сочетание округлой формы гиппокампа и глубокой вертикально расположенной коллатеральной щели 8,9% [21].
На следующем этапе проводилось сравнение изменений субполей и субрегионов гиппокампа при разных заболеваниях [21, 24]. Нами было выявлено достоверное уменьшение объема молекулярного слоя гиппокампа и молекулярного слоя дентальной фасции гиппокампальной формации, а также СА3 поля Бродмана у пациентов на ранней стадии болезни Альцгеймера (БА), сосудистой деменции (СД) и депрессии в сравнении со здоровыми добровольцами, что указывает на то, что уже на ранней стадии заболевания в основном страдают субполя гиппокампа, ответственные за координацию его деятельности и распределение потоков информации, поступающих от других структур головного мозга. При этом более выраженные изменения этих субполей выявлялись в правом гиппокампе при депрессии и в левом — при сосудистой деменции в сравнении со здоровыми добровольцами [18, 21].
В результате проведения сравнительного анализа полных отсегментированных объемов гиппокампа в целом и отдельных его субполей были получены статистически значимые различия.
Наибольшие различия в объемах субполей и субрегионов гиппокампов у пациентов на ранней стадии болезни Альцгеймера были выявлены в СА3 поле Бродмана, молекулярных слоях гиппокампа и зубчатой фасции. Для группы пациентов с сосудистой деменцией отличия наиболее выражены в объемах хвоста гиппокампа, молекулярного слоя зубчатой фасции и СА3 поля. Для группы пациентов с депрессией наибольшие отличия в молекулярном слое зубчатой фасции, СА3 поле и фимбрии.
Детальное сравнение групп между собой показало, что у пациентов на ранней стадии БА по сравнению со здоровыми добровольцами были выявлены достоверно значимые различия по объемам гиппокампов в целом (21%), молекулярному слою гиппокампов (22%), молекулярному слою зубчатой фасции (22%) и СА3
189
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
