
5 курс / Госпитальная педиатрия / РЛС_Доктор_Неврология_и_психиатрия,_2015
.pdf
|
|
|
|
|
Зонегран® |
289 |
|||||
|
• пациенты с высоким риском разви+ |
||||||||||
|
тия нефролитиаза (см. «Особые |
||||||||||
|
указания»); |
|
|
|
|
|
|
||||
|
• пациенты с печеночной недоста+ |
||||||||||
|
точностью легкой и умеренной сте+ |
||||||||||
|
пени тяжести (вследствие ограни+ |
||||||||||
|
ченного клинического опыта, мо+ |
||||||||||
|
жет потребоваться более медлен+ |
||||||||||
|
ный подбор дозы препарата — см. |
||||||||||
|
«Способ применения и дозы»); |
|
|||||||||
|
• одновременное |
применение |
|
у |
|||||||
|
взрослых с ингибиторами карбоан+ |
||||||||||
|
гидразы, такими как топирамат и |
||||||||||
|
ацетазоламид |
(недостаточно |
дан+ |
||||||||
|
ных, чтобы исключить фармакоди+ |
||||||||||
|
намическое взаимодействие); |
|
|
||||||||
|
• одновременное |
применение |
|
у |
|||||||
|
взрослых |
|
с |
пирогенными |
|
ЛС, |
|||||
|
включая ингибиторы карбоангид+ |
||||||||||
|
разы и ЛС с антихолинергическим |
||||||||||
|
действием; |
|
|
|
|
|
|
|
|||
препарата для данной категории |
• начало лечения, его отмена или из+ |
||||||||||
менение дозы зонисамида при од+ |
|||||||||||
пациентов недостаточно); |
новременном |
применении |
с |
суб+ |
|||||||
• беременность и период грудного |
стратами Р+гликопротеина (напри+ |
||||||||||
вскармливания (данных по безо+ |
мер, дигоксин, хинидин); |
|
|
|
|||||||
пасности препарата для данной ка+ |
• пациенты с массой тела <20 кг |
||||||||||
тегории пациентов недостаточно |
(клинический |
опыт |
применения |
||||||||
(см. «Применение при беременно+ |
ограничен). |
|
|
|
|
|
|
||||
сти и кормлении грудью»); |
ПРИМЕНЕНИЕ |
ПРИ |
БЕРЕМЕН1 |
||||||||
• детский возраст до 6 лет (данных |
|||||||||||
НОСТИ И КОРМЛЕНИИ ГРУДЬЮ. |
|||||||||||
по безопасности и эффективности |
Женщины с сохраненным детородным |
||||||||||
препарата для данной категории |
потенциалом должны применять на+ |
||||||||||
пациентов недостаточно). |
дежные методы контрацепции во вре+ |
||||||||||
• одновременное применение у де+ |
мя лечения препаратом Зонегран® |
|
и на |
||||||||
тей с ингибиторами карбоангидра+ |
протяжении 1 мес после его отмены. |
||||||||||
зы, такими как топирамат и ацета+ |
Нет достаточных данных о примене+ |
||||||||||
золамид. |
нии препарата Зонегран® у беремен+ |
||||||||||
С осторожностью |
ных женщин. Исследования на жи+ |
||||||||||
вотных показали, что зонисамид по+ |
|||||||||||
• пациенты пожилого возраста (не+ |
|||||||||||
тенциально |
обладает |
репродуктив+ |
|||||||||
обходимо проявлять осторожность |
ной токсичностью, риск возникнове+ |
||||||||||
при назначении препарата из+за ог+ |
ния которой у людей неизвестен. |
|
|
||||||||
раниченности имеющегося опыта; |
Зонегран |
® |
не следует применять во |
||||||||
• пациенты с почечной недостаточ+ |
|
||||||||||
время беременности, за исключением |
|||||||||||
ностью (вследствие ограниченного |
тех случаев, |
когда |
потенциальные |
||||||||
клинического опыта, может потре+ |
преимущества, по мнению врача, пре+ |
||||||||||
боваться более медленный подбор |
обладают над возможным риском для |
||||||||||
дозы препарата — см. «Способ при+ |
плода. Если женщина планирует бе+ |
||||||||||
менения и дозы»); |
ременность, |
следует проанализиро+ |
|||||||||

290 |
Зонегран® |
|
Глава 2 |
вать необходимость |
противосудо+ |
кормления грудью или об отмене пре+ |
|
рожной терапии. В случае назначе+ |
парата у кормящих матерей. Вследст+ |
||
ния препарата Зонегран® рекоменду+ |
вие длительного периода полувыве+ |
||
ется тщательное наблюдение. |
дения, грудное вскармливание может |
||
Риск возникновения врожденных по+ |
быть возобновлено не ранее чем через |
||
роков развития у детей, чьи матери |
месяц после отмены препарата. |
||
принимают противоэпилептические |
СПОСОБ ПРИМЕНЕНИЯ И ДОЗЫ. |
||
препараты, возрастает в 2–3 раза. |
Внутрь, запивая водой, вне зависимо+ |
||
Чаще всего выявляются следующие |
сти от приема пищи. |
||
пороки: расщепление верхней губы, |
Взрослые пациенты |
||
аномалии развития ССС и дефекты |
Зонегран® может назначаться взрос+ |
||
нервной |
трубки. Комбинированная |
лым в виде монотерапии, и в качестве |
|
терапия |
противосудорожными пре+ |
дополнения к уже назначенному ле+ |
|
паратами сопровождается повыше+ |
чению. Доза препарата подбирается с |
||
нием риска развития врожденных по+ |
учетом лечебного эффекта. Рекомен+ |
||
роков в сравнении с монотерапией. |
дуемый режим повышения доз и ве+ |
||
Недопустима резкая отмена противо+ |
личина поддерживающих доз приве+ |
||
судорожной терапии из+за риска раз+ |
дены в таблице 1. Некоторые пациен+ |
||
вития эпилептического приступа, ко+ |
ты, в частности те, которые не прини+ |
||
торый может привести к серьезным |
мают препараты, индуцирующие ци+ |
||
последствиям, как для матери, так и |
тохром CYP3A4, могут реагировать |
||
для ребенка. |
|
на меньшие дозы. |
|
Препарат выделяется с грудным мо+ |
Отмена |
||
локом в концентрациях аналогичных |
Отмену препарата Зонегран® произво+ |
||
таковым в плазме, поэтому следует |
дят постепенно путем снижения дозы |
||
принять |
решение о |
прекращении |
на 100 мг в неделю при одновременной |
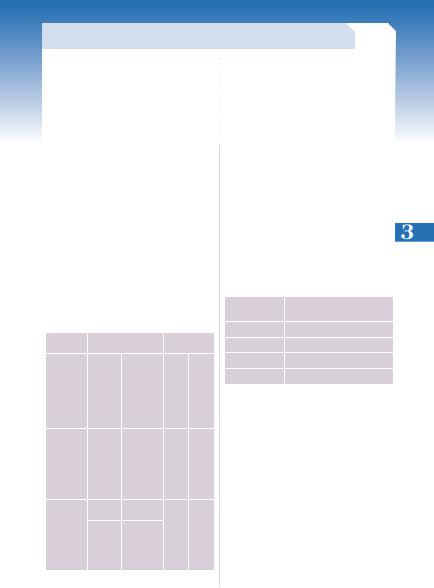
Таблица 1
Рекомендованный режим повышения дозы и величина поддерживающих доз у взрослых
Схема лечения |
|
Подбор дозы |
Поддерживающая доза |
|
Монотерапия |
Неделя 1–2 я |
Неделя 3–4 я |
Неделя 5–6 я |
|
взрослые с впервые ди |
100 мг/сут (од |
200 мг/сут |
300 мг/сут (одно |
300 мг/сут (однократный при |
агностированной эпи |
нократный |
(однократ |
кратный прием) |
ем). Если требуются более |
лепсией |
прием) |
ный прием) |
|
высокие дозы: увеличение на |
|
|
|
|
100 мг с 2 недельным интер |
|
|
|
|
валом до максимальной реко |
|
|
|
|
мендованной дозы 500 мг |
Дополнительная тера |
Неделя 1 я |
Неделя 2 я |
Неделя 3–5 я |
от 300 до 500 мг/сут (одно |
пия |
|
|
|
кратно или в 2 приема) |
пациенты, принимаю |
50 мг/сут (в 2 |
100 мг/сут (в |
увеличение на |
|
щие препараты, инду |
приема) |
2 приема) |
100 мг с недель |
|
цирующие изофермент |
|
|
ными интервала |
|
CYP3A4; |
|
|
ми |
|
пациенты, не прини |
Неделя 1–2 я |
Неделя 3–4 я |
Неделя 5–10 я |
от 300 до 500 мг/сут (одно |
мающие препараты, ин |
50 мг/сут (в 2 |
100 мг/сут (в |
увеличение не бо |
кратно или в 2 приема), неко |
дуцирующие изофер |
торые пациенты могут реаги |
|||
мент CYP3A4 или паци |
приема) |
2 приема) |
лее чем на 100 мг |
ровать на более низкие дозы |
енты с почечной или |
|
|
с 2 недельными |
|
|
|
интервалами |
|
|
печеночной недостаточ |
|
|
|
|
|
|
|
|
|
ностью |
|
|
|
|
|
|
|
|
|
|
|
|
|
Зонегран® |
291 |
|||||
коррекции |
дозы |
других |
совместно |
менять дозу по мере изменения массы тела до дости |
|||||||||||
принимаемых ПЭП (при необходимо+ |
жения 55 кг. Дозовый режим составляет 6–8 мг/кг/сут |
||||||||||||||
до максимальной суточной дозы 500 мг. |
|
||||||||||||||
сти — см. «Особые указания»). |
|
|
|||||||||||||
|
Безопасность и эффективность пре+ |
||||||||||||||
Подростки и дети с 6 лет |
|
|
|||||||||||||
|
|
парата Зонегран |
® |
у детей в возрасте |
|||||||||||
Зонегран® |
может назначаться детям с |
младше 6 лет или детей с массой тела |
|||||||||||||
6 лет в качестве дополнения к уже на+ |
менее 20 кг не установлены. |
|
|||||||||||||
значенному лечению. Доза препарата |
В клинических исследованиях полу+ |
||||||||||||||
подбирается с учетом клинического |
чены ограниченные данные у пациен+ |
||||||||||||||
эффекта. Рекомендуемый режим по+ |
тов с массой тела менее 20 кг. В связи с |
||||||||||||||
вышения дозы и величина поддержи+ |
этим у детей в возрасте 6 лет и старше |
||||||||||||||
вающих доз приведены в таблице 2. |
с массой тела менее 20 кг при лечении |
||||||||||||||
Некоторые пациенты, в частности те, |
следует соблюдать осторожность. |
||||||||||||||
которые |
не принимают |
препараты, |
Отмена |
|
|
|
|
|
|
|
|||||
индуцирующие изофермент CYP3A4, |
Отмену препарата Зонегран® произ+ |
||||||||||||||
могут отвечать на меньшие дозы. |
водят |
постепенно |
путем |
снижения |
|||||||||||
Следуетобращатьвниманиедетейиих |
дозы на 2 мг/кг/нед (в соответствии с |
||||||||||||||
родителей или лиц, осуществляющих |
рекомендациями, |
|
приведенными в |
||||||||||||
уход на особые указания для пациента |
таблице 3). |
|
|
|
|
|
|
|
|||||||
по мерам предотвращения теплового |
|
|
|
|
|
|
|
Таблица 3 |
|||||||
удара (см. «Особые указания»). |
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
Таблица 2 |
Рекомендованная схема снижения |
||||||||||
Рекомендованный режим |
|
|
дозы у детей с 6 лет |
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
||||||
|
повышения дозы |
|
Масса тела |
Снижение дозы с недельными |
|||||||||||
и величина поддерживающих |
|||||||||||||||
|
|
|
|
|
интервалами на*: |
|
|||||||||
доз у детей с 6 лет |
|
20–28 кг |
|
|
|
от 25 до 50 мг/сут |
|
||||||||
|
|
|
|
|
|
|
|
|
|
||||||
Схема ле |
|
Подбор дозы |
Поддержива |
29–41 кг |
|
|
|
от 50 до 75 мг/сут |
|
||||||
чения |
|
|
|
ющая доза |
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||
Дополните |
|
Неделя |
Неделя |
Паци |
Паци |
42–55 кг |
|
|
|
100 мг/сут |
|
||||
льная тера |
|
1 я |
2–8 я |
енты с енты с |
более 55 кг |
|
|
|
100 мг/сут |
|
|||||
пия |
|
|
|
мас |
мас |
|
|
|
|
||||||
|
|
|
|
сой |
сой |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
тела |
тела |
* при однократном приеме. |
|
|
|
|
|
||||
|
|
|
|
от 20 |
более |
Применение |
у пациентов |
пожилого |
|||||||
|
|
|
|
до 55 |
55 кг |
возраста |
|
|
|
|
|
|
|
||
|
|
|
|
кг* |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
Необходимо |
проявлять |
осторож+ |
||||||||
пациенты, |
1 мг/кг |
увеличение |
от 6 |
от 300 |
|||||||||||
ность |
при |
назначении |
препарата |
||||||||||||
принимаю |
/сут (од на 1 мг/кг с |
до 8 |
до 500 |
||||||||||||
из+за |
ограниченности |
имеющегося |
|||||||||||||
щие препа |
нократ |
недельны |
мг/кг/ |
мг/сут |
|||||||||||
раты, инду |
но) |
ми интер |
сут |
(одно |
опыта. Следует учитывать профиль |
||||||||||
цирующие |
|
|
валами |
(одно |
крат |
безопасности препарата (см. «Побоч+ |
|||||||||
изофер |
|
|
|
крат |
но) |
ное действие»). |
|
|
|
|
|
|
|||
мент |
|
|
|
но) |
|
|
|
|
|
|
|
||||
|
|
|
|
Применение у пациентов с почечной |
|||||||||||
CYP3A4; |
|
|
|
|
|
||||||||||
пациенты, |
|
Неделя |
Неделя 3 я |
от 6 |
от 300 |
недостаточностью. |
Необходимо |
||||||||
|
проявлять осторожность |
при |
лече+ |
||||||||||||
не прини |
|
1–2 я |
и далее |
до 8 |
до 500 |
||||||||||
мающие |
1 |
увеличение |
мг/кг/ |
мг/сут |
нии пациентов с почечной недоста+ |
||||||||||
препараты, |
сут |
(одно |
точностью вследствие ограниченного |
||||||||||||
мг/кг/сут |
на 1 мг/кг с |
||||||||||||||
индуцирую |
(одно |
2 недель |
(одно |
крат |
клинического опыта — может потре+ |
||||||||||
щие изо |
кратно) |
ными ин |
крат |
но) |
боваться более |
медленный подбор |
|||||||||
фермент |
но) |
|
|||||||||||||
CYP3A4 |
|
|
тервалами |
|
|
дозы препарата. Так как зонисамид и |
|||||||||
|
|
|
|
|
|||||||||||
* Для обеспечения сохранения поддерживающей дозы, |
его метаболиты выводятся почками, |
||||||||||||||
необходимо контролировать массу тела ребенка и из |
его следует отменить у пациентов, у |
||||||||||||||

292 |
Зонегран® |
|
|
|
|
|
|
|
|
|
|
Глава 2 |
|
которых развилась острая почечная |
рексия. Наиболее частыми нежелате+ |
||||||||||||
недостаточность, или |
наблюдается |
льными реакциями в рандомизиро+ |
|||||||||||
клинически значимая |
гиперкреати+ |
ванном контролируемом исследова+ |
|||||||||||
нинемия. |
|
нии |
монотерапии |
зонисамидом |
в |
||||||||
У пациентов с почечной недостаточ+ |
сравнении с карбамазепином пролон+ |
||||||||||||
ностью почечный клиренс однократ+ |
гированного высвобождения в груп+ |
||||||||||||
ных доз зонисамида прямо пропорци+ |
пе пациентов, |
получавших |
зониса+ |
||||||||||
онален Cl креатинина. AUC зониса+ |
мид, были снижение уровня бикарбо+ |
||||||||||||
мида повышена на 35 % у пациентов с |
натов, потеря аппетита и снижение |
||||||||||||
тяжелой почечной недостаточностью |
массы тела. Частота |
значительного |
|||||||||||
(Cl креатинина <20 мл/мин). |
снижения уровня бикарбонатов в сы+ |
||||||||||||
Применение у пациентов с печеночной |
воротке (снижение до уровня менее |
||||||||||||
недостаточностью |
|
17 мЭкв/л и более 5 мЭкв/л) состав+ |
|||||||||||
|
ляла |
|
3,8%. |
Частота |
значительного |
||||||||
Применение препарата у пациентов |
|
||||||||||||
с печеночной недостаточностью не |
снижения массы тела на 20% и более |
||||||||||||
изучалось. Применение у пациентов |
составляла 0,7%. |
|
|
|
|
|
|||||||
с тяжелой печеночной недостаточно+ |
Частота |
возникновения |
определя+ |
||||||||||
стью не рекомендуется. Необходимо |
лась как очень часто (≥1/10); часто |
||||||||||||
проявлять осторожность при лече+ |
(≥1/100 |
<1/10); нечасто |
(≥1/1000 |
||||||||||
нии пациентов с печеночной недо+ |
<1/100) и очень редко (<1/10000, |
||||||||||||
статочностью легкой |
и умеренной |
включая отдельные отчеты). |
|
|
|||||||||
степени тяжести — может потребова+ |
Описаны единичные случаи внезап+ |
||||||||||||
ться более медленный подбор дозы |
ной необъяснимой смерти пациентов |
||||||||||||
препарата. |
|
с эпилепсией, |
принимавших Зонег+ |
||||||||||
ПОБОЧНЫЕ ДЕЙСТВИЯ. Побоч+ |
ран® (SUDEP). |
|
|
|
|
|
|
||||||
ные реакции на фоне приема препара+ |
Дополнительная информация по безо. |
||||||||||||
та Зонегран®, выявленные в ходе кли+ |
пасности в особых группах пациентов |
||||||||||||
нических исследований (более чем на |
Пациенты пожилого возраста. Свод+ |
||||||||||||
1200 пациентов, 400 из которых полу+ |
ный анализ данных по безопасности у |
||||||||||||
чали Зонегран® на протяжении не ме+ |
95 пациентов пожилого возраста по+ |
||||||||||||
нее 1 года) и постмаркетинговых на+ |
казал относительно более высокую |
||||||||||||
блюдений (в Японии с 1989 г, в США |
частоту |
развития |
периферического |
||||||||||
с 2000 г.) приведены в таблице. |
отека и зуда в сравнении с более мо+ |
||||||||||||
Зонегран® содержит |
сульфонамид+ |
лодыми пациентами. |
|
|
|
|
|||||||
ную группу. К серьезным побочным |
Обзор постмаркетинговых данных по |
||||||||||||
реакциям со стороны иммунной сис+ |
переносимости терапии препаратом |
||||||||||||
темы, связанных с приемом препара+ |
Зонегран® |
у пожилых пациентов |
|||||||||||
тов, |
которые содержат сульфона+ |
(старше 65 лет) позволяет предполо+ |
|||||||||||
мидную группу, относятся появле+ |
жить, что у данной категории пациен+ |
||||||||||||
ние кожной сыпи и других аллерги+ |
тов |
развитие |
синдрома |
|
Стивен+ |
||||||||
ческих реакций, а также развитие |
са+Джонсона и реакция лекарствен+ |
||||||||||||
выраженных гематологических на+ |
ной гиперчувствительности выявля+ |
||||||||||||
рушений, в т. ч. апластической ане+ |
ются чаще, чем в общей популяции. |
|
|||||||||||
мии, в очень редких случаях приво+ |
Пациенты детского возраста. Про+ |
||||||||||||
дящей к летальному исходу (см. |
филь |
|
безопасности |
зонисамида |
у |
||||||||
«Особые указания»). |
|
детей, |
|
участвовавших |
в |
плаце+ |
|||||||
Наиболее частыми нежелательными |
бо+контролируемых |
клинических |
|||||||||||
реакциями в контролируемых иссле+ |
исследованиях (в возрасте от 6 до |
||||||||||||
дованиях комплексной терапии были |
17 лет), соответствует профилю бе+ |
||||||||||||
сонливость, головокружение и ано+ |
зопасности препарата у взрослых. |
||||||||||||

|
|
|
|
Зонегран® |
293 |
|
|
|
|
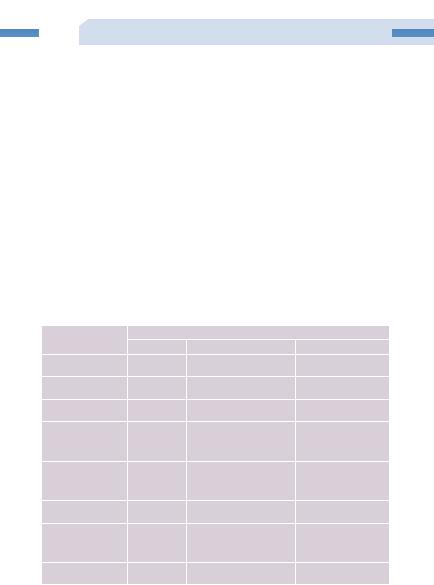
Таблица 4 |
|
Побочные реакции, выявленные в ходе клинических исследований |
|||||
комплексной терапии и постмаркетинговых наблюдений |
|
||||
Системы органов |
|
|
Частота |
|
|
|
Очень часто |
Часто |
Нечасто |
Очень редко |
|
Инфекционные и |
|
|
Пневмония, |
|
|
паразитарные за |
|
|
урогенитальные |
|
|
болевания |
|
|
инфекции |
|
|
Со стороны крови и |
|
Экхимоз |
|
Агранулоцитоз, апластиче |
|
лимфатической |
|
|
|
ская анемия, лейкоцитоз, |
|
системы |
|
|
|
лейкопения, лимфаденопа |
|
|
|
|
|
тия, панцитопения, тромбо |
|
|
|
|
|
цитопения |
|
Со стороны им |
|
Реакции гипер |
|
|
|
мунной системы |
|
чувствительно |
|
|
|
|
|
сти |
|
|
|
Нарушения обмена |
Анорексия* |
|
Гипокалиемия |
Метаболический ацидоз, ту |
|
веществ и питания |
|
|
|
булярный почечный ацидоз |
|
Нарушения психи |
Возбуждение,/ |
Неустойчивость, |
Гнев, агрессия, |
Галлюцинации |
|
ки |
раздражитель |
тревога, бессон |
суицидальные |
|
|
|
ность*, спутан |
ница, психотиче |
мысли и попыт |
|
|
|
ность сознания*, |
ское расстрой |
ки |
|
|
|
депрессия* |
ство |
|
|
|
Со стороны нерв |
Атаксия*, голово |
Брадифрения, |
Судороги |
Амнезия, кома, большие эпи |
|
ной системы |
кружение,* сни |
нарушение вни |
|
лептические приступы, миа |
|
|
жение памяти*, |
мания, нистагм*, |
|
стенический синдром, злока |
|
|
сонливость* |
парестезия, на |
|
чественный нейролептиче |
|
|
|
рушение речи*, |
|
ский синдром, эпилептиче |
|
|
|
тремор |
|
ский статус |
|
Со стороны органа |
Диплопия |
|
|
|
|
зрения |
|
|
|
|
|
Со стороны дыха |
|
|
|
Одышка, аспирационная |
|
тельной системы, |
|
|
|
пневмония, нарушение дыха |
|
органов грудной |
|
|
|
ния, реакции гиперчувстви |
|
клетки и средосте |
|
|
|
тельности по типу пневмони |
|
ния |
|
|
|
та |
|
Со стороны ЖКТ |
|
Боль в животе, |
Рвота |
Панкреатит |
|
|
|
запор, диарея, |
|
|
|
|
|
диспепсия, тош |
|
|
|
|
|
нота |
|
|
|
Со стороны печени |
|
|
Холецистит, хо |
Гепатоцеллюлярные повреж |
|
и желчевыводящих |
|
|
лелитиаз |
дения |
|
путей |
|
|
|
|
|
Со стороны кожи и |
|
Сыпь, зуд* |
|
Ангидроз, мультиформная |
|
подкожных тканей |
|
|
|
эритема, синдром Стивен |
|
|
|
|
|
са Джонсона, токсический |
|
|
|
|
|
эпидермальный некролиз |
|
Со стороны мы |
|
|
|
Рабдомиолиз |
|
шечно скелетной и |
|
|
|
|
|
соединительной |
|
|
|
|
|
ткани |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
294 |
Зонегран® |
|
|
Глава 2 |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Системы органов |
|
|
Частота |
|
|
|
|
|
|
|
|
|||
|
|
|
Очень часто |
Часто |
Нечасто |
Очень редко |
|
|
|
|
|
||||
|
Со стороны почек и |
|
Нефролитиаз |
Уролитиаз |
Гидронефроз, почечная не |
|
|
|
|
|
|||||
|
мочевыводящих |
|
|
|
достаточность, нарушения |
|
|
|
путей |
|
|
|
|
состава мочи |
|
|
|
|
|
|
|
||
|
Общие расстрой |
|
Повышенная |
|
|
|
|
|
|
|
|
|
|||
|
ства и нарушения в |
|
утомляемость, |
|
|
|
|
|
месте введения |
|
гриппоподобные |
|
|
|
|
|
|
|
|
состояния, по |
|
|
|
|
|
|
|
вышение темпе |
|
|
|
|
|
|
|
ратуры тела, пе |
|
|
|
|
|
|
|
риферический |
|
|
|
|
|
|
|
отек |
|
|
|
|
Лабораторные и |
Снижение уровня |
Снижение веса |
|
Повышенный уровень КФК, |
|
|
|
инструментальные |
бикарбоната |
|
|
повышение урвня креатини |
|
|
|
данные |
|
|
|
|
на, повышение уровня моче |
|
|
|
|
|
|
|
вины, нарушение биохимиче |
|
|
|
|
|
|
|
ских показателей печени |
|
|
Травмы, интоксика |
|
|
|
Тепловой удар |
|
|
|
ции и осложнения |
|
|
|
|
|
|
|
манипуляций |
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 5 |
|
Побочные реакции, выявленные в рандомизированном контролируемом исследовании монотерапии зонисамидом в сравнении с карбамазепином пролонгированного высвобождения
Системы органов |
Частота |
|
Очень часто |
Часто |
Нечасто |
Инфекционные и пара |
|
Урогенитальные инфекции, |
зитарные заболевания |
|
пневмония |
Со стороны крови и лим |
|
Лейкопения, тромбоцито |
фатической системы |
|
пения |
Нарушения обмена ве |
Снижение аппетита |
Гипокалиемия |
ществ и питания |
|
|
Нарушения психики |
Возбуждение, депрессия, бес |
Спутанность сознания, ост |
|
сонница, эмоциональная ла |
рый психоз, агрессивность, |
|
бильность, тревожность |
суицидальные мысли, гал |
|
|
люцинации |
Со стороны нервной сис |
Атаксия, головокружение, сни |
Нистагм, нарушение речи, |
темы |
жение памяти, сонливость, бра |
тремор, судороги |
|
дифрения, нарушение внима |
|
|
ния, парестезии |
|
Со стороны |
Диплопия |
|
органа зрения |
|
|
Со стороны дыхательной |
|
Нарушение дыхания |
системы, органов груд |
|
|
ной клетки и средосте |
|
|
ния |
|
|
Со стороны ЖКТ |
Запор, диарея, диспепсия, тош |
Боль в животе |
|
нота, рвота |
|

|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Зонегран® |
|
295 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Системы органов |
|
Частота |
|
|
|
|
|
|
|
|
|
|
||
|
|
Очень часто |
Часто |
Нечасто |
|
|
|
|
|
|
|
||||
|
Со стороны печени и |
|
|
Острый холецистит |
|
|
|
|
|
|
|
|
|||
|
желчевыводящих путей |
|
|
|
|
|
|
|
Со стороны кожи и под |
|
Сыпь, |
Зуд, экхимоз |
|
|
|
|
|
|
|
||||
|
кожных тканей |
|
|
|
|
|
|
|
Общие расстройства и |
|
Повышенная утомляемость, по |
|
|
|
|
|
|
|
|
|
|
||
|
нарушения в месте вве |
|
вышение температуры тела, |
|
|
|
|
|
дения |
|
раздражительность |
|
|
|
|
|
Лабораторные и инстру |
Снижение уров |
Снижение веса, повышение |
Нарушение анализа мочи |
|
||
|
ментальные данные |
ня бикарбонатов |
уровня КФК, повышение уровня |
|
|
|
|
|
|
|
АЛТ, повышение уровня АСТ |
|
|
|
|
Из 465 пациентов, включенных в базу данных по безопасности у де+ тей (в т.ч. 67 пациентов, продолжав+ ших участие в открытой фазе про+ долженного контролируемого кли+ нического исследования) леталь+ ный исход наступил у 7 детей (1,5%; 14,6/1000 пациенто+лет): в 2 случа+ ях в результате эпилептического статуса, из которых один был связан со значительным снижением массы тела (на 10% в течение 3 мес) у паци+ ента с низкой массой тела, с после+ дующей отменой препарата; в 1 слу+ чае в результате ЧМТ/гематомы и в 4 случаях летальные исходы прои+ зошли у пациентов с предшествую+ щим функциональным неврологи+ ческим дефицитом различного гене+ за (2 случая сепсиса, связанного с пневмонией/полиорганной недо+ статочностью, 1 случай SUDEP и 1 случай ЧМТ). В общей сложности из 70,4% пациентов, которые в конт+ ролируемом исследовании или в от+ крытой фазе продолжения этого ис+ следования получали зонисамид, во время терапии по меньшей мере од+ нократно определялся уровень би+ карбонатов менее 22 ммоль/л. Низ+ кий уровень бикарбонатов сохра+ нялся в течение длительного перио+ да времени (медиана — 188 дней).
В сводном анализе данных по безо+ пасности, полученных у 420 детей (183 в возрасте от 6 до 11 лет и 237 в возрасте от 12 до 16 лет, у которых
средняя продолжительность приема препарата составляла примерно 12 мес), было установлено относитель+ но более частое поступление сооб+ щений о возникновении пневмонии, дегидратации, снижения потоотде+ ления, нарушение биохимических показателей функции печени, сред+ него отита, фарингита, синусита и инфекций верхних дыхательных пу+ тей, кашля, носового кровотечения и ринита, боли в животе, рвоты, сыпи и экземы, а также лихорадки по сравнению со взрослыми пациен+ тами (особенно у лиц младше 12 лет).
С более низкой частотой поступали сообщения о возникновении амне+ зии, повышении уровней креатинина, лимфаденопатии и тромбоцитопе+ нии. Частота снижения массы тела на 10% и более составляла 10,7% (см. «Особые указания»). В некоторых случаях снижения массы тела наблю+ далась задержка при переходе к сле+ дующей стадии Таннера и созревания костной ткани.
Извещение о нежелательных реакциях
Крайне важно извещать о нежелате+ льных реакциях, возникших во время пострегистрационного применения ЛС. Это позволит контролировать соотношение пользы и риска ЛС. Просьба медицинским работникам извещать о возникновении любых не+ желательных реакций.

296 |
Зонегран® |
|
|
|
|
|
|
|
|
|
|
|
Глава 2 |
||||
ВЗАИМОДЕЙСТВИЕ. |
|
Ферменты |
слабым ингибитором P+гликопроте+ |
||||||||||||||
системы цитохрома Р450 |
|
|
|
|
ина (белка лекарственной мультире+ |
||||||||||||
Изучение влияния препарата Зонег+ |
зистентности (MDR1) с концентра+ |
||||||||||||||||
ран® in vitro на микросомальное окис+ |
цией полумаксимального ингибиро+ |
||||||||||||||||
ление в гепатоцитах человека показа+ |
вания (IC50) — 267 мкМоль/л, в силу |
||||||||||||||||
ли отсутствие |
значимого |
влияния |
чего существует теоретическая воз+ |
||||||||||||||
(<25%) на активность изоферментов |
можность |
влияния |
зонисамида |
на |
|||||||||||||
цитохрома P450 CYP1A2, |
CYP2A6, |
фармакокинетику ЛС, которые яв+ |
|||||||||||||||
CYP2B6, CYP2C8, CYP2C9, CYP2C19, |
ляются субстратами P+гликопротеи+ |
||||||||||||||||
CYP2D6, CYP2E1 и CYP3A4 при кон+ |
на. Рекомендуется с осторожностью |
||||||||||||||||
центрациях зонисамида в плазме кро+ |
начинать или останавливать лечение |
||||||||||||||||
ви в 2 раза и более превышающих тера+ |
или изменять дозу зонисамида у па+ |
||||||||||||||||
певтические. |
|
|
|
|
|
|
|
циентов, которые также принимают |
|||||||||
Маловероятно, что Зонегран® будет |
ЛС, являющиеся субстратами P+гли+ |
||||||||||||||||
влиять на фармакокинетику других |
копротеина (например дигоксин, хи+ |
||||||||||||||||
ЛС через механизмы, связанные с ци+ |
нидин). |
|
|
|
|
|
|
||||||||||
тохромом P450, это продемонстриро+ |
Потенциально |
возможное влияние |
|||||||||||||||
вано in vivo для карбамазепина, фени+ |
других ЛС на действие препарата Зо. |
||||||||||||||||
тоина, этинилэстрадиола и дезипра+ |
негран® |
|
|
|
|
|
|
||||||||||
мина. |
|
|
|
|
|
|
|
|
При одновременном применении с |
||||||||
Потенциально возможное влияние |
ламотриджином не выявлено значи+ |
||||||||||||||||
препарата Зонегран® |
на действие |
мое влияние на фармакокинетику зо+ |
|||||||||||||||
других ЛС |
|
|
|
|
|
|
|
нисамида. При |
одновременном на+ |
||||||||
|
|
|
|
|
|
|
значении препарата Зонегран® с ЛС, |
||||||||||
Другие ПЭП |
|
|
|
|
|
|
|
которые могут вызвать развитие мо+ |
|||||||||
У пациентов с эпилепсией длитель+ |
|||||||||||||||||
ный прием препарата Зонегран |
® |
не |
чекаменной |
болезни, |
повышается |
||||||||||||
|
риск |
развития |
нефроуролитиаза, |
в |
|||||||||||||
оказывает влияния на фармакокине+ |
связи с чем следует избегать их одно+ |
||||||||||||||||
тику карбамазепина, ламотриджина, |
временного применения. |
|
|
||||||||||||||
фенитоина и вальпроата натрия. |
|
|
Зонисамид |
метаболизируется |
с |
||||||||||||
Ингибиторы карбоангидразы |
|
|
|||||||||||||||
|
|
участием |
цитохрома |
CYP3A4 |
и |
||||||||||||
Следует |
соблюдать осторожность |
||||||||||||||||
N+ацетил+трансфераз, а также че+ |
|||||||||||||||||
при совместном назначении препа+ |
рез |
конъюгацию с |
глюкуроновой |
||||||||||||||
рата Зонегран |
® |
с ингибиторами кар+ |
|||||||||||||||
|
кислотой. Следовательно, вещест+ |
||||||||||||||||
боангидразы |
(например топирама+ |
ва, которые индуцируют или инги+ |
|||||||||||||||
том и ацетазоламидом), т.к. их со+ |
бируют эти ферменты, могут оказы+ |
||||||||||||||||
вместное применение может увели+ |
вать влияние на фармакокинетику |
||||||||||||||||
чить степень |
тяжести |
метаболиче+ |
зонисамида: |
|
|
|
|
|
|||||||||
ского ацидоза, а также риск образо+ |
Индукторы ферментов: концентра+ |
||||||||||||||||
вания камней в почках (см. «Особые |
ция зонисамида в крови снижается |
||||||||||||||||
указания»). |
|
|
|
|
|
|
|
при одновременном приеме ЛС, по+ |
|||||||||
Пероральные контрацептивы |
|
|
|||||||||||||||
|
|
вышающих |
активность |
цитохрома |
|||||||||||||
Прием препарата Зонегран® и комби+ |
CYP3A4 (например фенитоин, кар+ |
||||||||||||||||
нированных |
пероральных |
контра+ |
бамазепин и фенобарбитал). Эти |
||||||||||||||
цептивов в рекомендованных дозах |
эффекты не являются клинически |
||||||||||||||||
не влияет на концентрацию в сыво+ |
значимыми в случаях, когда Зонег+ |
||||||||||||||||
ротке крови этинилэстрадиола или |
ран® |
присоединяется к уже получае+ |
|||||||||||||||
норэтистерона. |
|
|
|
|
|
|
мой |
терапии, |
однако |
клинически |
|||||||
Субстраты P.гликопротеина |
|
|
значимые изменения концентрации |
||||||||||||||
Результаты исследований in vitro по+ |
зонисамида возможны при отмене, |
||||||||||||||||
казывают, что зонисамид является |
изменении |
|
режима |
дозирования |
|||||||||||||

|
|
|
|
|
|
|
|
|
Зонегран® |
297 |
или |
дополнительном |
назначении |
сознание, и у него не отмечалось ника+ |
|||||||
ЛС, индицирующих CYP3A4 (мо+ |
ких осложнений. |
|
|
|||||||
жет потребоваться коррекция дозы |
Лечение: специфичного антидота для |
|||||||||
препарата Зонегран®). Рифампицин |
лечения передозировки препаратом |
|||||||||
является |
мощным |
индуктором |
Зонегран® |
не |
существует. После |
|||||
CYP3A4, если требуется его совме+ |
предполагаемой |
передозировки по+ |
||||||||
стное назначение с препаратом Зо+ |
казано немедленное промывание же+ |
|||||||||
негран®, следует тщательно контро+ |
лудка на фоне обычных мер, направ+ |
|||||||||
лировать состояние пациента, при |
ленных на поддержание проходимо+ |
|||||||||
необходимости корректируя дозу |
сти дыхательных путей. Проводят |
|||||||||
препарата Зонегран®. |
|
|
поддерживающую терапию, включая |
|||||||
Ингибиторы ферментов: клиниче+ |
регулярный контроль основных по+ |
|||||||||
ские данные не показали значимого |
казателей |
состояния организма, и |
||||||||
влияния ингибиторов CYP3A4 на |
тщательное наблюдение. Зонисамид |
|||||||||
фармакокинетические |
параметры |
имеет длительный T1/2, в связи с чем |
||||||||
зонисамида. Назначение кетокона+ |
симптомы его передозировки могут |
|||||||||
зола (400 мг/сут) или циметидина |
иметь стойкий характер. Исследова+ |
|||||||||
(1200 мг/сут) не оказывало клини+ |
ний лечения передозировки не про+ |
|||||||||
чески |
|
значимого |
воздействия на |
водилось, вместе с тем известно, что |
||||||
фармакокинетику зонисамида, при+ |
гемодиализ снижает концентрацию |
|||||||||
нимаемого |
здоровыми |
доброволь+ |
зонисамида в плазме крови у пациен+ |
|||||||
цами (изменение режима дозирова+ |
тов с почечной недостаточностью и |
|||||||||
ния препарата Зонегран® |
при соче+ |
может рассматриваться в |
качестве |
|||||||
танном |
приеме |
с ингибиторами |
средства лечения передозировки. |
|||||||
CYP3A4 не требуется). |
|
|
ОСОБЫЕ УКАЗАНИЯ. Кожные вы. |
|||||||
Пациенты детского возраста. Иссле+ |
сыпания |
|
|
|
||||||
дования лекарственного взаимодей+ |
При терапии препаратом Зонегран® |
|||||||||
ствия у детей не проводились. |
сообщалось о развитии тяжелых кож+ |
|||||||||
ПЕРЕДОЗИРОВКА. Симптомы: от+ |
ных реакций, включая синдром Сти+ |
|||||||||
мечались случаи намеренной и не+ |
венса+Джонсона и токсический эпи+ |
|||||||||
преднамеренной передозировки пре+ |
дермальный некролиз. |
|
||||||||
паратом Зонегран® у взрослых и де+ |
Рекомендуется отмена препарата Зо+ |
|||||||||
тей. В некоторых случаях передози+ |
негран® у пациентов, у которых поя+ |
|||||||||
ровка протекала бессимптомно, осо+ |
вились кожные высыпания и которые |
|||||||||
бенно при немедленном промывании |
невозможно объяснить другими при+ |
|||||||||
желудка. В других случаях, передози+ |
чинами. Все пациенты с появлением |
|||||||||
ровка |
сопровождалась |
следующими |
высыпаний на коже во время приема |
|||||||
симптомами: сонливость, |
тошнота, |
препарата Зонегран® должны находи+ |
||||||||
симптомы гастрита, нистагм, миокло+ |
ться под тщательным наблюдением, |
|||||||||
нус, кома, |
брадикардия, |
нарушение |
особенно пациенты с одновременным |
|||||||
функции почек, артериальная гипо+ |
назначением других противоэпилеп+ |
|||||||||
тензия и угнетение функции дыхания. |
тических средств, которые сами спо+ |
|||||||||
Очень высокая концентрация зониса+ |
собны вызывать кожные высыпания. |
|||||||||
мида в плазме крови (100,1 мкг/мл) |
Синдром отмены |
|
||||||||
отмечалась приблизительно через 31 ч |
Отмену препарата Зонегран® произ+ |
|||||||||
после передозировки препаратом Зо+ |
водят путем постепенного снижения |
|||||||||
негран® |
и клоназепамом. У пациента с |
дозы во избежание возникновения |
||||||||
передозировкой данными препарата+ |
эпилептических приступов. Недоста+ |
|||||||||
ми развились кома и угнетение дыха+ |
точно данных об отмене одновремен+ |
|||||||||
ния. Однако через 5 дней он пришел в |
но применяемых противоэпилепти+ |
|||||||||

298 |
Зонегран® |
|
|
Глава 2 |
|
ческих препаратов после достижения |
ных мыслей и поведения, а также пре+ |
||||
контроля над приступами при приме+ |
дусмотреть |
соответствующее лече+ |
|||
нении препарата Зонегран® в рамках |
ние. Пациентам (и ухаживающим за |
||||
вспомогательной терапии для пере+ |
ними лицам) следует рекомендовать |
||||
хода к монотерапии препаратом Зо+ |
обратиться |
за врачебной помощью |
|||
негран®. Поэтому отмена сопутству+ |
при появлении суицидальных мыс+ |
||||
ющего противоэпилептического ле+ |
лей и поведения. |
||||
чения должна проводиться с осто+ |
Нефролитиаз |
||||
рожностью. |
|
|
У некоторых пациентов, особенно с |
||
Реакции, связанные с наличием суль. |
предрасположенностью к нефроли+ |
||||
фонамидной группы |
|
тиазу, возможно увеличение риска |
|||
Зонегран® содержит |
сульфонамид+ |
образования камней в почках и воз+ |
|||
ную группу. К серьезным побочным |
никновения таких признаков и симп+ |
||||
реакциям со стороны иммунной сис+ |
томов, как почечная колика, боль в |
||||
темы, связанных с приемом препара+ |
почках или боль в боку. |
||||
тов, которые содержат сульфонамид+ |
Нефролитиаз может приводить к хро+ |
||||
ную |
группу, |
относятся появление |
ническому поражению почек. Факто+ |
||
кожной сыпи и других аллергических |
ры риска нефролитиаза включают |
||||
реакций, а также развитие выражен+ |
предшествующее образование камней |
||||
ных гематологических нарушений, в |
в почках, а также нефролитиаз и ги+ |
||||
т.ч. апластической анемии, в очень |
перкальциурию в семейном анамнезе. |
||||
редких случаях приводящей к лета+ |
Ни один из этих факторов риска не яв+ |
||||
льному исходу. |
|
ляется достоверным признаком, по+ |
|||
Сообщалось о развитии случаев агра+ |
зволяющим спрогнозировать образо+ |
||||
нулоцитоза, тромбоцитопении, лей+ |
вание камней в почках при лечении |
||||
копении, апластической анемии пан+ |
зонисамидом. Кроме того, риск может |
||||
цитопении и лейкоцитоза. Информа+ |
быть повышен у пациентов, принима+ |
||||
ции для оценки возможной взаимо+ |
ющих другие препараты, провоциру+ |
||||
связи этих явлений с величиной при+ |
ющие развитие мочекаменной болез+ |
||||
нимаемой дозы препарата Зонегран® |
ни. Повышение потребления жидко+ |
||||
и продолжительностью лечения не+ |
сти и форсированный диурез помога+ |
||||
достаточно. |
|
|
ет снизить риск образования камней, в |
||
Суицидальное мышление и поведение |
т.ч. и у пациентов с предрасположен+ |
||||
Развитие суицидального мышления |
ностью к этому. |
||||
и поведения возможно у пациентов, |
Метаболический ацидоз |
||||
принимавших |
противоэпилептиче+ |
Формирование гиперхлоремическо+ |
|||
ские препараты по ряду показаний. |
го метаболического ацидоза без ани+ |
||||
Мета+анализ |
рандомизированных |
онного разрыва (снижение уровня |
|||
плацебо+контролируемых исследова+ |
бикарбонатов при отсутствии хрони+ |
||||
ний противоэпилептических препа+ |
ческого газового алкалоза) связыва+ |
||||
ратов |
также |
показал |
повышенный |
ют с терапией препаратом Зонегран®. |
|
риск |
возникновения |
суицидальных |
Развитие метаболического ацидоза |
||
мыслей и поведения. |
|
обусловлено потерей бикарбонатов в |
|||
Механизм этого явления неизвестен, |
почках вследствие ингибирующего |
||||
имеющиеся данные не исключают |
действия зонисамида на карбоангид+ |
||||
возможности |
повышенного риска |
разу, и возможно на любой стадии |
|||
формирования суицидального пове+ |
лечения, хотя чаще отмечается на |
||||
дения и на фоне приема препарата |
ранних этапах лечения. Подобные |
||||
Зонегран®. |
|
|
нарушения отмечались как в ходе |
||
Необходимо наблюдать за пациента+ |
проведения |
плацебо+контролируе+ |
|||
ми на предмет появления суицидаль+ |
мых клинических исследований, так |
||||
