
5 курс / Госпитальная педиатрия / Изосерологическая_несовместимость_матери_и_плода_по_системе_Rh_Hr
.pdfДля детей с массой тела более 2500 грамм для решения вопроса о заменой гемотрансфузии более целесообразно использовать методологический подход с определением уровней риска.
Перед проведением ЗПК необходимо установление фенотипа по системам резус и ABO крови новорожденного.
Объем ЗПК в размере двух или трех объемов циркулирующей крови (ОЦК). Для доношенных детей ОЦК составляет 70-80 мл/кг, для недоношенных – 90100 мл/кг. Заменное переливание крови в объеме двух ОЦК меняет 80 % крови, а трех ОЦК - 95 %.
Выбор препаратов для проведенuя ЗПК. При изолированном Rh-
конфликте используют резус-отрицательную одногруппную с кровью ребенка эритроцитарную массу или отмытые эритроциты - 2 части и свежезамороженную плазму одногруппную с пациентом – 1 часть. При конфликте по системе АВО используются отмытые эритроциты O(I) группы совпадающие с резус-фактором эритроцитов ребенка – 2 части и плазма АВ (IV) или одной группы с группой крови ребенка.
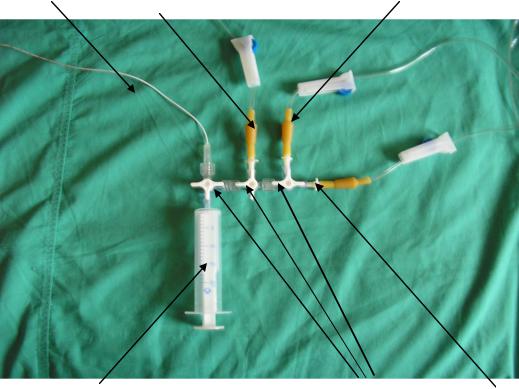
Техника ЗПК. ЗПК проводится через один из крупных сосудов (пупочная вена. подключичная вена) при надежной эксфузии. Проводят традиционные тесты на индивидуальную групповую и резус совместимость. Перед ЗПК определяется уровень билирубина до ЗПК. ЗПК проводят выводя и вводя поочередно порции крови по 10 мл. Замена крови пациента проводится поочередно на 2 шприца донорской эритроцитарной массы или отмытых эритроцитов и 1 шприц плазмы. С целью минимизации инфекционных осложнений возможно использование закрытой многоканальной системы (Рис. 27). При выраженной анемии - НЬ ниже 80 г/л ЗПК начинают с коррекции анемии введением эритроцитарной массы или отмытых эритроцитов под контролем уровня НЬ. В конце ЗПК последняя порция крови забирается для определения уровня билирубина. В процессе заменного переливания крови продолжается полифункциональный гемодинамический и метаболический мониторинг.
31
1 |
2 |
4 |
3 |
6 |
5 |
Рисунок 9. - Пятиканальная закрытая система для заменной гемотрансфузии
1-катетер; 2- канал сброса крови, 3- шприц; 4-канал отбора свежезамороженной плазмы, 5- канал отбора эритроцитарной массы,
6- трехходовые краны
32
Профилактика резус-иммунизации
Внедрение в практику анти-Rh0(D)-иммуноглобулина явилось одним из самых крупных достижений в акушерстве за несколько последних десятилетий.
Назначение антирезус-иммуноглобулина (Резонатив, компания «Октафарма АВ», Швеция, регистрационное удостоверение № 8638/08 от 27.05.08) предотвращает развитие сенсибилизации при назначении его резусотрицательным женщинам в 28-32 недели беременности и повторно в течение 72 часов после родов резус-положительным ребенком. Механизм защитного действия при введении иммуноглобулинов обусловлен блокированием Fc-рецепторов на макрофагах ретикулоэндотелиальной системы плода.
Анти-Rh0(D)-иммуноглобулин не оказывает отрицательного действия на плод и новорожденного. Анти-Rh0(D)-иммуноглобулин не защищает от сенсибилизации другими антигенами системы резус (помимо кодируемых генами D, C, E), но риск гемолитической болезни плода, вызванный антителами к антигенам системы Kell, Duffy, Kidd и др., значительно ниже.
Резонатив содержит иммуноглобулин человека антирезус Rh0(D) для внутримышечного введения, полученный из плазмы, содержащей высокие титры человеческого иммуноглобулина антирезуса Rh0(D), и прошедший вирусную инактивацию с помощью сольвент/детергентного метода (С/Д).
Антенатальная профилактика проводится:
Резус-отрицательным несенсибилизированным беременным в 28-32 недель по 250 мкг (1250 МЕ).
В послеродовом периоде Резонатив вводится:
Резус – отрицательным, несенсибилизированным женщинам родившим резус – положительного новорожденного не позднее 72 часов после родов 250 мкг анти-D (1250 МЕ).
Если профилактика во время беременности в сроке 28-32 нед не была проведена, то каждой неиммунизированной женщине с резус-отрицательной кровью в пределах 72 часов после родов при рождении ребенка с резусположительной кровью вводится 250 мкг (1250 МЕ) анти-Rh0(D)- иммуноглобулина. Такой же практики придерживаются, если по тем или иным причинам резус-принадлежность ребенка определить не представляется возможным. В случае если постнатальная профилактика не проведена в пределах 72 часов, допускается введение препарата в течение 28 дней после родов.
Профилактика в особых случаях: самопроизвольный или искусственный аборт, внематочная беременность, пузырный занос, или
33
при наличии другого фактора возникновения кровотечения у матери, например при абдоминальной травме.
До 12-й недели беременности 625 МЕ (125 мкг)
После 12-й недели беременности 1250 МЕ (250 мкг)
После амниоцентеза и биопсии хориона 1250 МЕ (250 мкг)
Препарат необходимо вводить как можно раньше, но не позднее 72 часов.
Способ введения Резонатива
Анти-Rh0(D)-иммуноглобулин вводят внутримышечно в дельтовидную или ягодичную мышцу. При геморрагическом синдроме, когда внутримышечные инъекции противопоказаны, Резонатив можно вводить подкожно. Стандартная доза 250 мкг (1250 МЕ) анти-Rh0(D)- иммуноглобулина перекрывает плодово-материнское кровотечение в объеме 30 мл цельной резус-положительной крови или 15 мл эритроцитов плода. Если требуется ввести большую дозу препарата (более 5 мл), то рекомендуется ее разделить на несколько частей и вводить в разные участки тела.
Коррекция дозы анти-Rh0(D)-иммуноглобулина требуется при подозрении на значительное плодово-материнское кровотечение.
Непрямой тест Кумбса позволяет определить свободно циркулирующие анти-D-антитела или Rh–иммуноглобулин. Если введено необходимое количество анти-Rh0(D)-иммуноглобулина, то на следующий день определяется положительный непрямой тест Кумбса (избыток свободных антител).
Профилактика может быть неэффективной в следующих ситуациях:
-введенная доза слишком мала и не соответствует объему плодовоматеринского кровотечения;
-доза введена слишком поздно;
-пациентка уже была иммунизирована, но уровень антител при этом меньше, чем это необходимо для лабораторного определения; введен нестандартный
анти-Rh0(D)-иммуноглобулин (недостаточной активности) для нейтрализации фетальных эритроцитов, проникших в организм матери.
Побочные эффекты:
Нечастые (1/100-1/1000)
Общие: транзиторная лихорадка (38˚-40˚С), недомогание, головная боль, озноб Кожа: местная боль и болезненность в месте инъекции
Редкие (<1/1000)
34
Общие: аллергические (анафилактические)реакции, включая диспноэ, шок, гипотонию и тахикардию Кожные реакции ЖКТ: тошнота, рвота
Обучение пациента
Каждая женщина должна знать свою группу крови и резус-фактор, а также группу крови и резус-фактор партнера до наступления беременности.
Все женщины с резус-отрицательной кровью должны быть проинформированы о необходимости профилактического использования антирезус-иммуноглобулина (Резонатива) после родов, абортов, выкидышей, внематочной беременности от резус-положительного партнера. Несмотря на положительный эффект профилактики антирезус-иммуноглобулином, нежелательным является искусственное прерывание беременности (аборт) ввиду риска иммунизации у женщины с резус-отрицательной кровью от партнера с резус-положительной кровью, особенно в сроках более 7 недель беременности.
35
Список литературы
1.Айламазян Э.К. Кордоцентез в антенатальной диагностике, терапии, хирургии болезней плода / Э.К. Айламазян // Вестник РАМН. – 1998. - №1. – С.6-11.
2.Ветров В.В. История применения эфферентных методов и аутодонорства в акушерско-гинекологической практике СанктПетербурга / В.В. Ветров // Эфферент. Терап. – 2002. – Т.8. - № 1. – С.
16-19.
3.Донсков С.И. Группы крови системы Rhesus. Теория и практика / С.И. Донсков. – Москва: ВИНИТ И РАН, 2005. – 392 с.
4.Косяков П.Н. Гемолитическая болезнь новорожденных / П.Н. Косяков // Изоантигены и изоантитела человека в норме и патологии / П.Н. Косяков. – Москва: Медицина, 1974. – С.199-208.
5.Мордухович А.С. Беременность и роды при изоиммунизации / А.С. Мордухович. – Ташкент: Медицина, 1972. – 135с.
6.Меркулова Н.Н. Иммунологическая диагностика гемолитической болезни новорожденных / Н.Н. Меркулова // Акуш. И гин. – 2004. - № 5.
– С.42-44.
7.Минеева Н.В. Группы крови человека. Основы иммуногематологии / Н.В. Минеева. – Санкт-Петербург, 2004. – 188с.
8.Митря И.В., Федорова Т.А., Рогачевский О.В. Оптимизация методов диагностики, профилактики и лечения резус-сенсибилизации / И.В. Митря, Т.А. Федорова, О.В. Рогачевский // Вестн. Службы кров. Росс.
2006. - № 1. – С. 7-10.
9.Михайлов А.В., Константинова Н.М., Пигина Т.В. Внутриматочные переливания крови плоду как способ лечения отечной формы гемолитической болезни / А.В. Михайлов, Н.М. Константинова, Т.В. Пигина // Акуш.и гин. – 1990. - № 7. – С.41-44.
10.Персианинов Л.С., Сидельникова В.М.. Елизарова И.П. Гемолитическая болезнь плода и новорожденного / Л.С. Персианинов, В.М. Сидельникова., И.П. Елизарова. – Москва: Медицина, 1981. – 208с.
11.Сидельникова В.М., Антонов А.Г. Гемолитическая болезнь плода и новорожденного / В.М. Сидельникова, А.Г. Антонов. – Москва: Триада- Х, 2004. – 192 с.
12.Сухих Г.Т., Ванько Л.В. Иммунология беременности / Г.Т. Сухих, Л.В. Ванько. – Москва: РАМН, 2003. – 400 с.
13.Скачилова Н.Н. Гравитационный плазмаферез для коррекции иммунных нарушений. Гравитационная хирургия крови / Н.Н. Скачилова. – Москва: Медицина, 1984. – С. 195-211.
14.Шуваева Б.А. Ингибиторная терапия резус-конфликта: автореф. Дисс. … канд. Мед. наук 9.03.71 / Б.А. Шуваева; Смоленск. Гос. Мед. ун- т. - Смоленск. – 1971. – 16 с.
15.Abdalla MGK, Beattie B., Alfirevic Z. Intrauterine transfusion techniques
in fetuses with Rhesus incompatibility (Protocol for a Cochrane Review) /
36
MGK Abdalla, B. Beattie, Z. Alfirevic // The Сосhrane Library. – Chichester: John Wiley and Sons, 2004. – Issue 2.
16.Allaby M. The use of routine antenatal anti-D prophylaxis for rhesus negative women. / Allaby M., Forman K., Touch S., Chilcott J. – Sheffield: University of Sheffield, Trent Institute for Health Services Research., 1999. – P. 1-45.
17.American College of Obstetricians and Gynecologists. Prevention of D isoimmunisation // ACOG Technical Bull. N 147. – Washington: ACOG, 1990.
18.Avery’s neonatalogy: pathophysiology and management of the newborn / edited by Mhairi G. MacDonald, Mary M.K. Seshia, Martha D. Mullett. – 6th ed., 2005. – Chapt. 46. – P.1177-1181.
19.Barclay C.S., French M. A., Ross L. D., Soko R. J., Successful pregnancy
following steroid therapy and plasma exchange in woman with anti-Rh0 (SS- A) antibodies / C.S. Barclay, M. A. French, L. D. Ross, R. J. Soko // Br. J. Obstet. Gynecol. – 1987. – Vol. 94. – P. 369-371.
20.Berkowitz R.L., Chitkara U, Wilkins I. et al. Intravascular monitoring and management of erythroblastosis fetalis / R.L. Berkowitz, U Chitkara, I. Wilkins et al. // Am. J. Obstet. Gynecol. – 1988.Vol. 158. – P. 783-795.
21.Berlin G., Selbing A., Ryden G. Rhesus hemolytic desease treated with high-dose intravenous immunoglobulin // Lancet. – 1985. – Vol. 8438. – P. 1153.
22.Bevis D.C.A. The composition of liquor amnii in hemolytic disease of newborn / D.C.A. Bevis // J. Obstet. Gynecol. Br. Emp. – 1953. – Vol. 60. – P.
23.Bowman J.M. Hemolytic disease of newborn / J.M. Bowman // Can. Med. Assoc. J. – 1974. – Vol. – 111. – P. 318.
24.Bowman J.M. Hemolytic disease (Erythroblastosis fetalis). In: Creasy RK, Resnik R, eds. Maternal-fetal medicine. 4th ed. Philadelphia: W.B. Saunders, 1999. – P. 736-767.
25.Bowman J.M. The management of Rh-isoimmunization / J.M. Bowman // Obstet. Gynecol. – 1978. – Vol. 52. – P. 1.
26.Bowman J.M., PeddleL.J., Anderson C. Plasmspheresis in severe Rh isoimmunization / J.M. Bowman, L.J Peddle., C. Anderson // Vox Sang. – 1968. – Vol. 15. – P. 272-277.
27.Bowman J.M., Chown B., Lewis M., Pollock J.M. Rh isoimmunization during pregnancy: antenatal prophylaxis // Can. Med. Assoc. J. – 1978. – Vol.
118.– P.623-627.
28.Ch de Crespigny L.C., Robinson H.P., Quinn M et al. Ultrasoundguided fetal blood transfusion for severe rhesus isoimmunisation / L.C. Ch de Crespigny, H.P. Robinson, M Quinn et al. // Obstet. Gynecol. – 1985. – Vol.
66.– P. 529-532.
29.Clarke C.A., Elson C.J., Bradley J., Donohoe W.T. Intensive plasmapheresis as a therapeutic measure in rhesus immunized women / C.A.
37
Clarke, C.J. Elson, J. Bradley, W.T. Donohoe // Lancet. – 1970: ii. – P. 793798.
30.Commission of the European Communities, Brussels. Committee for Proprietary Medicine Products. Notes for guidance: core summary of product characteristics for human anti-D immunoglobulin IM. 1994: 111/34463/92EN.
31.Costa J.M, Giovangrandi Y., Emault P. et al. Fetal RHO genotyping in maternal serum during the first trimester of pregnancy / J.M. Costa, Y. Giovangrandi, P. Emault et al. // Br. J. Haematol. – 2002. – Vol. 119. – P. 255.
32.Crowther C.A. Anti-D administration in pregnancy for preventing Rhesus alloimmunisation (Cochrane Review) / C.A. Crowther // The Cochrane library. – Chichester: John Wiley and Sons, 2004. –Issue 2.
33.Crowther C., Middleton P. Anti-D administration after childbirth for preventing Rhesus alloimmunisation (Cochrane Review) // Ibid.
34.Cherif-Zahar B. et al. Localization of the human RH-blood Group gene structure to chromosome region 1p34.3-1p36.1 by in sity gybridization // Hum. Genetic. – 1991. – Vol. 86. – P. 398-400.
35.Daffos F., Capella-Povolsky M., ForstierF. Fetal blood sampling during pregnancy with use of a needle guided by ultrasound. A study of 606 consecutive cases / F. Daffos, M. Capella-Povolsky, F. Forstier // Am. J. Obstet. Gynecol. – 1985. – Vol. 153. – P. 655-660.
36.Divakaran T.G., Waugh J., Clark T.J. et al. Noninvasive techniques to detect fetal anemia due to red blood cell alloimmunization: a systematic review / T.G. Divakaran, J. Waugh, T.J. Clark et al. // Obstet. Gynecol. – 2001. – Vol. 98, N 3. – P. 509-517.
37.Finn R., Clarke C. A., Donohoe W.T.A. et al. Experimental studies on prevention of Rh haemolytic disease / R. Finn, C. A. Clarke, W.T.A. Donohoe et al. // Br. Med. J. – 1961. – Vol. 1. – P. 1486.
38.Finning K.M., Martin P.G., Soothill P. W, Avent N.D. Prediction of fetal D status from maternal plasma: introduction of a new noninvasive fetal RHO genotyping service / K.M Finning., P.G. Martin, P. W. Soothill, N.D. Avent // Transfusion. – 2002. – Vol. 42. – P. 1079.
39.Freda V., Gorman J., Pollack W. Prevention of Rh isoimmunisation in obstetrics with “Rh immunoglobulin”. A progress. Report. // J. Int. Fed.
Gynec. Obst. – 1966. – Vol. 4 (4). – P. 169-189.
40.Guidelines on the prophylactic use of Rh D Immunoglobulin (Anti D) in obstetrics // NHMRC Rep. – 22 March 1999.
41.Gonsoulin W.J., Moise K.J.Jr, Milam J.D. et al. Serial maternal blood donations for intrauterine transfusion / W.J. Gonsoulin, K.J.Jr. Moise, J.D. Milam et al. // Obstet Gynecol. – 1990. – Vol. 75.P.158-162.
42.Harman C.R., Bowman J.M., Manning F.A. et al. Intrauterine transfusionintraperitoneal versus intravascular approach: a case control comparison / C.R. Harman, J.M. Bowman, F.A. Manning et al. // Am. J. Obstet Gynecol. -1990. – Vol. 162. – P. 1053-1059.
38
43.Harrison R., Campbell S., Craft I. Risks of fetomaternal hemorrhage resulting from amniocentesis with and without ultrasound placenta localization / R. Harrison, S Campbell., I. Craft // Obstet. Gynecol. – 1975. – Vol. 46. – P. 389.
44.James V., Weston I., Scott I.V., Doughty R., Tomlison J., Whitefield M. Intensive plasma exchange in Rhesus isoimunization / V. James, I. Weston, I.V. Scott, R. Doughty, J. Tomlison, M. Whitefield // Vox Sang. – 1979. – Vol. 37. – P. 290-295.
45.Joint Working Group of the British Blood Transfusion Society and the RCOG. Recommendations for the use of anti-D immunoglobulin for Rh prophylaxis // Transfus. Med. – 1999. – Vol. 9. – P. 93-97.
46.Johnson P.R., Tait R.C., Austen E.B. et al. Flow cytometry in diagnosis and management of large feto-matemal haemorrhage / P.R. Johnson, R.C. Tait, E.B. Austen et al. // J. Clin. Pathol. – 1995. – Vol. 48. – P. 1005-1008.
47.Kleihauer E., Braun H., Betke K. Demonstration of fetal hemoglobin in erythrocytes of a blood smear / E. Kleihauer, H. Braun, K. Betke // Klin. Wochenschr. -1957. – 15; 35(12). – P.637-638.
48.Kochenour N.K., James R.S. Rh isoimmunization in pregnancy // Immunology in Obstetrics and Gynecology. 1985. – Chapt.6. – P. 141-163.
49.Landsteiner K., Wiener A.S. An agglutinable factor in human blood recognized by immune sera for rhesus blood / K. Landsteiner, A.S. Wiener // Proc. Soc. Exp. Biol. Med. – 1940. – Vol. 40. – P.223.
50.Lee D., Rawlinson V.I. Multicentre trial of antepartum low-dose anti-D immunoglobulin / D. Lee, V.I. Rawlinson // Transfus. Med. – 1995. – Vol. 5.
– P. 15-19.
51.Leveque C., Murat I., Toubas F. et al. Fetal neuromuscular blockade with vecuronium bromide: Studies during intravascular intrauterine transfusion in isoimmunised pregnancies/ C. Leveque, I. Murat, F. Toubas et al. // Anethesiology. – 1992. – Vol. 76. – P. 642-644.
52.Liley A.W. Intrauterine transfusion of fetus in hemolytic disease // BMJ. -1963. – Vol. 2. – P. 1107.
53.Lo Y.M., Hjelm N.M., Fidler C. et al. Prenatal diagnosis of fetal RhD status by molecular analysis of matemal plasma // N. Engl. J. Med. -1998. – - Vol. 339. – P. 1734.
54.Mari G., Deter R.L., Carpenter RL. Et al. Noninvasive diagnosis by Doppler ultrasonography of fetal anemia due to maternal red-cell alloimmunization. Collaborative Group for Doppler Assessment of the Blood Velocity in Anemic Fetuses // Ibid. – 2000. – Vol. 342. – P. 9.
55.Mollinson P.L., Engelfriet C.P., Contreras M. Haemolytic disease of the fetus and newborn // Blood Transfusion in Clinical Medicine. – 10th ed. - Boston: Blackwell Science, 1997. – P. 414.
56.Ruma M.S., Moise K.J., Kim E. et al. Combinated plasmapheresis and intravenous immune globulin for the treatment of severe maternal red cell alloimmunization // Am. J. Obstet. Gynecol. – 2007. – Vol. 198. – P. 138-140.
39
57.Selbing A., Stangenberg M., Westgren M. et al. Intrauterine intravascular transfusions in fetal erythroblastosis: The influence of net transfusion volume on fetal survival II Acta Obstet. Gynecol. Scand. – 1993. – Vol. 72. – P.20-23.
58.Stangenberg M. Rhesus immunization: new perspectives in MaternalFetal Medicine / Stangenberg M. Selbing A., Lingman G., Westergren M.// Obstet. Gynecol. Surv. – 1991. – Vol. 46. – P. 189-195.
59.Sussman Leon N. Intensive plasmapheresis during pregnancy and spurious amniotic fluid bilirubin / N. Leon Sussman, M. Barias, W. Colli // Am. J. Obstet. Gynecol. – 1979. – Vol. 135. – P. 156-157.
60.Teixeira J.M., Duncan K., Letsky E., Fisk N.M. Middle cerebral artery peak systolic velocity in the prediction of fetal anemia // Ultrasound Obstet. Gynecol. – 2000. – Vol. 15. – P. 205-208.
61.Van der Veyver I. et al. Single-cell analysis of the RHD blood type for use in preimplantation diagnosis in prevention of severe hemolytic disease of the newborn // Am. J. Obstet. Gynecol. – 1995. – Vol. 172 (2). – P. 533-544
62.Wiener C.P., Williamson R.A., Wenstrom K.D. et al. Management of fetal hemolytic disease by cordocentesis: II Outcome of treatment // Am. J. Obstet. Gynecol. -1991. – Vol. 165. – P. 1302-1307.
63.William J. et all. Plasmapheresis during pregnancy: Review // Obstet. Gynecol. – 1990. – Vol. 76. – P. 451-457.
40
