
5 курс / Госпитальная педиатрия / Детские болезни Баранов А.А. 2009
.pdfПервичная профилактика не разработана. Вторичная профилактика заключается в раннем распознавании и адекватном лечении больных острым вирусным гепатитом. Дети, перенѐсшие острый вирусный гепатит В, С, D, G, должны состоять на диспансерном учѐте не менее одного года. В период диспансерного наблюдения рекомендуют, помимо осмотра с определением размеров печени, проводить биохимическое исследование сыворотки крови (общий билирубин, активность трансаминаз, осадочные пробы, специфические маркѐры и др.). Показаны отвод от медицинских прививок, ограничение физических нагрузок, строгое соблюдение диеты, санаторнокурортное лечение (вне обострения). Широкое внедрение вакцинации против гепатитов А и В позволит решить проблему не только острого, но и хронического гепатита.
ПРОГНОЗ
Вероятность полного выздоровления незначительная. По мере прогрессирования процесса развиваются цирроз печени и гепатоцеллюлярная карцинома.
Аутоиммунный гепатит
Аутоиммунный гепатит - прогрессирующее гепатоцеллюлярное воспаление неясной этиологии, характеризующееся наличием перипортального гепатита, гипергаммаглобулинемии, печѐночно-ассоциированных сывороточных аутоантител и положительным эффектом иммуносупрессивной терапии.
Распространѐнность аутоиммунного гепатита в европейских странах составляет 0,69 случаев на 100 000 населения. В структуре хронических заболеваний печени доля аутоиммунного гепатита у взрослых больных составляет 10-20%, у детей - 2%.
Этиология и патогенез
Этиология аутоиммунного гепатита не известна, а патогенез изучен недостаточно. Предполагают, что аутоиммунный гепатит развивается вследствие первично обусловленного нарушения иммунного ответа. В качестве возможных пусковых (триггерных) факторов, способствующих возникновению заболевания, указывают на вирусы (ЭпстайнаБарр, кори, гепатитов А и С) и некоторые лекарственные средства (например, интерферон).
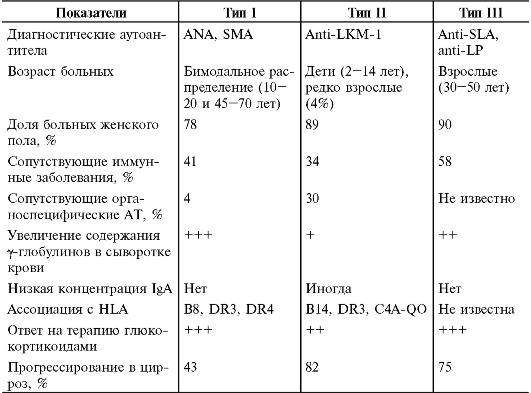
При наличии соответствующей генетической предрасположенности под воздействием триггерных факторов или без них возникает нарушение иммунной регуляции, проявляющееся дефектом функции супрессорных Т- клеток, сцепленным гаплотипом HLA A1-B8-DR3 в белой популяции в Европе и Северной Америке, или аллелем HLA DR4, более распространѐнным в Японии и других странах Юго-Восточной Азии). В результате возникает неуправляемый синтез В-клетками АТ класса IgG, разрушающих мембраны нормальных гепатоцитов. В совокупности аллели DR3 и/или DR4 выявляют у 80-85% больных с аутоиммунным гепатитом. В настоящее время выделяют аутоиммунный гепатит I, II и III типов.
• I тип - классический вариант, на его долю приходится около 90% всех случаев болезни. Роль основного аутоантигена при аутоиммунном гепатите I типа принадлежит печѐночно-специфическому белку (liver specific protein, LSP). В сыворотке крови обнаруживают антинуклеарные (antinuclear antibodies, ANA) и/или антигладкомышечные (smooth muscle antibody, SMA) АТ в титре более 1:80 у взрослых и более 1:20 у детей. У 65-93% больных с этим типом гепатита обнаруживают также перинуклеарные нейтрофильные цитоплазматические АТ (pANCA).
• Аутоиммунный гепатит II типа составляет около 3-4% всех случаев, большая часть больных - дети от 2 до 14 лет. Основной аутоантиген при аутоиммунном гепатите II типа - Аг микросом печени
и почек I типа (liver kidney microsomes, LKM-1). При аутоиммунном гепатите II типа в сыворотке крови обнаруживают АТ к микросомам клеток печени и эпителиальных клеток клубочкового аппарата почек I типа (анти-LKM-!).
• Выделяют и аутоиммунный гепатит III типа, характеризующийся наличием AT к растворимому печѐночному Аг (soluble liver antigen) анти-SLA при отсутствии ANA или анти-KLM-1 У больных с заболеванием III типа часто выявляют SMA (35%), антимитохондриальные АТ (22%), ревматоидный фактор (22%) и АТ к Аг печѐночной мембраны (анти-LMA) (26%).
Клиническая картина
Клиническая картина у детей в 50-65% случаев характеризуется внезапным появлением симптомов, сходных с таковыми при вирусном гепатите. В ряде случаев заболевание начинается незаметно с астеновегетативных расстройств, болей в области правого подреберья, незначительной желтухи. Последняя часто появляется на поздних стадиях болезни, бывает непостоянной и усиливается в период обострений. Характерно появление телеангиэктазий (на лице, шее, руках) и пальмарной эритемы. Печень уплотнена и выступает из-под края рѐберной дуги на 3-5 см, селезѐнка почти всегда увеличена. Часто аутоиммунный гепатит сопровождается аменореей и бесплодием, у мальчиков может развиться гинекомастия. Возможно развитие острого рецидивирующего мигрирующего полиартрита с вовлечением крупных суставов без их деформаций. Один из вариантов начала заболевания - лихорадка в сочетании с внепечѐночными проявлениями.
Лабораторные исследования
При анализе крови обнаруживают гипергаммаглобулинемию, увеличение концентрации IgG, снижение концентрации общего белка, резкое увеличение СОЭ. Лейкопению и тромбоцитопению выявляют у больных при гиперспленизме и синдроме портальной гипертензии. В сыворотке крови обнаруживают аутоантитела против клеток печени.
Диагностика и дифференциальная диагностика
Выделяют «определѐнный» и «вероятный» аутоиммунный гепатит.
•«Определѐнный» диагноз аутоиммунного гепатита подразумевает наличие ряда показателей: перипортального гепатита, гипергаммаглобулинемии, аутоантител в сыворотке крови, повышенной активности сывороточных
трансаминаз при нормальной концентрации церулоплазмина, меди и а1- антитрипсина. При этом концентрация сывороточных γ-глобулинов превышает верхнюю границу нормы более чем в 1,5 раза, а титры АТ (ANA, SMA и анти- LKM-1) не
•менее 1:80 у взрослых и 1:20 у детей. Кроме того, отсутствуют вирусные маркѐры в сыворотке крови, поражение жѐлчных протоков, отложение меди в ткани печени и другие гистологические изменения, предполагающие иную этиологию процесса, а также в анамнезе нет сведений о гемотрансфузиях и применении гепатотоксичных лекарственных препаратов. «Вероятный» диагноз оправдан, когда имеющиеся симптомы позволяют думать об аутоиммунном гепатите, но недостаточны для постановки «определѐнного» диагноза.
При отсутствии аутоантител в сыворотке крови (около 20% больных) заболевание диагностируют на основании увеличения активности трансаминаз в крови, выраженной гипергаммаглобулинемии, избирательного повышения в сыворотке крови содержания IgG, типичных гистологических признаков и определѐнного иммунологического фона (выявление иных аутоиммунных болезней у больного ребѐнка или его родственников) при обязательном исключении других возможных причин поражения печени. Некоторые диагностические признаки различных типов аутоиммунного гепатита приведены в табл. 16-9.
Таблица 16-9. Диагностические критерии разных типов аутоиммунного гепатита
Дифференциальную диагностику проводят с хроническим вирусным гепатитом, недостаточностью а1-антитрипсина, болезнью УилсонаКоновалова.
Лечение
Основа лечения - иммуносупрессивная терапия. Назначают преднизолон, азатиоприн или их сочетание. Комбинированную терапию рекомендуют для снижения вероятности развития побочных реакций от применения глюкокортикоидов: преднизолон в таком случае назначают в меньшей дозе, чем при монотерапии. Позитивный ответ на такую терапию - один из критериев диагноза аутоиммунного гепатита. Однако при отсутствии эффекта нельзя полностью исключить этот диагноз, так как возможно нарушение больным режима приѐма препаратов или недостаточная дозировка. Цель лечения - достижение полной ремиссии. Под ремиссией подразумевают отсутствие биохимических признаков воспаления [активность аспартатаминотрансферазы (АСТ) выше нормы не более чем в 2 раза] и гистологических данных, указывающих на активность процесса.
Терапия преднизолоном или комбинацией преднизолона с азатиоприном позволяет достичь клинической, биохимической и гистологической ремиссии у 65% больных в течение 3 лет. Средняя продолжительность лечения до достижения ремиссии составляет 22 мес. Пациенты с гистологически подтверждѐнным циррозом печени отвечают на терапию так же хорошо, как и пациенты без признаков цирроза: 10-летняя выживаемость больных с циррозом или без цирроза печени на фоне терапии практически не различается и составляет 89 и 90% соответственно. Преднизолон назначают
вдозе 2 мг/кг (максимальная доза 60 мг/сут) с еѐ последующим снижением на 5-10 мг каждые 2 нед под еженедельным контролем биохимических показателей. При нормализации содержания трансаминаз дозу преднизолона снижают до минимально возможной поддерживающей (обычно 5 мг/сут). Если
втечение первых 6-8 нед терапии не происходит нормализации печѐночных проб, дополнительно назначают азатиоприн в начальной дозе 0,5 мг/кг. При отсутствии признаков токсического действия увеличивают дозу препарата до 2 мг/сут. Хотя снижение активности трансаминаз на 80% от первоначальной происходит в течение первых 6 нед у большинства больных, полная нормализация концентрации ферментов происходит лишь через несколько месяцев (через 6 мес при аутоиммунном гепатите I типа, через 9 мес при II типе). Рецидивы на фоне терапии возникают в 40% случаев, при этом временно увеличивают дозу преднизолона. Через 1 год от начала ремиссии рекомендуют попытаться отменить иммуносупрессивную терапию, но только после проведения контрольной пункционной биопсии печени. При этом морфологическое исследование должно свидетельствовать об отсутствии или минимальной выраженности воспалительных изменений. Однако полностью отменить иммуносупрессивную терапию в большинстве случаев не удаѐтся. При повторном рецидиве аутоиммунного гепатита после отмены иммуносупрессивных препаратов назначают пожизненную поддерживающую терапию преднизолоном (5-10 мг/сут) или азатиоприном (25-50 мг/сут). Продолжительная иммуносупрессивная терапия вызывает побочные реакции у 70% детей. При неэффективности глюкокортикоидной терапии применяют циклоспорин, циклофосфамид.
У 5-14% больных с подтверждѐнным диагнозом аутоиммунного гепатита наблюдают первичную резистентность к лечению. Эту небольшую группу пациентов можно чѐтко выделить уже через 14 дней после начала лечения: показатели печѐночных проб у них не улучшаются, а субъективное самочувствие остаѐтся прежним или даже ухудшается. Летальность среди больных этой группы высокая. Они подлежат обязательной консультации в центрах трансплантации печени, как и те больные, у которых на фоне лечения или после его окончания развивается рецидив, резистентный к терапии. Медикаментозное лечение таких больных обычно оказывается неэффективным, продолжение приѐма глюкокортикоидов в высоких дозах приводит лишь к потере драгоценного времени.
Профилактика
Первичная профилактика не разработана. Вторичная заключается в регулярном диспансерном наблюдении за больными, периодическом определении активности ферментов печени, содержания γ-глобулинов и аутоантител для своевременной диагностики рецидива и усиления иммуносупрессивной терапии. Важные моменты: соблюдение режима дня, ограничение физических и эмоциональных нагрузок, диета, отвод от вакцинации, минимальный приѐм лекарственных средств. Показаны периодические курсы гепатопротекторов и поддерживающая терапия глюкокортикоидами.
Прогноз
Заболевание без лечения непрерывно прогрессирует и не имеет самопроизвольных ремиссий. Улучшения самочувствия бывают кратковременными, нормализации биохимических показателей не происходит. В исходе аутоиммунного гепатита формируется цирроз печени макронодулярного или микронодулярного типа. Неблагоприятен прогноз у детей с первичной резистентностью к лечению. При неэффективности иммуносупрессивной терапии больным показана трансплантация печени. После трансплантации печени 5-летняя выживаемость у больных аутоиммунным гепатитом составляет более 90%.
Дополнительные материалы на компакт-диске
•Запоры у детей.
•Дисбактериоз кишечника.
ГЛАВА 17 БОЛЕЗНИ ПОЧЕК И МОЧЕВЫХ ПУТЕЙ
Заболевания почек и мочевых путей выявляют у 3-4% детей. Кроме высокого удельного веса в структуре болезней, патология мочевой системы привлекает внимание серьѐзностью прогноза. Несвоевременно распознанное заболевание и поздно начатое лечение часто лежат в основе прогрессирования патологического процесса и развития ХПН, что приводит к задержке роста и развития ребѐнка, инвалидизации, уменьшению продолжительности жизни. Заболевания мочевой системы у взрослых нередко бывают продолжением болезни, начавшейся в детском возрасте.
Все болезни мочевой системы у детей можно разделить на 2 большие группы: первую составляют наследственные и врождѐнные заболевания, вторую - приобретѐнная патология.
•Нефропатии первой группы имеют большое значение в педиатрии: у детей их регистрируют чаще, чем у взрослых (за счѐт небольшой продолжительности жизни больных). Наиболее часто выявляют структурные аномалии развития почек и мочевыводящих путей, аномалии строения и расположения почечных сосудов, а также иннервации органов мочевой системы с синдромом нейрогенного мочевого пузыря.
•Из всего многообразия нефропатий второй группы, наблюдающихся у детей, преобладает мочевая инфекция. По частоте она занимает второе место в структуре детских болезней, уступая лишь инфекциям дыхательных путей (данные ВОЗ).
МОЧЕВАЯ ИНФЕКЦИЯ
Мочевая инфекция - воспалительный процесс, вызванный микроорганизмами и локализующийся на любом участке слизистой оболочки мочевого тракта (в мочеиспускательном канале, мочевом пузыре, лоханках, чашечках) или на всѐм еѐ протяжении.
Диагноз «мочевая инфекция» правомочен у детей раннего возраста, поскольку у них в силу недостаточной зрелости и дифференцировки
ткани почек (и всех мочевыводящих путей), а также сниженного иммунитета (возрастная физиологическая особенность) воспалительный процесс не ограничивается одним отделом мочевого тракта. У детей 1,5-2 лет не бывает только уретрита, цистита или пиелита. В этом возрасте в острых случаях диагностируют цистопиелонефрит. У старших детей термин «мочевая инфекция» используют как временный диагноз на момент обследования, а после определения уровня поражения мочевых путей диагноз заменяют другим, более конкретным.
Особенно часто мочевую инфекцию выявляют у детей до 3 лет. Второй пик заболевания приходится на возраст старше 20 лет. Среди новорождѐнных и детей первых месяцев жизни мальчики и девочки болеют с одинаковой частотой, что служит подтверждением гематогенного пути инфицирования и подчѐркивает роль аномалий развития мочевой системы, развивающихся с
равной частотой у лиц обоих полов. В более старшем возрасте болеют преимущественно девочки.
Чаще всего острая мочевая инфекция протекает в форме пиелонефрита (первичного необструктивного и вторичного обструктивного) или цистопиелонефрита. Реже наблюдают такие еѐ формы, как цистоуретрит и цистит.
Этиология
Наиболее часто воспалительный процесс в органах мочевой системы вызывает кишечная палочка (уропатогенные штаммы), источниками инфекции служат кишечник (особенно у детей с дисбактериозом) и периуретральная область. Возникновению и дальнейшему развитию инфекции способствуют глистные инвазии и воспалительные заболевания наружных половых органов. Микроорганизмы, благодаря наличию на их поверхности фимбрий, фиксируются на слизистой оболочке мочевого тракта, что препятствует их элиминации с током мочи. Наиболее патогенны для мочевых путей кишечные палочки, имеющие капсулу (К-Аг). Предполагают, что К-Аг обладают низкой иммуногенностью, поэтому иммунная система человека распознаѐт их недостаточно активно, что приводит к длительной персистенции бактерий.
Патологический процесс в мочевых путях и почках также могут вызывать протей, синегнойная палочка и другие грамотрицательные микроорганизмы, реже причиной становятся грамположительные микробы. Среди последних чаще обнаруживают золотистый стафилококк, попадающий в почки гематогенным путѐм из воспалительных очагов, например при гнойном омфалите у новорождѐнного, абсцедирующей пневмонии или гнойновоспалительных заболеваниях кожи. Этиологическую роль отводят также внутриклеточным микроорганизмам (хламидиям, микоплазме), обладающим высокой тропностью к эпителиальным клеткам мочеполового тракта. Определѐнное значение имеют энтерококки и вирусы. Инфицирование вирусами нередко способствует персистированию бактериальной инфекции.
Патогенез
Инфекционный агент может попасть в почку гематогенным и восходящим (уриногенным) путѐм, а также лимфогенным, через лимфатические сосуды, идущие от мочевого пузыря вдоль мочеточников (возможность проникновения этим путѐм признают не все). Гематогенный путь наиболее характерен для новорождѐнных и детей первых месяцев жизни. У старших детей основное значение приобретает восходящий путь, когда инфицирование происходит из нижних мочевых путей per continuitatem. Девочки страдают чаще мальчиков, так как у девочек мочеиспускательный канал шире и короче. Большое значение имеет гигиенический уход за ребѐнком.
• Проникновению инфекции из мочевого пузыря в вышележащие отделы мочевого тракта и почки способствует пузырно-мочеточниковый рефлюкс (обратный заброс мочи), возникающий в результате недостаточности интрамурального клапанного механизма мочеточников или пузырно-
мочеточникового соустья (рис. 17-1 на вклейке). Может иметь значение и нейрогенная дисфункция мочевого пузыря. Развитию пиелонефрита также способствуют нарушения оттока мочи, сопровождающие некоторые врождѐнные пороки развития мочевой системы (рис. 17-2, 17-3, 17-4 на вклейке) или мочекаменную болезнь. Выше препятствия под влиянием микроорганизмов происходит разложение мочевины с образованием аммиака, инактивирующего C4 и другие компоненты комплемента, в результате чего возникает нарушение местной иммунорезистентности к инфекции. Одновременно развивается венозный застой, нарушается лимфоотток, повышается внутрипочечное давление, при этом почечный кровоток уменьшается, что способствует более быстрому развитию воспаления и нарушению функции органа.
• Развитию пиелонефрита способствуют не только грубые структурные аномалии строения мочевой системы, рефлюкс и камни, нарушающие пассаж мочи. Предрасполагающими факторами могут быть:
-структурная и функциональная незрелость мочевых путей и тубулярного отдела нефрона у новорождѐнных и детей первых месяцев жизни;
-инфекционный процесс у матери во время беременности, поздний гестоз;
-тяжѐлые желудочно-кишечные расстройства с эксикозом и гипокалиемией; воспаление наружных половых органов (вульвиты,
вульвовагиниты, баланопоститы); пневмония; гипотрофия; рахит; гипервитаминоз D (у детей первых лет жизни), глистные инвазии, наличие очагов хронической инфекции.
•Важную роль отводят наследственным нарушениям обмена веществ, ферментопатиям и дисплазии эпителия тубулярного отдела нефрона. Благоприятные условия для развития болезни создаются при обменных нарушениях, сопровождающихся повышенной экскрецией с мочой оксалатов, уратов, фосфатов, цистина и кальция.
•Наряду с перечисленными факторами, в развитии пиелонефрита большое значение имеют иммунологическая реактивность организма, факторы местной клеточной защиты.
Корковый слой и мозговое вещество почки обладают различной резистентностью к микробной инвазии. Чаще происходит инфицирование мозгового вещества, так как кровоток в нѐм менее интенсивен и ниже местная иммунологическая защита (именно здесь происходит инактивация большей части фракции комплемента C4). Бактерии размножаются в мозговом веществе почки быстрее, поэтому воспаление, начинающееся в интерстициальной ткани почек, очень быстро переходит на находящиеся там элементы нефрона (петля Хенле, собирательные трубочки). Повреждение канальцев в зонах воспаления с нарушением их целостности приводит к попаданию микроорганизмов и лейкоцитов в мочу. Распространяясь, процесс захватывает дистальные, а затем и проксимальные канальцы. Постепенно он приводит к гиалинозу и склерозу артериол и мелких артерий интерстиция, а

затем и к деструкции нефрона. При инфекции мочевых путей это проявляется сначала ухудшением функции канальцев (снижение концентрационной способности почки), а затем нарушением функции клубочков с развитием гиперазотемии. Повышение показателей остаточного азота, мочевины и креатинина крови у больных хроническим пиелонефритом свидетельствует о далеко зашедших структурных нарушениях в почках и ХПН.
Острый пиелонефрит
Острый пиелонефрит - острое неспецифическое экссудативное воспаление ткани почки и чашечно-лоханочной системы с выраженной лихорадкой, болью, пиурией и нарушением функций почки.
Клиническая картина
Ведущие синдромы заболевания у старших детей в остром периоде отражены в табл. 17-1.
Таблица 17-1. Ведущие синдромы острого пиелонефрита у детей старшего возраста
Особенности клинической картины острого пиелонефрита у детей раннего возраста, в частности преобладание внепочечных симптомов, обусловлены морфологической незрелостью мочевой системы и склонностью к генерализации воспалительного процесса. Заболевание начинается с гипертермии, нарастающих признаков токсикоза и эксикоза. Бурное начало особенно характерно для детей с постгипоксической энцефалопатией. Возбуждение, характерное для первых дней болезни, быстро сменяется адинамией. Возможны явления менингизма. У ребѐнка снижается масса тела из-за выраженной анорексии, упорных срыгиваний и рвоты, жидкого стула. Диспептические явления могут преобладать над дизурическими. Иногда при внимательном наблюдении за ребѐнком можно отметить беспокойство перед или во время мочеиспускания. В целом клиническая картина острой мочевой инфекции у детей раннего возраста напоминает сепсис и сопровождается изменениями не только в почках, но также в печени, надпочечниках и ЦНС.
Лихорадка ремиттирующего типа, иногда с ознобом и потливостью, сохраняется около недели. В течение последующих 1-2 нед все проявления постепенно исчезают. Если заболевание затягивается более чем на 3 мес или
рецидивирует, диагноз острого пиелонефрита следует пересмотреть с целью исключения обострения хронического процесса.
Осложнения. Среди осложнений следует выделить сепсис, апостематозный нефрит (интерстициальный нефрит, характеризующийся формированием множественных гнойных очагов, особенно в корковом слое почки), карбункул почки, паранефрит, пионефроз и некроз почечных сосочков. Осложнения более характерны для детей раннего возраста.
Лабораторные исследования
Наиболее характерны для пиелонефрита патологические включения в моче. Она часто становится мутной, может содержать небольшое количество белка. В осадке обнаруживают множество лейкоцитов, иногда - лейкоцитарные цилиндры, большое количество эпителиальных клеток, могут быть эритроциты, возможны гематурия (при папиллярном некрозе) или сгустки свежей крови, свидетельствующие об остром воспалительном процессе в мочевом пузыре. Лейкоциты обычно представлены нейтрофилами. Почти всегда выявляют большое количество микроорганизмов (50 000-100 000 микробных тел в 1 мл, взятом из средней порции выделяемой мочи, - достоверный признак бактериального воспалительного процесса у детей старшего возраста, 10 000 микробных тел в 1 мл - у младшей возрастной группы).
При исследовании крови обнаруживают умеренную анемию, лейкоцитоз со сдвигом лейкоцитарной формулы влево, увеличение СОЭ, концентрации C- реактивного белка, диспротеинемию. Изменяются показатели иммунной системы: количество Т- и В-лимфоцитов, содержание Ig. Определяют повышенный титр сывороточных АТ к бактериям, выделенным из мочи.
Диагностика
Диагностика острого пиелонефрита особенно трудна у маленьких детей. Острый пиелонефрит необходимо исключить у любого ребѐнка первых лет жизни при немотивированных лихорадке, интоксикации и диспептических явлениях. У старших детей в типичных случаях ориентируются на совокупность таких признаков, как лихорадка, дизурия и боли в пояснице или животе. Основные симптомы - изменения в моче (лейкоцитурия и бактериурия). Диагноз должен содержать следующую информацию.
•Определение патогенетической сущности процесса (первичный или вторичный пиелонефрит) с указанием предрасполагающих к его развитию факторов (аномалии развития, рефлюкс, камни, нарушения обмена веществ и т.д.).
•Период заболевания (активный, обратного развития симптомов, полная клинико-лабораторная ремиссия).
•Состояние функций почек.
•Наличие или отсутствие осложнений.
