
3 курс / Патологическая физиология / ТИПОВЫЕ ПАТОЛОГИЧЕСКИЕ ПРОЦЕССЫ
.pdf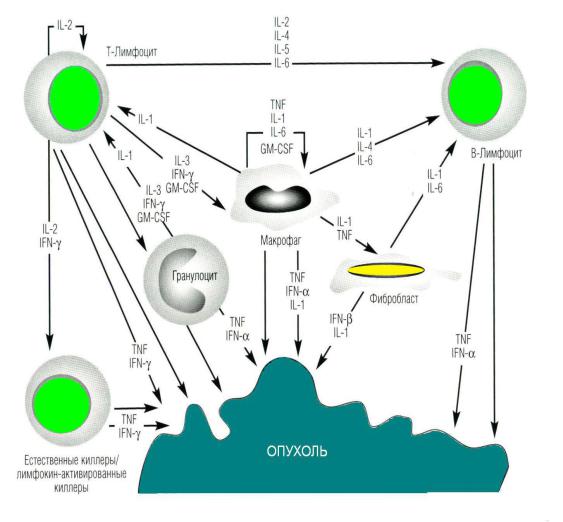
процесс пролиферации (это происходит, например, из-за уменьшения количества рецепторов для гормонов на мембране опухолевых клеток).
Специфический противоопухолевый иммунитет формируется на поздних стадиях опухолевого роста и малоактивен. Слабая антигенность опухолей (за счет антигенной дивергенции, антигенной реверсии и антигенного упрощения опухолевых клеток), развитие иммунодефицитного состояния в организме являются основными факторами, обеспечивающими неэффективность противоопухолевого иммунитета. Появление иммунодефицита в процессе развития опухоли может быть связано с эн- докринно-обменными нарушениями в организме и, в частности, с увеличением продукции кортикостероидов. Их действие приводит к угнетению иммунной системы, а проявляется это в угнетении лимфопролиферации и образования антител. Нарушение иммунной системы считается одним из важных факторов и условий в возникновении, развитии и прогрессии опухолевого процесса.
Влияние опухоли на организм. Паранеопластические синдромы
Паранеопластические синдромы - это совокупность признаков (симптомов), возникающих при выявлении опухоли, сопровождающих ее течение и исчезающих после удаления ново-
образования. Многие паранеопластические синдромы неспецифичны для определенных видов опухолей, могут возникать за месяцы и годы до развития клинических проявлений опухолевого процесса. Следовательно, многие стойкие отклонения в клинической картине должны вызывать онкологическую настороженность врача. Паранеопластические синдромы подразделяют на кожные, неврологи-
ческие, психоневрологические, параэндокринные, метаболические (с развитием раковой кахексии), гематологические, сосудистые, почечные, костные, иммунодепрессию (с повышенной подверженно-
стью к инфекционным заболеваниям) и др.
Среди кожных проявлений паранеопластического синдрома следует отметить эритему Гаммела, чернеющий акантоз, акро- и гиперкератоз, кожную порфирию, ихтиоз, гипертрихоз, псориаз, кожный зуд неясной этиологии, дерматомиозит. К группе неврологических проявлений паранеопластического синдрома относят мионейропатии (при миеломе, раке легкого и молочной железы),
191
полиневриты, а также синдромы, напоминающие миастению. Часто при раке молочной железы, плоскоклеточном раке почки, яичка, щитовидной железы выявляется паранеопластический синдром гиперкальциемии, который сопровождается развитием неврологических проявлений при отсутствии видимых поражений метастазами костной системы. При аденоме паращитовидных желез и раке легкого отмечаются гиперкальциемия и остеопороз. Конкретным примером паранеопластического синдрома может служить карциноидный синдром, который проявляется усиленной продукцией серотонина, гистамина, ряда нейромедиаторов, гормонов, вызывающих клинические проявления в виде со-
судистых изменений.
Среди признаков гематологического паранеопластического синдрома выделяют анемию,
не связанную с кровопотерей, эритроцитоз, полиглобулию (почечно-клеточный рак почки, опухоль Вильмса, рак надпочечников). Нередко при опухолях наблюдаются эозинофилия, моноцитоз, тромбоцитоз, лейкоцитоз, повышение СОЭ, нарушения системы свертывания крови – у большинства онкологических больных свертываемость крови повышена. Необходимо подчеркнуть, что факторы свертывающей и противосвертывающей систем крови могут способствовать инвазии опухолевых клеток в окружающие ткани, возникновению и стимуляции роста метастазов.
Продукты распада опухоли вызывают системную неспецифическую реакцию, заключающуюся в общей интоксикации организма, лихорадке. Продуцируемые злокачественными новообразованиями эктопические гормоны, нейромедиаторы, факторы роста могут влиять на клиническое течение и прогноз опухолевого процесса, а также использоваться в дифференциальной диагностике заболеваний.
Опухолевые маркеры
Уже в конце XIX в. в моче больных множественной миеломой были обнаружены специфические белки (иммуноглобулины), получившие название «белки Бенс-Джонса», однако следующего успеха пришлось ждать более 80 лет. Он связан с открытием Г.И. Абелевым и Ю.С. Татариновым α- фетопротеина в крови больных гепатомой. Эти исследования положили начало новому этапу в изучении факторов, ассоциированных с ростом злокачественных опухолей, и привели к открытию в ХХ столетии серии различных соединений, получивших название «опухолевые маркеры». Маркеры широко используются клиническими биохимиками для выявления первичной опухоли и ее метастазов. К маркерам злокачественного роста относят вещества различной природы. В их число входит более 200 соединений: антигены, гормоны, ферменты, гликопротеины, липиды, белки, метаболиты, концентрация которых коррелирует с массой опухоли, ее пролиферативной активностью, а в некоторых случаях – со степенью злокачественности новообразования. Аномальная экспрессия генома – один из основных механизмов продукции маркеров опухолевыми клетками, который обусловливает синтез эмбриональных, плацентарных и эктопических белков, ферментов, антигенов и гормонов.
Вкачестве «идеальных тестов» для ранней диагностики злокачественных опухолей предлагалось множество маркеров, однако эта проблема до настоящего времени остается нерешенной. Сложности обусловлены многообразием требований, предъявляемых к «идеальному маркеру». Идеальный опухолевый маркер должен продуцироваться опухолевой клеткой в достаточных количествах, чтобы его можно было определить с помощью современных методов. Он не должен присутствовать у здоровых людей и при доброкачественных опухолях, но должен выявляться на ранних стадиях опухолевого процесса еще до клинических проявлений опухоли. Количество опухолевого маркера должно быть прямо пропорционально объему опухоли, а его уровень должен коррелировать с результатами противоопухолевого лечения.
Вклинических исследованиях используется ряд достаточно эффективных «опухолевых маркеров», которые, однако, не всегда соответствуют всем вышеуказанным критериям в полной мере.
Современные биохимические и иммунологические методы позволяют выявить новообразования, когда число опухолевых клеток достигает 109-1010, а минимальный уровень секретируемого опухолью маркера – от одного до нескольких фемтомолей (10-15 моль) в 1,0 мл сыворотки крови. Большая эффективность использования опухолевых маркеров в клинике может быть достигнута путем комбинации разных тестов. Следует отметить, что количество предлагаемых маркеров для диагностики и мониторинга злокачественных новообразований постоянно увеличивается, и наступает этап критической их переоценки с целью формирования стратегии и адекватного использования. Большинство опухолевых маркеров в достаточной степени изучено (табл. 3 и 4).
192
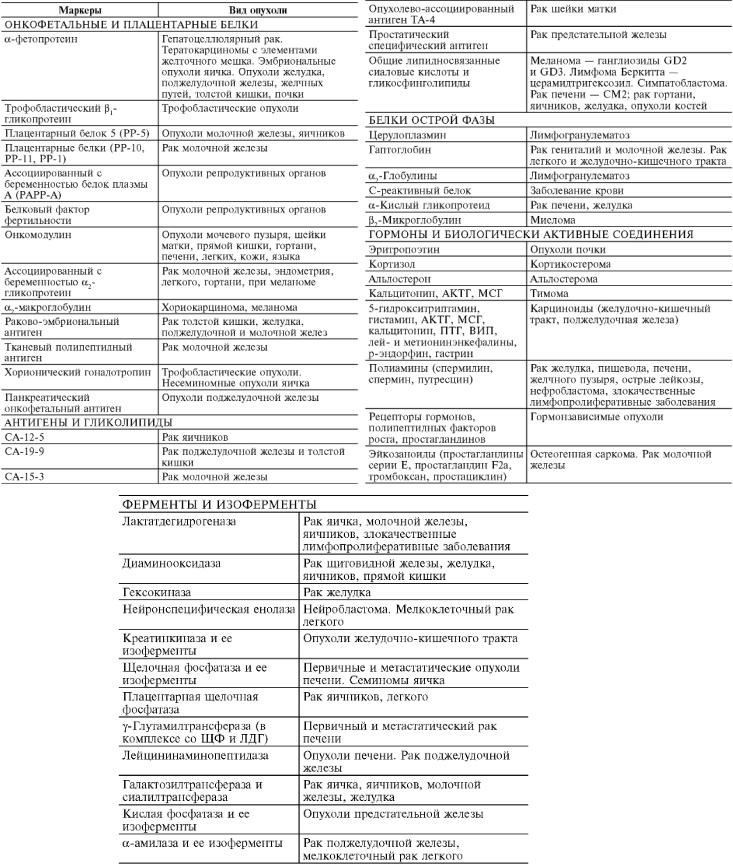
Таблица 3. Маркеры злокачественного роста
Примечание. АКТГ - аденокортикотропный гормон; ВИП - вазоактивный интестинальный пептид; ЛДГ - лактатдегидрогеназа; МСГ - меланоцитстимулирующий гормон; ПТГ - паратиреоидный гормон; ЩФ - щелочная фосфатаза.
193

Таблица 4. Гормоны, секретируемые опухолями, и вызываемые ими синдромы
Секретируемый гормон |
Клинический |
Локализация, вид опухоли |
|||||
синдром |
|||||||
|
|
|
|
|
|||
Кортикотропин |
|
|
Синдром |
Иценко- |
Аденомы гипофиза, опухоли надпочечников |
||
(АКТГ) |
|
|
Кушинга |
|
|
|
|
β-Эндорфин |
|
|
|
|
Аденомы гипофиза, |
феохромоцитомы надпочечни- |
|
|
|
|
|
ков |
|
||
|
|
|
|
|
|
||
Энкефалины |
|
|
|
|
Аденомы гипофиза, |
феохромоцитомы надпочечни- |
|
|
|
|
|
ков |
|
||
|
|
|
|
|
|
||
Катехоламины и их ме- |
|
|
Феохромоцитомы надпочечников. |
||||
таболиты |
|
|
|
|
Хемодектома, ганглионейрома, нейробластома |
||
Инсулин |
|
|
Гипогликемия |
Инсулиномы поджелудочной железы |
|||
Глюкагон |
|
|
Гипергликемия |
Глюкагономы поджелудочной железы |
|||
Панкреатический |
поли- |
|
|
Опухоли поджелудочной железы |
|||
пептид (ПП) |
|
|
|
|
|||
|
|
|
|
|
|
||
ВИП |
|
|
Синдром |
«водной |
ВИПы поджелудочной железы |
||
|
|
диареи» |
|
||||
|
|
|
|
|
|
||
Соматостатин |
|
|
|
|
Соматостатиномы поджелудочной железы |
||
Кальцитонин |
|
|
|
|
Медуллярные карциномы щитовидной железы |
||
КТ, гастрин, ВИП, инсу- |
Синдром Вермера |
МЭН-I: опухоли гипофиза, поджелудочной и пара- |
|||||
лин, ПП |
|
|
|
|
щитовидных желез |
|
|
КТ, катехоламины, |
|
Синдром Сиппла |
МЭН-II: медуллярный рак щитовидной и паращито- |
||||
ПТГ |
|
|
видной желез, феохромоцитомы надпочечников |
||||
|
|
|
|
||||
ОПУХОЛИ ЭНДОКРИННЫХ ЖЕЛЕЗ НЕ ИЗ КЛЕТОК APUD-СИСТЕМЫ |
|||||||
Гормон роста |
|
|
Гигантизм, акроме- |
Аденомы гипофиза |
|
||
|
|
|
галия |
|
|
|
|
Пролактин |
|
|
Аменорея- |
|
Пролактиномы гипофиза |
||
|
|
галакторея |
|
||||
|
|
|
|
|
|
||
Тиреотропин |
|
|
Гипертиреоидизм |
Аденомы гипофиза |
|
||
ЛГ |
|
|
|
|
Аденомы гипофиза |
|
|
ФСГ |
|
|
|
|
Аденомы гипофиза |
|
|
ПТГ |
|
|
|
|
Опухоли паращитовидных желез |
||
Хорионический |
гонадо- |
|
|
Трофобластические опухоли |
|||
тропин |
|
|
|
|
|||
|
|
|
|
|
|
||
АКТГ, β-эндорфин, |
эн- |
|
|
Опухоли легкого, яичника, щитовидной, молочной, |
|||
|
|
паращитовидных, поджелудочной желез, желудоч- |
|||||
кефалины, β-ЛПТ, |
α- |
|
|
||||
|
|
но-кишечного тракта, пищевода, тимомы, параган- |
|||||
МСГ |
|
|
|
|
|||
|
|
|
|
глиомы надпочечников |
|||
|
|
|
|
|
|||
Кортикотропинрилизинг- |
|
|
Опухоли легкого, яичника |
||||
фактор |
|
|
|
|
|||
|
|
|
|
|
|
||
Кальцитонин |
|
|
|
|
Опухоли легкого, молочной и поджелудочной же- |
||
|
|
|
|
лез, почек, желудочно-кишечного тракта |
|||
|
|
|
|
|
|||
Инсулин |
|
|
Гипогликемия |
Опухоли легкого, почек, молочной железы, шейки |
|||
|
|
матки |
|
||||
|
|
|
|
|
|
||
Вазопрессин |
|
|
|
|
Опухоли легкого, вилочковой железы, яичка, желч- |
||
|
|
|
|
ного пузыря |
|
||
|
|
|
|
|
|
||
Глюкагон |
|
|
Гипергликемия |
Опухоли почек, яичников, легкого |
|||
ВИП |
|
|
Синдром |
«водной |
ВИПы желудочно-кишечного тракта, эпидермиса, |
||
|
|
диареи» |
|
феохромоцитомы надпочечников |
|||
|
|
|
|
||||
Примечание. ЛГ - лютеинизирующий гормон, ЛПТ - липотрофин, ФСГ - фолликулостимулирующий гормон.
194
Раковая кахексия
Термин «кахексия» (от греч. kakos – плохой и hexis – состояние) обозначает состояние общего истощения организма, потери массы тела за счет мышечной и жировой ткани и встречается при различных заболеваниях. У онкологических больных кахексия характеризуется анорексией, отвращением к пище, снижением массы тела, анемией, мышечной слабостью, при этом наблюдается интенсивный распад жиров и белков в организме, в результате чего наступает смерть.
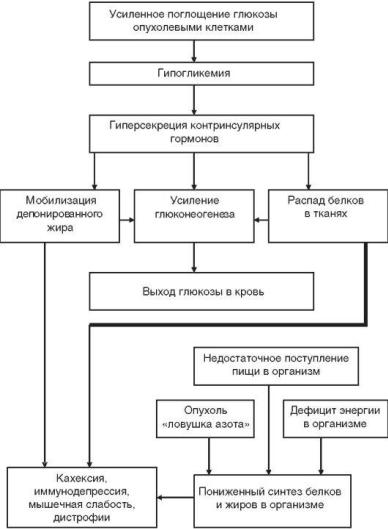
Растущая в организме опухоль затрагивает многие стороны деятельности организма, оказывает существенное влияние на различные его функции. Для интенсивных синтетических процессов в ходе пролиферации опухолью потребляется огромное количество энергии, которую она получает за счет гликолиза, определяющего большой расход глюкозы. Общеизвестно, что опухоль – «ловушка глюкозы». Поэтому в организме возникает угроза гипогликемии, что сопровождается активацией компенсаторно-приспособительных механизмов. Усиливается продукция контринсулярных гормонов. Это приводит к усиленному распаду гликогена в печени и в мышцах, к распаду белков и жиров в тканях и органах организма для усиления процессов глюконеогенеза. Все это обеспечивает сохранение нормогликемии в течение достаточно длительного времени. Указанная компенсация так называемого «гипогликемического давления опухоли на организм» (по В.С. Шапоту) имеет нежелательные последствия для организма. Отмечается повышенный распад лимфоидной ткани, что сопровождается развитием иммунодефицитного состояния, тем более что процесс синтеза антител в организме при гипогликемии снижен. Кроме этого имеется повышенный распад мышечной ткани, в результате у больных развиваются дистрофические изменения в мышцах, мышечная слабость.
Ворганизме-опухоленосителе ограничены возможности синтеза собственных белков и жиров, что усугубляет дистрофию тканей (мышечной, лимфоидной и др.) и кахексию. Это объясняется энергодефицитом (из-за гипогликемии), использованием метаболитов (аминокислот) для глюконеогенеза
иснижением поступления питательных веществ в организм из-за анорексии, возникающей у онкологических больных.
Многие биологически активные вещества, выделяемые опухолями и нормальными клетками организма, способны влиять на развитие кахексии при онкологической патологии. К ним относятся цитокины, неконтролируемое выделение которых может быть одной из причин изменения обмена веществ в организме-опухоленосителе. Высказываются предположения о том, что TNF-α, IL-6 и γ- интерферон, повышенная экспрессия которых часто определяется при кахексии, могут выступать в качестве медиаторов этого процесса, способствуя развитию интоксикации, анорексии, снижению массы тела. При кахексии перечисленные цитокины определяются в повышенном количестве не только в опухоли, но и в циркулирующих жидкостях, а при снижении их содержания возможно обратное развитие кахексии.
Вразвитии кахексии, вызванной онкологической патологией, определенную роль может играть фактор мобилизации липидов, который осуществляет прямой гидролиз триглицеридов в жировой ткани до глицерина и неэстерифицированных жирных кислот. Введение сыворотки крови мышей с лимфомой здоровым особям вызывало массивную мобилизацию жиров. Фактор мобилизации липидов присутствовал и в опухолевой ткани, и в культуре клеток лимфомы. Дальнейшие исследования показали, что это стабильный протеин с молекулярной массой около 5 кД, состоящий из двух субъединиц с высокой и низкой молекулярной массой. Он термостабилен, не реагирует на воздействие липазы, разрушается трипсином c образованием низкомолекулярной субъединицы, резистентной к воздействию протеолитических ферментов. Позже фактор мобилизации липидов был назван токсогормоном L. Его определили в асцитической жидкости больных гепатомой и у мышей с саркомой180. Соединение с аналогичными характеристиками присутствовало в сыворотке крови больных с клиническими проявлениями онкологической кахексии и отсутствовало у здоровых пациентов. Оно также не было обнаружено у больных со значительным снижением массы тела при болезни Альцгеймера. Содержание фактора мобилизации липидов в сыворотке крови больных злокачественными опухолями коррелировало со снижением массы тела, а при эффективном лечении уровень определяемого фактора снижался.
Несмотря на большое число исследований по изучению механизмов развития кахексии при раке, медиатор этого состояния до настоящего времени не выявлен. На первый взгляд кахексия представляется невыгодным состоянием для опухоли, так как смерть организма ведет и к умиранию опухоли. Однако рост новообразования сильно зависит от экзогенного поступления липидов и аминокислот, поэтому выработка опухолью факторов, способствующих процессам катаболизма тканей, необходима для повышения метаболизма в ней самой. В этом случае ингибиторы кахексии при раке с помощью отграничения опухоли от главного энергетического материала, вероятно, могут вызвать
195
снижение опухолевого роста. Все полученные результаты и высказанные исследователями предположения, возможно, помогут разработать новые подходы к лечению опухолей.
Рис. Патогенез раковой кахексии
Большинство людей не болеет раком не потому, что у них не возникают мутантные раковые клетки, а потому, что последние, возникнув, своевременно распознаются и уничтожаются Т-цитотоксическими лимфоцитами и другими звеньями иммунной системы раньше, чем успевают дать злокачественное потомство. Если раковые клетки вовремя не распознаются и не уничтожаются иммунной системой, то создаются условия для их беспрепятственного и бесконтрольного размножения.
ЛЕЧЕНИЕ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Большинство трансформированных клеток распознаются и устраняются иммунной системой. Ослабление защитных сил организма влечет за собой быстрое развитие опухоли. Можно пытаться подавить рост опухоли методами физиоили химиотерапии. Для этих целей используют рентгеновское облучение, которое благодаря мутагенному действию блокирует размножение клеток. Еще большее применение получило подавление опухолевого роста с помощью химиотерапии. Применяющиеся для этих целей вещества носят название цитостатиков. К сожалению, как облучение, так и химиотерапия — методы недостаточно избирательные, т. е. при таком воздействии на организм повреждаются и нормальные клетки, вследствие чего часто наблюдаются побочные эффекты.
196
ЗАНЯТИЕ №6
Тема: ГИПОКСИЯ
Актуальность темы. Гипоксия или кислородное голодание – типический патологический процесс, который возникает при разных заболеваниях и в значительной мере влияет на их развитие и завершение. Жизнь человека от его рождения и до смерти сопровождается явлениями гипоксии, поэтому не случайно изучение гипоксических состояний издавна привлекало к себе внимание многих исследователей.
Вследствие того, что кислородное голодание наблюдается при многих заболеваниях, то и в комплексе патогенетической терапии необходимо употреблять антигипоксические мероприятия, а это требует знания основных внешних проявлений кислородного голодания, сущности процессов, которые лежат в основе гипоксии, механизмов их развития и течения.
Общая цель – уметь охарактеризовать гипоксию как типический патологический процесс, оценивать функциональные расстройства в организме, объяснить основные механизмы повреждения и компенсации при кислородном голодании для того, чтобы выработать умение применять симптоматическое и патогенетическое лечение данной патологии на кафедрах клинического профиля.
Для этого необходимо уметь (конкретные цели):
1.Интерпретировать понятие «гипоксия», «гипоксемия», уметь классифицировать кислородное голодание по этиологии и патогенезу.
2.Обнаруживать основные проявления гипоксии и определять, какие реакции носят собственнопатологический, а какие защитно-приспособительный характер, объяснять механизмы их возникновения с целью обоснования симптоматической и патогенетической терапии гипоксических состояний.
Необходимые для реализации целей обучения базисные знания-навыки. Уметь:
1.Охарактеризовать легочную вентиляцию, объяснить механизм ее изменения в соответствии с изменениями газового состава крови (каф. нормальной физиологии).
2.Интерпретировать кислородную емкость крови (каф. нормальной физиологии).
3.Оценивать данные результатов исследования частоты дыхания и результатов спектрометрического анализа крови на содержание метгемоглобина (каф. нормальной физиологии, каф. биохимии).
ВОПРОСЫ К ЗАНЯТИЮ
1.Понятие «гипоксемия», «гипоксия».
2.Классификация кислородного голодания по этиологии и патогенезу.
3.Сущность и механизмы развития функциональных расстройств в организме при кислородном голодании.
4.Главные патогенетические механизмы развития каждой формы кислородного голодания.
5.Компенсаторные механизмы, которые препятствуют развитию кислородного голодания.
197
ТЕОРЕТИЧЕСКИЙ МАТЕРИАЛ ДЛЯ ПОДГОТОВКИ К ЗАНЯТИЮ
ГИПОКСИЯ
Термин «гипоксия, (hypoxia)» этимологически и содержательно трактуют двояко.
В одних случаях за основу берут терминологический элемент oxy как относящийся к кислороду – oxygenium (кислород). В такой трактовке термин «гипоксия» определяют следующим образом:
Гипоксия – состояние, возникающее в результате недостаточного обеспечения тканей организма кислородом и/или нарушения его усвоения в ходе биологического окисления.
Синонимами понятия «гипоксия» в такой трактовке являются «кислородное голодание» и «кислородная недостаточность».
В других случаях терминологический элемент oxy трактуют как относящийся к окислению (от англ. oxydation – окисление). В этом варианте термин «гипоксия» применяют в более широком смысле:
Гипоксия – типовой патологический процесс, развивающийся в результате недостаточности биологического окисления, приводящий к нарушению энергетического обеспечения функций и пластических процессов в организме.
Такая трактовка термина «гипоксия» означает абсолютную или относительную недостаточность уровня реального энергообеспечения по сравнению с уровнем функциональной активности и интенсивности пластических процессов в органе, ткани, организме. Это состояние приводит к нарушению жизнедеятельности организма в целом, расстройствам функций органов и тканей. Морфологические изменения в них имеют различный масштаб и степень, вплоть до гибели клеток и деструкции неклеточных структур.
Гипоксия (в любом варианте трактовки) нередко сочетается с гипоксемией.
Гипоксемия – (hypoxaemia; греч. hypo – ниже, лат. oxygenum – кислород, греч. haema –
кровь) – уменьшение по сравнению с должным уровнем напряжения и содержания кислорода в крови.
В связи с разработкой проблемы гипоксии в эксперименте (например, при работе с препаратами изолированных органов, фрагментов тканей или клеток) создают условия аноксии – отсутствия кислорода и, как правило, прекращения процессов биологического окисления – или аноксемии
– отсутствия кислорода в крови, применяемой для перфузии отдельных органов, тканей, клеток или субклеточных структур. В целостном живом организме формирование этих состояний невозможно.
Гиперкапния (hypercapnia; греч. hyper – сверх, kapnos – дым) – повышение напряжения углекислого газа в артериальной крови выше 50 мм рт.ст.
Гипокапния (hipocapnia; греч. hypо – ниже, греч. kapnos – дым) – понижение напряжения углекислого газа в артериальной крови ниже 40 мм рт.ст.
Гипоксические состояния классифицируют с учётом различных критериев: этиологии, выраженности расстройств, скорости развития и длительности гипоксии и т.д.
Классификации гипоксии
По этиологии выделяют несколько типов гипоксии, условно объединяемых в две группы:
Экзогенная или гипоксическая (нормо- и гипобарическая гипоксия);
Эндогенная:
Дыхательная (респираторная);
Гемическая (кровяная);
Циркуляторная;
Тканевая (гистотоксическая);
Перегрузочная;
Смешанная – любая тяжелая/длительная гипоксия приобретает тканевой компонент (гипоксия → ацидоз → блокада гликолиза → отсутствие субстрата для окисления → блокада окисления → тканевая гипоксия).
198
По распространенности (только для циркуляторной гипоксии)
Общая
Местная
По степени тяжести:
скрытая (выявляется только при нагрузке),
компенсированная – гипоксии в состоянии покоя нет за счет напряжения систем доставки кислорода,
выраженная – с явлениями декомпенсации (в покое – недостаточность кислорода в тканях),
некомпенсированная – выраженные нарушения обменных процессов с явлениями интоксикации,
терминальная – необратимая.
По критерию выраженности расстройств жизнедеятельности организма различают сле-
дующие виды гипоксии:
лёгкую,
среднюю (умеренную),
тяжёлую,
критическую (опасную для жизни, летальную).
Вкачестве основных признаков той или иной выраженности (тяжести) гипоксии используют следующие:
степень нарушения нервно-психической деятельности,
выраженность расстройств функций сердечно-сосудистой и дыхательной систем,
величину отклонений показателей газового состава и КОС крови, а также некоторых других показателей.
По критериям скорости возникновения и длительности гипоксического состояния выде-
ляют несколько его разновидностей:
Молниеносная (острейшая) гипоксия. Развивается в течение нескольких секунд. Как правило, через несколько десятков секунд (в пределах первой минуты) после действия причины гипоксии выявляется тяжёлое состояние пациента, нередко служащее причиной его смерти [(например, при разгерметизации летательных аппаратов на большой (более 9000-11000 м) высоте или в результате быстрой потери большого количества крови (например, при ранениях крупных артериальных сосудов или разрыве аневризмы их стенки)].
Острая гипоксия. Развивается через несколько минут (как правило, в пределах первого часа) после воздействия причины гипоксии (например, в результате острой кровопотери или острой дыхательной недостаточности).
Подострая гипоксия. Формируется в течение нескольких часов (но в пределах первых суток). Примерами такой гипоксии могут быть гипоксические состояния, развивающиеся в результате попадания в организм метгемоглобинообразователей (нитратов, окислов азота, бензола), венозной кровопотери, медленно нарастающей дыхательной или сердечной недостаточности.
Хроническая гипоксия. Развивается и/или длится более чем несколько суток (недели, месяцы, годы), например, при хронической анемии, сердечной или дыхательной недостаточности.
ЭКЗОГЕННЫЙ ТИП ГИПОКСИИ
К экзогенным типам гипоксии относят нормо- и гипобарическую гипоксию. Причина их развития: уменьшение парциального давления кислорода (р02) в воздухе, поступающем в организм.
При нормальном барометрическом давлении говорят о нормобарической экзогенной гипоксии.
199
При снижении барометрического давления экзогенную гипоксию называют гипобариче-
ской.
Нормобарическая экзогенная гипоксия
Причины нормобарической экзогенной гипоксии: ограничение поступления в организм кислорода с воздухом при нормальном барометрическом давлении. Такие условия складываются при:
Нахождении людей в небольшом и/или плохо вентилируемом пространстве (помещении, шахте, колодце, лифте).
Нарушениях регенерации воздуха и/или подачи кислородной смеси для дыхания в летательных и глубинных аппаратах, автономных костюмах (космонавтов, лётчиков, водолазов, спасателей, пожарников).
Несоблюдении методики ИВЛ.
Гипобарическая экзогенная гипоксия
Причины гипобарической экзогенной гипоксии: снижение барометрического давления при подъёме на высоту (более 3000-3500 м, где р02 воздуха снижено примерно до 100 мм рт.ст.) или в барокамере. В этих условиях возможно развитие либо горной, либо высотной, либо декомпрессионной болезни.
Горная болезнь наблюдается при подъёме в горы, где организм подвергается воздействию не только пониженного содержания кислорода в воздухе и пониженного барометрического давления, но также более или менее выраженной физической нагрузки, охлаждения, повышенной инсоляции и других факторов средне- и высокогорья.
Высотная болезнь развивается у людей, поднятых на большую высоту в открытых летательных аппаратах, на креслах-подъёмниках, а также при снижении давления в барокамере. В
этих случаях на организм действуют в основном сниженные р02 во вдыхаемом воздухе и барометрическое давление.
Декомпрессионная болезнь наблюдается при резком снижении барометрического давления (например, в результате разгерметизации летательных аппаратов на высоте более 10000-11000 м). При этом формируется опасное для жизни состояние, отличающееся от горной и высотной болезни острым или даже молниеносным течением.
Косновным звеньям патогенеза экзогенной гипоксии (независимо от её причины) отно-
сятся артериальная гипоксемия, гипокапния, газовый алкалоз, сменяющийся ацидозом; артериальная гипотензия, сочетающаяся с гипоперфузией органов и тканей.
Снижение напряжения кислорода в плазме артериальной крови (артериальная гипоксемия) – инициальное и главное звено экзогенной гипоксии. Гипоксемия ведёт к уменьшению насыщения кислородом Нb, общего содержания кислорода в крови и как следствие – к нарушениям газообмена и метаболизма в тканях.
Снижение напряжения в крови углекислого газа (гипокапния). Она возникает в результате компенсаторной гипервентиляции лёгких (в связи с гипоксемией).
Газовый алкалоз является результатом гипокапнии.
Вместе с тем следует помнить, что при наличии во вдыхаемом воздухе высокого содержания углекислого газа (например, при дыхании в замкнутом пространстве или в производственных условиях) экзогенная гипоксемия может сочетаться с гиперкапнией и ацидозом. Умеренная гиперкапния (в отличие от гипокапнии) не усугубляет влияний экзогенной гипоксии, а напротив, способствует увеличению кровообращения в сосудах мозга и сердца. Однако значительное увеличение рС02 в крови приводит к ацидозу, дисбалансу ионов в клетках и биологических жидкостях, гипоксемии, снижению сродства Нb к кислороду и ряду других патогенных эффектов.
Снижение системного АД (артериальная гипотензия), сочетающееся с гипоперфузией тканей,
в значительной мере является следствием гипокапнии. С02 относится к числу основных факторов регуляции тонуса сосудов мозга. Значительное снижение раС02 является сигналом к сужению просвета артериол мозга, сердца и уменьшения их кровоснабжения. Эти изменения
200
