3 курс / Патологическая физиология / Основы общей патологии
.pdf! |
|
|
|
581 |
|
|
тучклетнакапливают, ыеегозначительныхколичествах |
|
|
дробноописаннижев |
|
||
гранул.Мехпроцессадегрануляциихнизмпо |
|
|
|
|||
разделе «Анафилактреакци» ические |
|
.Отм,чтодетимгрануляция |
|
|||
|
|
|
|
|
|
|
возможнаответразличныестимулы: |
|
|
|
|
|
|
• Связываниеантигенчерезгомоцитотропныев |
|
рыпри(анафилактическом |
|
|||
иммуноглобулиныреагиновыерецепто |
|
|
|
|
||
воспалении). |
|
|
|
|
|
|
• Связываниефрагкомплементаентов |
|
|
— анафилотоксиновС |
5а |
||
иС 3а .вменьшей, мереС |
|
4а |
(приобычномианафилактическом |
|
||
воспалении). |
|
|
|
|
|
|
• Нейропептдиффузнойэндокриннойс ,стемыдынапример, |
|
йфизическиусилиями). и |
|
|||
вещеΡпри(аст,вызванновоме |
|
|
|
|||
• ЦитокиныИЛ( |
-1иИЛ |
-8 — приГЗТ). |
|
|||
•Физическиеповрежденияклетокприм( ханилической температурнойтравме).
•Агонипрострецепторовагландиновыхизоцианаты( синтетическкрасокгерметприаллергоиднойхастмеков« новостроек»).
•Никотиновуюкислотупри(аллергапоитдвнетойице
навитаминРР).
Типичкожреакциянагистаминтриада(сэраТомаса |
- |
Льюиса)выражаетсяточечнойэритместенаинъ,пекциири |
|
фокальнойэрите. ме |
|
Привоспалениигистаминвызыва |
етрасшартериолрение |
повышениепроницаемостивенул.Онусиливаетсекрецслиз, ию |
|
вызудиываетболь,способствуетосвобождениюкининов |
[338] егоэффектыперечисленыв |
липимед.Другиеныхиаторов |
|
таблице 17.Следуотм,чтогиетситьтаминужаеткрупные |
|
сосудычтоделает(егоучастникоманафилактического |
|
коронароспазма)и,подавляяфункциюномотопноговодителя |
1-реце),способенвызваторыари, тмииь |
сердечногоритмачерез( Η |
|
! |
|
583 |
|
сосусеротониндыействует,каквазок(онстрикторзм,ег жно |
|
|
|
эффектопосредовнервами)участвуеттогенмигрсм(. енизе |
)Серотонин. какнейромедиатор |
||
ниже «Больиеероль» |
|||
|
|
|
|
используетсяядрамишваучаствуетрегуляциисна |
|
|
|
бодрствования,перенсорндачеинформации, рмированиий |
|
|
|
эмоц,апрсистемномйгормональномдействиистимулирует |
|
|
|
стероидогенвнадпочечниках.Вышеужговзегоролиось |
|
|
|
прифиброплазии.Любопытно,чтоизбытоксеротонина |
|
|
|
способствуетобразованиюхиноновыхформфибринапод |
|
|
|
каталитическцерулоплазмидействием.Этпроизводныеа |
|
иобразуютстойкиедепозиты. |
|
фибррезикфибринастентныолизу |
|
||
Именнопоэтубольныхкарциноидомму (серотонинпродуцирующейопухольюизэнтерохромаффинных клеток)воспаленияпротеквырфиброзоютженным
фибриновыедепозитымогутвызватьпорокисердцаВ.( |
З. Горкин, |
|
1966)А. . |
Гавенлок |
исоавторыуказывают,чтосходныеявления |
могутприводитькпоражениюпроцессовфибру инотелейиза тропичстранприерееданиискихбогатыхсеротониномбананов!
Моноразрушаетминсерсобразовксидазатониннием ацетальдегидаиндолкислоты,луксусной экскретируемых мочой.
Полиаминырассм,кпротивовоспалительныектриваются медиаторыстимуляторырепарации,клеточныемед аторы ростовогоэффексома.таомединов
Катехтромбоцитламиныпроисхожденияучавствуютрного развитииспазмасосудоввосстанов лениинарушеннойсосудистой проница.Болееподробнорольбиогенмостиаминовых характеризуетсяв таблице 17.
Полипептиднмедиаторые
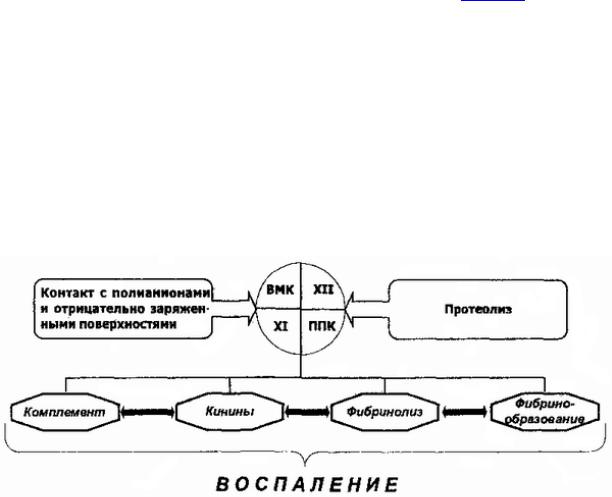
Большполимедиаторовнствопептидныхвоспаления присутствуютби ологическихжидкостяхорганизмадоначал воспаленнеактформеивступаютивнойяде результатествие каскадногопротеолиза.
! |
587 |
циркулируютвнеактформеза(внойсключениемфактораD, которыйприсутствуетплазмемалыхколичествах,активном виде),самособивответнаопределенныесигналыаются, активируютдругапричем(служатэтомсериновыми
протеазами/илив заимнымирецепторами),врезультате осуществнесковажныхэффелькояют,основныеизктовоторых:
•Лизисмишеней,активирующихкомплемент;
•Опсонизацобъектов,фиксфакторыикомплементаярующих;
•Хемотаксисусилениефагоцитоза;
• Активациялейкоцитов |
иопосредованиеихадгезии; |
•Регуляцияиммунногоответа;
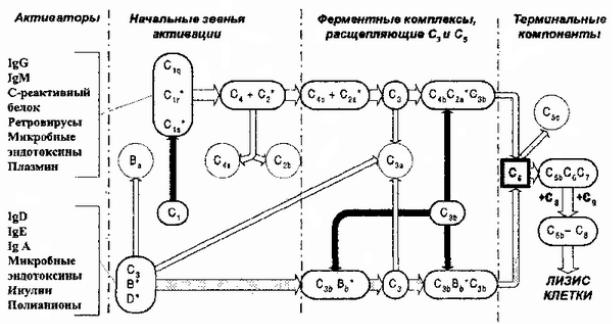
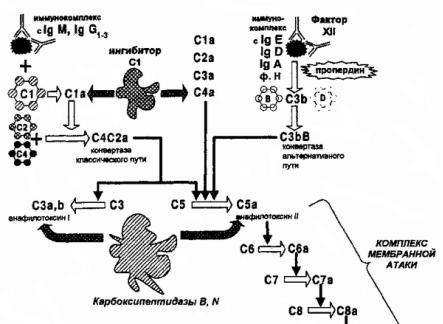
•Освобождениемедиатороввоспа.Бекомплементаенияки услподразделяювнафакторыклассическогопуактивациися
(обозначаютсябуквСсоответствующимийиндексами |
|
— С1,С 2, |
||
С4),факторыал |
ьтернативногопутиактивацииВ(, термD), нальные |
5,С 6 С7,С |
8,С 9),атакже |
|
компонмеплексамбраннойытС(аки |
|
|||
усиингибиторылителикомплементаΡ,Η(, СI, |
4bр |
, DAF, MCP, |
||
HRF,С |
1, [342] IΝНидр.)Особняком. стоитцентральныйфактор |
|
|
|
всейистемыС |
3, входящобапутктивациикомплементай |
|
|
|
участвующийреализацпрактическивсехегофункций. |
|
|
||