
3 курс / Патологическая физиология / Nedost
.pdf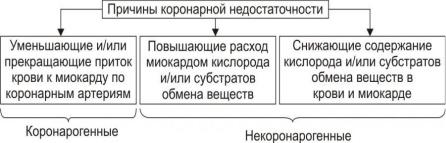
развивается коронарная недостаточность. Возникает несоответствие между потребностями миокарда в кислороде, с одной стороны, и уровнем оксигенации кардиомиоцитов - с другой. В результате возникшего дефицита кислорода в клетках сердечной мышцы нарушаются энергообразование, а также другие метаболические процессы, что приводит к изменению сократительной функции миокарда в зоне ишемии, появлению болевого синдрома
(стенокардии).
Клинические формы ИБС:
• внезапная коронарная смерть,
• стенокардия напряжения (впервые возникшая, стабильная, прогрессируюшая и спонтанная (особая),
•инфаркт миокарда (крупноочаговый, мелкоочаговый),
•аритмии,
•постинфарктный кардиосклероз,
•сердечная недостаточность.
Этиология коронарной недостаточности
Выделяют 2 основные группы причин коронарной недостаточности.
1.Коронарогенные: уменьшение или прекращение притока крови к миокарду по коронарным артериям (абсолютная недостаточность),
2.Некоронарогенные: повышение потребности миокарда в кислороде и субстратах обмена веществ; а также снижение содержания кислорода или субстратов обмена веществ в крови коронарных артерий (например, при общей гипоксии).
Коронарная недостаточность может быть абсолютной и относительной.
I. Абсолютная коронарная недостаточность – это коронарная недостаточность,
вызванная уменьшением или полным закрытием просвета коронарных артерий и снижением доставки крови к миокарду.
Причины:
1.Атеросклероз коронарных артерий является морфологической основой ишемического повреждения сердца в подавляющем большинстве случаев (90% и более). При уменьшении просвета венечной артерии на 70-80% возникают выраженные приступы стенокардии напряжения.
2.Спазм коронарных артерий. Следует сказать, что спастическая реакция сосудов сердца на те, или иные воздействия может вызвать болевой приступ даже при незначительном стенозе коронарных артерий и, более того, при полном отсутствии такового.
3.Тромбоз коронарных артерий. Чаще тромбы формируются на поверхности атеросклеротической бляшки, где нарушились структура и целостность эндотелиального слоя, в виде изъязвления и деструкции бляшки. Поскольку в таких ситуациях просвет коронарных артерий быстро перекрывается стремительно образующимся тромбом, а коллатеральное кровообращение не успевает компенсировать сниженный кровоток, то возникает нестабильная форма стенокардии и может развиться инфаркт миокарда или наступить внезапная сердечная смерть.
4.Уменьшение притока крови к сердцу и снижение в связи с этим перфузионного давления в коронарных артериях. К этому приводят значительная брадикардия или
11
тахикардия, трепетание и мерцание предсердий и/или желудочков сердца, недостаточность аортальных клапанов, острая артериальная гипотензия, уменьшение ОЦК, сдавление коронарных артерий сердца (рубцом, опухолью).
II. Относительная коронарная недостаточность – это коронарная недостаточность,
вызванная повышением «запроса» и расхода миокардом кислорода и субстратов метаболизма в сравнении с уровнем их притока. Она может развиваться при измененных и неизмененных артериях сердца и при нормальном или даже повышенном уровне притока крови к миокарду. Это состояние возникает при гипертоническом кризе, чрезмерной физической нагрузке, при двусторонней пневмонии и др.
Причины:
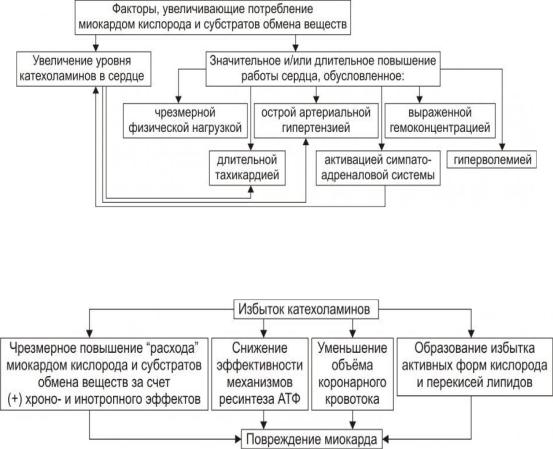
1. Факторы, увеличивающие потребление миокардом кислорода и субстратов обмена веществ (см. рис.):
Механизмы кардиотоксического действия избытка катехоламинов в миокарде.
Избыток катехоламинов (КА) в миокарде (например, при стрессе или феохромоцитоме) обусловливает развитие их кардиотоксического эффекта.
1.Чрезмерное повышение расхода O2 и субстратов метаболизма миокардом, что связано с положительным хроно- и инотропным эффектами КА и значительным возрастанием в связи с этим выполняемой сердцем работы.
2.Снижение эффективности ресинтеза АТФ, что обусловлено повреждением мембранного аппарата кардиомиоцитов, инактивацией ферментов тканевого дыхания, гликолиза (КА стимулируют образование свободных радикалов, активируют процесс ПОЛ). КА активируют липолиз, образование ВЖК, что приводит к разобщению процессов окислительного фосфорилирования.
3.Уменьшение величины коронарного кровообращения в результате укорочения диастолы (катехоламиновая тахикардия), в течение которой приток крови к миокарду максимален, повышения напряжения миокарда и сдавления в связи с этим коронарных сосудов, усиления агрегации клеток крови в просвете микрососудов.
12
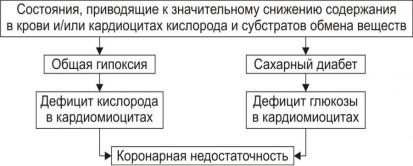
2. Состояния, приводящие к снижению содержания в крови и/или кардиомиоцитах кислорода и субстратов метаболизма.
Виды коронарной недостаточности: в зависимости от степени и обратимости поражения миокарда, подразделяют на обратимые и необратимые.
1. Обратимые нарушения коронарного кровотока Обратимые (транзиторные) нарушения коронарного кровотока клинически проявляются
различными формами стенокардии и состояниями после реперфузии (реваскуляризации) миокарда, включая состояние оглушенного миокарда.
Стенокардия (angina pectoris – «грудное сжатие», «грудное стеснение», от лат. ango - сжимать). Достаточно распространенным является также термин «грудная жаба».
Стенокардия – заболевание, обусловленное коронарной недостаточностью, и характеризующееся обратимой ишемией миокарда. Характеризуется в типичных случаях сильной сжимающей болью в области грудины слева вследствие ишемии миокарда. Боль часто иррадиирует в область левой лопатки и левого плеча. Типичный приступ стенокардии длится от 1 до 5-10 мин. Обычно ангинозные боли быстро исчезают после прекращения физической нагрузки, но появляются вновь после ее возобновления.
Состояние оглушенного миокарда. Гибернирующий миокард, или иначе говоря, миокард, находящийся в состоянии спячки. Гибернация – это очаговая обратимая дисфункция миокарда. Этим термином в 1986г. американский физиолог E. Braunwald обозначил ишемическое повреждение сердца, которое напоминает инфаркт миокарда, но в отличие от последнего характеризуется обратимостью электрофизиологических изменений.
Гибернирующий участок миокарда сохраняет жизнеспособность, но перестает сокращаться. Он как бы балансирует между жизнью и смертью. Ишемические изменения в этом случае носят обратимый характер, и восстановление коронарного кровотока, как правило, сопровождается восстановлением сократимости кардиомиоцитов. Однако если состояние ишемии продлится слишком долго, в зоне гибернации могут произойти необратимые изменения, заканчивающиеся гибелью клеток миокарда.
2. Необратимые нарушения коронарного кровотока
Необратимое прекращение или длительное значительное уменьшение кровотока по коронарным артериям завершается, как правило, инфарктом миокарда.
Инфаркт миокарда (ИМ) — очаговый некроз сердечной мышцы, который развивается в связи с резким и продолжительным уменьшением коронарного кровотока. Чаще ИМ поражает мышцу левого желудочка.
При типичном течении ИМ клинически проявляется: сильные боли
(продолжительностью более 15 мин, не купирующийся нитроглицерином), симптомы сердечной недостаточности, аритмии, повышение температуры тела, лейкоцитоз, увеличение СОЭ, гиперферментемия.
ЭКГ-признаки: при инфаркте миокарда возникают изменения сегмента ST и зубца Т — депрессия или подъѐм сегмента ST и инверсия зубца Т. Подъѐм сегмента ST — характерный признак инфаркта миокарда, свидетельствующий о повреждении миокарда. Через 8–12 ч от
13
начала боли на ЭКГ возникает важный признак инфаркта миокарда — патологический зубец Q (характеризующий наличие некроза миокарда).
Боль. Основной причиной болей при ИМ является накопление в зоне ишемии лактата, который раздражает нервные окончания афферентных симпатических волокон. Кроме того, важная роль в генезе болей отводится простагландинам и брадикинину, которые в больших количествах накапливаются в ишемизированной ткани. Существуют и так называемые
безболевые инфаркты миокарда, при которых боль отсутствует.
Симптомы сердечной недостаточности (одышка, тахикардия, отеки и гипотензия)
относятся к типичным проявлениям ИМ. Появление этих симптомов связано с нарушением насосной функции сердца, которая снижается прямо пропорционально размеру очага некроза. Если размер зоны инфаркта составляет 50% от массы левого желудочка, то такое поражение миокарда, как правило, несовместимо с жизнью, поскольку центральная гемодинамика в этом случае страдает настолько, что нарушается кровоснабжение жизненно важных органов.
Нарушения сердечного ритма практически всегда сопровождают развитие инфаркта миокарда.
Резорбционный синдром. Характерными признаками инфаркта миокарда являются:
повышение температуры, лейкоцитоз, увеличение СОЭ, гиперферментемия. Коронарный кровоток в зоне ишемии никогда не падает ниже 10% от нормального уровня, поэтому в кровь из пораженного миокарда поступают продукты распада кардиомиоцитов. В результате формируется симптомокомплекс, получивший название резорбционного синдрома. В частности, уже в конце первых - начале вторых суток начинает повышаться температура тела, что связано с резорбцией некротических масс. Для картины периферической крови в это время характерен нейтрофильный лейкоцитоз со сдвигом влево. СОЭ начинает возрастать спустя 1-3 суток после возникновения заболевания и сохраняется на повышенном уровне 3-4 недели, иногда дольше. Для инфаркта миокарда характерна также гиперферментемия, т.е. повышение активности ферментов в плазме крови. При возникновении некроза они поступают из некротизированных миокардиальных клеток в кровь. При появлении инфаркта миокарда повышается активность ферментов крови: креатинфосфокиназы (КФК), аспартатаминотрансферазы (АсАТ), лактатдегидрогеназы (ЛДГ). Информативным показателем развития инфаркта миокарда может быть также повышение в крови уровня миоглобина. Уровень миоглобина в крови больных крупноочаговым инфарктом миокарда может повышаться в 4-10 раз и более по сравнению с нормой.
Осложнения инфаркта миокарда.
Ранние осложнения: кардиогенный шок, острая сердечная недостаточность, острая аневризма и разрывы сердца, тромбоэмболические осложнения, нарушения ритма и проводимости, перикардиты.
Поздние осложнения возникают в подостром периоде рубцевания инфаркта миокарда: постинфарктный перикардит, хроническая аневризма сердца, хроническая сердечная недостаточность и др.
Если инфаркт не приводит к смерти пациента, то погибший участок сердца замещается соединительной ткань — развивается крупноочаговый кардиосклероз.
Изменения показателей сократительной функции сердца при инфаркте миокарда.
•Ударный и сердечный выброс – снижаются. Причина: «выключение» ишемизированного региона миокарда из сократительного процесса. Одним из механизмов компенсации снижения ударного выброса сердца является тахикардия. Она обусловлена главным образом активацией симпатикоадреналовой системы (в ответ на падение величины сердечного выброса), а также — повышением давления крови в полых венах и предсердиях.
•Конечное диастолическое давление в полостях сердца обычно возрастает. Основные причины: снижение сократительной функции повреждѐнного миокарда и уменьшение степени диастолического расслабления миокарда. Это вызвано субконтрактурным состоянием его в связи
сизбытком Ca2+ в цитозоле и миофибриллах кардиомиоцитов.
•Скорость систолического сокращения и диастолического расслабления миокарда существенно снижается. Основные причины: дефицит энергии АТФ, повреждение мембран миофибрилл, саркоплазматической сети и саркоплазмы.
14
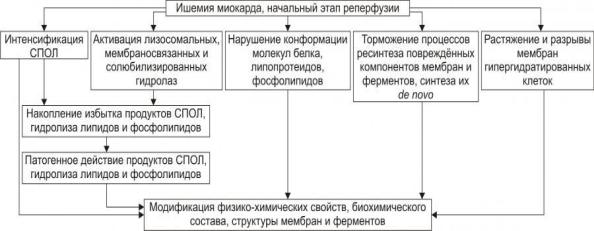
Патогенез ишемического и реперфузионного синдромов при коронарной недостаточности, их проявления
Основные звенья патогенеза ишемического повреждения кардиомиоцитов.
1.Нарушение энергообеспечения кардиомиоцитов. В аэробных условиях в кардиомиоцитах основными субстратами для синтеза АТФ служат жирные кислоты (65–70%), глюкоза (15–20%) и лактат (10–15%). В условиях нарастающей ишемии в миокарде развивается снижение интенсивности окислительного фосфорилирования, что приводит к активации гликолиза и накоплению в миокарде лактата.
Быстро уменьшаются запасы гликогена. Активация гликолитического метаболизма углеводов обусловливают развитие ацидоза, что существенно изменяет проницаемость мембран для метаболитов и ионов, подавляет активность ферментов энергообеспечения, синтеза клеточных структур, транспорта субстратов метаболизма и катионов.
Последствия: снижение сократительной функции миокарда, нарушения кровообращения в органах и тканях, развитие сердечных аритмий.
2.Повреждение мембран и ферментов кардиомиоцитов. Основные свойства миокарда
(автоматизм, возбудимость, проводимость, сократимость), а также их регуляция в значительной мере зависят от состояния мембран и ферментов кардиомиоцитов. В условиях ишемии их повреждение является следствием действия ряда общих факторов (см. рис.).
3.Дисбаланс ионов и жидкости развивается вслед за расстройствами энергообеспечения
кардиомиоцитов, повреждением их мембран и ферментов или одновременно с ними. Увеличение K+ вне кардиомиоцитов вследствие снижения активности Na+, K+-АТФазы,
дефицита АТФ, повышения проницаемости плазматической мембраны.
Потеря K+ кардиомиоцитами сопровождается повышением его содержания в интерстициальной жидкости и крови.
Гиперкалиемия является одним из характерных признаков коронарной недостаточности,
особенно при инфаркте миокарда.
Повышение содержания ионов Na+ в кардиомиоцитах, увеличение Ca2+ в клетках миокарда, расстройство регуляции объѐма клеток миокарда. Указанные факторы приводят к накоплению избытка жидкости в клетках миокарда и существенному увеличению их объѐма.
Дисбаланс ионов и жидкости вызывает нарушение сократительной функции миокарда и электрогенеза. При ишемии страдают все процессы мембранного электрогенеза: возбудимость, автоматизм, проводимость клеток миокарда. В связи с существенным расстройством трансмембранного электрогенеза развиваются аритмии сердца.
4.Расстройства механизмов регуляции сердечной деятельности.
• На начальном этапе ишемии миокарда, как правило, наблюдается значительная активация симпатикоадреналовой системы. Это сопровождается увеличением содержания в миокарде норадреналина и особенно адреналина. Вследстие этого развивается тахикардия и увеличивается сердечный выброс.
15
Паралелльно с этим могут усиливаться и парасимпатические влияния (о чем свидетельствует увеличение содержания в миокарде ацетилхолина - АХ). Однако, эффекты симпатических воздействий на сердце преобладают.
• На более поздних сроках коронарной недостаточности отмечаются признаки доминирования парасимпатических влияний (уменьшение содержания в миокарде норадреналина и сохранение повышенного уровня АХ). Отмечается развитие брадикардии, снижение величины сердечного выброса, скорости сокращения и расслабления миокарда.
В условиях коронарной недостаточности (особенно при длительном еѐ течении) нередко отмечается феномен гормоно-нейромедиаторной диссоциации катехоламинов. Характерное для этого феномена значительное увеличение в ишемизированном миокарде концентрации адреналина при одновременном существенном снижении в нем содержания норадреналина играет в основном патогенную роль (см. выше механизм кардиотоксического действия КА).
Механизмы реперфузионного повреждения миокарда
Возобновление тока крови (реперфузия) является самым эффективным способом прекращения действия патогенных факторов ишемии миокарда и устранения последствий их влияния на сердце.
Для восстановления миокардиального кровообращения при хронической ИБС были разработаны различные методы хирургической реваскуляризации, среди которых наибольшее распространение получила операция аортокоронарного шунтирования, суть которой сводится к формированию сосудистого шунта, обеспечивающего кровоток в обход склерозированного участка венечной артерии.
Адаптивные эффекты реперфузии:
•препятствует развитию инфаркта миокарда,
•предотвращает формирование аневризмы в ранее ишемизированной зоне сердца,
•способствует образованию соединительной ткани в стенке аневризмы, если она развилась;
•потенцирует восстановление сократительной функции сердца.
В то же время оказалось, что восстановление коронарного кровотока даже после непродолжительной ишемии может вызвать реперфузионное повреждение сердца, для которого характерны следующие проявления:
1.сократительная дисфункция сердца – уменьшения силы сокращений миокарда и его неполного диастолического расслабления, в результате чего уменьшается сердечный выброс.
2.нарушения сердечного ритма;
3.феномен невосстановленного кровотока (no-reflow phenomenon) – это сохранение дефицита коронарной перфузии после возобновления магистрального кровотока в ветвях венечных артерий, питающих ишемизированные участки миокарда.
Главными факторами, препятствующими восстановлению коронарной микроциркуляции после реперфузии миокарда, являются:
• набухание клеток эндотелия;
• агрегация форменных элементов и повышение вязкости крови;
• образование тромбов;
• «краевое стояние» лейкоцитов у стенки микрососудов и инфильтрация ими сосудистой стенки.
Основными механизмами реперфузионного повреждения миокарда являются так называемые кальциевый парадокс и кислородный парадокс.
Кальциевый парадокс – это перегрузка кардиомиоцитов ионами Са2+. Ионы Са2+ в избытке проникают через сарколемму кардиомиоцитов, накапливаясь в саркоплазматическом ретикулуме и митохондриях. Механизм усиленного проникновения Са2+ через клеточную мембрану тесно связан с нарушением Na+/ Са2+ обмена.
Если в норме основное поступление Са2+ в клетку происходит через медленные Са2+-
каналы, то в условиях реперфузии резко активируется Na+/Са2+-транспорт (обмен
16
внутриклеточного Na+ на внеклеточный Са2+), который осуществляется белком-переносчиком, расположенным на сарколемме.
Кальциевая перегрузка кардиомиоцитов ведет к замедлению процесса расслабления сердца (реперфузионная контрактура), что сопровождается уменьшением диастолического объема сердца и снижением сердечного выброса.
Кислородный парадокс – это токсическое действие кислорода, которое испытывает миокард в момент реоксигенации после ишемии. Дефицит кислорода приводит к восстановлению переносчиков электронов (НАДН-дегидрогеназа, убихинон, цитохромы) в дыхательной цепи митохондрий. В момент реоксигенации эти переносчики становятся донорами электронов для молекул кислорода. Последние при этом превращаются в свободные радикалы (активные формы кислорода). Активные формы кислорода повреждают молекулы ферментов, осуществляющих энергозависимый транспорт ионов в кардиомиоцитах. В результате происходит нарушение внутриклеточного ионного гомеостаза, развивается перегрузка кардиомиоцитов Са2+ и, как следствие, страдает сократительная функция сердца.
Таким образом, и кальциевый, и кислородный парадоксы приводят к перегрузке кардиомиоцитов ионами Cа2+. Более того, в условиях реперфузии оба эти патологических процесса взаимно усиливают друг друга.
В настоящее время сформулировано положение о том, что коронарная недостаточность является совокупностью двух синдромов: ишемического и реперфузионного, а не только одного
— ишемического, как считалось ранее.
Эндогенные механизмы защиты сердца при ишемии и реперфузии. Долгое время господствовало мнение, что клетки сердца абсолютно беззащитны в отношении ишемического повреждения.
Ситуация изменилась в 1986 г., когда американские физиологи Murray и Jennings в экспериментах на собаках обнаружили так называемый феномен адаптации к ишемии
(феномен ишемического прекондиционирования – ischemic preconditioning,). Суть этого явления сводится к повышению устойчивости миокарда к длительной ишемии в тех случаях, когда ей предшествовали несколько эпизодов 5-мин ишемии.
Авторы показали в экспериментах на собаках, что если моделировать кратковременные 5- мин эпизоды сублетальной ишемии миокарда и чередовать их с периодами восстановления коронарного кровотока, это задерживает развитие некроза в миокарде собаки при последующей продолжительной ишемии, в итоге зона инфаркта оказывается на 75% меньше по сравнению с контрольной группой. Показано, что механизм феномена ишемической адаптации тесно связан с активацией АТФ-зависимого К+-канала (К+АТф-канал). В результате отмечается тенденция к нормализации внутри- и внеклеточного баланса ионов.
Адаптация сердца к ишемии на уровне целого организма. Повышенная устойчивость миокарда к ишемии формируется при физических тренировках или периодическом действии на организм гипоксии, холода, кратковременного стресса и любых других экстремальных воздействий. Особенностью подобной адаптации является развитие ее перекрестных эффектов (например, при адаптации к холоду одновременно повышается устойчивость миокарда к ишемии).
17
