
5 курс / Паллиативная помощь / Национальное_руководство_по_паллиативной_медицинской_помощи_в_онкологии
.pdf
Лечение пациентов с метастатическим поражением костей при раке легких и меланоме имеет плохие результаты (табл. 6). У пациентов, имеющих рак легких, метастазы в основном множественные. Медиана выживаемости у данной группы составляет менее одного года. В настоящее время выделяют следующие факторы, которые положительно влияют на выживаемость больных раком легкого: гистологический подтип аденокарциномы, солитарные поражения, отсутствие висцеральных метастазов, хорошее общее состояние здоровья пациента и использование химиотерапии, применение таргетной терапии (ингибитор EGFR).
Таблица 6. Выживаемость онкологических больных, которым проводилось
хирургическое лечение метастазов в кости
Авторы, год публикации исследования |
Кол-во пациентов |
Локализация первичной опухоли |
Медиана выживаемости (месяцы) |
6 месяцев (%) |
1 год (%) |
2 года (%) |
3 года (%) |
5 лет (%) |
10 лет (%) |
|
|
|
|
|
|
|
|
|
|
Lin |
295 |
Рак почки |
|
|
47 |
30 |
|
11 |
|
2007 |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Hwang |
135 |
Рак почки |
|
|
72 |
|
45 |
28 |
|
2014 |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Toyoda |
50 |
Рак почки |
12 |
|
|
37 |
|
|
|
2007 |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
19,2; |
|
Szendrői |
64 |
Рак почки |
|
|
58 |
39,5 |
30 |
При |
|
2010 |
|
|
солитарных |
|
|||||
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
35,5 |
|
|
|
|
|
|
|
|
|
|
|
Dürr |
|
Рак |
|
|
|
|
|
13; При |
|
70 |
молочной |
|
|
59 |
36 |
|
солитарных |
7 |
|
2002 |
|
|
|
||||||
|
железы |
|
|
|
|
|
39 |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
Ahn |
|
Рак |
|
|
|
|
|
|
При |
110 |
молочной |
55 |
|
|
|
|
|
солитарных |
|
2013 |
|
|
|
|
|
||||
|
железы |
|
|
|
|
|
|
34,9 |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
Weiss |
|
Рак |
|
|
|
|
|
|
|
301 |
молочной |
|
|
45 |
27 |
|
8 |
|
|
2014 |
|
|
|
|
|||||
|
железы |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Oster |
|
Рак |
|
|
|
|
|
|
|
621 |
молочной |
|
|
66,3 |
|
32,8 |
|
|
|
2013 |
|
|
|
|
|
||||
|
железы |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Sugiura |
118 |
Рак легкого |
9,7 |
59,9 |
36 |
11 |
|
|
|
2008 |
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
120

Weiss and |
98 |
Рак легкого |
3 |
24 |
13 |
6 |
|
|
|
Wedin 2011 |
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Oster 2013 |
477 |
Рак легкого |
|
|
19 |
|
2,5 |
|
|
|
|
|
|
|
|
|
|
|
|
Ratasvuori |
|
Все типы |
|
|
|
|
|
|
|
1107 |
первичной |
|
58 |
41 |
|
|
2 |
|
|
2013 |
|
|
|
|
|||||
|
опухоли |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Harvey |
|
Все типы |
|
|
|
|
|
|
|
158 |
первичной |
|
|
51 |
29 |
|
|
|
|
2012 |
|
|
|
|
|
||||
|
опухоли |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Mavrogenis |
|
Все типы |
|
|
|
|
|
|
|
110 |
первичной |
|
|
54 |
30 |
20 |
16 |
|
|
2012 |
|
|
|
||||||
|
опухоли |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Все типы |
|
|
|
|
|
|
|
Wedin 2012 |
208 |
первичной |
|
|
40 |
21 |
16 |
|
|
|
|
опухоли |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Hansen |
|
Все типы |
|
|
|
|
|
|
|
474 |
первичной |
|
|
39 |
26 |
18 |
|
|
|
2004 |
|
|
|
|
|||||
|
опухоли |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Nakayama |
|
Рак |
|
|
|
|
|
|
|
40 |
щитовидной |
|
|
77 |
|
|
64 |
45 |
|
2014 |
|
|
|
|
|||||
|
железы |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Некоторые данные последних исследований выживаемости онкологических больных, которым проводилось хирургическое лечение метастазов в кости, представлены в табл. 6. В исследованиях, где включены все типы первичной опухоли, показатели однолетней выживаемости находились в диапазоне от 40 до 50%, при этом показатели значительно ниже, чем при метастазах рака молочной железы, почки, предстательной железы и дифференцированного рака щитовидной железы, но выше, чем при метастазах рака легких. Отмечены высокие значения однолетней выживаемости при раке молочной железы и почки (от 45 до 59%), в течение первых пяти лет показатели выживаемости снижаются (от 8 до 20%). Наилучшие пятилетние результаты были достигнуты у тех пациентов, которым выполнено хирургическое лечение солитарных метастазов.
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
Хирургическое пособие не является основным методом лечения метастазов в кости. При множественных метастазах в кости различные типы паллиативной системной терапии, такие как химио-, радиоили гормональная терапия, таргетная терапия или иммунотерапия, являются основными. Вероятность патологического перелома может быть
121
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/

эффективно снижена при использовании бисфосфонатов и деносумаба. Хирургическое вмешательство выполняется при осложненном течении метастатического процесса в костях – патологический перелом или его угроза, компрессия спинного мозга, выраженный болевой синдром, а также при солитарном поражении.
Основными целями хирургического лечения являются: уменьшение болевого синдрома, профилактика развития патологического перелома либо его фиксация, восстановление мобильности пациента и улучшение качества его жизни.
Вначале XX века наиболее часто применяемым и эффективным паллиативным методом лечения патологических переломов на фоне метастатического поражения костей была внешняя иммобилизация пораженного костного сегмента с последующей лучевой терапией. Прогресс, произошедший в науке в целом и, в частности, в медицине, обусловил появление новых химиотерапевтических препаратов и модернизацию методик лучевой терапии, что привело к увеличению эффективности лечения и, соответственно, продолжительности жизни пациентов с метастатическим поражением костей. Все это дало толчок к бурному развитию онкоортопедии, заключающийся в модификации, модернизации, расширении показаний для существующих и появлению новых малоинвазивных хирургических методов лечения метастазов в кости.
Ортопедические хирургические вмешательства в онкологии чаще стали носить органосохранный характер при лечении пациентов с метастазами в кости вследствие расширения анестезиологических, хирургических показаний, а также усовершенствования подходов и методов лечения онкологических больных с IV стадией заболевания. Ранее при хирургическом вмешательстве онкологическим пациентам выполнялись калечащие операции и основным вопросом, стоявшим перед врачами, было сохранение жизни больного, в крайнем случае максимального ее продления. Обеспечение качества жизни не было приоритетной задачей.
Внастоящее время онкоортопедическое пособие, оказываемое пациентам с метастатическим поражением костей, можно разделить на два вида: радикальные оперативные вмешательства, оказываемые при солитарном поражении, и паллиативные, применяемые при множественных метастазах. В настоящее время при лечении метастазов в кости наиболее часто применяются такие оперативные вмешательства, как: эндопротезирование, интрамедуллярный, накостный, чрескостный внеочаговый остеосинтез, аппараты наружной фиксации, кюретаж опухоли, остеосинтез с использованием костного цемента, декомпрессивные операции при поражении позвоночника и другие методы онкоортопедической хирургии. Эндопротезирование и интрамедуллярный остеосинтез являются основными методиками, используемыми в лечении метастазов в длинные кости. Адекватное онкоортопедическое пособие при поражении различных отделов скелета позволяет улучшить качество жизни больного и проводить впоследствии специальную терапию в комфортных для пациента и медицинского персонала условиях.
Впоследние годы в онкологии активно развивается принцип профилактического хирургического лечения метастатического поражения костей, направленного на снижение угрозы патологического перелома, для того чтобы избежать проблем при его возникновении. Выявление пациентов с высоким риском возникновения патологического перелома и выполнение им онкоортопедического пособия в настоящее время является общепризнанным и необходимым за счет экономических (снижения государственных затрат на лечение, сокращает время пребывания в клинике), медицинских аспектов (адекватно купирует болевой синдром, позволяет проводить раннюю реабилитацию, уменьшает процент и частоту интра- и послеоперационных осложнений) и социальной сферы (короткие сроки адаптации).
122

Выраженный болевой синдром, не купируемый консервативными методами лечения, и наличие патологического перелома являются безусловными показаниями к хирургическому вмешательству. При наличии угрозы патологического перелома показания к хирургическому вмешательству требуют более дифференцированного подхода. Необходимо учитывать общее состояние пациента, гистологическую структуру первичной опухоли, а также предположительную эффективность других консервативных методов лечения, которые должны быть оценены до принятия решения о проведении операции. Безусловно, хирургическое вмешательство несет в себе риски для пациента, однако результаты многих исследований свидетельствуют о том, что консервативная тактика при угрозе патологического перелома редко бывает эффективной.
Сегодня существует множество различных хирургических методик для остеосинтеза и реконструкции костных дефектов. Гистологическая структура первичной опухоли, общее состояние здоровья пациента, другие прогностические факторы ожидаемой продолжительности жизни и локальная степень распространения метастаза в кости несут определяющую роль в планировании операции. В редких случаях, например, при солитарном метастазе в кость, небольшом поражении или когда опухоль можно удалить без большой операционной травмы, опухоль должна быть удалена радикально, чтобы избежать дальнейшего продолженного роста опухоли и рецидива болевого синдрома. В большинстве случаев хирургический подход с использованием мини-инвазивной методики оправдан в качестве сугубо паллиативной помощи в исходе заболевания для предотвращения осложнений.
ДЛИННЫЕ КОСТИ
В настоящее время при лечении метастазов длинных трубчатых костей применяются: эндопротезирование, погружной (интрамедуллярный и накостный), чрескостный внеочаговый остеосинтез, аппараты наружной фиксации, кюретаж опухоли, остеосинтез с использованием костного цемента и другие методы онкоортопедической хирургии.
Принимая во внимание достаточно большое разнообразие хирургических методик коррекции метастатического поражения костей в зависимости от опыта и оснащенности лечебного учреждения, может превалировать одна из них.
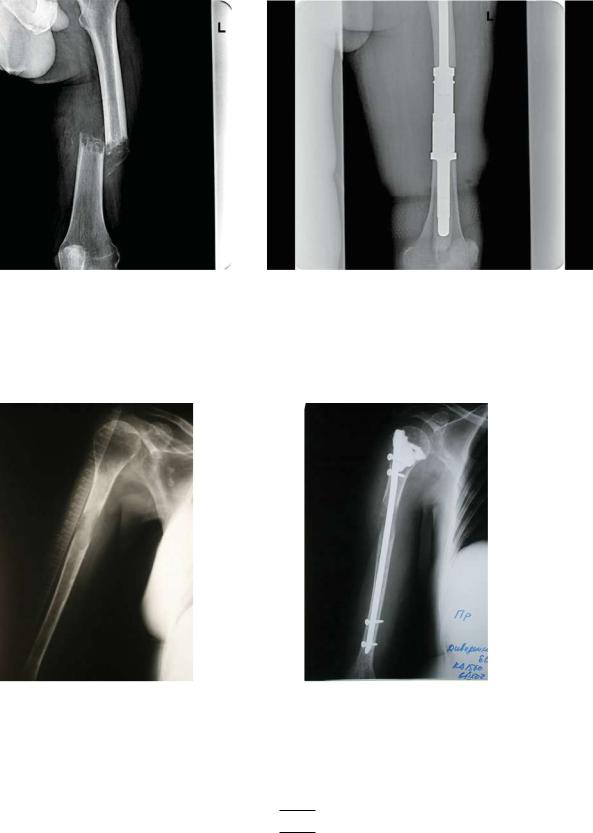
1.Эндопротезирование – сегментарная, радикальная резекция кости с устранением дефекта путем имплантации протеза (рис. 2).
Показания для выполнения сегментарной резекции с эндопротезированием: ● солитарный характер метастатического поражения;
● угроза и/или состоявшийся патологический перелом при благоприятном онкологическом прогнозе.
2.Интрамедуллярный остеосинтез – фиксация костных отломков путем антеградного и ретроградного введения штифта в костно-мозговой канал длинной трубчатой кости (рис. 3).
3.Накостный остеосинтез — использование пластины на поверхности кости для репозиции и фиксации (рис. 4).
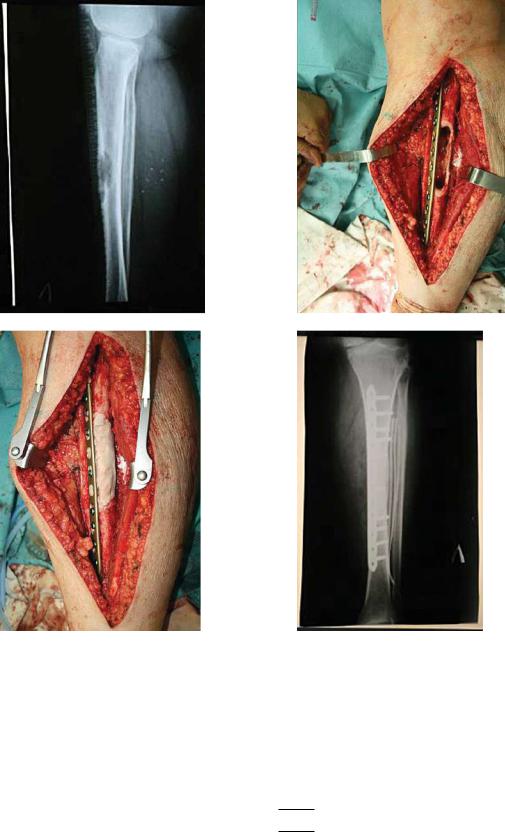
4.Кюретаж опухоли с использованием костного цемента. Самостоятельно метод используется при лечении метастазов плоских костей, однако при поражении длинных трубчатых костей данный вид хирургического лечения требует проведения дополнительной фиксации в виде интрамедуллярного или накостного остеосинтеза за счет значительной осевой нагрузки скелета.
123
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
а |
б |
Рис. 2:
а – рентгенография левой бедренной кости – патологический перелом диафиза бедренной кости со смещением на фоне метастаза рака почки;
б – рентгенография левой бедренной кости после хирургического лечения – состояние после сегментарной резекции диафиза бедренной кости с эндопротезированием диафиза
а |
б |
Рис. 3:
а – рентгенография правой плечевой кости – литический метастаз рака молочной железы в диафизе и головке левой плечевой кости
с угрозой патологического перелома диафиза;
б– рентгенография правой плечевой кости – интрамедуллярный остеосинтез правой плечевой кости с остеопластикой головки
124
а |
б |
в |
г |
Рис. 4:
а– рентгенография костей левой голени – литический метастаз рака молочной железы
вдиафиз б/берцовой кости с угрозой патологического перелома;
б – интраоперационная фотография – выполнен кюретаж опухоли диафиза б/берцовой кости с накостным остеосинтезом пластикой;
в – интраоперационная фотография – выполнена остеопластика дефекта диафиза левой б/берцовой кости;
г – послеоперационная рентгенография костей левой голени – накостный остеосинтез б/берцовой кости с остеопластикой
125
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/

Показания для выполнения внутрикостного и накостного остеосинтеза:
● угроза и/или состоявшийся патологический перелом при множественном метастатическом поражении.
5.Чрескостный остеосинтез аппаратами наружной фиксации при лечении патологических переломов, а также их угрозы в отечественной и мировой литературе мало освещены и в настоящее время носят историческое значение и практически не применяются.
6.Сегментарные резекции с замещением дефектов массивными аллотрансплантатами. Ампутации и экзартикуляции – данные хирургические методы не отличаются от по-
добных операций, выполняемых по другим показаниям, но требуют соблюдения онкологических принципов (зональности, футлярности и радикальности). Выполнение данной операции в литературе описывается крайне редко и рекомендуется при отсутствии альтернативных возможностей лечения.
7. Частота послеоперационных осложнений, хирургического лечения пациентов с метастазами в кости может составлять от 9 до 22% при поражении верхней конечности, и от 10 до 30% при поражении нижней конечности. Пациенты, которым показано проведение хирургической коррекции метастатического очага в костях, представляют из себя группу людей немолодого возраста, с наличием хронических заболеваний и часто имеют множественное поражение, в том числе и паренхиматозных органов. Вышеизложенное определяет частоту послеоперационных осложнений, наиболее частыми из которых являются соматические, со стороны различных органов и систем, а также инфицирование металлоимпланта.
МЕТАСТАТИЧЕСКОЕ ПОРАЖЕНИЕ ПОЗВОНОЧНИКА
Кости позвоночного столба – наиболее частая локализация метастазов различных солидных опухолей. Частота симптомных метастазов позвоночника постоянно растет вместе с ростом онкологической заболеваемости и увеличившейся выживаемостью. Учитывая особенности анатомии и биомеханики позвоночника, ранняя диагностика и адекватное лечение метастазов в позвоночник имеют решающее значение для сохранения качества жизни пациента. Определение показаний к хирургическому вмешательству является ключевым вопросом, и оно тесно связано с клиническим проявлением и общим прогнозом.
После проведения комплексного обследования пациента, проводимого по поводу метастатического поражения костей, при наличии метастазов в позвонки, необходимо оценить биомеханическую стабильность позвоночного столба. Нестабильность связана с последующими патологическими переломами и неврологическими нарушениями, которые значительно снижают качество жизни пациента, а также влияют на продолжительность его жизни. Раннее выявление очагов нестабильности имеет решающее значение в выборе метода лечения. Это является сложной задачей, поскольку необходимо учитывать совокупность как рентгенологических, так и клинических данных. Опухолевая нестабильность характеризуется потерей структурной целостности позвоночника на фоне неопластического процесса, который может сопровождаться болевым синдромом при движении, появлением неврологических нарушений и деформацией позвоночного столба при физиологических нагрузках.
Первая научно обоснованная, комплексная и простая в использовании шкала оценки нестабильности позвоночника при метастатическом поражении была опубликована в 2010 году исследовательской группой по изучению онкологических заболеваний позвоночника (SOSG). Онкологическая шкала нестабильности позвоночника (SINS) — это балльная система, основанная на шести признаках (табл. 7).
126

Таблица 7. Онкологическая шкала нестабильности позвоночника (SINS)
|
Локализация |
|
|
|
|
3 балла: |
Переходный уровень (C0-C2, C7- |
|
T2, T11-L1, L5-S1) |
||
|
||
|
|
|
2 балла: |
Mобильный сегмент (C3-C6, |
|
L2-L4) |
||
|
||
|
|
|
1 балл: |
Полуригидный (T3-T10) |
|
|
|
|
0 баллов: |
Ригидный (S2-S5) |
|
|
|
Исчезновение боли горизонтально и/или боль при нагрузке/перемене положения
3 балла: |
Да |
|
|
|
|
1 балл: |
Нет (периодически при |
|
надавливании) |
||
|
||
|
|
|
0 баллов: |
Безболезненно |
|
|
|
|
|
Характеристика метастаза |
|
|
|
|
2 балла: |
Литический |
|
|
|
|
1 балл: |
Смешанный (литическое/ |
|
бластическое) |
||
|
||
|
|
|
0 баллов: |
Бластический |
|
|
|
|
|
Рентгенологическая картина |
|
|
|
|
4 балла: |
Подвывих / нестабильность |
|
|
|
|
2 балла: |
De novo деформация (кифоз / |
|
сколиоз) |
||
|
||
|
|
|
0 баллов: |
Без патологии |
|
|
|
|
|
Снижение высоты тел позвонков |
|
|
|
|
3 балла: |
>50% коллапс |
|
|
|
|
2 балла: |
<50% коллапс |
|
|
|
|
1 балл: |
Без коллапса, >50% тела |
|
позвонков поражено |
||
|
||
|
|
|
0 баллов: |
Ничего вышеперечисленного |
|
|
|
127
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/

|
Вовлечение задних элементов |
|
(фасетки, ножки или реберно-позвоночные суставы) |
|
|
3 балла: |
Двустороннее |
|
|
1 балл: |
Одностороннее |
|
|
0 баллов: |
Ничего вышеперечисленного |
|
|
|
Интерпретация |
|
|
0–6: |
Стабильное поражение |
|
|
7–12: |
Умеренная нестабильность |
|
|
13–18: |
Выраженная нестабильность |
|
|
При наличии 7 баллов и более необходимо направить пациента на консультацию к вертебрологу.
Сумма этих параметров оценивается баллами (от 0 до 18), где более высокий указывает на большую нестабильность позвоночника. Шкала была разработана для помощи онкологу поликлинического звена с целью определения возможных показаний или противопоказаний к онкоортопедическому пособию уже на стадии первичного обследования, облегчая тем самым логистику пациентов с метастазами в позвоночник. Консультация онкоортопеда с целью определения возможностей хирургической коррекции показана пациентам с баллом ≥ 7 (потенциально нестабильные и нестабильные повреждения). Достоверность и специфичность данной шкалы были доказаны в различных независимых исследованиях. В своем исследовании члены SOSG выявили высокую достоверность и чувствительность (95,7%) и умеренную специфичность (79,5%) шкалы SINS.
Внастоящее время опубликованы результаты клинического использования шкалы SINS в онкологии. Сегодня она включена в клинические рекомендации и протоколы западноевропейских стран. В SINS используются такие критерии, как: степень неврологических нарушений, онкологические параметры заболевания, механические критерии стабильности позвоночного столба, системные критерии заболевания (NOMS), а также показатели физического статуса (LMNOP).
За последние несколько лет был опубликован ряд исследований, касающихся клинического прогностического значения шкалы SINS, наиболее высокий балл был достоверно связан с необходимостью повторного облучения и с возникновением неврологических нарушений после проведения лучевой терапии метастатических очагов. Было установлено, что выживаемость после хирургического лечения не связана с количеством баллов SINS, но последующий компрессионный перелом позвоночника, в случаях с более высоким показателем шкалы SINS, значительно снижал качество жизни пациентов.
Внастоящее время при лечении метастатического поражения позвоночника применяются различные по объему и периоперационным рискам хирургические вмешательства. К ним относятся: корпорэктомия с замещением дефекта аутотрансплантатом либо эндопротезом тела позвонка с передним или задним спондилодезом, вертебрэктомия с
128
эндопротезированием и транспедикулярной фиксацией, ламинэктомия с крючковой или транспедикулярной фиксацией, чрескожная вертебропластика.
Показания для выполнения вертебрэктомии с эндопротезированием и задней стабилизацией:
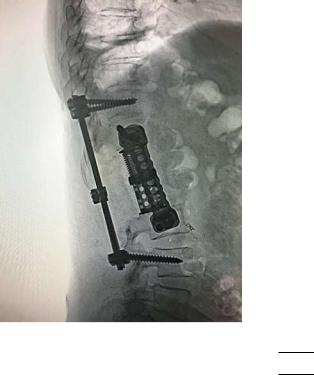
● Солитарный характер метастатического поражения позвоночника с переходом опухоли на задние отделы позвоночника у пациентов с хорошим онкологическим прогнозом (рис. 5).
Показания для выполнения корпорэктомии с эндопротезированием:
●Солитарный характер метастатического поражения позвоночника без перехода на дужки задние отделы позвонка у пациентов с хорошим онкологическим прогнозом.
●Метастатическое поражение шейного отдела позвоночника с патологическим переломом и компрессией спинного мозга (рис. 6).
Показания для выполнения декомпрессивной ляминэктомии с фиксацией:
●Метастатическое поражение позвоночника с компрессией спинного мозга.
●Неврологический дефицит (пара-, тетраплегия не более 7 суток, с положительным стероидным тестом).
●Нестабильный патологический перелом позвонка.
●Выраженный болевой синдром, при отсутствии эффекта от консервативных методов лечения (рис. 7).
Показаниями для выполнения малоинвазивных методов (вертебропластика, радиочастотная термоабляция) лечения метастатического поражения позвоночника являются:
●Метастатическое поражение позвоночника с наличием и/или угрозой перелома позвоночника.
●Болевой синдром при метастатическом поражении позвонков литического характера, при отсутствии признаков компрессии элементов спинного мозга (рис. 8).
МЕТАСТАТИЧЕСКОЕ ПОРАЖЕНИЕ КОСТЕЙ ТАЗА
Кости таза представляют собой важную ста- тико-динамическую структуру скелета, выполняющую защитную, опорную, а также кроветворную функции. В зоне наибольшей нагрузки
Рис. 5. Рентгенография поясничного отдела
позвоночника после вертебрэктомии L1 позвонка с эндопротезированием раздвижным эндопротезом с передним спондилодезом и задней транспедикулярной фиксацией по поводу солитарного метастаза рака почки
129
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
