
4 курс / Оториноларингология / Оптимизация_диагностики_и_лечения_артериовенозных_мальформаций_головы
.pdf51
Для оценки артериальной, венозной и отсроченной фазы исследование проводилось на 20-25 секунде, на 60-80 секунде, на 5 минуте (300 секунде) после начала внутривенного введения КВ соответственно. Применяли функцию Bolus Track. Наиболее диагностически значимой фазой принимали артериальную, в
некоторых случаях ее было достаточно для получения всей необходимой информации. В 8 случаях (40 %) исследование выполняли в артериальную и венозную фазу. В случае, если артериальная и венозная фаза оказывались недостаточно информативными, также проводили исследование в отсроченную фазу, что позволяло предположить патологию, отличную от АВМ.
Для стандартизации описания выявленных при МСКТ-ангиографии параметров АВМ, значимых для планирования лечения, был разработан унифицированный протокол описания результатов МСКТА у пациентов с сосудистыми аномалиями головы и шеи (Рисунок 4).

52
ГБОУ ВПО МГМСУ имени А. И. Евдокимова Минздравсоцразцития РФ КАФЕДРА ЛУЧЕВОЙ ДИАГНОСТИКИ
127473, г.Москва, ул.Делегатская, 20/1, тел: (495)611-27-44
E-mail:KLD@msmsu.ru
Мультисрезовая компьютерная томографическая ангиография
ФИО. |
Дата исследования |
Дата рождения |
Код исследования |
Пол |
Доза |
И/б № |
Направительный диагноз |
Конфигурация лица__________________ Деформация костей черепа__________________
Исследование в артериальную фазу:
Сосудистая |
|
Локализация |
|
|
|
Расположение |
|
|
Размеры |
|
||||
аномалия |
|
|
|
В виде |
|
Диффузно |
|
Длина, |
|
Ширина, |
Высота, |
|||
|
|
|
|
клубка |
|
|
|
|
см |
|
см |
см |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Тип сосудов, формирующих аномалию (артерии, вены, лимфатические сосуды): |
|
|||||||||||||
Поражение прилежащих мягкотканых структур |
|
|
|
|
|
|
|
|||||||
Поражение прилежащих костных структур |
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|||||
Афферентные |
|
Наполненность |
Диаметр, |
Извитость |
Топография |
|
|
|
Денситометрическая |
|||||
сосуды |
|
контрастом |
см |
|
|
|
|
|
|
|
|
плотность |
|
|
1) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
Участие в формировании сосудистой аномалии интракраниальных артерий: |
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||
Эфферентные |
|
Наполненность |
Диаметр, |
Извитость |
Топография |
|
|
|
Денситометрическая |
|||||
сосуды |
|
контрастом |
см |
|
|
|
|
|
|
|
|
плотность |
|
|
1) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Участие в формировании сосудистой аномалии интракраниальных вен:
Количество и локализация артериовенозных шунтов:
Исследование в |
Наполненность контрастом |
Денситометрическая |
||
венозную и |
Артерии |
Вены |
Паренхима |
плотность |
|
||||
паренхиматозную |
|
|
|
|
фазу (дополнительно) |
|
|
|
|
Венозная фаза |
|
|
|
|
|
|
|
|
|
Паренхиматозная |
|
|
|
|
фаза |
|
|
|
|
Предполагаемый тип сосудистой аномалии:
ЗАКЛЮЧЕНИЕ:_______________________________________________________________
Рисунок 4. Протокол описания результатов МСКТ-ангиографии у пациентов с сосудистыми аномалиями головы и шеи
53
2.2.2.3.3.Алгоритм исследования
1.Регистрация пациента
2.Изучение результатов клинического обследования пациента, в т.ч.
данных анамнеза жизни, анамнеза заболевания, осмотра
3.Объяснение пациенту методики и цели исследования.
Информирование о том, что введение контрастного препарата будет сопровождаться ощущением жара в области кубитальной вены и что в течение исследования необходимо сохранять неподвижное положение тела, воздержаться от глотания слюны.
4.Получение информированного согласия пациента на проведение исследования.
5.Пациенту предлагали снять ювелирные украшения и съемные зубные
протезы
6.Укладка пациента, фиксация головы на подголовнике
7.Подготовка автоматического инъектора, физиологического раствора,
подогревание контрастного препарата
8.Установка внутривенного катетера
9.Определение зоны сканирования и зоны интереса
10.Установление параметров сканирования в зависимости от предполагаемой патологии
11.Проведение предварительной зонограммы
12.В некоторых случаях – проведение нативной МСКТ
13.Начало введения контрастного препарата
14.Отслеживание болюса с помощью Bolus Track, сканирование в артериальную фазу
15.Сканирование в венозную фазу через 40-60 сек.
16.При необходимости – сканирование в паренхиматозную фазу через 5
минут после начала исследования
17.Окончание введения контрастного препарата
54
18.Наблюдение за пациентом в течение 30 минут после проведения исследования.
19.Обработка изображений на рабочей станции
20.Архивирование результатов исследования
21.Оформление протокола исследования
2.2.2.3.4. Характеристика контрастных препаратов
Применяли неионные низкоосмолярные иодосодержащие водорастворимые контрастные препараты, которые вводили внутривенно: Ультравист-370
(Йопромид, Iopromide), Оптирей-350 (Йоверсол, Ioversol), Омнипак-350 (Йогексол, Iohexol).
Для введения препаратов применяли двухголовочный автоматический инъектор OptiVantage DH (Covidien AG, Швейцария).
2.2.3.3.5. Анализ результатов МСКТ-ангиографии
Полученные изображения представлялись в трех взаимно перпендикулярных плоскостях (аксиальной, сагиттальной и фронтальной) с
толщиной среза 0,6 мм. В ходе постпроцессорной обработки на рабочей станции
AW Volumeshare 4.0 и в программе Osirix 10.0 осуществляли построение мультипланарных реконструкций в различных плоскостях (кососагиттальной,
ортогональной и других) для оптимальной визуализации патологических изменений.
С целью визуализации формирующих АВМ сосудов на их протяжении толщину среза увеличивали до 1,5─3,0 мм и применяли метод MIP
реконструкции.
Построение 3D-реконструкций выполняли с использованием стандартного программного обеспечения по двум плотностям (кости, мягкие ткани,
контрастный препарат) с целью определения и уточнения пространственного
55
взаимоотношения АВМ и анатомических структур костей и мягких тканей головы и шеи.
Анализ результатов сканирования включал определение размеров поражения, точной локализации АВМ, количество и диаметр афферентных и эфферентных сосудов, участие или отсутствие в кровоснабжении АВМ интракраниальных сосудов и наличие или отсутствие повреждения прилежащих костных структур.
Проведен анализ достоверности измерения размеров АВМ с помощью МСКТА в сравнении с интраоперационными данными методом Бленда-Алтмана.
Сцелью оценки достоверности отличия артериальных и венозных сосудов на МСКТ-ангиограмме, участвующих в кровоснабжении АВМ, была отмечена локализация сосудов и проведена интраоперационная верификация принадлежности сосудов к артериальному или венозному типу.
Сцелью уточнения МСКТ-семиотики АВМ головы и шеи были определены прямые и косвенные признаки заболевания, частота их проявления и причины отсутствия.
2.2.2.3.6. Изучение диагностической эффективности метода
Для оценки диагностической эффективности в установлении диагноза заболевания использовали значения диагностической специфичности и чувствительности, точности, прогностичности положительного или отрицательного результатов.
За референтные методы были приняты: УЗИ — в 20 случаях, ДСА — в 5
случаях, интраоперационная картина — в 20 случаях и результаты гистологического исследования — в 20 случаях.
Основными референтными методами считали ДСА, которая в настоящее время является «золотым стандартом» диагностики АВМ головы и шеи, и
интраоперационную верификацию.
56
Оценивали диагностическую эффективность в определении размеров и локализации АВМ, количества и диаметра афферентных и эфферентных сосудов,
наличии и локализации АВШ, определении скорости и направления кровотока,
наличии деструкции прилежащей кости, участия в кровоснабжении АВМ интракраниальных сосудов, наличии дополнительных, анатомически не типичных сосудов.
На этапе динамического наблюдения МСКТА проводили пациентам при наличии признаков продолжения роста АВМ клинически и по результатам УЗИ.
2.2.2.4. Дигитальная субтракционная ангиография
ДСА выполняли на базе НИИ нейрохируургии им. академика Бурденко Н.Н.
РАМН у 14 пациентов на аппарате Artis zee (Siemens, Германия) с системой
Axiom Sensis XP (Siemens, Германия) по стандартной методике. Из них 12
пациентам под контролем ДСА была проведена эмболизация афферентных сосудов препаратами этиленвинилалкоголя кополимера (EVHO Onyx 18) или N-
цианбутилакрилата (Гистоакрил), частицами ПВА, спиралями COOK.
2.2.3. Гистологическое исследование операционного материала
Все срезы макропрепарата, представляющего собой удаленную АВМ или в отдельных случаях часть АВМ, были приготовлены из парафиновых блоков. В
каждом наблюдении исследовали от 5 до 10 фрагментов макропрепаратов,
состоявшего в основном из сосудов, формирующих АВМ, и афферентных и эфферентных сосудов. Толщина срезов от 5 до 10-12 нм. Всего просмотрены 86
препаратов, из которых 54 – препараты пациентов из группы исследования, 32 –
из архивной группы. Все препараты были окрашены стандартными обзорными методиками гематоксилином-эозином. Увеличение Х100, увеличение Х200,
увеличение Х200 с приближением, увеличение X400.
57
Морфологию полученных срезов оценивали визуально с помощью световой микроскопии. Проведенный морфологический анализ выявил наличие некоторых особенностей строения стенки измененных сосудов, позволил верифицировать диагноз АВМ.
2.3. Планирование лечения
На основе полученной информации о параметрах АВМ: локализации,
размерах, взаимоотношениях с прилежащими мягкоткаными и костными структурами, питающих и дренирующих сосудах, возможном участии в кровоснабжении АВМ интракраниальных сосудов, скорости кровотока – проводилось планирование лечения, что включало выбор хирургического доступа, локализацию и длину разреза, локализацию лигирования сосудов в случае необходимости. Планировали предполагаемый объем иссекаемых тканей,
и, соответственно, метод закрытия послеоперационного дефекта.
2.4. Методики проведения хирургического вмешательства
Хирургическое лечение АВМ мягких тканей небольших и средних размеров заключалось в радикальном удалении мальформации под эндотрахеальным наркозом и местной анестезией с одномоментным устранением послеоперационного дефекта.
Перед хирургическим вмешательством операционное поле со стороны кожи и при необходимости со стороны слизистых оболочек обрабатывали Октенисептом.
Если проведение предоперационной эмболизации было невозможно, с
целью снижения объема интраоперационной кровопотери перед удалением АВМ лигировали афферентные артерии (Рисунок 5 а,б).
58
а |
б |
|
Рисунок 5. Пациентка с АВМ лобной области. Выделение афферентного сосуда (а). Лигирование афферентного сосуда (б).
При локализации АВМ в лобной, лобно-теменной, теменной, височной,
лобно-височной, подбородочной, верхней или нижней губы было проведено предварительное прошивание мальформации по периферии шелком по Крогиусу
(Рисунок 6а).
Производили разрезы на коже в соответствии с локализацией и размерами АВМ, послойно рассекали кожу, подкожно-жировую клетчатку (Рисунок 6б).
а |
б |
Рисунок 6. Пациентка с АВМ лобной области. Прошивание АВМ по периферии
шелковой нитью (а). Выполнение разреза (б).
В ходе операции определяли действительную топографию, тип, диаметр приводящих и отводящих сосудов, измеряли продольный, поперечный и вертикальный размеры поражения.
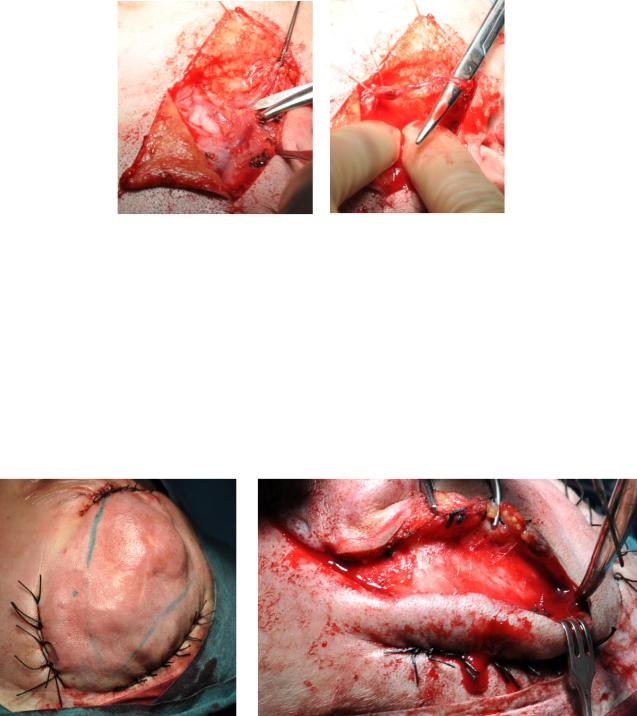
Полутупым, полуострым путём выделяли и удаляли мальформацию. В
случае, если АВМ прилежала к надкостнице, но надкостница не была поражена,
ее сохраняли (Рисунок 7а).
59
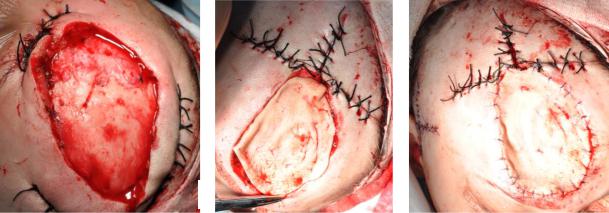
Проводили одномоментное устранение послеоперационного дефекта с использованием пластики местными тканями, свободной пересадки кожи,
(Рисунок 7б, в), свободным микрососудистым лучевым или торакодорзальным кожно-фасциальным или кожно-мышечным лоскутом.
Рану или раны ушивали послойно с применением современных атравматичных шовных материалов.
а |
б |
в |
|
Рисунок 7. Удаление АВМ с сохранением надкостницы (а). Проведение пластики дефекта местными тканями и свободным расщепленным кожным лоскутом с передне-боковой
поверхности живота (б,в).
В рану вводили дренажи из перчаточной резины. По ходу операции осуществляли гемостаз прошиванием тканей и сосудов, с помощью гемостатической губки и электрокоагулятором. По окончании операции накладывали асептическую повязку, в большинстве случаев давящую. Назначали противовоспалительную и антибиотикотерапию.
При обширных поражениях радикальное удаление АВМ представлялось невозможным, т.к. потенциально создавало угрозу здоровью и жизни пациента в связи с массивной интраоперационной кровопотерей и тяжелыми функциональными нарушениями вследствие потенциального возникновения обширных послеоперационных дефектов, не подлежащих одномоментному замещению. В таких случаях пациентам планировали поэтапное нерадикальное удаление АВМ с лигированием афферентных сосудов или, по возможности, с
выполнением предоперационной эмболизации АВМ.
Хирургическое лечение пациентов с АВМ нижней челюсти заключалось в удалении пораженного сегмента челюсти методом блок-резекции, блок-резекции
60
с остеотомией или частичной резекцией нижней челюсти с экзартикуляцией.
Выбор тактики лечения зависел от размеров и локализации АВМ и характера ее кровоснабжения.
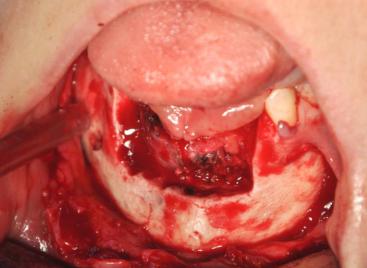
При небольших и средних размерах поражения проводилась блок-резекция нижней челюсти (Рисунок 8).
Рисунок 8. Пациентка с АВМ альвеолярной части нижней челюсти в области 3.2 -4.2 зубов. Проведена блок-резекция.
Перед хирургическим вмешательством операционное поле со стороны кожи и при необходимости со стороны слизистых оболочек обрабатывали Октенисептом.
Под эндотрахеальным наркозом в поднижнечелюстной области со стороны поражения проводили линейный разрез параллельно краю нижней челюсти,
отступив от него на 2 см. Послойно рассекали кожу, подкожно-жировую клетчатку, платизму. По ходу операции перевязывали и пересекали патологически измененные артериальные и венозные сосуды. В ходе операции также определяли топографию, тип, диаметр приводящих и отводящих сосудов. Распатором поэтапно отслаивали надкостницу наружной кортикальной пластинки тела нижней челюсти. При наличии сильного кровотечения из надкостницы и костной ткани из перфорационных отверстий на поверхности кости, останавливали его втиранием воска Bonewax W810 (Ethicon). Для более эффективного гемостаза проводили внутрикостное введение Гистоакрила через перфорационные и
