
3. Активированный комплекс находится в равновесии с исходными
веществами
|
k1 |
k |
|
|
AB C |
ABC |
BC A . |
||
|
k2
Скорость реакции определяется лимитирующей стадией – распадом активированного комплекса. Еѐ можно определить либо по закону действующих масс
|
|
|
w k |
c , |
||
|
либо как число активных комплексов, прореагировавших в единицу времени |
|||||
|
|
|
w |
c |
, |
|
|
|
|
|
|
||
|
|
|
||||
где c - концентрация активированных |
комплексов, а τ – время жизни |
|||||
активированного комплекса. |
|
|
|
|||
. |
|
путь |
|
|
|
|
|
|
|
|
|
|
|
|
скорость |
|
|
|
||
|
|
|
|
|
||
Активированный комплекс существует не при определенном значении межъядерных расстояний, а в каком-то интервале δ, следовательно, время жизни комплекса
V ,
где V - средняя скорость движения активированного комплекса через вершину энергетического барьера (одномерная скорость).
Используя приведенные выражения для средней скорости движения активного комплекса и аппарат статистической термодинамики, получаем следующее выражение для константы скорости:
|
k |
БT |
|
kск |
|
|
K равн , |
|
|
||
|
|
h |
|
где k Б - постоянная Больцмана, h – постоянная Планка
31

K равн - константа равновесия активированного комплекса, которая равна
с |
. |
|
|
||
с АВ сС |
||
|
В тех случаях, когда адиабатическое приближение не выполняется, и
электронная подсистема преодолевает свой энергетический барьер, в
выражение для kск вносят трансмиссионный множитель , он меньше единицы:
kск |
k Б T |
K равн. |
|
h |
|||
|
|
Физический смысл трансмиссионного коэффициента состоит в том, что не всегда образованный активированный комплекс разваливается с образованием продуктов реакции, существует вероятность образования из него исходных веществ. При χ=1 эффективность развала АК в продукты составляет
100%.
При термодинамическом подходе константу равновесия выражают через разность термодинамических функций активированного комплекса и исходных веществ.
Для бимолекулярной реакции в растворе константу равновесия выражают через функцию Гельмгольца образования активированного комплекса:
kск |
k BT |
exp |
F |
|
k BT |
exp |
S |
exp |
U |
. |
h |
RT |
|
h |
RT |
RT |
|||||
|
|
|
|
|
|
Для бимолекулярной реакции в газовой фазе в формулу добавляется
множитель RT/p0, необходимый для перехода от K c |
к K p : |
|
|
|
||||||||||||
kск |
k BT RT |
exp |
G |
|
k BT RT |
exp |
|
S |
exp |
H |
. |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||
h |
|
p0 |
RT |
|
h p0 |
|
RT |
RT |
||||||||
|
|
|
|
|
|
|
|
|||||||||
Энтропийный множитель иногда интерпретируют как стерический фактор Р
из теории активных соударений.
32
Серьезным недостатком теории переходного состояния является отсутствие экспериментальных данных о строении активированного комплекса, что затрудняет ее применение. Несмотря на это, благодаря сравнительной простоте математического аппарата она является наиболее широко используемой теорией кинетики элементарных химических реакций, позволяет правильно объяснить и полуколичественно предсказать много закономерностей для кинетики химических реакций.
КАТАЛИЗ
Явление катализа – это изменение скорости реакции под действием некоторых веществ, которые к концу реакции остаются в химически неизменном виде.
Разновидности катализа:
1)положительный – под действием некоторых веществ скорость реакции увеличивается;
2)отрицательный: под действием некоторых веществ скорость реакции уменьшается, такие вещества называются ингибиторами;
3)автокатализ: катализатором являются продукты реакции;
4)гомогенный: катализатор и реагенты находятся в одной фазе (газ или раствор);
5)гетерогенный: катализатор и реагенты находятся в разных фазах;
6)ферментативный: катализатором является биологический фермент.
Принципы катализа:
1)катализатор принимает участие в химической реакции, образуя промежуточные продукты, но в конце реакции выделяется в химически неизменном виде. Физическое состояние катализатора,
входящего в активный комплекс, может существенно изменяться,
33
например, уменьшатся размеры зерен твердого катализатора,
изменится структура поверхностных слоев;
2)катализатор не смещает положение равновесия, а лишь увеличивает скорость прямой и обратной реакции в равной степени;
3)действие катализатора является специфичным (селективным);
4)катализатор увеличивает скорость реакции за счет уменьшения Еакт,
ведет реакцию по пути с меньшим энергетическим барьером.
Гомогенный катализ
Рассмотрим схему реакции, протекающей без катализатора:
A + B → AB* →C + D.
В присутствии катализатора реакция протекает в несколько стадий:
k1
1. A K |
AK |
k2
2. AK B k3 ABK *
3. ABK * k4 C D K
При условии k3>>k1 скорость образования продуктов можно выразить через концентрации реагентов и катализатора:
w |
dcC |
|
k1k3c AcB |
cK |
|
|
|||
|
dt |
|
k2 k3cB |
|
Это уравнение лежит в основе кинетики гомогенных каталитических реакций. Из уравнения видно, что скорость процесса прямо пропорциональна концентрации катализатора, исключение составляют лишь случаи, когда катализатор находится в большом избытке, в результате чего скорость процесса лимитируется не кинетическими, а физическими закономерностями, например,
диффузией растворенного вещества к катализатору.
Энергетический профиль каталитической реакции представлен на рисунке 3.
34
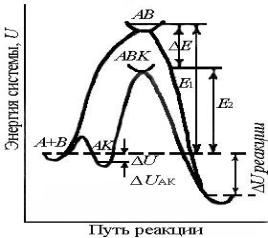
Рис. 3: Энергетические профили реакций с
катализатором и без него.
Е1 – энергия активации некаталитической реакции, Е2 – каталитической реакции
В ранних исследованиях предполагалось, что поверхность катализатора энергетически однородна (Лэнгмюр). В дальнейшем была экспериментально доказана адсорбционная неоднородность поверхности. Возникло представление о том, что каталитически активны только определенные участки поверхности,
на которых имеются адсорбционные центры. Здесь вещество способно образовать активное для протекания данного каталитического процесса промежуточное поверхностное соединения, благодаря чему понижается энергия активации реакции.
Гетерогенный катализ
В случае гетерогенного катализа реакции происходят на границе раздела
фаз.
Гетерогенный катализ состоит из следующих стадий:
1.массоперенос реагентов к катализатору;
2.абсорбция – образование абсорбированного комплекса между реагентом и катализатором;
3.каталитическая реакция – образование продукта в основном адсорбированном состоянии;
4.десорбция продукта;
5.внутренний массоперенос (изнутри катализатора);
35
6. внешний массоперенос (из области реакции).
Общая скорость каталитической реакции определяется скоростью самой медленной из этих стадий. Если не рассматривать диффузию и считать, что равновесие «адсорбция ↔ десорбция» устанавливается быстро, то скорость каталитической реакции определяется скоростью реакции в адсорбционном слое, где роль реагента играют свободные адсорбционные центры.
Простейший механизм гетерогенного катализа описывается схемой:
|
kадс |
k1 |
|
|
S газ |
Sадс |
Pадс . |
||
|
kдес
Для придания катализаторам большей избирательности, термической стойкости, механической прочности и активности их часто применяют в форме многокомпонентных систем: смешанных, на носителях, промотированных катализаторов.
Промоторы - это вещества, которые не обладают каталитическими свойствами, но добавление их к катализатору значительно увеличивает его активность.
Каталитические яды - это вещества, понижающие активность катализатора.
Активность катализаторов оценивают либо количеством вещества (в
молях), реагирующих в единицу времени под воздействием единицы массы катализатора, или количеством вещества (в молях), реагирующих в единицу времени под воздействием единицы поверхности катализатора.
Ферментативный катализ
Ферментативными реакциями называются такие химические процессы в биологических системах, скорость которых регулируется веществами
36
биологического происхождения. Это белковые молекулы, называемые
ферментами или энзимами.
Ферментативный катализ играет огромную роль в жизнедеятельности организма. Широкое применение получили ферментные препараты при нарушениях функции желудочно-кишечного тракта, связанных с недостаточной выработкой пищеварительных ферментов (пепсин, панкреатин). При ожогах,
гнойных ранах, гнойно-воспалительных заболеваниях легких, когда необходимо разрушить накопившиеся в большом количестве белковые образования, применяются протолитические ферменты, приводящие к быстрому гидролизу белков и способствующие рассасыванию гнойных скоплений. Для лечения инфекционных заболеваний используются препараты лизоцина, которые разрушают оболочку некоторых болезнетворных бактерий.
Очень важные ферменты, которые рассасывают тромбы (сгустки крови внутри кровеносных сосудов) – плазмин, трипсин, химотрипсин, на их основе с разными добавками созданы различные лекарственные препараты – стрептокиназа, стрептаза, и т.п., широко применяемые в медицине.
Выделения ферментов в особый класс катализаторов обусловлен особыми свойствами этих веществ:
1)высокая специфичность;
2)эффективность действия;
3)биологические катализаторы образуются и разрушаются в процессе жизнедеятельности организма.
По своей каталитической активности биологические катализаторы в тысячи раз превышают неорганические. Специфичность действия связана с особенностями структуры фермента и субстрата. Одни части каталитической системы выполняют функции, главным образом связанные с пространственной организацией системы, другие в этой организационной системе осуществляют собственно катализ. Т.е., как и при неферментативном катализе, в
37
каталитической реакции участвует не вся белковая молекула в целом, а лишь определенные ее участки – активные центры фермента.
Простейшая схема ферментативного катализа включает обратимое образование промежуточного комплекса фермента (Е) с реагирующим веществом (субстратом S) и разрушение этого комплекса с образованием продуктов реакции (Р):
|
k1 |
k3 |
|
|
E S |
ES |
E P . |
||
|
||||
|
k2 |
|
|
При условии, что k3>>k1 , с учетом уравнения материального баланса
[E]=[E0]-[ES] (индекс «0» означает начальную концентрацию) получаем
уравнение Михаэлиса-Ментен. В уравнении скорость образования продукта выражена через начальную концентрацию фермента и текущую концентрацию субстрата:
w |
d P |
|
wmax S |
, |
dt |
|
K M S |
где wmax=k2[E0] – максимальная скорость реакции;
K M |
k3 |
k2 |
- это константа Михаэлиса. |
|
k1 |
||
|
|
|
Анализ уравнения Михаэлиса-Ментен
Константа Михаэлиса равна концентрации субстрата, при которой скорость реакции равна половине максимальной скорости. Она характеризует специфичность фермента по отношению к субстрату (чем меньше, тем специфичнее). Типичные значения KM от 10-6 до 10-1 моль/л.
Константу скорости k3 иногда называют числом оборотов фермента.
38

Число оборотов фермента – число молекул субстрата, которые превращаются на активном центре фермента в единицу времени (обычно от 10 до 108 мин-1).
Уравнение Михаэлса можно записать в линейных координатах:
1 |
1 |
|
K M 1 |
||||
|
|
|
|
|
|
|
. |
w |
|
wmax |
wmax |
[S] |
|||
Для определения параметров уравнения KM и wmax проводят серию измерений начальной скорости реакции от начальной концентрации субстрата и представляют экспериментальные данные в координатах 1/w0 – 1/[S0].
Течение химических реакций может быть заторможено присутствием некоторых веществ. Ингибиторы ферментативного катализа, способны образовывать комплексы с ферментом или фермент-субстратным комплексом.
Вопросы для самоконтроля
1.Что изучает химическая кинетика?
2.Что называется скоростью химической реакции?
3.Напишите выражение для средней скорости реакции. Как она определяется экспериментально?
4.Что собой представляет истинная скорость реакции?
5.По каким признакам классифицируют реакции в кинетике? Приведите эти классификации.
6.Дайте определения понятиям молекулярность, порядок реакции, период полупревращения.
7.Какие факторы влияют на скорость химической реакции?
8.Какова зависимость скорости реакции от концентрации. Сформулируйте основной постулат химической кинетики. Приведите его запись.
9.Что называют константой скорости химической реакции?
39
10.Запишите кинетические уравнения реакций нулевого, первого, второго порядков.
11.Опишите экспериментальные методы определения скорости и константы скорости реакций.
12.Каким образом увеличение температуры влияет на скорость химической реакции? Сформулируйте правило Вант-Гоффа.
13.Запишите уравнение Аррениуса.
14.Изобразите энергетический профиль реакций с различным тепловым эффектом (энергетическая диаграмма для реакции, протекающей без тепловых эффектов; энергетическая диаграмма для экзотермической реакции, для эндотермической реакции).
15. Что такое энергия активации?
16.Опишите теорию активных соударений (ТАС).
17.Какова роль стерического фактора?
18.Опишите теорию переходного состояния.
19.Дайте определение понятию катализ (гомогенный и гетерогенный катализ).
Изобразите энергетический профиль каталитической реакции. Какое влияние оказывает катализатор на выход продуктов реакции?
20.Каковы особенности каталитической активности ферментов? Запишите и проанализируйте уравнение Михаэлиса - Ментен.
Тренировочный тест
1.Какое уравнение позволяет математически точно описать влияние температуры на скорость химической реакции?
а) Аррениуса;
б) Гиббса;
в) Вант-Гоффа;
г) Ньютона.
2.Какие реакции называют сложными?
40
