

Термодинамика и кинетика
В соответствии с правилом Вант-Гоффа, как и во сколько раз в среднем изменится скорость реакции при повышении температуры на 10; C:
•увеличится в 3 раза
γот 2 до 4, а среднее между 2 и 4 – это 3
Энергия активации разложения лекарственного вещества в присутствии ингибитора:
•увеличивается
Скорость реакции уменьшается за счет увеличения энергии активации
Константа химического равновесия не зависит от
• концентраций реагирующих веществ
ни одна константа не зависит от концентраций
При понижении температуры равновесие эндотермической реакции: PCl5 (г) =
PCl3 (г) + Cl2 (г) - Q
•сместится влево
при понижении температуры смещается в сторону экзо
Выражение константы равновесия для обратимой химической реакции
CuO (т) + H2 (г) = Cu (т) + Н2О (г) имеет вид
•
Сверху – продукты, снизу – реагенты (твердые вещества не учитываем)
Константа скорости прямой реакции: 2 СO(г)+ О2(г) = 2 СО2(г)+ Q
при уменьшении общего объёма системы в 3 раза
•не изменится
константы скорости не зависят от давления, объема и концентрации зависят только от природы веществ, температуры и энергии активации
Скорость прямой реакции:
2 NO(г)+ Cl2(г) = 2 NOCl(г)
при уменьшении концентрации NO в 5 раз
•уменьшится в 25 раз
по уравнению скорости: v=k*C(NO)2*C(Cl2)
так как С(NO) в квадрате, а при снижении конц скорость уменьшается, то скорость уменьшится в 52=25 раз
Фермент - это
•катализатор биохимической реакции
Константа скорости реакции НЕ зависит от
•Концентрации реагентов
константы скорости не зависят от давления, объема и концентрации зависят только от природы веществ, температуры и энергии активации
Скорость реакции уменьшается
•При введении ингибитора
Дана схема реакции: 2N2O + С(кокс) = СO2 + 2N2 + Q Равновесие сместится вправо при
•Увеличении концентрации N2O
При увеличении концентрации реагентов (газы, жидкости) равновесие смещается вправо
Дана схема реакции: N2 + 3H2 = 2NH3. Увеличили давление в системе в 2 раза. При этом
• Скорость прямой реакции возрастет в 16 раз
Скорость прямой реакции до: v1=k*C(H2)3*C(N2)
При увеличении давления в 2 раза концентрации увеличиваются в 2 раза.
Тогда после v2=k*(2C(H2))3*2C(N2) =16k*C(H2)3*C(N2)=16v1
Дана схема реакции: СO2 + С(кокс) = 2СO + Q. Равновесие сместится влево при
•Увеличении концентрации угарного газа
При увеличении концентрации продуктов (жидкости, газы) равновесие смещается влево
Дана схема реакции: 2NО + О2 = 2NО2. Увеличили давление в системе в 2 раза.
Во сколько раз изменятся скорости реакций?
•
Скорость прямой реакции до: v1=k*C(NO)2*C(O2)
При увеличении давления в 2 раза концентрации увеличиваются в 2 раза.
Тогда после v2=k*(2C(NO))2*2C(O2) =8k*C(NO)2*C(O2)=8v1
Скорость обратной реакции до: v1=k*C(NO2)2
При увеличении давления в 2 раза концентрации увеличиваются в 2 раза.
Тогда после v2=k*(2C(NO2))2=4k*C(NO2)2=4v1
Дана схема реакции N2 + O2 = 2NO - Q. Все вещества газообразные. Как можно сместить равновесие в сторону образования продукта? (вправо)
•Увеличить концентрацию азота
Чтобы сместить равновесие вправо, можно увеличить концентрацию реагентов
Тепловой эффект химической реакции при постоянном давлении (Qp) равен:
•∆H
Q = ∆E + A, а ∆H = ∆E + p ∆V
при постоянном давлении A= p ∆V и Q=∆H
Под стандартным тепловым эффектом понимают его значение при:
•p = 1 атм и температуре Т = 298 K (25C)
Открытая система - это система, которая:
•может обмениваться с окружающей средой и веществами, и энергией
Укажите, какое неравенство или равенство верно при протекании кристаллизации вещества из жидкого состояния.
•∆S<0
Беспорядочность (энтропия) уменьшается, так как жидкость становится твердым веществом
Укажите, какое неравенство верно при самопроизвольном растворении кристаллов сахарозы в воде, если известно, что это эндотермический процесс:
•∆S>0
Беспорядочность (энтропия) увеличивается, так как твердое вещество переходит в раствор (становится жидким)
Уравнение реакции, для которой энтропия системы увеличивается, имеет вид:
•CaCO3 (т) = CaO (т) + CO2 (г)
Смотрим по газам. Самый явный пример увеличения энтропии (беспорядочности) – образование газа из твердого вещества
Закрытая система - это система, которая:
•не может обмениваться с окружающей средой веществами, но может обмениваться энергией
Дано термохимическое уравнение: 2GaI3 (т) = 2Ga (т) + 3I2 (т); ∆ r H 298 = 440 кДж. Определите, чему равна стандартная энтальпия образования GaI3 (в кДж/моль).
•- 220
Упростых веществ ∆H обр = 0, ∆Hр=-2∆H GaI3
Первому закону термодинамики для систем, в которых единственным видом работы является работа расширения газа, соответствует уравнение:
•∆Q = ∆E + p ∆V
Стандартная энтальпия образования HCN (г) равна стандартной энтальпии
реакции:
•
Так как тут HCN образуется из простых веществ
Энергия Гиббса определяется формулой:
•G = Е - TS + pV
G = Н- TS =Е + pVTS, так как Н = Е + pV
Тепловой эффект химической реакции НЕ зависит от:
• количества стадий
Зависит от начальной и конечной точки
Универсальным критерием возможности самопроизвольного протекания процесса является условие:
•∆G<0
Выбрать параметры, абсолютные значения которых измерить НЕвозможно:
•Энтальпия (∆H)
Невозможно измерить ∆G ∆E ∆H ∆S – функции состояния
1-й закон термодинамики является частным случаем закона сохранения:
•энергии
При окислении 1 г жира в колбе выделяется определённое количество энергии. Какое количество энергии (в соответствии с законом Гесса) должен получить организм человека при переваривании 1 г такого же жира?:
•такое же
Тепловой эффект не зависит от количества стадий, а зависит от начальной и конечной точки (начало – жир, конец – продукты окисления)

Укажите, какое неравенство или равенство верно при протекании эндотермического процесса.
•∆H>0
При эндотермических реакциях (поглощение тепла) теплосодержание системы (энтальпия) увеличивается
Выбрать параметры, которые относятся к термодинамическим функциям состояния:
•внутренняя энергия (∆E)
Невозможно измерить ∆G ∆E ∆H ∆S – функции состояния
Стандартная энтальпия образования какого вещества НЕ равна нулю:
•Бром газообразный
Стандартная энтальпия образования простых веществ стабильных при нормальных условиях равна нулю. При н.у. бром не газ, а жидкость – значит эта форма его не стабильна при н.у.
Установите соответствие между процессом и изменением термодинамического параметра
Изменение энтропии при |
∆S<0 |
растворении газообразного |
(переход из газа в жидкость – |
вещества в жидкости |
беспорядочность уменьшается) |
Изменение энтропии разрушения |
∆S>0 |
кристаллической решетки при |
(переход из твердого в жидкое – |
растворении твердого вещества в |
беспорядочность увеличивается) |
жидкости |
|
Изменение энтальпии при |
∆Н<0 |
растворении газообразного |
(растворение газов – экзотермично – |
вещества в жидкости |
система теряет тепло – теплосодержание |
|
(энтальпия) снижается) |
Изменение свободной энергии |
∆G<0 |
Гиббса при растворении твердого |
(самопроизвольный процесс) |
вещества в жидкости |
|
Растворы, рН, буферы
Изотонический коэффициент сильного электролита в разбавленном растворе
•Равен числу ионов, на которые диссоциирует одна структурная единица
Степень диссоциации кислоты рассчитывается по формуле
Из закона разбавления Оствальда: К=С*α2
Какой раствор характеризуется максимальным осмотическим давлением при одинаковой температуре
• 0,01 М раствор хлорида бария
Посм=i*CM*RT
Максимальное осмотическое давление у растворов сильных электролитов с большим изотоническим коэффициентом (образующие больше ионов)
Гипотонический раствор характеризуется в сравнительном плане
•Меньшей осмолярной концентрацией
Плазмолиз это -
•Сморщивание клеток
Константа диссоциации зависит
•От температуры
Кдисс зависит от температуры и природы электролита
С увеличением температуры растворимость газа
•Уменьшается
Растворение газа – экзотермично, поэтому при повышении температуры растворимость снижается
Осмотическое давление 0,02 молярного раствора хлорида кальция при нормальных условиях (0С = 273К) составляет (ответ дать с точностью до сотых)
•"136,12"
Посм=i*CM*RT = 3 * 0,02 * 8,31 * 273 = 136,12
Осмотическое давление раствора 0,15М раствора хлорида натрия (физиологического раствора) при 37С составляет (ответ дать с точностью до сотых)
•"772,83"
Посм=i*CM*RT=2 * 0,15 * 8,31 * (37+273) = 772,83
Рассчитайте осмолярную концентрацию раствора, изотоничного крови, при 37С. Посм крови - 772,8 кПа. (ответ дать с точностью до сотых)
•",3"
Изотоничные растворы, значит, их Сосм равны.
Посм=i*CM*RT, отсюда Сосм = i*CM = Посм / RT = 772,8 / ((37+273)*8,31) = 0,3
Осмотическое давление раствора, содержащего хлорид натрия (0,01 М) и глюкозу (0,01 М) при нормальных условиях (0C = 273K) составляет (ответ дать с точностью до сотых, разделитель - запятая).
•"68,06"
Посм=((i*CM)+( i*CM))RT = ((2*0.01)+(1*0.01))*8.31*273=68.06
Изменение температуры кипения 0,5 моляльного водного раствора хлорида натрия равно (ответ дать с точностью до сотых). Е воды=0,52 град*кг/моль. Ответ дать с точность до сотых, разделитель - запятая
•",52"
tкип = iCm*E = 2*0,5*0,52=0.52
Если рН раствора равен 8, то концентрация ионов Н+ равна:
•10 -8
pH = -lg[H+], отсюда Н+ = 10-рН = 10 -8
рН 0,0001н раствора КОН равен:
10
рН = 14+lgCn = 14+lg(0.0001)=14-4=10
рН 0,0001 н раствора азотной кислоты равен
•4
рН = -lgCn = -lg(0.0001)=4
рН сантинормального раствора гидроксида натрия равен
•12
рН = 14+lgCn = 14+lg(0.01)=14-2=12
Для вычисления рН раствора слабой кислоты используют формулу
•pH=-lg (альфа *C)
Как можно увеличить степень диссоциации уксусной кислоты
•разбавлением
По закону разбавления Оствальда (К=С*α2) при разбавлении (увеличение объема -
снижение концентрации) увеличивается диссоциация ( = √КС ~ 1С ~ )
рН крови в норме
•7,36 – 7,42 (слабощелочная)
Щелочной резерв крови – это
•число мл СО2 в 100 мл крови
рН желудочного сока пациента составляет 1,3. Ему следует порекомендовать
•щелочную минеральную воду
Сильно кислая среда (1,3), в норме около 3 в желудке. Нужно снизить кислотность щелочью.
Как можно изменить константу диссоциации пропановой кислоты
•изменением температуры
Константа диссоциации зависит от температуры и природы электролита
Вычислить рН в 0,005 М растворе серной кислоты Ответ дать с точность до целых
•"2"
рН = -lgCn = -lg(n*CМ) = -lg(0.005*2)= 2
Плотность раствора глюкозы 1г/мл. Рассчитать массовую долю (в процентах) сантимолярного раствора глюкозы. (ответ дать с точностью до сотых, разделитель - запятая).
• |
|
",18" |
|
|
= |
|
= 0,01 |
180 |
= 0.18 |
10 |
|
10 1 |
|
|
Молярная концентрация 10% раствора глюкозы равна (плотность =1г/см3) (ответ дать с точностью до сотых, разделитель - запятая).
•",56"
|
= |
10 |
= 10 |
10 1 |
= 0.56 |
|
|
||||
|
|
|
180 |
|
|
|
|
|
|||
рН децимолярного раствора аммиака (рК аммиака=4,75) равен
•11,125
pH = 14 - 0.5(pKb-lgC) = 14-0.5(4.75-lg0,1)=11.125

Указать потенциальную кислотность раствора уксусной кислоты, если степень диссоциации 0,3, Кд уксусной кислоты=1,78*10 -5
•1,4*10 -4
К
Потенциальная кислотность: С(1-α), а С = 2,
тогда С(1-α)= |
К |
(1 − ) = |
1,78 10 |
−5 |
(1 − 0,3) = 1,4 10−4 |
2 |
2 |
|
|||
|
|
0,3 |
|
|
|
Раствор сильного электролита (рН =12) разбавили в 10 раз. Чему равен рН полученного раствора?
•рН=11
Сильный электролит с рН=11 – щелочь.
рН = 14+lgCn, в исходном Сn = 10-2. После разбавления будет 10-3. Тогда рН=14+lgCn =11
pK(H2CO3)= 6.1. При физиологическом значении рН крови =7,4 соотношение
[HCO3 -] / [CO2] равно
•20/1
Можно посчитать по формуле кислотного буфера рН = рК + lg([HCO3 -] / [CO2])
7,4 = 6,1 + lg([HCO3 -] / [CO2]), 1,3 = lg([HCO3 -] / [CO2]), [HCO3 -] / [CO2] = 101,3 =20/1
Или запомнить.
В фосфатном буферном растворе при добавлении сильной кислоты изменению рН противодействует
•K2HPO4
Фосфатный буфер состоит из гидрофосфата (сопряженное основание) и дигидрофосфата (сопряженная кислота). С сильной кислотой будет реагировать сопряженное основание - гидрофосфат
Буферный раствор можно приготовить
•частичной нейтрализацией аммиака
Два способа изготовления буферов: сливание растворов слабого электролита и его сопряженного основания/кислоты или частичной нейтрализации
pK(H2PO4 -)=6.8. При физиологическом значении рН крови 7,4 соотношение
[HPO42 -]/[H2PO4 -] равно
•4/1
Можно посчитать по формуле кислотного буфера рН = рК + lg([HCO3 -] / [CO2]) 7,4 = 6,8+ lg([HCO3 -] / [CO2]), 0,7 = lg([HCO3 -] / [CO2]), [HCO3 -] / [CO2] = 100,6 = 4/1
Или запомнить.
Какую кислоту – угольную или лимонную – лучше взять для приготовления буферного раствора, стойко сохраняющего рН=3,15, если Кд угольной кислоты=8*10 -7, Кд лимонной кислоты=8,20*10 -4
•лимонную кислоту
Буфер поддерживает определённый рН тогда, когда его рК близко к рН. рК = -lgKд. Для лимонной 3,1, для угольной 6,1
При алкалозе рН крови
•рН > 7,36
Алкалоз – смещение в щелочную сторону (рН больше 7,36)
Какую смесь следует выбрать для приготовления буферного раствора с рН=9,2, чтобы раствор имел большую буферную емкость и по щелочи и по кислоте?
•боратную Кд Н3ВО3=6,0 *10 -10
Наибольшая емкость и по щелочи и по кислоте при рН = рК. А для поддержания определённого рН нужно брать буфер с рКа близко к рН.
Ищем буфер с рН около 9,2. рК = -lgKд. Для боратной рК 9,22
Если к ацетатному буферному раствору добавить соляную кислоту, то
•концентрация уксусной кислоты увеличится, ацетата натрия
уменьшится
Ацетат уменьшится (так как прореагирует с соляной), а уксусная увеличится
В бикарбонатном буферном растворе изменению рН при добавлении сильной кислоты противодействует
•соль
Бикарбонатный буфер состоит из соли гидрокарбоната (сопряженное основание) и угольной кислоты (сопряженная кислота). С сильной кислотой будет реагировать сопряженное основание – соль гидрокарбонат
Как изменится рН буферного раствора, содержащего в исходном растворе по 0,07 моль экв. соли и кислоты, если в раствор добавить 100 мл воды?
•не изменится
При добавлении воды рН буфера не меняется
Если слабая кислота нейтрализована на 50%, то
•рН равен рК
рН = рК + lg([соль] / [кислота]), при нейтрализации на 50% Ссоли = Скислоты, тогда логарифм равен нулю и рН=рК
Рассчитать рН аммонийного буфера, полученного сливанием равных объемов 0,1н раствора аммиака и 0,01 н раствора хлорида аммония. рК аммиака=4,75 (Ответ дать с точностью до сотых).
•10,25
рН = 14 – рК - lg([соль] / [аммиак]) = 14 – 4,75 – lg (0.01/0.1) = 10.25
В бикарбонатном буферном растворе возрастанию рН противодействует
•H2CO3
Возрастание рН = добавление щелочи. Бикарбонатный буфер состоит из соли гидрокарбоната (сопряженное основание) и угольной кислоты (сопряженная кислота). С щелочью будет реагировать сопряженная кислота – угольная кислота
Если рН буферного раствора > рКд слабой кислоты, то система более устойчива
•к добавлению кислоты
рН = рК + lg([соль] / [кислота]), если рН>рК, то логарифм больше единицы, тогда числитель больше знаменателя – соли больше, чем кислоты. А соль (сопряженное основание) противодействует добавлению кислоты
Рассчитать рН бикарбонатного буфера, полученного сливанием равных объемов 0,2 н раствора бикарбоната натрия и децинормального раствора угольной кислоты. рК угольной кислоты=6,1 Ответ дать с точностью до десятых, разделитель - запятая
•6,4
рН = рК + lg([соль] / [кислота]) = 6,1 + lg(0,2/0,1) = 6,4
Рассчитать рН бикарбонатного буфера, полученного смешиванием 200 мл 0,2 н раствора угольной кислоты и 100 мл 0,2 н раствора гидроксида калия. рК угольной кислоты=6,1 (ответ дать с точностью до сотых, разделитель -запятая).
•6,1
рН = рК + lg([щелочь] / [кислота-щелочь]) = 6,1 + lg((100*0,2)/(200*0,2-100*0,2)) = 6,1
Фосфатный буфер является основным буфером мочи. В фильтрате 80% фосфатов присутствует в виде аниона НРО42-, а 20% в виде аниона Н2РО4-. Кд Н2РО4 - =1,6*10-7. Рассчитать рН мочи. Ответ дать с точностью до десятых, разделитель - запятая
•7,4
рН = -lgK + lg([гидрофосфат] / [дигидрофосфат]) = -lg(1,6*10-7) + lg([80] / [20]) = 7.4
Если рН буферного раствора больше рК сопряженной кислоты, что нужно добавить в систему, чтобы рН стал равен рК
•сопряженную кислоту
рН = рК + lg([соль] / [кислота]), если рН>рК, то логарифм больше единицы, тогда числитель больше знаменателя – соли больше, чем кислоты. Чтобы рН был равен рК нужно уменьшить количество соли – добавить сильную кислоту
Раствор какого вещества замерзает при более низкой температуре, если моляльные концентрации растворов равны
•нитрата бария
tзам = iCm*К. Чем больше i, тем больше изменение температуры. Самые большие i у сильных электролитов, диссоциирующих на большое число ионов
Понижение давления насыщенного пара растворителя над раствором обусловлено протеканием процесса
•гидратации
Величина понижения температуры замерзания раствора является коллигативным свойством и зависит от
• числа частиц в растворе
Коллигативные свойства зависят от ЧИСЛА частиц
Изменение температуры замерзания одномоляльного водного раствора гидроксида бария равно (ответ дать с точностью до сотых, разделитель - запятая). Кводы=1,86 град кг/моль
•5,58
tзам = iCm*К = 3*1*1,86 = 5,58
Температура кипения 0,5 моляльного водного раствора хлорида натрия равно (ответ дать с точностью до сотых, разделитель - запятая). Еводы= 0,52 град*кг/моль
•100,52
tкип = iCm*E = 2*0,5*0,52
Ткип воды = 100С, Траствора = Ткип+ tкип=100,52
Рассчитать давление насыщенного пара растворителя над водным раствором сахарозы при 100 градусов С, если мольная доля сахарозы в растворе составляет 5*10-3. 1 атм= 101.3кПа. Ответ дать с точностью до десятых, разделитель - запятая:
•100,8
Р0 |
− Р |
Р |
(1 − ) = 101,3 (1 − 5 10−3) = 100.8 |
||
|
|
= , |
|
= 1 − , Р = |
|
|
|
|
|||
Р0 |
0 |
|
|||
Р0 |
|
||||

Раствор, содержащий 1,05 г некоторого неэлектролита в 30 г воды, замерзает при -0,7 градусов С. Рассчитайте молярную массу этого неэлектролита. Криоскопическая постоянная воды К (Н2О)= 1,86 (град.кг)/моль.
Ответ дать с точность до целых
• |
93 |
|
|
|
|
|
|
зам = К = |
1000 |
, = |
1000 |
= |
1 1,86 1000 1,05 |
= 93 |
|
воды |
∆ зам воды |
0,7 30 |
|||||
Степень диссоциации слабого электролита уменьшается:
•при добавлении сильного электролита, содержащего такой же ион
По закону разбавления Оствальда (К=С*α2) при растворении сильного электролита увеличится число
ионов (концентрация возрастает) – степень диссоциации снижается. = √КС ~ 1С
Константа диссоциации слабого электролита зависит от:
•от природы вещества и растворителя
Степень диссоциации уксусной кислоты возрастает при добавлении в раствор
•Воды
По закону разбавления Оствальда (К=С*α2) при добавлении раствора (увеличение объема -
снижение концентрации) увеличивается диссоциация ( = √КС ~ 1С ~ )
Нормальная концентрация раствора хлорида натрия
• Равна молярной концентрации
Сn= z*CM, эти концентрации равны при z = 1
Изотонические растворы ВСЕГДА имеют
•Равное осмотическое давление
Растворы изотоничны, если имеют равные осмотические давления
Явление, происходящее с клеткой в гипертоническом растворе, называется
•Плазмолиз
Вгипертоническом растворе Сосм больше, чем в клетке. Вода покидает клетку
Степень диссоциации серной кислоты
•равна 1
Сильные электролиты диссоциируют полностью, то есть α=1
Гипертонический раствор характеризуется в сравнительном плане
•Большей осмолярной концентрацией
Гемолиз это -
•Разрыв эритроцитов
Если слабая кислота нейтрализована на 50%, то
•рН равен рК
рН = рК + lg([соль] / [кислота]), при нейтрализации на 50% Ссоли = Скислоты, тогда логарифм равен нулю и рН=рК
В каком из буферных растворов больше соотношение концентраций соли и кислоты при рН крови 7,36
•цитратном, Кд = 7,45*10 -4
рН = рК + lg([соль] / [кислота]). Чем больше соотношение концентраций, тем больше рН-рК. Выбираем тот буфер, у которого рК самое маленькое, то есть самое большое Кд.
Сколько миллилитров 0,4 н раствора хлорида аммония нужно добавить к 400 мл 0,1 н раствора аммиака, чтобы получить буфер с рН=9,25? рК аммиака=4,75 Ответ дать с точностью до целых
•100
рН = 14 – рК - lg([соль] / [аммиак]), 14 – 4,75 – lg ((0,4х)/(400*0,1)) = 9.25, тогда х = 100
Рассчитать соотношение концентраций соли и кислоты в ацетатном буферном растворе, если рН раствора 3,75. Кд уксусной кислоты=1,75*10 -5 Ответ дать с точностью до десятых, разделитель - запятая
•0,1
рН = рК + lg([соль] / [кислота]) = -lg(1.75*10-5)+lg(x)= 3,75, отсюда х = 0,1
Рассчитать буферную емкость 1 л раствора, содержащего по 0,05 моль экв. аммиака и хлорида аммония при добавлении 0,005 моль экв гидроксида натрия. рК аммиака=4,75. (ответ дать с точностью до сотых, разделитель - запятая
•0,06
рН = 14 – рК - lg([соль] / [аммиак]) = 14 – 4,75 – lg ((0,05)/(0,05)) = 9.25 до добавления рН = 14 – рК - lg([соль-щелочь] / [аммиак+щелочь]) = 14 – 4,75 – lg ((0,05-
0,005)/(0,05+0,005))=9,34
0.005 В= ( 2− 1) = (9.34−9.25) = 0.056~0.06
Рассчитать рН раствора аммиака, нейтрализованного соляной кислотой на 60%. рКаммиака = 4.75 (ответ дать с точностью до сотых, разделитель - запятая
•9,07
Рассчитать рН раствора, полученного при смешивании 0,5 экв. дигидрофосфата натрия и 0,25 экв. гидроксида натрия. рК кислоты = 6,8 Ответ дать с точностью до десятых, разделитель - запятая
•6,8
рН = рК + lg([щелочь] / [соль-щелочь]) = 6,8 + lg((0.25)/(0.5-025)) = 6.8
Рассчитайте молярную массу неэлектролита, если раствор, содержащий 9,2 г этого вещества в 1,087 л раствора, имеет осмотическое давление 226,9 кПа при
0 С.
• |
84,6 |
|
|
|
|
|
|
|
|
|
Посм=i*CM*RT, = |
Посм |
= |
|
, = |
|
= |
9,2 1 8,31 273 |
= 84,6 |
||
|
|
|
|
|
||||||
|
|
|
|
|
Посм |
|
1,087 226,9 |
|
||
Выберите пары растворов с одинаковым осмотическим давлением при одинаковой температуре
Если одинаковая Т, то для одинакового Посм должны быть одинаковы Сосм=i*CM
•0,01 М раствор хлорида натрия (0,01*2) и 0,02 М раствор глюкозы
(0,02*1)
•0,01 М раствор глюкозы (0.01*1) и 0,01 М раствор сахарозы (0.01*1)
•0,01 М раствор сульфата натрия (0.01*3) и 0,01 М раствор серной
кислоты (0.01*3)
Расположите растворы по убыванию осмотического давления при одинаковой температуре
Если одинаковая Т, то вместо Посм можно считать Сосм=i*CM
раствор, содержащий 5,85 г хлорида натрия (2*5,85/58,5=0,2) и 1,8 г глюкозы
(1*1,8/180=0,01) в 1 литре (в сумме будет 0,21)
0,02М раствор хлорида кальция (0,02*3=0,06)
раствор, содержащий 1,17 г хлорида натрия в 1 литре раствора
(2*1,17/58,5=0,04)
0,035М раствор глицерина (1*0,035=0,035)
0,01М раствор хлорида натрия (2*0,01=0,02)
раствор, содержащий 1,8 г глюкозы в 1 литре (1*1,8/180=0,01)
Выберите верные утверждения
•осмотическое давление зависит от температуры Посм=i*CM*RT
•осмотическое давление не зависит от размеров ионов в растворе
(осмотическое давление – коллигативное свойство – зависит не от размеров, а от количества частиц)
•для расчета осмотического давления растворов электролитов необходимо использовать количественные характеристики процесса
диссоциации да, то есть учитываем диссоциацию – число i
Выберите пары растворов, рН которых имеет одинаковое значение:
•0,01М раствор серной кислоты (0,01*2) и 0,02М раствор соляной
кислоты (0,02*1) (рН=-lg(C*z), если C*z равны, то рН равны)
•0,01М раствор уксусной кислоты рК=4,75 [0,5(4,75-lg0,01)=3.375] и 0,001М раствор муравьиной кислоты рК=3,75 [0,5(3,75-lg0,001)=3.375]
рН=0,5(рК-lgC)
Подберите к высказыванию левого столбца продолжение из правого столбца:
Высказывание - Продолжение
Осмолярная концентрация серной |
утроенной молярной |
кислоты равна |
концентрации Сосм = i*CM, i=3 для серной |
Изотонический коэффициент хлорида |
3 |
кальция равен |
Хлорид кальция диссоциирует на три иона, |
|
поэтому i=3 |
Отношение числа растворяемых |
1 |
молекул глюкозы и числа молекул в |
У неэлектролитов i=1 |
растворе равно |
|
Осмолярная концентрация |
сумме осмолярных концентраций |
трехкомпонентного раствора равна |
компонентов |
Установите соответствие между раствором вещества и формулой для расчета рН разбавленного раствора.
Для просмотра вариантов ответа разверните окно на весь экран.
Раствор, полученный смешиванием 200 мл и 100 мл эквимолярных растворов уксусной кислоты и ацетата натрия
Раствор, полученный смешиванием 200 мл 0,01М раствора уксусной кислоты и 100 мл 0,01М гидроксида натрия
рН = 14 – рК - lg([соль] / [аммиак]) = 14 – 4,75 – lg(0.6/0.4) = 9.07

Раствор, содержащий по 0,06 моль дигидрофосфата натрия и гидрофосфата натрия
Раствор, полученный смешиванием одинаковых объемов 0,01 н раствора аммиака и 0,02 н раствора хлорида аммония
Расположите в ряд по уменьшению рН бикарбонатные буферные растворы. рК диссоциации УГОЛЬНОЙ КИСЛОТЫ=6,1
рН = рК + lg([соль] / [кислота]) = 6,1 + lg([соль] / [кислота])
При уменьшении рН уменьшается соотношение соль/кислота
раствор, содержащий 0,04 моль эквивалента гидрокарбоната калия и 0,02 моль эквивалента угольной кислоты 0,04/0,02 = 2
раствор, полученный нейтрализацией угольной кислоты щелочью на 60%
60/40 = 1,5
раствор, содержащий по 0,04 моль эквивалента гидрокарбоната калия и угольной кислоты 0,04/0,04 = 1
раствор, полученный нейтрализацией УГОЛЬНОЙ КИСЛОТЫ щелочью на 40%
40/60=2/3=0,667
раствор, содержащий 0,02 моль эквивалента гидрокарбоната калия и 0,04 моль эквивалента угольной кислоты 0,02/0,04=0,5
раствор, полученный сливанием равных объемов 0,02М раствора гидрокарбоната калия и 0,1М угольной кислоты. 0,02/0.1 = 0,2
Расположите в ряд по уменьшению рН аммонийные буферные растворы. рК ионизации аммиака =4,75
рН = 14 – рК - lg([соль] / [аммиак]) = 14 – 4,75 - lg([соль] / [аммиак])
чем меньше соотношение соль/аммиак, тем больше рН
раствор, полученный нейтрализацией аммиака соляной кислотой на 20%
0,2/0,8 = 0,25
раствор, содержащий 0,03 моль эквивалента аммиака и 0,01 моль эквивалента хлорида аммония 0,01/0,03 = 0,333
раствор, содержащий по 0,04 моль эквивалентов аммиака и хлорида
аммония 0,04/0,04 = 1
раствор, содержащий 0,01 моль эквивалента аммиака и 0,03 моль эквивалента хлорида аммония 0,03/0,01 = 3
раствор, полученный нейтрализацией аммиака соляной кислотой на 80%
80/20 = 4
раствор, полученный сливанием равных объемов 0,01М раствора аммиака и 0,05 М раствора хлорида аммония 0,05/0,01 = 5
Установите соответствие между раствором вещества и формулой для расчета рН разбавленного раствора
Раствор серной кислоты рН = - lgN
Раствор сернистой кислоты
Раствор гидроксида натрия |
pH = 14 |
+ lgCM |
Раствор гидроксида бария |
pH = 14 |
+ lg2CM |
Расположите растворы в ряд по уменьшению рН
сантимолярный раствор гидроксида натрия рН = 14+lg(1CM) = 14-2=12
сантимолярный раствор уксусной кислоты рК=4,75 рН=0,5(рК-lgC) = 3,375
сантимолярный раствор муравьиной кислоты рК=3,75 рН=0,5(рК-lgC) = 2,875
миллимолярный раствор серной кислоты рН = -lg(2CM) = 2,7
сантимолярный раствор соляной кислоты рН = -lg(1CM) = 2
Расположите растворы в ряд по увеличению рН
сантимолярный раствор муравьиной кислоты рК=3,75 рН=0,5(рК-lgC) = 2,875
сантимолярный раствор уксусной кислоты рК=4,75 рН=0,5(рК-lgC) = 3,375
сантимолярный раствор аммиака рК=4,75
рН = 14 – 0,5(рК-lgC)= 14 – 0,5(4,75+2)=10,625
сантимолярный раствор гидроксида натрия pH = 14 + lgCM = 14 – 2 = 12
сантимолярный раствор гидроксида бария pH = 14 + lg(2CM) = 14-1,7=12,3
Установите соответствие между раствором вещества и расчетом концентрации рН влияющих ионов
Раствор серной кислоты |
[H+]=n кислоты |
Раствор углекислого газа в воде |
[H+]=альфа*n кислоты |
Раствор аммиака |
[ОН ]=альфа* СМ основания |
Раствор гидроксида калия |
[ОН ]=СМ щелочи |
•бикарбонатный буферный раствор, полученный сливанием равных объемов эквимолярных растворов гидрокарбоната натрия и угольной кислоты
•ацетатный буферный раствор, полученный нейтрализацией уксусной кислоты гидроксидом натрия на 50%
Выберите растворы, которые стойко поддерживают рН=5
Это кислотные буферы, у которых рК около 5 (ацетатный буфер)
•ацетатный буферный раствор, содержащий по 0,01 моль эквивалента ацетата натрия и уксусной кислоты К диссоциации уксусной кислоты
= 1,75*10-5
•ацетатный буферный раствор, содержащий 0,05 моль эквивалента ацетата натрия и 0,05 моль эквивалента уксусной кислоты Кдисссоциации уксусной кислоты = 1,75*10-5
Выберите верные утверждения
•При добавлении в любой буферный раствор сильной кислоты рН незначительно уменьшается
•При небольшом разбавлении буферного раствора водой рН не изменяется
•При добавлении в буферный раствор сильной кислоты число моль эквивалента сопряженного основания убывает, сопряженной кислоты возрастает
Выберите верные утверждения
•бикарбонатная буферная система в крови действует кооперативно с гемоглобиновой и оксигемоглобиновой буферными системами
•рН бикарбонатной буферной системы зависит от парциального давления углекислого газа воздуха, находящегося в равновесии с кровью
•один из процессов восполнения щелочного резерва крови может быть описан уравнением
Выберите верные утверждения:
При добавлении к фосфатному буферному раствору гидроксида бария
•рН раствора незначительно увеличивается
•концентрация дигидрофосфата-аниона убывает, гидрофосфатааниона - возрастает
Выберите пары растворов с одинаковой массовой долей (плотность растворов принять 1 г/мл; расчеты с точностью до тысячных)
•0,01 молярный раствор глюкозы и 0,01 молярный раствор фруктозы
•раствор, содержащий 0,141 моль сульфата натрия и раствор, содержащий 0,122 моль фосфата натрия в каждом литре раствора
•0,01 М раствор пропановой кислоты и 0,01 М раствор этилформиата
Выберите пары растворов с одинаковой молярной концентрацией (плотность растворов принять 1 г/мл)
•раствор, содержащий 1,80 г глюкозы и раствор, содержащий 3,42 г сахарозы в каждом литре раствора
•раствор, содержащий 36,5 г соляной кислоты и раствор, содержащий 40,0 г гидроксида натрия в 1 литре раствора
•20% раствор глюкозы и 20% раствор фруктозы
•сантимоляльный раствор бутановой кислоты и сантимоляльный раствор 2-метилпропановой кислоты
Установите соответствие между реагентом, добавленным в буферный раствор, и уравнением реакции, протекающей в растворе
Бикарбонатный буферный раствор + соляная кислота
Бикарбонатный буферный раствор + гидроксид натрия
Фосфатный буферный раствор + соляная кислота
Фосфатный буферный раствор + гидроксид натрия
Выберите из списка растворы, буферная емкость которых по щелочи меньше буферной емкости по кислоте (когда соли больше, чем кислоты, в кислотном буфере или, когда основания больше, чем соли, в основном буфере)
Выберите растворы, буферная емкость которых по кислоте равна буферной |
|
емкости по щелочи (это при соль=кислоте) |
• |
•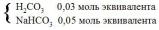
•Раствор аммиака, нейтрализованный соляной кислотой на 30%
Установите соответствие между смешиваемыми растворами и составом конечного раствора
Эквимолярные растворы |
|
молочной кислоты-100 мл и |
|
гидроксида натрия-100 мл |
|
200 мл 0,01 М раствора молочной |
|
кислоты и 100 мл 0,01М раствора |
|
гидроксида натрия |
|
200 мл 0,01 М раствора |
|
гидроксида натрия и 0,01 моль |
|
углекислого газа |
|
200 мл 0,01 М раствора |
Na2CO3 |
гидроксида натрия и 0,001 моль |
|
углекислого газа |
|
Выберите из списка буферные растворы, которые противодействуют изменению рН в организме человека бикарбонатный и фосфатный
▪
▪
Установите соответствие между способом выражения концентрации и формулой
Молярная концентрация
Молярная концентрация эквивалента
Моляльная концентрация
Массовая доля вещества
Электрохимия
Определить направление ОВР: С2Н5ОН + НАД+ = СН3СОН + НАДН + Н+
(ацетальдегид/этанол)= -0,20 В; (НАД+/НАДН)= -0,320 В
•справа налево
ОВР идут от окислителя (тут ацетальдегид).
Окислитель – окисленная форма (первая в записи) той пары, у которой Е больше. (ацетальдегид – окисленная форма, а этанол - восстановленная)
Рассчитать потенциал водородного электрода в 0,1н растворе уксусной кислоты, pK CH3COOH = 4,75.
Ответ дать с точностью до сотых, разделитель - запятая
•-0,17
Е=-0,059рН = -0,059 * 0,5(4,75+1) =-0,17
Как изменится потенциал платинового электрода, помещенного в раствор солей CrCl2 и CrCl3, при разбавлении раствора водой?
•Не изменится
= 0 − |
0.059 |
|
[ок] |
при разбавлении обе концентрации уменьшаются, а соотношение не меняется в |
||
|
|
|
|
|||
|
|
[вос] |
||||
итоге |
|
|
|
|
|
|
Рассчитать ЭДС элемента, состоящего из насыщенного каломельного электрода и водородного электрода, опущенного в 0,01 н раствор соляной кислоты. Екалом=0,244 В.
Ответ дать с точностью до тысячных, разделитель - запятая
•,362
Е= -0,059рН = -0,059*2=-0,118В ε = Екалом – Е = 0,244 – (-0,118) = 0,362В
Рассчитать потенциал хингидронного электрода в 0,01 н растворе уксусной кислоты наполовину нейтрализованной щелочью. рК кислоты =4,75; хг=0,699 В. Ответ дать с точностью до тысячных, разделитель - запятая
•,419
Ехг = 0,699 – 0,059рН = 0,699-0,059*4,75=0,419
Как изменится потенциал водородного электрода в бикарбонатном буферном растворе при добавлении к этому раствору соли NaHCO3.
Е = -0,059рН = -0,059 * (рК + lg([соль] / [кислота]))
Чем больше соли, тем выше рН, тем меньше Е
•Уменьшится
Электрохимический ряд металлов (ряд напряжений) – это последовательность металлов, расположенных в зависимости от:
•электродных потенциалов
Электрохимическая реакция протекает самопроизвольно, если ЭДС элемента:
•больше 0
Рассчитайте ЭДС гальванического элемента по значениям равновесных потенциалов электродов Cu = 0,34 В; Zn = -0,76 B
Ответ дать с точностью до десятых, разделитель - запятая
•1,1
ε= ЕCu – Ezn = 0,34 – (-0,76) = 1.1
Как изменится величина равновесного потенциала водородного электрода, помещенного в раствор уксусной кислоты, если нейтрализовать кислоту?
Е = -0,059рН = -0,059 * (рК + lg([соль] / [кислота]))
Нейтрализуем кислоту, становится больше соли, тем выше рН, тем меньше Е
•Уменьшится
Платиновый электрод находится в растворе, содержащем пируват и лактат при рН=7. Какая реакция протекает в системе при уменьшении равновесного потенциала?
•Восстановление
′ = 0′ + |
0.059 |
|
[ок] |
Снижаем E, снижаем логарифм – тогда окислителя мало и восстановителя |
2 |
[вос] |
много – значит идет процесс восстановления
В каком растворе потенциал водородного электрода имеет большее значение?
•0,1 н HCl
Большее значение Е будет при меньших рН (в сильных кислотах)
Какая система является окислителем (акцептором протонов) в реакции фумарат + лактат = сукцинат + пируват (пируват/лактат)= -0,18 В; (фумарат/сукцинат)= -0,031 В.
• фумарат/сукцинат
Окислитель – тот, у кого потенциал больше
Хингидронный электрод используют в кислых средах. хг=0,699 В. Выберите верное утверждение:
•максимальное значение Eхг=0.699В
Ехг = 0,699 – 0,059рН, причем рН может быть от 0 до 7. Максимальное значение при рН = 0 – это 0,699В
Как можно увеличить потенциал водородного электрода?
•добавить кислоты
Еувеличивается при уменьшении рН – то есть добавляем кислоту
Стеклянный электрод применяется для:
•определения рН раствора
Fe3+ + Sn2+ = Fe2+ +Sn4+ Рассчитать изменение изобарно-изотермического потенциала этой реакции. Eo (Fe3+/ Fe2+)=0,77 B; Eo (Sn4+/ Sn2+)=0,15 B
Ответ дать с точностью до целых
•-119660
G = -nFε = - 2 * 96500 * (0.77-0.15) = -119660
Число электронов в элементарном реакции n = 2
Определить рН раствора, в который погружен водородный электрод. ЭДС элемента, состоящего из водородного и хлорсеребряного электродов, равна 0,379В. Ехс=0,202 В. Ответ дать с точностью до целых
•3
ε= Ехс – Е = Ехс + 0,059рН, отсюда рН = (ε- Ехс)/0,059 = (0,379 – 0,202)/0,059=3
Как изменится величина равновесного потенциала водородного электрода, если нейтрализовать раствор уксусной кислоты? Pt(H2) | CH3COOH 0,1н, pKCH3COOH = 4,75.
•Уменьшится на 0.243
До Е = -0,059 * 0,5(4,75+1) = -0.17 После E = -0,059*7 = - 0.413 Изменение -0,413 – (-0,17) = - 0,243

2Fe2+ + I2 = 2Fe3+ + 2IРассчитать изменение изобарно-изотермического потенциала этого процесса. Eo (Fe3+/ Fe2+)=0,77 B; Eo(I-/I2) = 0,54B
•-44390
G = -nFε = - 2 * 96500 * (0.77-0.54) = -44390
Число электронов в элементарном реакции n = 2
Рассчитать ЭДС элемента, состоящего из насыщенного каломельного электрода и водородного электрода, погруженного в 0,05 н раствор серной кислоты. Екалом=0,244В. Ответ дать с точностью до тысячных, разделитель – запятая
•0.321
Е= -0,059рН = -0,059*1,3=-0,077В ε = Екалом – Е = 0,244 – (-0,077) = 0,321В
Рассчитать ЭДС элемента, состоящего из насыщенного каломельного электрода и водородного электрода, погруженного в 0,01 н раствор аммиака. рКаммиака= 4,75; Екалом=0,244В.
Ответ дать с точностью до сотых, разделитель - запятая
•,87
Е= -0,059рН = -0,059*10,625=-0,6267В ε = Екалом – Е = 0,244 – (-0,627) = 0,87В
Рассчитать ЭДС элемента, состоящего из водородного электрода в нейтральном растворе и хингидронного электрода, погруженного в 0,01 н раствор уксусной кислоты. рКуксусной кислоты= 4,75; Е0хг=0,699 В Ответ дать с точностью до тысячных, разделитель - запятая
•,913
Е= -0,059рН = -0,059 * 7 = -0,413
Ехг = 0,699 – 0,059рН = 0,669 – 0,059*3,375 = 0,499875 ε = Е – Ехг = -0,413 – 0,499875 = 0,913В
Рассчитать соотношение концентраций соли и кислоты в бикарбонатном буфере, если потенциал хингидронного электрода в этом растворе равен 0,398
В. Еохг=0,699 В
Ответ дать с точность до десятых, разделитель - запятая
•,1
Ехг = 0,699 – 0,059рН, тогда рН = (0,699-Ехг)/0,059 = 5,1
рН = рК + lg([соль] / [кислота]) = 6,1 + lg([соль] / [кислота]) = 5,1, тогда lg([соль] / [кислота]) =-1, [соль] / [кислота]=10-1=0.1
Расположите процессы в ряд по возрастанию изобарно-изотермического потенциала (Ео (О2/Н2О)=0,82 В.):
G = -nFε, чем больше G, тем меньше ЭДС
ε= Ео (О2/Н2О)-Еоцитохром
Цитохром с1 + О2 Еоцитохром с1=0,22 В
Цитохром с + О2 Еоцитохром с =0,26 В
Цитохром а + О2 Еоцитохром а =0,29 В
Выберите правильное утверждение для ОВР с учетом направления самопроизвольной реакции:
С2Н5ОН + НАД+ ; СН3СОН + НАДН + Н+ Eo’(ацетальдегид/этанол) = -0,20 В; Eo’ (НАД+/НАДН)= -0,320 В
•Ацетальдегид принимает электроны, НАДН отдает электроны
Выберите одну пару утверждений, которые правильно характеризуют самопроизвольную ОВР:
С2Н5ОН + НАД+ ; СН3СОН + НАДН + Н+ Eo’(ацетальдегид/этанол)= -0,20 В; Eo’ (НАД+/НАДН)= -0,320 В
ацетальдегид - окислитель НАДН отдает 2 протона и 2 электрона
Выберите правильное утверждение для ОВР с учетом направления самопроизвольной реакции: 2MnO4- + 5NO2- + 6H+ ; 2Mn2+ + 5NO3- + 3H2O Eo (MnO4 / Mn2+)=1,51B; Eo (NO3 /NO2 )=0,94B
•Перманганат - окислитель, нитрит - восстановитель
Выберите одну пару утверждений, которые правильно характеризуют самопроизвольную ОВР: 2MnO4 + 5NO2 + 6H+ ; 2Mn2+ + 5NO3 + 3H2O Eo (MnO4 / Mn2+)=1,51B; Eo (NO3 /NO2 )=0,94B
•перманганат восстанавливается
•направление реакции слева направо
Стандартный окислительно-восстановительный потенциал системы пируват/лактат при рН=7 составляет - 0,180 В. Выберите верные утверждения:
•При уменьшении равновесного потенциала концентрация лактата возрастает
•При уменьшении равновесного потенциала идет реакция восстановления
Расположите растворы в ряд по увеличению потенциала погруженного в них водородного электрода:
рН водородного электрода увеличивается со с увеличением кислотности
0,1 н NaOH
вода
0,1 н HCl
Выберите верные утверждения для элемента: Ag AgCl, KСlнас. физ.раствор (XГ) Pt
EoХГ = 0,699В, Ехс= 0,202В
•ЭДС = Ехг - Ехс
•Равновесный потенциал электрода сравнения постоянный
Гальванический элемент состоит из водородного электрода, погруженного в 0,01н раствор гидроксида натрия, и хингидронного электрода в 0,01 н растворе НCL. Еохг=0,699 В. Выберите верные утверждения для этого элемента:
•ЭДС = Ехг - Ен2
•При изменении рН любого из растворов ЭДС изменится
ЭДС элемента, составленного из насыщенного каломельного электрода и водородного электрода, опущенного в желудочный сок, равна 0,421 В. Екал = 0,244 В. Рассчитать рН желудочного сока с точностью до целых.
•"3"
ε= Екалом – Е = 0,244 – Е = 0,421, тогда Е = 0,244-0,421 = -0,177
Е= -0,059рН = -0,177, отсюда рН = 0,177/0,059 = 3
Лигандообменные
В комплексном соединении K4[Fe(CN)6] заряд иона комплексообразователя равен:
•+2
Вкаком из растворов комплексных соединений концентрация лиганда (аниона аминокислоты аспарагина) наибольшая (молярные концентрации растворов равны)?
•[Mg(Asn)2] KH=1,0*10 -4
Наибольшая концентрация лиганда (ионов) больше там, тем где больше Кн (так как соединение более нестойкое и больше диссоциирует)
Вкомплексном соединении [Pt(NH3)2Cl2] заряд внутренней сферы равен:
•0
Вкомплексном соединении (NH4)2[PtCl4] лигандами являются ионы:
•хлора
Вкомплексном соединении К2[PtCl6] комплексообразователем является ион:
•платины
С каким из анионов аминокислот: аспарагина, аланина или глицина ион меди образует более прочное комплексное соединение? Константы нестойкости соответственно равны 1,2*10 -15; 4,0*10 -18; 1,4*10 -8:
•аланинатом
Более прочные комплексы имеют малые Кн
Константа нестойкости комплексных соединений не зависит от:
•концентрации
Вкаком из растворов равной молярной концентрации комплексных соединений пиридина с ионами металлов кадмия, меди или цинка концентрация лиганда наибольшая, если константы нестойкости соответственно равны
•1,2*10 -2
Наибольшая концентрация лиганда (ионов) больше там, тем где больше Кн (так как соединение более нестойкое и больше диссоциирует)
Какое из комплексных соединений с аминокислотой глицином является наименее устойчивым, если константы нестойкости комплексов соответственно равны:
•KH= 1*10 -4
Наименее нестойкое соединение то, у кого больше Кн (больше диссоциирует)
Выберите верные утверждения, характеризующие процесс диссоциации комплексного соединения K3[Fe (CN)6]:
•Продукты первичной диссоциации: 3К+ + [Fe (CN)6] 3-
•Вторичная диссоциация протекает ступенчато
Выберите верные утверждения, характеризующие процесс диссоциации комплексного соединения [Pt (NH3)2 Cl2 ] :
•Один из продуктов диссоциации NH3
•На последней ступени диссоциации образуется Pt+2
Установите соответствие между комплексным соединением и комплексообразователем в его составе:
комплекс ----------------------------------- |
комплексообразователь |
Гемоглобин |
ион железа |
Хлорофилл |
ион магния |
Mg[Cd (CN)4] |
ион кадмия |
Cd[Pt (CN)4] |
ион платины с зарядом +2 |
Выберите верные утверждения, характеризующие процесс диссоциации комплексного соединения К2[Cd(CN)4] :
•Ион Cd+2 образуется в результате вторичной диссоциации
•В результате первичной диссоциации образуется [Cd (CN)4] 2
Расположите комплексы меди с аспарагином, аланином и глицином в порядке увеличения их устойчивости (от самой большой Кн к самой маленькой). Константы нестойкости соответственно равны:
1,4*10-8
1,2*10-15
4*10-18
Константы нестойкости комплексов:
[Ag(NH3)2]+=10-8 [NH4]+= 10-10 [Pt(NH3)4]+2=10-34
Выберите верные утверждения.
•Комплекс серебра можно разрушить сильной кислотой
Да, так как NH4+ более устойчив, так как Кн меньше (равновесие смещено в сторону более устойчивых продуктов)
•Комплекс серебра менее устойчив, чем комплекс платины
УКС серебра больше Кн – он менее устойчив
Даны константы нестойкости комплексов цинка с пиридином и аммиаком соответственно равны: 10-2 и 10-10. Выберите верное утверждение:
•При добавлении аммиака к раствору [Zn(пиридин)4]+2 образуется
аммиакат (аммиакат более устойчив, его Кн меньше)
Константы нестойкости комплексов токсичного свинца с биосубстратом в организме и с комплексоном соответственно равны 10-4 и 10-10. Выберите верные утверждения.
•Комплексон можно использовать для вывода свинца из организма
•Лигандообменное равновесие смещено в сторону комплекса с комплексоном
Укомплексона более устойчивый комплекс со свинцом, так как Кн меньше
Гетерогенные
К насыщенному раствору хлорида серебра с донной фазой добавили одно из перечисленных веществ. В каких случаях изменится растворимость AgCl:
•хлорид натрия
•нитрат серебра
•этанол
Растворимость изменяется при добавлении ионов, входящих в состав осадка и неполярного растворителя
Известно, что этот процесс растворения хлорида натрия эндотермический. Выберите верные утверждения:
•При нагревании растворимость хлорида натрия увеличивается
•Изменение энтальпии при растворении хлорида натрия больше нуля
Эндотермический (поглощение тепла) процесс, то есть энтальпия (теплосодержание) увеличивается А при нагревании равновесие смещается в сторону эндотермической – растворимость увеличивается
Установить последовательность выпадения осадков при добавлении раствора нитрата серебра к раствору, содержащему хлорид-, бромид- и иодидионы в равных количествах.
Сначала выпадает у того, у кого ПР самое маленькое
ПР(AgI) = 8,3*10-17
ПР(AgBr) = 5,3*10-13
ПР(AgCl) = 1,8 *10-10
Какую соль нужно добавить к раствору сульфида натрия для наиболее эффективного удаления сульфид-ионов – нитрат свинца (II), нитрат ртути (II) или нитрат платины (II) ? Расположите эти соли в порядке уменьшения эффективности
Самая большая эффективность (раньше выпадает осадок), у кого ПР самое маленькое
ПР(PtS) = 1.2*10-61
ПР(HgS) = 1.6*10-52
ПР( PbS) = 2.5*10-27
При лечении опухолей используются комплексные соединения платины. Используя данные константы, выберите верные утверждения:
ПР (Pt(OH)2) = 10-35, Кнест [PtCl4]2- = 10-43
Так как ПР меньше Кн, то равновесие смещено в сторону образования комплекса (образуется более устойчивое соединение)
•Можно приготовить лекарство, содержащее [PtCl4]2- , используя свеже-осажденный гидроксид платины (II)
•При добавлении ионов хлора осадок Pt(OH)2 растворяется
Концентрация свободных ионов кальция в плазме крови 1,1*10-3 моль/л; гидрофосфат-анионов 2,9*10-4 моль/л.
ПР(CaHPO4) =2,7*10-7. Выберите верные утверждения:
•ПИ = 3.19*10-7
ПИ = 1,1*10-3 *2,9*10-4=3,19*107
•Возможно образование осадка гидрофосфата в плазме
Так как ПИ больше ПР (перенасыщенный раствор), то возможно
ПР (AgCl)=1,8*10-10 Кнест. диамминсеребра (1)=10-8
Выберите верные утверждения, характеризующие равновесие в аммиачном растворе хлорида серебра:
Так как ПР меньше Кн, то равновесие то равновесие смещено в сторону образования комплекса (образуется более устойчивое соединение)
•Возможно растворение осадка в избытке аммиака
•Самопроизвольная реакция идет в сторону образования осадка
Установите соответствие между растворами и их характеристиками раствор - характеристика
ненасыщенный |
в нем осадок растворяется |
насыщенный |
концентрация ионов постоянна |
перенасыщенный |
ПР меньше ПИ |
Выберите вещество, добавление которого приведет к увеличению растворимости сульфата кальция в воде:
•Вода
Установите соответствие между растворами и их характеристиками
ненасыщенный |
ПР больше ПИ |
насыщенный |
содержит максимально возможное |
|
при данных условиях количество |
|
растворенного вещества |
перенасыщенный |
скорость растворения меньше |
|
скорости осаждения |
Возможно ли полное растворение 0,1 г хлорида серебра в 1л воды при стандартных условиях? ПР (AgCl) = 1.8*10-10
•Невозможно, т.к. концентрация ионов в растворе 7*10-4 моль/л
Концентрация 0,1/((108+35,5)*1) = 7*10-4
Растворимость = √ПР = 1,3 10−5 Так как концентрация больше растворимости, то образуется осадок
Вычислить равновесную концентрацию ионов бария в насыщенном растворе хромата бария. ПР (ВаСrО4)=1,1*10-10.
•1.05* 10-5
Внасыщенном растворе ПИ=ПР=[Ba2+][CrO42-]=[Ba2+]2
Тогда [Ba2+] = √ПР = √1,1 10−10 = 1,05 10−5
В1л насыщенного раствора сульфата кальция при температуре 20 С содержится
2,04 г вещества. Рассчитайте произведение растворимости.
•2.25 *10-4
Внасыщенном растворе ПИ=ПР=[Сa2+][SO42-]=[CaSO4]2
ПР = ((2,04/(136))/1)2=2,25*10-4
Рассчитать равновесную концентрацию ионов серебра в насыщенном растворе
AgI. ПР = 2.3*10-16
•1.5 *10-8
Внасыщенном растворе ПИ=ПР=[Ag+][Cl-]=[Ag+]2
Тогда [Ag+] = √ПР = √2.3 10−16 = 1,5 10−8

Органика
формуле |
соответствует название |
•2-амино-3-гидроксипропановая кислота
Ккакому классу относится 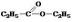
•сложные эфиры
Ккакому классу относится соединение 
•карбоновые кислоты
Название гетероциклического соединения
•тиофен
Коксосоединениям не относится
•
Общая формула
•ангидридов карбоновых кислот
Соединение 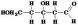 относится к классу
относится к классу
•альдегидов
Формуле  соответствует название
соответствует название
•3,5 дигидроксипентаналь
Название гетероциклического соединения 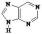
•пурин
Название гетероциклического соединения
•пиримидин
Наиболее устойчивой конформацией гександиона-2.5 является конформация:
•заторможенная
Наиболее устойчивая конформация обычно – заторможенная (анти-), так как заместители находятся на максимальном расстоянии друг от друга (энергия наименьшая)
Наиболее устойчивой конформацией ментола (5-метил-2-изопропил- циклогексанола-1) является конформация:
•кресло
Наиболее устойчивая конформация шестичленных циклов (то есть с наименьшей энергией) обычно – кресло с заместителями в экваториальных положениях
Наиболее устойчивой конформацией циклогексанкарбоновой кислоты является конформация:
•кресло
Наиболее устойчивая конформация шестичленных циклов (то есть с наименьшей энергией) обычно – кресло с заместителями в экваториальных положениях
Химическое строение молекулы определяется
•природой и последовательностью связей и атомов в молекуле
Молекула какого соединения обладает большей энергией сопряжения:
•каротин
Так как самая длинная цепь сопряжения з данных молекул (чем больше цепь сопряжения, тем больше энергия сопряжения и больше стабильность)
Молекула какого соединения обладает большей энергией сопряжения:
•циклогексатриен-1,3,5 (бензол)
Самая высокая энергия сопряжения у ароматических соединений, потом у закрытых сопряженных систем, а в конце – у открытых
Молекулы каких соединений обладают большей энергией сопряжения:
•ароматические
Кгетероциклическим ароматическим соединениям относится
•имидазол
Кгетероциклическим ароматическим соединениям относится
•пурин
Кислотные свойства наиболее выражены у
•пропантриола-1,2,3
Умногоатомных спиртов сильнее кислотные свойства, чем у одноатомных и у воды
Вреакцию со свежеосажденным гидроксидом меди (II) не вступает
•этанол
Вреакцию с водным раствором щелочи вступает
•этантиол
У тиолов (меркаптаны) кислотные свойства сильнее, чем у одноатомных спиртов
Какое соединение обладает наиболее сильными кислотными свойствами
•орто-гидроксибензойная кислота (салициловая)
За счет стабилизации водородными связями
В молекуле имидазола сопряженное электронное облако, охватывающее все атомы цикла содержит электронов:
•6
Какой тип сопряжения в молекуле пиримидина?
•П,П-
Пентандион-1,2 относится к классу:
•Кетонов
Гександиаль относится к классу:
•альдегидов
Ккарбоциклическим ароматическим соединениям относится:
•антрацен
Сточки зрения теории Брёнстеда, вода - это:
•амфолит
Пиррол:
•проявляет кислотные свойства
Пиридин:
•проявляет основные свойства
Имидазол:
•является амфолитом
Фенол:
•проявляет кислотные свойства
Анилин:
•проявляет основные свойства
Ацетилен:
•проявляет кислотные свойства
Установите соответствие между терминами в левом столбце и утверждениями в правом.
химическое строение |
Изображается структурной |
|
формулой |
конфигурация |
Определяется типом гибридизации |
|
атомов углерода |
конформация |
Изменяется при повороте молекулы |
|
вокруг сигма-связи |
Установить соответствие между утверждением в левом столбце и видом изомерии.
Смесь изомеров невозможно разделить |
конформационная изомерия |
Изомеры отличаются расположением |
оптическая изомерия |
заместителей вокруг асимметрического |
|
атома углерода |
|
Разновидность структурной изомерии |
изомерия углеродного скелета |

Установите соответствие между схемой процесса и преимущественным
|
продуктом |
Процесс ----------------------- |
Преимущественный продукт |
Пиридин + хлорметан |
|
В пиридине замещение в β-положение |
|
|
|
Пиррол +хлорметан |
|
В пирроле замещение в α-положение |
|
Пиримидин + хлорметан
В пиримидине замещение в β-положение от обоих атомов азота
Фенол + хлорметан
ОН-группа - орто/пара-ориентант
Выберите верные утверждения, относящиеся к понятию "ароматичность"
•Ароматическими являются только циклические соединения
•К ароматическим соединениям относятся все перечисленные вещества: нафталин, пиримидин, пурин
•Ароматические соединения вступают в реакции электрофильного замещения, реакции присоединения нехарактерны, протекают в жестких условиях
Выберите верные утверждения
•Пиррол более активен, чем бензол в реакции электрофильного замещения с хлором
Выберите верные утверждения
•Бензол вступает в реакцию электрофильного замещения с хлором в присутствии хлорида железа (III)
•Реакция замещения атома водорода на атом хлора в пирроле преимущественно протекает в альфа-положение
Аминокислоты
При значении рН раствора равном рI аминокислоты данная аминокислота существует в растворе в виде:
•биполярного иона
Ккислым аминокислотам относится:
•аспарагиновая кислота
Каминокислотам основного типа относится:
•лизин
Кислая среда образуется при растворении в воде аминокислоты:
•глутаминовая кислота
Кнейтральным относится аминокислота:
•глутамин
Аминокислоты являются мономерами
•белков
Изоэлектрическая точка глутаминовой кислоты
•в кислой среде
Щелочная среда образуется при растворении в воде аминокислоты:
•аргинин
Изоэлектрическая точка гистидина
•в щелочной среде
Изоэлектрическая точка лизина
•в щелочной среде
Уаминокислот основного типа изоэлектрические точки в области рН
•больше 7
Уаминокислот кислотного типа изоэлектрические точки в области рН
•меньше 7
При рН крови =7,4 аспарагиновая кислота существует в виде
•аниона
Так как ее pI лежит в кислой среде, рН > pI, в виде аниона
При рН крови =7,4 лизин существует в виде
•катиона
Так как ее pI лежит в щелочной среде, рН < pI, в виде катиона
При рН раствора меньших, чем изоэлектрическая точка, аланин существует в виде
•катиона
рН < pI, в виде катиона
При рН раствора больших, чем изоэлектрическая точка, лизин существует в виде
•аниона
рН > pI, в виде аниона
При растворении в воде дипептида Лиз-Сер получается среда
•щелочная
Лизин – основная, Серин – нейтральная. В сумме щелочная
При растворении в воде дипептида аланил-гистидин получается среда
•щелочная
аланин – нейтральная, Гистидин – основная. В сумме щелочная
При растворении в воде дипептида Глу-Гли получается среда
•кислая
Глутаминовая кислота – кислая, глицин – нейтральная. В сумме кислая
Белок с pI 3 поместили в 0,01 М раствор соляной кислоты. К какому электроду при электрофорезе будет передвигаться белок? Рассчитать рН раствора
•к катоду, рН = 2
рН = 2, рН < pI, в виде катиона – идёт к катоду
К какому электроду при электрофорезе будет передвигаться белок миозин мышц (pI 5) в 0,005М растворе серной кислоты. Рассчитать рН раствора
•к катоду, рН = 2
pH =2, рН < pI, в виде катиона – идёт к катоду
К какому электроду при электрофорезе будет передвигаться белок с pI9,8 в аммонийном буферном растворе, содержащем 0,06 моль аммиака и 0,03 моль хлорида аммония? Кдисс. (NH3) = 1,810 -5. Рассчитать рН раствора
•к катоду, рН = 9.55
pH = 9.55, рН < pI, в виде катиона – идёт к катоду
Рассчитайте соотношение концентраций компонентов в бикарбонатном буферном растворе, в котором глобулин (pI 5,8) находится в изоэлектрическом состоянии. Кдисс. (H2СО3) = 8*10-7. Введите ответ с точностью до десятых.
•,5
Визоэлектрическом состоянии рН = pI = 5,8
Для бикарбонатного буфера рН = рК + lg([соль] / [кислота]) = -lg(8*10-7)+lg(x)= 5,8, отсюда х = 0,5
Рассчитайте соотношение концентраций компонентов цитратного буферного раствора, в котором концентрация цвиттер-иона пепсина желудочного сока максимальна. рI пепсина 2,08; рКлимоннойкислоты=3,1 Введите ответ с точностью до десятых.
•,1
Цвиттер-ион максимален при рН = pI = 2,08
рН = рК + lg([соль] / [кислота]) = 3,1 +lg(x)= 2,08, отсюда х = 0,1
Рассчитать концентрацию соляной кислоты в растворе, в котором глутамин (pI 3) электрофоретически неподвижен. Введите ответ с точностью до тысячных.
•,001
Электрофоретически неподвижен при рН = pI = 3
рН = -lgCM = 3, отсюда СМ = 0,001
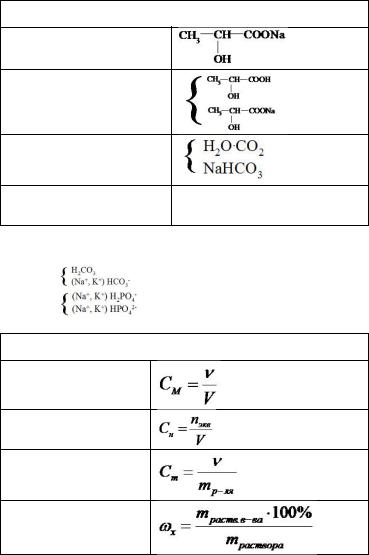
Формула |
отображает строение аминокислоты: |
•серин
Формула |
отображает строение аминокислоты: |
•аланин
Ккакому электроду при электрофорезе будет передвигаться белок каталаза крови (pI 7) в растворе аммиака, наполовину нейтрализованного соляной
кислотой? рКаммиака=4,75
рН = 9,25, рН > pI, в виде аниона – идёт к аноду
К аноду |
рН = 9.25 |
