

1,02г/мл. Определите точную концентрацию этого раствора по стандартному раствору Н2С2О4 и титр.
Методика приготовления раствора:
Сделайте расчеты по приготовлению раствора. Запишите порядок приготовления раствора. Проверьте правильность у преподавателя.
Приготовьте раствор.
Отберите из бюретки в колбу необходимое количество исходного раствора и прилейте необходимое количество воды или доведите объем до метки.
Раствор тщательно перемешайте и оставьте для определения точной концентрации раствора.
Определение концентрации раствора NaOH по стандартному
раствору Н2С2О4 .
-запишите уравнение реакции;
-укажите скачок титрования, Т.Э., индикатор. Дайте обоснование.
-в колбу для титрования прилейте из бюретки 5 мл 0,1N раствора Н2С2О4 ,
добавьте 1-2 капли фенолофталеина и титруйте раствором NaOH до бледно-
розовой окраски.
Титрование проводите до получения сходных результатов (отличия должны составлять 0,2мл ).
Данные запишите в таблицу и рассчитайте N и Т.
- где, с какой целью применяется этот метод в медицине? Укажите его
преимущества и недостатки перед другими методами.
|
|
|
|
|
Таблица 3. |
|
|
|
|
|
|
|
|
№ |
0,1N Н2С2О4, мл |
V (NaOH), |
Ind |
N |
Т(NaOH) |
|
|
|
мл. |
|
(NaOH) |
г/мл |
|
|
|
|
|
|
|
|
1 |
5 мл |
|
Феноло- |
|
|
|
|
|
|
фталеин |
|
|
|
|
|
|
|
|
|
|
2 |
5 мл |
|
|
|
|
|
|
|
|
|
|
|
|
3 |
5 мл |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
50 |
|
|
|
|
-Формулы для расчета и расчет.
-Вывод. - где, с какой целью, применяется этот метод в медицине?
Укажите его преимущества и недостатки перед другими методами.
7.Вопросы и упражнения для самостоятельной работы.
1.Растворы. Значение растворов в медицине.
2.Классификация растворов по степени дисперсности и агрегатному
состоянию.
3.Электролиты. Сильные и слабые электролиты. Примеры.
4.Константа и степень диссоциации. Их зависимость от различных
факторов.
5.Способы выражения концентрации растворов: массовая доля вещества в растворе, молярная концентрация, молярная концентрация эквивалента (или нормальная концентрация),
титр (.%, М,N, Т).
6.Расчет эквивалентных масс кислот, оснований и солей.
7.Закон эквивалентов и его следствия.
8.Способы приготовления растворов.
9.Понятия о первичных стандартных растворах. Требования предъявляемые к веществам, используемых для приготовления растворов методом точной навески.
10.Вторичные стандартные растворы. Методы определения их концентрации.
11.Понятие об объемном анализе. Что такое титрование, точка эквивалентности.
12.Классификация методов объемного анализа по типу химической
реакции..
13.Метод нейтрализации, его применение. Титрант (стандартный,
рабочий раствор), титруемый (исследуемый раствор).
14.Ионное произведение воды. Понятие о рН и рОН растворов.
15.Гидролиз солей. Случаи гидролиза и уравнения реакций.
51

16.Случаи титрования в методе нейтрализации. Точка эквивалентности, скачок титрования, Кривые титрования.
17.Методы фиксирования точки эквивалентности.
18.Теория индикаторов В. Оствальда. Одно-, двух и многоцветные индикаторы.
19.Принцип выбора индикаторов при кислотно-основном титровании.
Примеры задач для решения.
1.Как приготовить 500мл физиологического раствора хлорида натрия
смассовой доле 0,9%, если плотность раствора 1,05г/мл.?
2.Как приготовить 2 кг спирта с массовой долей 70%, если плотность чистого 96% спирта 0,8г/мл?
3. |
Как приготовить 50 мл 0,1N раствора CuSO4 из CuSO4 * 5H2О ? |
4.Как приготовить 200г 5% раствора глюкозы из 40% с  1,2г/мл.?
1,2г/мл.?
5.Как приготовить 500мл 0,2М раствора хлорида кальция из кристаллогидрата СаС12 *2 H2О ?
6.Как приготовить 100мл 0,1 Н раствора лидокаина из 0,5Н раствора лидокаина?
7.Сколько мл 0,2М раствора никотиновой кислоты необходимо взять для приготовления 50 мл 0,05М раствора никотиновой кислоты?
8.Ск грамм KAl(SO4) для при готовления 200 мл 0,1 Н раствора?
9.В 175мл воды растворили CuSO4 * 5H2О. Определите молярную концентрацию эквивалента (N) в полученном растворе.
10.Смешали 2л 0,5 н раствора и 0,5 л 2 н раствора. Пренебрегая изменением объѐма при смешивании, вычислить нормальность полученной смеси.
11.При обезвоживании организма внутривенно вводится 5% раствор глюкозы. Рассчитайте как приготовить 400 г 5 % раствора глюкозы из раствора
смассовой долей 15 % ?
52
12. Для обтирания и компрессов применяют этиловый спирт. Как приготовить 300 мл 40 % раствора спирта из 96 %? (ρ = 0,8 г/мл).
8.Тесты для самоконтроля
1.Выражение ω (СаС12)= 5% означает:
а) 5 г СаС12 растворено в 95 г Н2О,
б) 5 г СаС12 растворено в 100 г Н2О,
в) 5 г СаС12 растворено в 1000 г Н2О.
г) 5 г СаС12 растворено в 100 г раствора
2.Эквивалентная масса меди в соединении СuSO4 равна:
а) 80,0 г/моль, б) 31,75 г/моль, в) 79,5 г/моль, г) 16 г/моль.
3.Молярная концентрация показывает:
а) сколько г растворенного вещества содержится в 100 г воды;
б) сколько молей растворенного вещества содержится в 1 л раствора;
в) сколько моль-экв растворенного вещества содержится в 100 мл раствора;
г) сколько мл растворенного вещества содержится в 1000 мл раствора.
4.Эквивалент вещества - это:
а) количество вещества, которое которое способно соединится с 1 молем атомов водорода или заместить его в химической реакции.;
б) количество моль вещества, которое соединяется с 1 моль водорода;
в) масса вещества, которая соединяется с 1 моль атома водорода;
г) Количество моль вещества, которое замещает 1 моль атомарного водорода.
5. Эквивалентная масса фосфорной кислоты в реакции полной нейтрализации равна:
а) М(H3PO4); б) М (H3PO4)/2; в) М(H3PO4);/3; г) М(H3PO4)/6.
6.Нормальная концентрация – это:
а) nэ/Vр-ра; б) nэ/Vр-ля ; в) n/Vр-ра ; г) m/Vр-ра.
53

7.Нормальная концентрация – это количество моль эквивалентов вещества,
растворенного в:
а) 1 л раствора; б) 1 л растворителя; в) 100 г растворителя; г) 100 г раствора.
8.Титр показывает сколько:
а) г вещества содержится в 1000 мл раствора,
б) г вещества содержится в 1 мл раствора,
в) г вещества содержится в 100 г раствора.
г) г вещества содержится в 1000 мл воды
9.0,05г СаС12 растворено в 1 мл раствора. Это раствор соли с :
а) 0,05% концентрацией, б) 0,05н раствор, в) Т=0,05г/мл,
г) 0,05 молярной концентрацией
10. Раствор с точной концентрацией можно приготовить из:
а) Na2B4O7 ∙ 10 H2O; б) KOH; в) AlCl3 ; г) NaNO3.
11.Объем исходного и того же разбавленного раствора и их нормальные концентрации относятся:
а) N1V2= N2 V1; б) M1V1= M2 V2; в) V1 V2= N2 N1 ; г) N1V1 =N2 V2.
12.Приведите основную формулу для определения концентраций в объемном анализе.
а) С1V2= С2 V1, б) С1V1= С2 V2,
в) 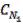 V2=
V2= 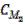 V1 г) m1V1 = m2 V2
V1 г) m1V1 = m2 V2
13. Закон эквивалентов имеет математическое выражение:
m1 Э1 а) m2 Э2
б) mв-ва*m р-ра*100%;
m1 Э2
в) m2 Э1 ;
г) m1*Э1 = m2*Э2.
54

14.Первое следствие закона эквивалентов имеет математическое выражение:
|
m1 |
|
Э1 |
|
m1 |
|
Э2 |
|
|
|
|
|
|
|
|
|
|
а) m2 |
|
Э2 ; б) V1N1=V2N2; в) m2 |
|
Э1 ; г) V1N2=V2N1. |
||||
15.Второе следствие закона эквивалентов имеет математическое выражение:
|
m1 |
|
Э1 |
|
m1 |
|
Э2 |
|
||
|
|
|
|
|
|
|
|
|
|
|
а) m2 |
|
Э2 ; |
б) V1N1=V2N2; в) m2 |
|
Э1 ; |
г) V1N2=V2N1. |
||||
16. Массовая доля показывает количество: |
|
|
|
|
||||||
а) моль-экв/л; б) г растворенного вещества на 100 г воды;
в) 1 моль вещества в 1 л раствора; г) г растворенного вещества в 100 г
раствора. |
|
|
17. Эквивалент Cu(NO3)2 равен: |
|
|
а) 188 г/моль; б) 171 г/моль; |
в) 94 г/моль; |
г) 114 г/моль. |
18. Массовая доля метилового спирта в растворе, содержащем 60 г спирта и 40
г воды равна:
а) 2, |
б) |
0,6, |
в) 1,5, |
г) 0,5. |
|
19.При полной нейтрализации Н3РО4 |
еѐ эквивалент равен: |
||||
а) 49 г/моль, |
б) 98 г/моль, |
в) 32,6 г/моль, г) 196 г/моль. |
|||
20.Методом точной навески можно приготовить раствор: |
|||||
а) Na2CO3, б) HCl, |
в) H2SO4, г) KOH. |
||||
21.Выражение 0,1N р-р КMnO4 означает: |
|||||
а) 0,1 моль-эквивалента КМnО4 |
растворено в 1 л раствора, |
||||
б) 0,1 моль КМnО4 растворено в 1 л раствора,
в) 0,1 моль-экв. растворено в 1 л растворителя,
г) 0,1 моль КМnО4 растворено в 1000 г воды.
22.Стандартный раствор – это раствор:
а) концентрация которого неизвестна ; б) концентрация которого известна,
в) раствор, который получился при титровании 2-х других растворов,
г) раствор при титровании которого выпадает осадок.
55
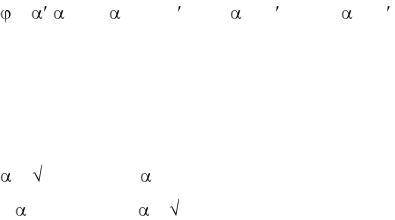
23.Степень диссоциации показывает: |
|
|
|
|||||||
а) число молекул электролита, распавшихся на ионы |
|
|||||||||
б) число моль электролита, распавшихся на ионы |
|
|
||||||||
в) концентрацию молекул электролита, оставшегося в растворе |
|
|||||||||
г) долю молекул электролита, распавшихся на ионы |
|
|||||||||
24.Степень диссоциации рассчитывается по формуле: |
|
|||||||||
|
а) |
= / |
; б) |
= N/ N ; |
в) |
= N /N; |
г) |
= N *N. |
|
|
25. |
Степень диссоциации слабого электролита при разбавлении: |
|
||||||||
|
а) уменьшается; б) увеличивается; |
в) |
не изменяется; |
г) вначале |
||||||
увеличивается, затем уменьшается. |
|
|
|
|||||||
26. |
Математическое выражение закона разбавления Оствальда: |
|
||||||||
|
а) |
= Кдис/с; |
б) |
= Кдис∙с; |
|
|
|
|
||
|
в) 1/ |
= Кдис∙с; |
г) |
= с/ Кдис . |
|
|
|
|||
27. |
Выражение ионного произведения воды, - это: |
|
||||||||
а) СН+ + СОН- = 10-14; б) СН+* СОН- = 10-7; |
|
|
|
|||||||
в) СН+/ СОН- = 10-14; |
г)СН+ * СОН- = 10-14; |
|
|
|
||||||
28. |
Водородный показатель (рН) – это: |
|
|
|
||||||
а) -ℓg C OH-; б) -ℓg CH+; в) ℓg CH+; г) ℓg CH0. |
|
|
|
|||||||
29. |
Если рН равно 9, то рОН равен: |
|
|
|
|
|||||
а) 9; |
б) 5; в) 4; |
г) 2. |
|
|
|
|
|
|||
30. |
Какие соединения подвергаются гидролизу: |
|
|
|||||||
а) Н2СО3 ; |
б) KOH в) Na2S |
г) |
CaCO3 |
NaNO3 |
|
|||||
31. |
В растворах каких солей рН = 7: |
|
|
|
||||||
a) CuSO4 |
б) K2S |
в) AlCl3 |
г) NaNO3 |
|
|
|
||||
32. |
При титровании раствора |
NH4OH |
раствором Н2SО4 |
рН в точке |
||||||
эквивалентности будет равен: |
|
|
|
|
|
|||||
а) 5; б) 7; в) 9; г) 10. |
|
|
|
|
|
|||||
33. |
При титровании раствора |
|
NаOH |
раствором Н2SО4 |
рН в точке |
|||||
эквивалентности будет равен: |
|
|
|
|
|
|||||
|
|
|
|
|
|
|
56 |
|
|
|
а) 5; б) 7; в) 9; г) 10.
34. Какие индикаторы можно применить при титровании NH4OH раствором Н2SО4 :
а) бромфеноловый красный ( ИПИ 6,8-8,4); б) бромтимоловый синий (ИПИ
5,2-6,8); в) тимоловый синий (ИПИ 1,2-2,8); фенолофталеин (ИПИ 8,3-10,5). 35. В каком из титрований точка эквивалентности находится в щелочной среде:
а) КОН+ НС1; б) NaOH + Н2SО4; в) СН3СООН + NaOH ; г) NH4OH + НС1 36. Индикатор метиловый красный слабая кислота, в интервале перехода окраски (рН3-4,6) окраска красно-желтая. Он будет находится в молекулярной форме ( красный) при рН:
а) 2; б) 4; в) 6; г) 9.
37.Индикатор ализариновый желтый - слабое основание, в интервале
перехода (ИПИ) |
11-13 рН окраска желто-сиреневая. Он будет иметь |
сиреневую окраску при рН: |
|
а) 9; б) 10; в) 12; |
г) 14. |
38. Кривой титрования в методе кислотно-основного титрования является зависимость:
а) рН от объема прилитого титранта; б) СН+ от концентрации титранта;
в) концентрации кислоты от концентрации основания;
г) рН от концентрации титранта.
39. При острых кишечных инфекциях в кровь вводят 0,89% раствор хлорида
натрия. Масса соли, введенная в организм при вливании 400 мл этого раствора
равна (ρ = 1 г/мл): |
|
а) 35,6 г б) 0,356 г в) 3,56 г |
г) 3,6 г |
40. При растворении 30 г гидроксида натрия в 100 г Н2О массовая доля его будет равна:
а) 0,23, б) 0,4, в) 0,17, г)0,01.
57
41. Адреналин обладает сосудосуживающим действием. Его терапевтическая
доза составляет 0,5 мл 0,1% раствора, ρ = 1,0 г/мл, масса адреналина,
содержащаяся в этом растворе равна:
а) 0,5 г б) 0,0005 г в) 0,005 г г) 0,1 г
42. При коньюктивитах в виде глазных капель применяют раствор сульфата цинка. Массы сульфата цинка и воды необходимые для приготовления 25 мл
0,25% раствора (ρ = 1,02 г/мл) равны: |
|
|
|
|
|
|
|
|
|||||
а) 6,372 и 19,128 |
|
б) 6,0 19 в) 6,25 и 18,75 |
г) 7 и |
|
|
|
|
||||||
|
|
|
|
Ответы к тестам |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
№теста |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
8 |
9 |
10 |
11 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ответ |
г |
а |
б |
А |
в |
а |
а |
|
в |
в |
а |
Г |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
№теста |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
|
19 |
20 |
21 |
22 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ответ |
б |
в |
б |
Б |
г |
в |
б |
|
в |
а |
а |
Б |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
№теста |
23 |
24 |
25 |
26 |
27 |
28 |
29 |
|
30 |
31 |
32 |
33 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ответ |
г |
в |
б |
А |
г |
б |
б |
|
в |
г |
а |
Б |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
№теста |
34 |
35 |
36 |
37 |
38 |
39 |
40 |
|
41 |
42 |
43 |
44 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ответ |
б |
в |
а |
Г |
а |
в |
а |
|
б |
а |
г |
В |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
58
ЗАКЛЮЧЕНИЕ
Необходимость изучения темы «Растворы» и «Кислотно-основное титрование» студентами медико-профилактического факультета не вызывает сомнений. В решении задач, стоящим перед медицинским образованием,
важная роль принадлежит курсу общей химии, который первым открывает химическое образование медиков.
Химические знания являются необходимым условием существования человека в окружающей среде, понимания сущности глобальных проблем современности. Изучение химии развивает различные навыки у студента,
необходимые для дальнейшего изучения дисциплин. Студент должен уметь следующее: пользоваться химическими формулами и при необходимости из одной вывести другую, что нужно для решения задач; готовить растворы различной концентрации; пользоваться химической посудой.
59
