
- •Глава1.Обзорлитературы 11
- •Глава2.Материалыиметодыисследования 36
- •Глава3.Результатысобственных исследований 55
- •Глава1.Обзорлитературы
- •РазвитиепредставленийодиагностикеГм
- •Гистологическоеисследование
- •КритериидиагностикиГм
- •Глава2.Материалыиметодыисследования
- •Общаяхарактеристикабольных
- •Проведениедиагностическойбиопсиикожи
- •Гистологическоеисследование
- •.Непрямойиммуногистохимическийметодисследования
- •2.4Статистическийанализ
- •Глава3.Результатысобственных исследований
- •Глава4.Заключение
Проведениедиагностическойбиопсиикожи
Объектамиисследованиябылипораженныеучасткикожи21больногоГМи21больногоБП,участкикожи16здоровыхлиц(полученныепослепластическихопераций),взятыеметодомпанч-биопсии.Дляпроведенияпанч-биопсииприменялиодноразовыйстерильныйтрубчатыйнождиаметром6мм(«Bloodline»,Италия)(Рисунок2.3,2.4).Использовалиинфильтрационнуюанестезию2%растворомлидокаина.

Рисунок2.3–Проведениепанч-биопсиитрубчатымножом

Рисунок2.4–Выделениеучасткакоживрезультатепроведенияпанч-биопсии
Гистологическоеисследование
Кусочкидлягистологическойобработкивырезалитак,чтобывмикроскопическомсрезесохранялисьтопографическиесоотношения,характерныедляисследуемогоматериала.Блокидляпроводкивырезалипослефиксации.
Биоптаткожипомещаливемкостьсфиксатором,объемфиксирующейжидкостипревышалв10–20разобъемфиксируемогообъекта.Еслиобъектбылразрезаннафрагментытолщинойболее5–6мм,егооставляливфиксаторена2–3часадляуплотнения,послечеготканьрассекалинапластинытолщиной2–3ммипомещаливсвежийрастворфиксатора.Общеевремяфиксацииприкомнатнойтемпературе(около20°С)составлялоот18до24часов.Вповседневнойработевкачествефиксирующейжидкостииспользовали10%растворформалинаилицинк-формалин,которыйобеспечиваетсохранениеантигенныхдетерминантдляпроведенияиммуногистохимическихисследований.
Обезвоживаниеипропитываниепарафиномбиоптатовкожипроводиливручнуюповосходящимспиртам(70%,80%,90%и100%)ваппаратегистологическойпроводкитканей«LeicaPeloris»(«LeicaMicrosystems»,Германия),заливаливпарафин.
Срезыприготовлялитолщиной3–4мкм.ИспользовалсямикротомротационныйAccu-Cut®SRM™200.Скаждогопарафиновогоблокаделали3–4препаратадлягистологическихокрасок,накаждомпрепаратеразмещали1–2среза.Однучастьпрепаратовокрашивалигематоксилином-эозином,сдругойчастьюматериалапроводилииммуногистохимическоеисследование.
Препараты,окрашенныегематоксилином-эозином,подвергалисьмикроскопическомуисследованию.Использовалсясветовоймикроскоп«OlympusBX-51»(Япония),оборудованныйцифровойкамерой«OlympusXС-10»ипрограммнымобеспечением«CellА»(Рисунок2.5).Исследованиеэпидермисаи
дермыпроводилосьнаувеличении×100,×200и×400.Вгистологическихпрепаратахопределялипатоморфологическиеизменениявэпидермисеидерме.

Рисунок 2.5 – Оборудование, используемое для приготовления иисследованиягистологическогопрепарата
.Непрямойиммуногистохимическийметодисследования
Начальнымэтапомнепрямогоиммуногистохимическогоисследованиябылаподготовкасрезов.Дляэтогоихнаклеивалинастекла,обработанныеполилизином,распарафинивали,блокировалиэндогеннуюпероксидазурастворомперекисиводородавметанолеивыполнялидемаскировкуантигеновпутемнагреваниявтрис-ЭДТАилицитратномбуферевтечение30минпритемпературе95°Снаводянойбане(рисунок2.6).
Дляиммуногистохимическойдетекциисубпопуляцийлимфоцитов,дендритныхклетокипролиферативнойактивностиклетокиспользовалипервичныемышиныеикроличьимоноклональныеантичеловеческиеантитела(Таблица2.2).Времяинкубацииспервичнымиантителамисоставляло18-20часовприt°=+40°C.

Рисунок2.6–Схемапроведениянепрямойиммуногистохимическойреакции
Таблица2.2–Первичныеантичеловеческиеантитела
Антиген |
Антитело(клон) |
Разведениеантител |
Способ демаскировкиантигена |
Производительантител |
CD3ε |
F7.2.38 |
1:600 |
трис-эдтабуфер,PH9,0 |
ThermoFisher Scientific,США |
CD83 |
NCL-CD83 |
1:70 |
трис-эдтабуфер,PH9,0 |
Novocastra, Великобритания |
Langerin(CD207) |
NCL- Langerin |
1:50 |
трис-эдтабуфер,PH9,0 |
Novocastra, Великобритания |
Ki67 |
SP6 |
1:600 |
трис-эдтабуфер,PH9,0 |
ThermoFisher Scientific,США |
ДлядетекцииклетокиспользовалиполимернуюсистемувизуализацииEnvision(Dako,Дания),гдевкачествехромогенаприменялидиаминобензидин(ДАБ)(Dako,Швеция),идвойнуюсистемувизуализацииMultivisionPolymer(ThermoFisherScientific,США).Инкубациюпроводилиссистемойвизуализации
–30мин.притемпературе+20°С.дляпроявлениярезультатареакцииДАБнаносилинасрезына5мин.
Двойнаясистемадетекции«MultivisionPolymerDetectionSystem:Multivisionanti-rabbit/HRP+anti-mouse/APpolymers»–набордляиммуногистохимическоговыявления(окрашивания)двухантигеновводномсрезе(гистологическомпрепарате).Онасостоитизсмесиантивидовыхантикроличьихантител,конъюгированныхспероксидазойхренаиантивидовыхантимышиныхантител,конъюгированныхсощелочнойфосфатазойидвухразныххромогенов(дополнительныереагенты).Пероксидазахренаприрасщеплениисвоегохромогенадаеткрасноеокрашивание,щелочнаяфосфатаза–синее.Даннаясистемапозволяетпроанализироватьвзаимноерасположениедвухразныхантигеновводномпрепарате,приусловии,чтохозяевапервичныхспецифическихантителкэтимантигенамразные–кроликимышь.
Выполнялосьопределениеколичестваокрашенныхцветовойметкой(позитивных)клетокпри200–кратномувеличениисветовогомикроскопавтрехполяхзрения(размерами720×530мкм),выбранныхсучетомнаибольшегоколичествамеченыхклеток,используякомпьютернуюпрограммуанализаизображения«UTHSCSAImageTool3.0»(Рисунок2.7)ипрограммноеобеспечение«Морфология5.2»(ВидеоТесТ,Россия)(Рисунок2.8,рисунок2.9,рисунок2.10).Полученныеданныезаносиливбазуданныхввидесреднегочислапозитивныхклетокнаизучаемойплощадисреза(0,38мм2),посчитанныхдлякаждогобиоптата.
Определялиотносительнуюплощадьэкспрессии,которуюрассчитываликакотношениеплощади,занимаемойиммунопозитивнымиклеткамикобщейплощадиклетоквполезрения,ивыражаливпроцентах.
ИндекспролиферативнойактивностиопределяликакотношениеколичестваKi-67-позитивныхклетоккобщемуколичествуядерныхклетоквполезрения,выраженноевпроцентах.
Коэффициентэпидермо-дермальногоотношенияопределяликакотношениеплощади, занимаемоевыявляемыммаркеромвэпидермисекплощадивдерме.
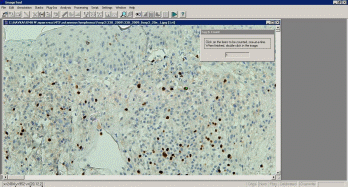
Рисунок2.7–Интерфейспрограммыанализаизображения«ImageTool3.0»

Рисунок2.8–Интерфейспрограммногообеспечения«Морфология5.2».
Детекцияопределяемыхклеток
 а б
а б
в г
Рисунок2.9Иммуногистохимическоеисследованиекожибольныхгрибовидныммикозом:а,в–домодификациипрограммой«Морфология»;б,г–модификацияизображенияпрограммой«Морфология».анти-CD3–желтоеокрашивание,анти-Ki-67–красноеокрашивание.а,б–увеличение×200;в,г–увеличение×400
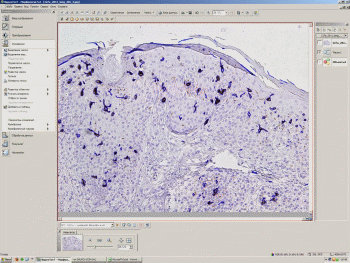
Рисунок2.10–Интерфейспрограммногообеспечения«Морфология5.2».Определениеплощади, занимаемойиммунопозитивнымиклетками
