

ные сложности в получении разрешения на этот вид лечения у каждого больного; низкая иммуногенность опухоли и/или преимущественное выделение из нее неили малоиммуногенных клонов в процессе подготовки вакцины.
При использовании вакцин из аллогенных клеток отпадают вышеперечисленные недостатки аутологичных вакцин; появляется возможность получения более широкого спектра опухолеассоциированных антигенов из нескольких линий; появляется возможность трансфекции в клетки особых генов, повышающих иммуногенность вакцины. Главный недостаток вак- цин-возможное несоответствие по антигенному спектру опухоли больного.
Рекомбинантные вакцины получаются путем биотехнологического синтеза in vitro опухолевыми или бактериальными клетками (E. Coli) опухолевых антигенов в чистом виде. Они могут обеспечить выраженный иммунный ответ, т.к. можно получить их в большом количестве. Кроме того, препараты таких вакцин можно унифицировать, что значительно упрощает административно-правовые проблемы их использования в клинике. Главный недостаток рекомбинантных синтетических вакцин - высокая степень вероятности ускользания клеток опухоли больного от индуцированного иммунного ответа. Антигенный спектр таких вакцин узок, а опухоли по своему антигенному составу гетерогенны и изменчивы в процессе роста и лечения.
Подводя итоги многочисленных испытаний разнообразных вакцин в различных лабораториях мира, можно отметить слабую их эффективность у большого числа исследуемых пациентов и на этом фоне выраженный эффект у отдельных больных, вплоть до полного регресса опухоли.
Основными препятствиями для активной иммунотерапии являются:
недостаточная иммуногенность опухолевых антигенов;
способность опухоли вызывать анергию эффектных клеток путем выде-
ления ИЛ-10, TGF- ;
гетерогенность первичного узла по клоновому составу;
клональные различия первичной опухоли и метастазов.
Для повышения эффективности вакцинотерапии необходимо:
максимальное уменьшение объема опухолевой массы в организме (циторедуктивные операции);
достаточная иммунокомпетентность организма больного;
отсутствие внешних иммуносупрессивных воздействий;
одновременная активная неспецифическая иммунотерапия (БЦЖ, ИЛ-2, КСФ).
79

Будущее вакцинотерапии в онкологии никогда не представлялось таким радушным, как сейчас, т.к. вакцины практически нетоксичны, могут предупреждать возникновение рецидивов после хирургического лечения и теоретически способны предупреждать возникновение других опухолей, несущих аналогичные антигены.
В качестве примера можно привести результаты рандомизированного исследования по оценке эффективности адьювантной вакцинотерапии больных раком ободочной кишки стадий В и С по Дюку. После операции 254 больных были разделены на 2 группы: вакцинотерапия и контроль. Вакцину приготавливали из клеток аутологичной опухоли и вводили внутрикожно 4 раза по схеме:
1 (30 день) 107 облученных клеток БЦЖ
2 (37 день) то же 3 (44 день) 107 облученных клеток без БЦЖ 4 (180 день) то же
Вконтрольной группе число больных с рецидивом достигало 28%,
ав опытной 16%. В контрольной группе умерло от рака 25%, а в опытной - 17%. Результаты адьювантной вакцинотерапии в стадии В были лучше, чем в стадии С. Наиболее частыми побочными реакциями были: местное изъязвление (98%), региональный лимфаденит (67%), лихорадка в первые
24 часа (40%).
Принципиально новый подход к вакцинотерапии рака представляет собой использование т.н. анти-идиотипических антител. Сначала путем иммунизации животных опухолевыми клетками или выделенным опухолеассоциированным антигеном получают полиили моноклональные антитела к интересующему антигену. Эти антитела называют первыми. Потом ими иммунизируют животных и получают анти-антитела, которые называют вторыми. Вторые, анти-идиотипические антитела несут в себе внутренний иммунологический образ опухолевого антигена. Если вторыми антителами иммунизировать животное или человека, то развивается иммунный ответ на опухолевый антиген. Как правило он сопровождается и противоопухолевым эффектом. В настояшее время в мире идет работа по созданию такого типа вакцин для лечения колоректального рака, меланомы, рака молочной железы.
Сейчас ни у кого нет сомнений в том, что несмотря на технологические и организационные трудности “второе рождение” вакцинотерапии, которое наблюдается в последние годы, приведет к ее внедрению в практику лечения злокачественных опухолей в ближайшее время.
80
Генотерапия
Генотерапия - наиболее бурно развивающееся и перспективное направление биотерапии. Достаточно сказать, что на 1 июня 1999 г. в мире было зарегистрировано уже 380 протоколов генотерапии и 3173 пациента имели в своем теле генетически модифицированные клетки. Из них в онкологии применялось 240 протоколов(63%), по которым были пролечены 2166 человек (68% от общего числа).
Под генотерапией понимается лечебный метод, основанный на переносе функционирующего генетического материала в клетки больного с целью коррекции генетических ошибок или придания новых генетических особенностей этим клеткам. Лечебный эффект генных терапевтических средств достигается в результате:
корректировки или замены дефектного гена;
экстрахромосомной экспрессии введенного терапевтического гена;
подавления функции “больного” либо сверхактивного гена (антисэнстерапия).
Основываясь на типе клеток-мишеней, генотерапию можно раз-
делить на соматическую и фетальную.
Имея в виду тактику введения генетических конструкций, можно выделить генотерапию:
системную (в/в, в/м);
локальную (сосуды, органы, опухоли).
Почти все существующие протоколы в той или иной мере основаны на локальном введении генетических конструкций.
Исходя из способов доставки терапевтического гена, выделяют протоколы, использующие:
вирусные векторы;
невирусные векторы и методы (микроинъекции в клетки, электропортация).
Основными направлениями генотерапии в онкологии являются:
модификация генетического аппарата опухолевых клеток с целью повышения их иммуногенности;
модификация иммунных эффекторных клеток с целью повышения их способности к распознаванию и лизису опухолевых клеток;
81
модификация генетического аппарата опухолевых клеток с целью повышения их чувствительности к цитостатикам;
модификация генетического аппарата здоровых клеток с целью повы-
шения их резистентности к цитостатикам; Первые два направления относятся собственно к активной иммуно-
терапии. Вторые два представляют собой т.н. комбинированную химио/генотерапию.
Первые испытания генно-инженерных методов повышения иммуногенности неоплазм завершились с успехом. Так, в одном из экспериментов в опухолевые клетки трансфецировали гены главного комплекса гистосовместимости человека (HLA B7, в частности). Эти гены кодируют белки, которые представляют аутоантигены, в т.ч. опухолевые, для распознавания иммунными клетками. После трансфекции злокачественные клетки начинают активнее продуцировать опухолеспецифические антигены, что активирует противоопухолевый иммунитет. Существенно, что защитная реакция организма осуществлялась не только против модифицированных, но и против исходных клеток новообразования.
Целью иммунотерапии является не только стимуляция противоопухолевого ответа, который может быть адекватным антигенности опухоли, но и реверсия индуцированной этой же опухолью иммуносупрессиии. Хорошо известно, что лимфоцитам для уничтожения опухолевых клеток необходим ИЛ-2 для увеличения киллерного потенциала лимфоцитов. Локальная гиперпродукция злокачественными тканями интерлейкинов “привлекает” в очаг новообразования лимфоциты, в т.ч. цитотоксические. Под действием интерлейкинов усиливается их функциональный потенциал, и противоопухолевый иммунный ответ становится эффективным. Т.о. трансфицированные злокачественные клетки индуцируют локальную реакцию, направленную на собственное уничтожение. При подобном подходе нет необходимости в генетической модификации всей опухоли: небольшая группа неопластических клеток, экспрессирующих интерлейкин, может привлекать лимфокиллеры к опухоли в целом. Первые результаты с трансфекцией генов цитокинов представляются многообещающими.
Принципиально новый двухэтапный подход к лечению опухолей, связанный с локальной метаболической активацией химио-препаратов по-
лучил название GDEPT (gene directed еnzyme prodrug therapy). Его целью
82
является повышение чувствительности опухолевых клеток к химиотерапевтическим средствам. Известно, что такие алкилирующие цитостатики, как циклофосфамид и его изомер ифосфамид фармакологически инертны и нетоксичны для клеток. Их активация в клетках происходит под действием ферментов семейства цитохромов Р450. В результате образуются цитотоксические метаболиты: 4-гидрокси-ЦФА и горчичный фосфорамид. Но очень часто активность этих ферментов в опухоли ниже, чем в исходной нормальной ткани. Поэтому системное применение цитостатиков сопровождается и значительной системной токсичностью. Метод GDEPT заключается в локальном введении генетических конструкций цитохромов Р450 в опухоль с последующим применением алкилирующих препаратов. И хотя эти разработки носят пока только экспериментальный характер, чрезвычайная их перспективность для химиотерапии опухолей очевидна.
Пассивная иммунотерапия
Идея использования антител с терапевтической целью при раке предложена еще Паулем Эрлихом. Однако действительно пассивная иммунотерапия стала реальностью только в конце 70-х годов после внедрения гибридомной технологии получения моноклональных антител, высоко специфичных к опухолевым антигенам.
Наиболее важные механизмы противоопухолевого действия мАТ:
комплемент-зависимая цитотоксичность;
антитело-зависимая клеточная цитотоксичность.
Своими гипервариабельными участками (Fab-фрагменты) мАТ присоединяются к антигенам на поверхности клеток, а константным участком (Fс-фрагмент) мАТ фиксируют комплемент или цитотоксическую клетку, которые собственно и разрушают клетки-мишени.
Несмотря на простоту концепции использования мАТ в онкологии, проблема еще далека от полного разрешения по следующим причинам:
мАТ биохимически и биологически нестабильны, что требует особых условий их хранения и транспортировки;
мАТ плохо проникают из кровяного русла;
мАТ, будучи как правило мышиными, являются иммуногенными для человека и индуцируют образование анти-мышиных инактивирующих анти-антител:
83
узкая специфичность мАТ и антигенная гетерогенность и изменчивость опухоли и метастазов.
Внастоящее время предпринимаются большие усилия с целью повышения эффективности терапии мАТ.
Наиболее перспективным считается получение биспецифичных антител, которые одним гипервариабельным участком связываются с опухолевой клеткой, а другим - с рецептором Т-киллера, что обеспечивает их тесный контакт.
Для снижения иммуногенности мАТ с помощью сложнейших методов генной инженерии получают химерные и гиперхимерные мАТ. Они содержат мышиный гипервариабельный участок и человеческий невариабельный участок. Гиперхимерные, “гуманизироанные” мАТ содержат всего 10% мышиного белка и 90% - человеческого. В результате частота образования нейтрализующих анти-антител у человека снижается с 74% до
4%.
Для повышения экстравазальной диффузии применяют усеченые мАТ, без Fс-фрагмента или отдельные Fab-фрагменты. В последнем случае мАТ лишаются своих натуральных свойств фиксировать комплемент и иммунокомплементные клетки. К ним присоединяют цитостатические препараты, токсины или радионуклиды. Т.о. мАТ выполняют роль проводников, обеспечивающих более специфическую, адресную доставку противоопухолевых средств точно по назначению.
Внастоящее время предклинические и клинические испытания проходит большая группа мАТ в разных странах. В Германии зарегистрирован и разрешен к клиническом применению панорекс - мышиное мАТ против поверхностного антигена 17-1А, экспрессируемого опухолями ободочной кишки. Применение панорекса по результатам 7-летнего наблюдения показало снижение числа умерших на 32%, числа рецидивов - на 23% и числа отдаленных метастазов - на 23%. В настоящее время проводится крупномасштабное клиническое исследование (более 3000 больных), в котором сравнивается панорекс и панорекс + стандартная химиотерапия (5-ФУ + лейковарин). Этот пример показывает, что пассивная иммунотерапия не рассматривается как альтернатива химиотерапии. Наоборот, несопостивимо малая токсичность мАТ является хорошей предпосылкой для рационального их сочетания с известными цитостатиками, значи-
84
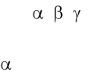
тельно расширяет возможности современного лекарственного лечения и делает его более эффективным.
Цитокинотерапия
Использование цитокинов несет в себе черты как активной. так и пассивной иммунотерапии. Перспективы их практического применения появились с получением рекомбинантных форм цитокинов в достаточных количествах. Наиболее значительным являются интерфероны , , , ИЛ-2, КСФ. В последнее время активно изучаются ФНО, ИЛ-1, ИЛ-12. В клинической практике в основном используются интерферон . Интерфероны обладают иммуномодулирующей активностью, оказывают антипролиферативное действие, ингибируют ангиогенез в опухоли, способствуют дифференцировке опухоли, усиливают экспрессию различных поверхностных антигенов. Препараты этой группы давно используются для лечения меланомы, рака почки, толстой кишки, саркомы Капоши, волосатоклеточного лейкоза. Эффективность интерферонов при солидных опухолях колеблется от 5 до 30%.
ИЛ-2 продуцируется активированными Т-лимфоцитами и играет центральную роль в иммунорегуляции, в первую очередь стимулируя рост Т-лимфоцитов. В результате применения ИЛ-2 наблюдается лимфоидная пролиферация и реверсия иммунодефицитных состояний. ИЛ-2 активно применяется за рубежом при меланоме, раке почки и толстой кишки. У 10% больных с его помощью удается добиться полного исчезновения признаков заболевания, а у 15% - частичного регресса.
Кроме того, ИЛ-2 является компонентом т.н. адоптивной терапии. Этот вид лечения предполагает введение больному клеток с противоопухолевой активностью - лимфокинактивированных киллеров (ЛАК). Лимфоциты выделяют из крови или опухоли, активируют их деление in vitro и вводят опять больному в сочетании с ИЛ-2. В 10% удается получить полный и у 20% - частичный лечебный эффект при меланоме и раке почки. К сожалению, это лечение высокотоксично.
Таким образом, даже такое краткое описание достижений биотерапии позволяет считать ее очень перспективным методом лечения онкологических заболеваний.
85
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА:
1.Александров В.А. Итоги и перспективы исследований по химиопрофилактике рака // Вопр. онкол., 1997, №1, с. 124-129
2.Александров В.А. и др. Принципы и перспективы химиопрофилактики рака // Вопр. онкол., 1991, №4, с. 387-393
3.Белохвостов А.С. и др. Роль молекулярногенетических исследований в диагностике солидных опухолей // Вопр. онкол., 1999, №6, с.
599-606
4.Глушков А.Н. Антитела в канцерогенезе - Кемерово, Кузбасвузиздат, 2000, 164 с.
5.Жданов Р.И. Генная терапия: надежды и реалии // Вопр. биолог., мед. фарм. химии, 1999, №4, с. 3-6
6.Зорин Н.А. и др. Возможная роль семейства макроглобулинов при раке // Вопр. онкол., 1994, № 1-3, с. 18-24
7.Ковалев В.И и др. Поток чужеродных веществ: влияние на человечество // Природа, 1980, с. 90-101
8.Козлов В.А. и др. Активность цитохромР450 -зависимых монооксигеназ и функции иммунокомпетентных клеток // Вестн. АМН СССР, 1991, №12, с 8-12
9.Кушлинский Н.Е. Возможности, неудачи и перспективы исследования опухолевых маркеров в современной онкологической клинике // Клин. лаб. диагностика, 1999, №3 с. 25-32
10.Магарилл Ю.А. и др. Социально-экономические аспекты заболеваемости злокачественными новообразованиями в Кузбассе / Иммунохимия канцерогенеза: доклады семинара, Кемерово, 21 ноября 2000 г. // Под ред. А.Н. Глушкова. - Кемерово, 2001, с. 7-11
11.Малахов С.М. и др. Оценка существующего положения охраны окружающей Среды в Кемеровской области, прогноз экологической ситуации, пути ее улучшения // Экология и экономика: региональные проблемы перехода к устойчивому развитию. Взгляд в ХХI век. Всероссийская научно-практ. конф., т 1, с. 142-145
12.Моисеенко В.М. Применение моноклональных антител для лечения злокачественных солидных опухолей // Вопр. онкол., 1999, №4, с.
458-462
13.Моисеенко В.М. и др. / Биотерапия при злокачественных новообразованиях // Рос. онкол. ж., 1997, №5, с. 57-59
14.Моисеенко В.М. и др. Вакцинотерапия злокачественных опухолей // Вопр. онкол., 1999, №3, с. 327-332
86
15.Пирузян Л.А. и др. Химические аспекты деятельности человечества и охрана природы // Природа, 1980, №3, с. 2-12
16.Соколов Н.Н. Комбинированная химиотерапия/генотерапия опухолей на основе активации противоопухолевых препаратов генетическими конструкциями цитохромов семейства Р450 // Вопр. мед. химии, 1999, №6, с. 462-471
17.Худолей В.В. Химические канцерогены // НИИ химии С.-П. гос. унив., С.-П., 1999, 419 с.
18.Худолей В.В. и др. Пути развития и перспективы экологической онкологии // Вопр. онкол., 1997, №1, с. 116-119
19.Худолей В.В. и др. Теоретические основы направленного поиска ингибиторов химического канцерогенеза // Вопр. онкол., 1996, №5, с. 113-117
20.Янковский Н.К. и др. Машина об одном колесе // Природа, 2000, №8, с. 9-15
87

Отпечатано редакционно-издательским отделом Кемеровской государственной медицинской академии
650029, Кемерово, |
Подписано в печать 14.03.2002. |
ул. Ворошилова, 22а. |
Формат 30 211/2. Бумага офсетная. |
Тел./факс. +7(3842)734856; |
Гарнитура таймс. Ризография. |
epd@ksma.kuzstu.ac.ru |
Усл. печ. л. 4,9. Тираж 100 экз. |
Технические редакторы: С. В. Черно, О. В. Богданова Лицензия ЛР №21244 от 22.09.97
88
