
3 курс / Общая хирургия и оперативная хирургия / Сосудистая_хирургия_по_Хаймовичу_Том_1_Ашер_А_,_Покровский_А_В_
.pdf
Глава 6
Компьютерная томография при сосудистых заболеваниях
Фредерик Л. Хофф, Киль Мюллер, Уильям Пирс
Значительное развитие компьютерной томографии (КТ) как технологии визуализации позволяет выявлять патологию многих сосудистых заболеваний. До 1980 г. диагноз большинства сосудистых заболеваний основывался в первую очередь на контрастной ангиографии или венографии в комбинации с ультразвуком. Контрастная ангиография или венография представляют детальную информацию для планирования хирургических вмешательств, неинвазивные тесты ценны для определения физиологической важности анатомических поражений. Ультразвуковая визуализация отображает как анатомические, так и гемодинамические детали, но ее использование ограничено поверхностными структурами. В брюшной полости газ кишечника и полых органов препятствует визуализации с помощью ультразвука. Использование ультразвука для обследования грудной клетки ограничено внутрисердечной патологией и грудной аорты. После появления в 1960-х годах и значительного усовершенствования, особенно за последние три десятилетия, КТ стало приемлемым методом в дооперационном и послеоперационном исследовании многих сосудистых заболеваний.
Практическая медицина видоизменилась с использованием КТ. Получив признание в 1979 г., Cormack и Hоunsfield были удостоены Нобелевской премии за развитие этой техники [1]. Главным достижением в развитии КТ стало то, что большинство данных было получено не с повышением разрешения, а с учетом различного контрастирования мягкотканых структур. Развитие КТ основывалось на последних достижениях во многих областях науки, включающих математику, компьютерные технологии и физику.
Первая клиническая КТ-установка была смонтирована в Atkinson Mortey’s госпитале в Англии 1 октября 1971 г. [1]. Для получения одного изображения требовалось 4 мин, и 2 дня уходило на реконструкцию всей серии изображений. Клиническая важность КТ была незамедлительно признана. К 1976 г. насчитывалось 22 компании, выпускающих КТ-сканеры, и уже в 1976 г. появилось около 1000 ус-
тановок, использовавшихся по всему миру. Процедуру называли «компьютерно-сопровождающаяся томография» или «КАТ-скани- рование», однако изображение не ограничивалось анатомическим аксиальным планом, оно укорачивалось КТ [2]. Способ получения КТ-изображения имел существенное продолжение и развитие, как в пространственном, так и во временном аспекте, зависящем от сроков, необходимых для исследования твердых и мягкотканых структур.
Для КТ характерна существенная точность в диагностике и лечении сосудистых поражений. До ее применения только контрастная ангиография и венография были методами оценки артериальной и венозной патологии и заболеваний. КТ не только предоставляла больше информации о сосудах (в т. ч. тромбозах) с помощью внутрисосудистой техники, но и давала оценку состояния прилежащих органов и тканей.
Хотя минуло 30 лет и, в общем, считалось, что техника КТ доведена до совершенства, метод продолжает развиваться. В начале 1990-х годов КТ стала спиральной, что важно для сосудистого использования. Получение частично перекрестного изображения, достаточного для захвата сосудов контрастом, стало возможным с введением трехмерной технологии и КТ-ангиографии. Позднее, в 1990-х годах, получило развитие использование мультидетекторных установок, которые ушли далеко вперед спиральных КТ. Эта глава отражает как основные принципы КТ, так и аспекты ее клинического применения.
Основные принципы
Фундаментальной концепцией КТ является использование множества проекций объекта с последующей реконструкцией его внутренней структуры [3, 4]. Создание КТ-изображения мож-
96 Раздел I. Техника визуализации
но описать тремя позициями: 1) получение данных при возможной экспозиции для облучения и сканирования пациента; 2) реконструкция изображения; 3) просмотр изображения.
Получение и сбор данных детектором
Генератор Х-лучей
Трубка Х-лучей и коллиматор
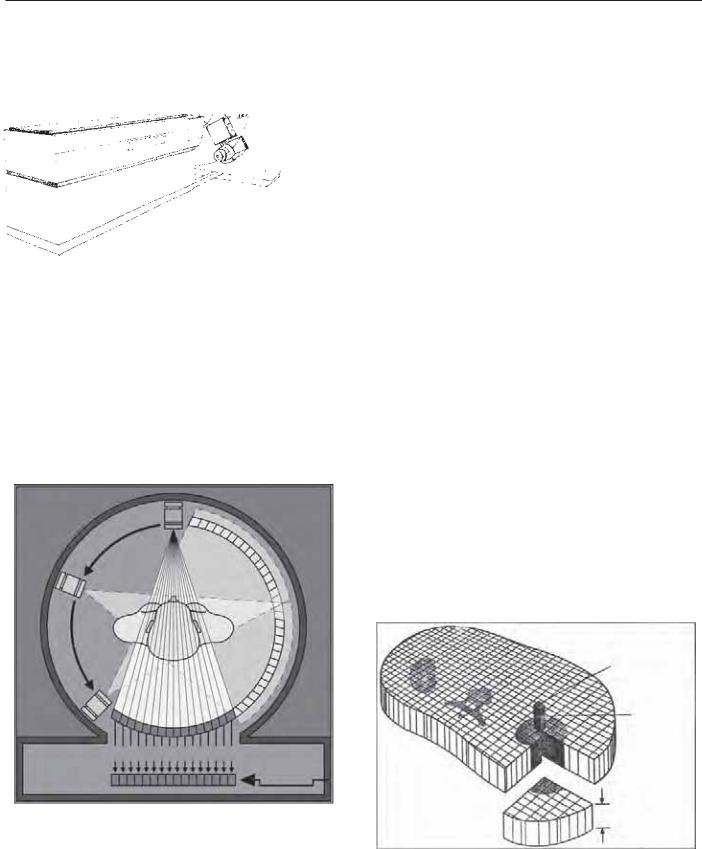
Рис. 6.1. Диаграмма, демонстрирующая радиографическую рентгеновскую трубку и детектор, установленный на специальной подвешенной платформе. Пациент размещается на столе и подвергается воздействию этой установки.
|
н |
а |
|
к |
|
С |
|
н а к
С
Проникновение данных |
Память |
|
|
|
компьютера |
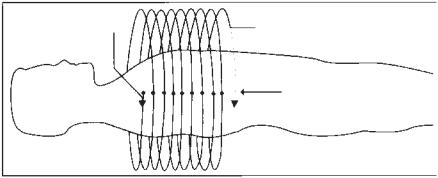
Рис. 6.2. Диаграмма, иллюстрирующая три простых позиции для проведения исследования с получением простого изображения. Данные собираются приблизительно из 1000 позиций во время каждого вращения. В каждой позиции данные получены от соответствующего детектора в определенном порядке, примерные изображения воспроизводят 16 детекторов, более точно используются в пределах между 500 и 1000 позициями. Данные об измеренных формах на выходе используют для реконструкции внутренней структуры сканированных объектов.
ПОЛУЧЕНИЕ ДАННЫХ
Радиографическая трубка и расположение детекторов связаны с электроникой, монтируемой в единую конструкцию, называемую «порталом» (рис. 6.1). Рентгеновская трубка испускает сконцентрированный поток Х-лучей, проходящих через тело пациента, адсорбирующихся или рассеивающихся; часть Х-лучей воспринимается детекторами. Во время получения данных трубка и детекторы вращаются вокруг пациента, и детекторы продолжают измерение определенного количества лучей, проходящих через тело пациента. Определенное количество лучей проходит к каждому детектору и порталу во время исследования под углом (рис. 6.2). Обычно матрица детекторов содержит 50–1000 детекторов, каждый из которых используется приблизительно 1000 раз за вращение [4]. Каждая линия отражает информацию, суммирующуюся с соответствующим коэффициентом для всех структур в этой части Х-лучей. Полученные данные оформляются как «необработанные данные», которые впоследствии подвергаются реконструкции.
Обычные или увеличенные сканы получаются путем обработки серии индивидуальных изображений во время приостановленного дыхания. После каждого вдоха пациента стол движется, и в большинстве установок аппаратные трубки и детекторы начинают другой скан [5]. Большинство сканов делают один 360°-ный оборот за секунду.
РЕКОНСТРУКЦИЯ ИЗОБРАЖЕНИЯ
Из собранных необработанных данных создается цифровое изображение. Его получают с помощью различных математических технологий, использующих принципы обратной проекции, повторяющиеся или аналитические формулы, как с трансформацией Fourier так и без нее [6]. В сосудистой патологии применяются результаты матричных рядов, особенно 512 к 512 матрице. Каждый номер в этой матрице называется пикселем, и каждый пиксель соотносится с объемом пикселей или вокселем пациента (рис. 6.3.). Средняя плотность тканей без каждого вокселя отража-
Пиксель
Воксель
Ширина участка
Рис. 6.3. Диаграмма иллюстрирует концепцию пикселей и вокселей. Средняя плотность тканей в каждом объеме элемента или вокселей у пациентов представлена в компьютере как пиксель или нарисованный элемент. Размеры вокселя эквивалентны FOV/матрице в Х- или Н-плоскостях и как часть ширины в Z-плоскости.
Глава 6. Компьютерная томография при сосудистых заболеваниях |
97 |
|
|
ется на объеме пикселей. Измерение вокселей в сканируемых проекциях находится в поле изображения (FOV) и матрицы; измерение пикселей на этой вершине может быть подсчитано разделением (FOV) на матричный размер. Трехмерное измерение, представляющее глубину вокселей, является плотностью изображения, предопределяемой коллиминированием ширины веерных лучей. Различие в затухании содержимого вокселей относительно к воде определяется КТ как затухающий ряд и выражается в единицах Hounsfild (HU) [7]. Двенадцатибитная шкала (212) используется при определении воды как ноль и воздуха как –1000; соответственно каждый пиксель находится в ряду от –1000 до +3095.
ПОЛУЧАЕМОЕ ИЗОБРАЖЕНИЕ
Для дальнейшей интерпретации цифровое изображение или матричные ряды конвертируются в визуализируемый формат. Серая шкала используется для плотных материалов, таких как кость (большие значения единиц плотности Hounsfield), предопределяя светлые оттенки по сравнению с материалами такой плотности как воздух (большинство негативных HU), ассоциируемых с темными оттенками. Любые цветные или серые шкалы изображения могут изменяться; стандартный формат, соответствующий этим условиям, находится в конвенциальных радиографах. Проблема заключается в том, что используемый метод ограничен демонстрацией приблизительно 60 оттенков серой шкалы, а человеческий глаз может различать 30–100 оттенков; 4096 КТрядов не могут быть воспроизведены без преобразования. Таким образом, широкий диапазон этих рядов преобразуется для воспроизведения в режиме «окон» по ширине и соответствующими уровнями контроля. Уровень «окна» специфичен для центрирования серой шкалы и выбора ширины специфичной для ряда удлиненных серых шкал. К примеру, если уровень «окна» составляет ноль и ширина составляет 500, каждый пиксель ниже –250 будет черным и каждый пиксель выше 250 будет белым; если имеется 50 оттенков серого, каждый будет задан в области 10 рядов со средним оттенком серого, используемых для рядов смежных с нулем.
Электронный луч компьютерной томографии
Другой подход к получению компьютерно-томографического изображения значительно отличается от конвентциальных и спиральных аппаратов электронно-лучевого сканирования. Метод имел название «Ultrafast CT», но теперь в общем называется электрон-
но-лучевой томографией (ЭЛT) или электронно-лучевой КТ (ЭЛКТ). Впервые примененный в 1980 г., аппарат использует электронный луч с магнетическим отражением удара от вольфрамовой мишени к пациенту и продуцированием Х-лучей для сканирования [8]. Единица скорости в начальном этапе кардиального сканирования ЭЛТ может содержать восемь смежных изображений за 50 мс. Позже это значение было адаптировано для получения единственного слоя и использования в сканировании тела [9]. ЭЛКТ не нашло широкого применения для получения других сосудистых изображений.
Спиральная и мультиспиральная компьютерная томография
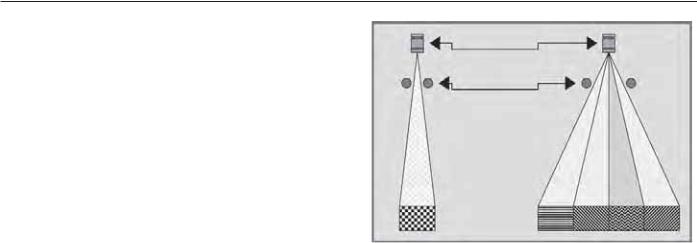
Спиралеобразная или спиральная КТ заключается в продолжительном вращении стойки вокруг пациента при его равномерном продвижении; распространяясь дискретно, данные преобразуются в конвентциальную КТ (рис. 6.4) [10, 11]. Эти созданные объемы являются необработанными данными, которые затем должны быть разделены для создания планарных изображений. Хотя термин «спиральная» более точно отражает концепцию новой технологии, оба названия используются в литературе как заменяющие друг друга [12]. Внедренная в 1989 г., технология имела быстрое признание и распространение. Главное преимущество спирального сканирования включает быстрое овладение, неограниченные возможности получения перекрытых изображений без повышения лучевой экспозиции, высококачественную мультипланарную реконструкцию и отсутствие дыхательных смещений (относительно базовой линии) [13]. Частичные профили и помехи изображения, получаемые при проведении спиральной КТ, часто немного ухудшают полученное изображение, однако успех в отдаленном клиническом применении компенсирует этот ущерб [14–16].
Для улучшения результатов спирального сканирования требовалось развитие как конструкции, так и программного обеспечения [17]. Лучесобирательное кольцо антенны главной конструкции повышало производительность компьютера. Предшествующие КТ-сканеры задумывались как сканеры с проводами, доставляющими электричество к лучевой трубке и передающие полученные данные от воспринимающих устройств к компьютеру. Таким образом, стойка нужна только для передачи сигнала на ограниченное расстояние, перед его возвращением и преобразованием к исходному для получения последующего изображения. Провода соединяют антенну с базой, избегая соединения с лучесобирательным кольцом, применение антенны способствует непрерывной
Начало спирального сканирования
Траектория продолжающей вращения Х-лучевой трубки и детектора
Направления движения
пациента
Рис. 6.4. Спиральное сканирование проводится во время движения пациента при продолжающемся вращении трубки; результаты могут быть визуализированы при «описании» спиралью пациента.
98 Раздел I. Техника визуализации
циркуляции в одном направлении. Так как пациент постоянно движется, индивидуально измеренное излучение собирается в определенный угол антенны с получением мало различающихся локаций вдоль продольной и Z-осей пациента. Мощные интерполяционные алгоритмы требуются для оценки измеренного затухания к каждому углу, если пациент не двигается и его положение постоянно. Для выполнения этой задачи необходимо повышение вычислительной мощности.
Новые концепции заключаются в том, что врач должен иметь представление о спиральной томографии. Угол наклона стола определен изменением положения трубки в 360° в соответствии с фазированием луча. При движении пациента это является эквивалентом фазирования луча и угол наклона — одинаковый. Увеличение угла измерения расширяет область Z-проекции, но с некоторыми ограничениями части профиля и помехами изображения. Использование большего угла также снижает дозу облучения пациента. Угол отклонения не оказывает влияния на толщину слоя или позицию полученного изображения; смежные изображения получаются при угле отклонения больше предыдущего. Вторая важная концепция в том, что изображение имеет приращение и наложения при реконструкции. Когда скан получен, толщина изображения предопределена фазированием луча, который не может быть изменен в спиральной КТ с единственным детектором. Однако, так как данные континуальны, локация центра изображения между z-вершинами может быть изменена. Это преследует две цели: наложение реконструкции для использования его после получения, без любого повышения дозы облучения пациента, и уменьшение среднего объема эффекта, который может способствовать повышению выявления малых повреждений [18].
Потребность в быстром сканировании остается, несмотря на усовершенствование эффективности проведения спиральной КТ. Два метода исследования удовлетворяют этой потребности: увеличение скорости вращения стойки (портала) и числа получаемых после каждого оборота (вращения) срезов. Сканер должен иметь скорость, позволяющую сделать одно вращение за 0,5 с.
Концепция мультидетекторной КТ в начале 1990-х годов предлагала использовать двойной детекторный сканер. Однако его применение не заслужило должного внимания до конца 1990-х годов до внедрения «четверки», или «четырехслойного» аппарата. Принципы и преимущества легко осмыслялись, однако специфика и приложения оказались сложны [20]. В отличие от сбора тонких секций или слоев данных во время вращения, мультидетекторный КТ-сканер собирает излучение при измерении от двух до шестнадцати смежных локаций вдоль тела пациента в z-плоскости (рис. 6.5.). Это позволяет собрать больше данных, которые могут быть использованы совместно в двух направлениях (или в комбинации) [21]:
1.Стол может двигаться быстрее с большей дистанцией согласно вращению трубки. Появляется возможность получения большего объема за тот же период времени, что важно для визуализации сосудов: с мультидетекторным КТ аорто-подвздош- ная зона может быть полностью сканирована, пока имеется достаточное количество контраста в сосудах. Важно, что два детектора проходят дважды, так же быстро и за то же время обследуя две области.
2.Мультидетектор используют для создания тонких изображений такого же объема и за то же время. Для примера, двухдетекторный аппарат получает 5 мм изображения аорты за то же время, как и монодетектор — 10 мм изображения такого же участка аорты за двойное вращение.
Х-лучевая трубка
Коллиматор
Рис. 6.5. Диаграмма иллюстрирует процесс КТ с одним детектором и мультидетекторной КТ. Одновременный процесс получения множества данных показывает увеличение масштаба в каждую единицу времени. Профиль мультидетекторного потока.
Как и в случае со спиральной КТ-технологией, внедряются новые концепции. Существуют некоторые технические особенности моделей детекторов, которые малозначимы для клинициста. Однако он должен осознавать концепцию детекторов «рядов» и «каналов». Большинство аппаратов, используемых сейчас, позволяют получать от 8 до 32 рядов изображения (срезов). Есть ряд детекторов, работающих в Z-оси по направлению к телу пациента. Это не означает, что можно получить 8 или 32 линии данных или срезов за вращение. Большинство аппаратов в настоящее время ограничены 4–8 каналами данных, получаемых за вращение, также ограничены соединяемыми проводами для электронной передачи данных от стола к детектору, а затем к компьютеру для реконструкции изображения. Техническим успехом перехода от монодетекторов к мультидетекторам можно считать способность последних изменять толщину изображения (без ограничений) после получения сканов.
Перспективы
История развития КТ заключается в быстром получении высококачественных более тонких изображений. Скорость сканирования значительно увеличивается с реализацией мультидетекторной спиральной технологии, однако остается потребность в ее усовершенствовании: повышении скорости вращения и одновременном увеличении объема получаемых данных. Повышение скорости и разрешения будет сокращать время, что важно для четвертого измерения в сосудистой визуализации [22]. Производство уже работает на «плоских панелях» КТ-единиц. Применяемые детекторы используют в цифровой маммографии, но прикрепленными к КТ-столу, и концепция толщины слоя может представлять только исторический интерес. Количество данных, полученных за одно вращение, так значительно, что создание изображения из них может занять часы или дни, — вспоминается первый аппарат Hounsfild.
Идеальным в пересекаемых секционных изображениях является следующий подход — через изотропический воксель. Изотропический воксель один из тех, разрешение которого находится во всех трех плоскостях. Преимущество заключается в способности к произвольному сканированию пациента в любой позиции, и то-
Глава 6. Компьютерная томография при сосудистых заболеваниях |
99 |
|
|
гда реконструкция изображения в определенной плоскости лучше демонстрирует патологию [23]. Практические вопросы в следующем. Станет ли неконтрастная КТ брюшной полости и таза «суперисследованием»XXI века? Необходима ли пациенту доза облучения? Как интерпретировать данное исследование — раскадровкой в различных плоскостях или на рабочих станциях? Понятно, что данные, получаемые с помощью техники, также будут изменяться. Приблизительно за 30-летний период КТ привнесет значительные изменения в практическую медицину.
Сосудистая техника и протоколы
При сравнении КТ-исследований выясняется, что КТ-исследова- ния сосудов имеют специфический протокол, вариабельный в зависимости от клинических показаний. В порядке проведения максимального объема диагностики, некоторые факторы должны быть специфичны. Для контрастных исследований наиболее важно само введение контраста и его распределение. Исследуемые параметры, такие как толщина слоя, интервал между слоями и угол наклона, не только влияют на разрешение осей изображений, но и способствуют созданию трехмерных изображений. Точность параметров зависит от мощности специфической аппаратуры и размеров анатомической области. В результате физических ограничений сканера, при увеличении включенной области суммарная способность к оптимизации качества сканирования снижается.
ВНУТРИВЕННОЕ КОНТРАСТИРОВАНИЕ
Для исследования сосудов с помощью КТ обычно используется внутривенный контраст, содержащий йод. При необходимости контраст применяют для идентификации и улучшения выявления повреждения и его характеристики. Все используемые в настоящее время контрастные йодсодержащие вещества быстро проникают во внеклеточные пространства. Поэтому усиление контрастирования сосудов и органов зависит от скорости инъекции и времени от начала инъекции до визуализации (начала сканирования), а также от внутренних характеристик структуры, таких как васкуляризация. Доконтрастное изображение требуется только в специфических ситуациях и не является рутинным при исследовании брюшной полости или сосудов. При рассмотрении сосудистого дерева доконтрастное изображение позволяет более точно выявлять кальциноз стенки артерии и проводить дифференциацию с тромбом при усилении (например, в ситуациях после имплантации эндопротеза).
Пригодны два основных класса контрастов: старый йонический класс и новый нейонический. Нейонические вещества имеют как слабую, так и сильную сторону действия, но они более дорогостоящи [24, 25]. Из-за пониженной вероятности возникновения тошноты и рвоты они в некоторой степени имеют теоретическое преимущество при КТ-получении субоптимальных данных во время движения пациента [26]. Количество контраста зависит от типа оборудования и интереса к определенным сосудам. В основном используется концентрация йода 60% (300 мг/мл), однако допустимы большая или меньшая концентрации. Инъекция контраста всегда проводится мощным инъектором, что гарантирует достижение желаемого соотношения скорости и времени введения. Терминология, используемая во время спиральной КТ, вариабельна в литературе и зависит от конкретного требования и интереса к тому или иному органу. Ранние сканы (обычно используются сканы от 15 до 30 с) часто называют «артериальной фазой», большинство контраста находится в артериальной систе-
ме. Сканы печени, выполняемые с задержкой 60–70 с, называются «портальной венозной фазой», при задержке контраст распределяется по всей паренхиме и венах печени. Эта задержка обычно используется при осмотре брюшной полости. Важно то, что задержка зависит от скорости инъекции; когда скорость введения меняется, может потребоваться регулирование задержки [27, 28]. Задержку сканирования следует удлинить при исследовании венозных структур. Метод КТ оптимально демонстрирует абдоминальную аорту, но будет давать малую информацию о нижней полой вене, если не будет проведено контрастное усиление.
С тщательным изучением контрастного усиления стали очевидны пациент-зависимые факторы. Большинство институтов используют для взрослых пациентов в основном подобную технику. Однако учет различий в кардиальных данных, весе, времени, прошедшем от приема пищи, общем душевном состоянии, явно способствуют получению более актуального изображения [29, 30]. При исследовании специфичного пациента для сканирования полезны автоматические системы, особенно когда получение оптимального усиления затягивается [31, 32]. В общем, используются серии сканов с низкой дозой контраста, получаемые в единственной локации в пределах живота. Область интереса располагается на аорте, и определяется начальный уровень плотности. После начала введения контраста сканы получают каждую секунду или до тех пор, пока измеряемая плотность в пределах зоны интереса не увеличится до пороговой величины. С этого времени начинается диагностическое сканирование.
ОВЛАДЕНИЕ ПАРАМЕТРАМИ
Традиционная КТ может использоваться для демонстрации различной сосудистой патологии, хотя не так оптимально, как при спиральной КТ. Спиральное оборудование предназначено для сосудистых исследований, если оно возможно. Когда используется традиционный сканер с толщиной слоя 5 мм и динамическое движение стола, должна быть использована минимальная внутрискановая задержка. Контраст обычно назначается начальным болюсом 50 мл от 2 до 4 мл/с с сохранением инфузии от 0,8 до 1,5 мл/с с дополнительным объемом 100–150 мл.
Единственный детектор спиральной КТ позволяет получить отличное изображение сосудов. Для аорты и крупных сосудов наиболее часто используется толщина слоя 2–3 мм. Выше имеется соотношение между анатомическими структурами и толщиной слоя. Если эти рамки точно определены, следует использовать малейшее возможное фазирование, которое можно получить в заключение исследования во время задержки дыхания (от 20 до 40 с, зависимой от пациента). Используется угол наклона в пределах от 1,5 до 2°. При повышении шага границы действия увеличиваются, однако это — негативное соотношение, заключающееся в повышении профиля слоя и снижении анализа полученного изображения. Приблизительно 150 мл контраста должно быть назначено для однофазной скорости в 3–4 м/с с использованием как временного болюса, так и автоматического болюса с программным обеспечением, предопределяющим задержку скана. До 50% совмещенных или наложенных реконструкций идеальны.
Мультидетекторная спиральная КТ позволяет получить тончайшие изображения или изображения с бóльшими анатомическими границами, чем при однодетекторном сканировании. Для грудной и брюшной аорт используется толщина слоя приблизительно в 1 мм. Если скан должен включать всю торакоабдоминальную аорту, аортоподвздошную область (КТ «артерий оттока») или необходимы составные постконтрастные фазы (как в случаях по-
100 Раздел I. Техника визуализации
сле эндоваскулярного стентирования), используется слой толщиной в 2,5–3 мм. Угол наклона мультидетекторных аппаратов определяется различными способами с некоторыми трудностями. Используется определение «луча угла-наклона», который аналогичен углу в однодетекторных КТ и находится в пределах от 1 до 2. Кроме того, получение 50% совмещенных реконструкций важно для улучшения качества любого реконструированного изображения. Техника введения контраста для артериальных исследований при использовании мультидетекторных аппаратов аналогична работе с однодетекторными.
ЗАКЛЮЧИТЕЛЬНАЯ ОБРАБОТКА, ТРЕХМЕРНАЯ ТЕХНИКА И КТ-АНГИОГРАФИЯ
Одно из важных преимуществ овладения спиральной техникой в том, что она дает достаточный объем данных. Значительно улучшилась способность к манипулированию данными в других, не только в односкановых направлениях. Наложения реконструкций, проявляющиеся в удлиненных плоскостях и трехмерных наложениях, минимальны и ступенчаты; с применением спиральной техники они могут быть получены без повышения лучевой нагрузки. Спиральное сканирование во время единственной задержки дыхания также устраняет дыхательное смещение относительно базовой линии, которое может быть значимым препятствием для реконструкций. Заключительная обработка данных может производиться на самом сканере или на рабочей станции. Наличие рабочей станции позволяет собственно сканеру оставаться в действии, пока производятся манипуляции с изображением.
Планарное построение в сагиттальной, коронарной или косой проекции необходимо для заключительной обработки. Это может быть полезно в локализации поражения или специфического пространства или органа. К примеру, наличие вещества, локализующегося между печенью, надпочечником и правой почкой, убедительнее продемонстрировать на удлиненном построении. Клиницисты подробно изучают коронарные изображения, которые могут быст-
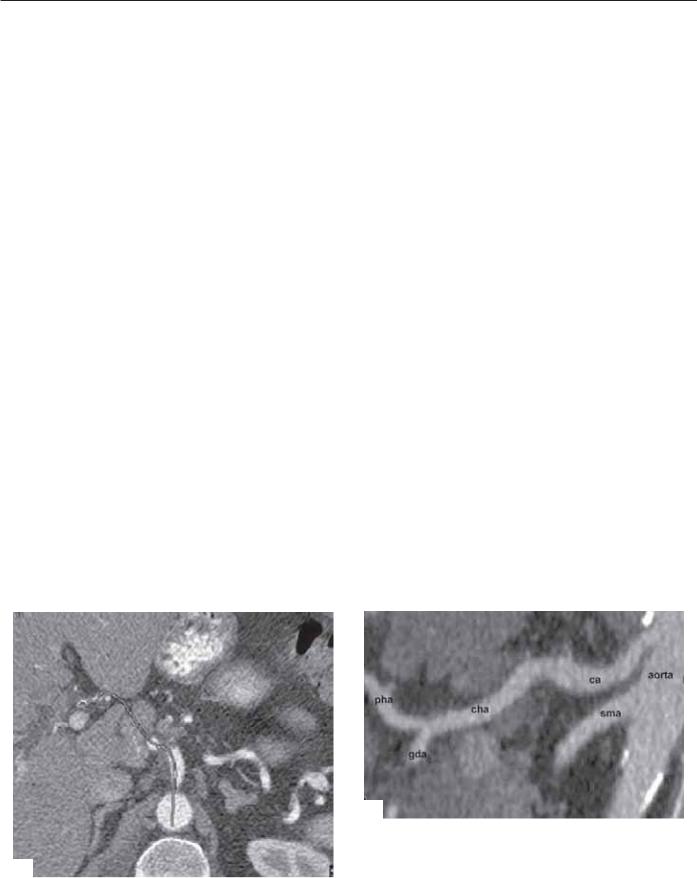
ро сравнивать. Изогнутое планарное построение полезно в установке полного объема единственного объекта с извилистым или изогнутым ходом на изображении (рис. 6.6).
Термин «трехмерное пространство» используется для описания поверхности с максимальной интенсивностью профиля и объемного воспроизведения. Имеются единичные ошибки изображения, полученного со всеми этими технологиями. Похожее на двумерную проекцию трехмерное изображение схоже с радиографом [33]. Три этих описания очень различны, имеют свои преимущества и недостатки.
Описание поверхности, известное также как теневая визуализация поверхности (SSD), может быть использовано для визуализации отдельных объектов, таких как сосуды или органы в различных проекциях. В начале проводится оценка объекта интереса путем определения расположения границ объемов среза к объекту, включая только пиксели основной плотности. Тогда математическая модель создает поверхность объекта. На этом этапе объем данных значительно снижен, так, каждый пиксель либо позитивен (определяется поверхность объекта), либо негативен (отсутствие поверхности объекта). Тогда объект освещается мнимым источником света; отражение и теневое изображение создают впечатление трехмерного пространства. Объемный срез выбирается критическим, так как он может значимо изменять размер объекта, например степень стеноза. Эта техника смещает всю информацию «серых» шкал: кальцинированные бляшки будут неотличимы от светящегося контраста.
Техника максимальной интенсивности проекции (MIP) проста и соотносится со схожей ангиографической процедурой. Для каждой визуализируемой позиции и вида параллельные лучи проходят через визуализируемый объем (группа аксиальных КТ-изо- бражений) и максимальный КТ-ряд встречается между каждым проходящим лучом. Остаточная информация между этими лучами исключается, и снова требуется восстановление энергии компьютера для выполнения этой техники. Различие между передним и задним планами невозможно на единственном MIP-изображении. Трехмерное изображение достигается с помощью серии MIP-изображений под разными углами. Важные пре-
Б
А
Рис. 6.6. Изогнутое планарное изображение используется для демонстрации структур, которые не лежат в одной плоскости. (А) Аксиальное изображение с линией (стрелки), демонстрирующее изогнутый путь печеночной артерии. (Б) Изогнутое саггитальное изображение, демонстрирующее общую печеночную и собственно печеночную артерии (cha), так же как и чревный ствол (ca), верхнебрыжеечную (sma) и гастродуоденальную артерию (gda).
Глава 6. Компьютерная томография при сосудистых заболеваниях |
101 |
|
|
Б
А
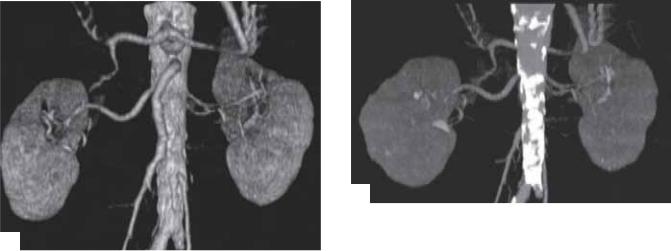
Рис. 6.7. КТ-ангиография. Начало изображения (не показано) получено в аксиальной плоскости с 1,25-мм фазированием и 1-мм инкрементом во время внутривенной инъекции контраста 4 мл/с. (А) Изображение затененной поверхности почек (SSD) у пациента с окклюзией правой общей подвздошной артерии. Чревная артерия и ветви, ВБА и НБА хорошо визуализируются впереди аорты. (Б) Максимальная интенсивная проекция (MIP). Только порции ВБА и НБА и ветви чревной артерии, не находящиеся в проекции с аортой (видимой в этой проекции), не отражаются в этой проекции; только визуализация изображения с множеством углов исправляет наложение структур. Однако визуализируемые кальцинированные бляшки не идентифицируются в затененной поверхности.
имущества техники SSD включают отсутствие пороговой зависимости и сохранение различного затухания [34].
Техника объемного воспроизведения имеет преимущества перед техникой затененной поверхности и MIP-техникой с различными эффектами, такими как полупрозрачные изображения, улучшенные четкие поверхностные и виртуальные эндоскопические изображения [35]. При этой технике каждый воксель сопоставляется с одной из групп, предусмотренной его номером. В результате сохраняется связь между сосудами и органами. Гистограммы чувствительности вокселов получают автоматически с каждым пиком представленного специфического материала.
Вероятность, что единственный воксель соответствует специфичной группе, основана на распределении Gaussian плотности каждого материала [36, 37]. Избегаются неточности, получаемые при выборе порогового уровня SSD и часто требующие редактирования в MIP. Объем, получаемый при воспроизведении полного потока данных, отличен как при SSD, так и при MIP, c исключением основных данных [38]. Этот факт отражает большие затруднения при получении объемного изображения: требуется значительная скорость и более утонченная компьютерная технология.
Одним из самых интересных и клинически применяемых методов является использование трехмерной техники в КТ-ангио- графии (КTA) [39, 40]. Используя специально полученное оформление и трехмерную технику, описанную выше, клинические вопросы, которые вначале требовали применения ангиографии, могут быть решены с помощью КТ. При этом отмечается снижение цены, инвазивности и дискомфорта для пациента. Принцип метода в следующем: вводимый внутривенный контрастный материал и спираль проходят через интересующую часть тела при нахождении контраста в сосудах зоны интереса. На заключительном этапе происходит визуализация сосудов аналогично конвенциальным ангиограммам (рис. 6.7). Хотя все данные доступны на оригинальных осевых изображениях, реконструкция и КТА часто представляют информацию в более практичном и полезном формате.
Для получения высококачественной КТА требуется тщательное соблюдение техники. Контрастное вещество должно вводить-
ся с высокой скоростью, обычно 4–5 мл/с. Временный болюс полезен для обеспечения того, чтобы старт спиральной части координировался с пассажем болюса. Длительность сканирования ограничена в основном как способностью пациента задерживать дыхание, так и нагревом трубки. Однако планируемый ход спирали обычно меняется между протяженностью зоны сканирования и толщиной слоя: фазирование будет снижать анализ, но повышать объем сканирования. В большинстве сосудистых исследований мультидетекторными сканерами используют слой толщиной 1–3 мм. Наложение реконструкций уменьшает пошаговый артефакт; 50% наложений корректны. В последующей обработке можно использовать MIP, SSD или объемную технику, как описано выше. Важно интерпретировать эти изображения в соответствии с оригинальным осевым изображением, так как теряется основное преимущество КТ перед обычной ангиографией при тромбозе, повреждении стенки или смежных органов.
ПРИНЦИПЫ ИНТЕРПРЕТАЦИИ
Обычный подход к интерпретации результатов КТ основан на «hard копии» фильма. В общем стандартный 14–17-дюймовый фильм заполнен 12–24 изображениями. Изображения, которые просматриваются при стандартной ширине «окна», и установочный уровень для различия твердых, жидких и воздухсодержащих структур («body window», уровень 40–70, ширина 380–550) могут быть не корректными для оценки сосудистых структур. С быстрым введением болюса контраст в пределах сосуда может быть таким плотным, что повреждения покрышки, включая интимальные отслоения, могут быть затененными. К сожалению, может быть создана различная вариабельность плотности в пределах сосуда, нестандартное «сосудистое окно». В общем, уровень должен быть поднят (80–120) и ширина повышена (600–1000).
Ряд факторов способствует изменению интерпретации от основного фильма до «soft копии» или мониторного вида. Несколько изображений получено при мультидетекторных сосудистых

102 Раздел I. Техника визуализации
КТ-исследованиях и часто в зоне от 250 до 500. Мультифазовый процесс — образец создания даже больших изображений. Это как повышает цену и неудобства, так и создает множество кадров фильма. Интерпретация результатов КТ происходит от анализа изображения до объемного анализа; это определяет данные для лечения не как множество изображений, но как объем вокселей [41].
ДОЗИМЕТРИЯ
Доза облучения подсчитывается для КТ комплексно [42[. Важно учитывать, что:
1)доза устанавливается только на определенный участок тела,
ане на весь организм;
2)доза может очень сильно варьировать от сканера к сканеру и от изображения к изображению и зависит от установочных технических факторов;
3)процент полученной центральной дозы сравнивается с кожной дозой, значительно большей при КТ, чем при обычной радиографии [3, 4].
Вобщем, эффективная доза при обычной КТ живота больше, чем при обычной радиографии, и находится в пределах 5–15 миллизиверт (мЗВ) [43]. Поэтому важно при возможности определять меньшее число разделов (для обследования), необходимых для получения диагностических данных [44]. Дозиметрия при спиральной технике анализируется по существу так же, как при обычной [4]. Мультидетекторная КТ характеризуется неэффективностью, обусловленной разделением между детекторными последовательностями, которые не накапливают данных и утрачивают использование излучения полутени.
Клиническое применение
Грудная аорта
Грудную аорту можно визуализировать рядом способов, включающих ангиографию, компьютерную ангиографию (КТ), магнит- но-резонансную томографию (МРТ) и трансэзофагальную эхокардиографию (ТЭЭ). До 1990 г. ангиография была обоснованным золотым стандартом для оценки грудной аорты при ее диссекциях и аневризмах, но с развитием технологий лидерство ангиографии заменилось неинвазивными исследованиями в качестве первичного теста выбора для оценки грудной аорты. В 1993 г. было продемонстрировано, что МРТ, ТЭЭ и КТ имели схожую чувствительность для определения диссекции грудной аорты (в 98,3%, 97,7% и 93,8% соответственно). Самая большая специфичность выявлена у МРТ — 97,8%, у КТ — 87,1%, у ТЭЭ — 76,9% [45]. По более поздним результатам, чувствительность для всех этих исследований приближается к 100% и при КТ выше, чем при МРТ и ТЭЭ в определении супрааортальных ветвей, вовлеченных в расслоение [46]. Несмотря на частично большую чувствительность и специфичность при диссекции грудной аорты, МРТ ограничена доступностью и медленным процессом получения изображения. ТЭЭ также ограничена возможностью применения и вариабельностью операторов. По этим причинам спиральная КТ становится методом выбора для оценки диссекции грудной аорты во многих медицинских центрах [47, 48].
Патогмоничные признаки расслоения грудной аорты при КТ — наличие двух рядом расположенных контрастирующихся
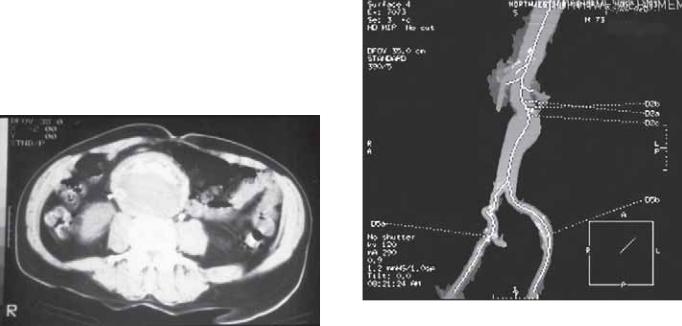
просветов (истинного и ложного) (рис. 6.8.). Два просвета разделены тонкой полоской, называемой отслоенной интимой. Отслоенная интима имеет необычные характеристики, выявляемые при КТ и включающие частичный тромбоз, циркулярное расположение по всей аорте или со множеством ложных каналов. КТ также эффективна для визуализации более точных признаков диссекции, таких как внутреннее смещение интимального кальциноза, пристеночное утолщение, ишемия органов, кровоснабжаемых ветвями аорты, или наличие левостороннего плеврального выпота [48]. КТ также демонстрирует направление флотирующей интимы по отношению к дуге аорты и ветвям, что является основным маркером для определения необходимости хирургического вмешательства [49]. Главные ограничения КТ при диссекции аорты — технические факторы, которые могут стать причиной ложноположительных результатов. Они включают ошибочное время введения контраста, движения стенки аорты или работу сердца, артефакты в виде полос или парааортальные структуры. В будущем развитие технологии визуализации, сочетаемой со знаниями опытного радиографа, будут устранять многие из этих факторов [50].
Аневризмы грудной аорты характеризуются своей локализацией, формой и этиологией. Приблизительно 75% грудных аневризм локализуется в нисходящей аорте, имеют веретенообразную форму, и причиной их является атеросклероз. Золотым стандартом для диагностики и хирургического лечения аневризм грудной аорты была контрастная аортография. Во многих исследованиях аортография преуменьшала размеры аневризмы из-за наличия пристеночного тромба и не выявляла подробности относительно медиастинальной гематомы или анатомической связи аневризмы с другими медиастинальными структурами. Спиральная КТ теперь становится первичным методом визуализации при оценке аневризм грудной аорты. Стенка аневризмы, с наличием внутристеночного кальциноза, легко определяется, что позволяет точно установить размеры аневризмы. КТ применяется для оценки протяженности пристеночного тромба и дефекта в
Рис. 6.8. Тип А или восходящая диссекция с интимальной флотацией, визуализируемая и в восходящей, и в нисходящей грудной аорте.
Глава 6. Компьютерная томография при сосудистых заболеваниях |
103 |
||
|
|
||
стенке аневризмы, так же как связи с расслоением, дистальной |
жет демонстрировать истончение стенки аорты и плотное при- |
||
эмболизацией или плевральным выпотом [51]. |
легание к окружающим структурам, что характеризует воспа- |
||
Хотя артериография остается золотым стандартом оценки |
лительную АБА (рис. 6.9). Случаи необычного истончения стен- |
||
травматического повреждения грудной аорты, последние иссле- |
ки аорты с наличием интрамурального воздуха свидетельствуют |
||
дования демонстрируют увеличение роли КТ в диагностике та- |
о микотической аневризме [56]. К тому же, методика КТ исполь- |
||
ких повреждений. По результатам проспективного исследования |
зуется для оценки отдаленных результатов протезирования, осо- |
||
1998 г., при тупой травмы аорты спиральная КТ имеет чувстви- |
бенно при таких осложнениях, как парапротезная инфекция и |
||
тельность 100%, по сравнению с 92% при аортографии и специ- |
аневризмы анастомозов. |
|
|
фичность при спиральной КТ — 83%, по сравнению с аортогра- |
Развитие и быстрое внедрение в клиническое применение |
||
фией — 99% [52]. Несмотря на то что большинство центров |
эндоваскулярных стент-графтов для АБА в 1990-х годах и в на- |
||
продолжают использовать аортографию для диагностики трав- |
стоящее время стали возможными благодаря применению КТ- |
||
матического повреждения аорты, многие центры увеличивают |
технологии и компьютерной обработки изображения. Отбор кан- |
||
роль КТ для оценки повреждений аорты у пациентов с нормаль- |
дидатов для эндоваскулярного вмешательства и последующего |
||
ным средостением по данным грудной рентгенограммы, но с суг- |
подбора размеров эндопротеза требует множества точных расче- |
||
гестивным механизмом [53]. В общем, КТ становится принци- |
тов. Последние включают длину и диаметр проксимальной шей- |
||
пиальным методом оценки сосудистых поражений грудной аорты. |
ки аорты, протяженность и размеры дистальных отделов анев- |
||
Этот метод существенно вытесняет контрастную ангиографию |
ризмы, расстояние от нижней почечной артерии до самой |
||
в диагностике расслоения грудной аорты и аневризм и имеет зна- |
дистальной части протеза (рис. 6.10). Эти измерения требуют |
||
чение при экстренной оценке травматического повреждения груд- |
точности менее 1 мм и любая ошибка в размере протеза имеет |
||
ной аорты. |
серьезные последствия: «подтекание» при разрыве аневризмы, а |
||
|
также угрозу миграции стента (рис. 6.16). Новая техника вклю- |
||
Брюшная аорта |
чает комбинацию спиральной КТ и мультипланарное перефор- |
||
матирование в развитии КТ-ангиографии, с применением для |
|||
|
|||
Роль КТ при аневризме брюшной аорты (АБА) стала возрастать |
точности трехмерной реконструкции аорты и ее ветвей. Допол- |
||
в 1980-х годах. В 1990-х годах метод стал инструментом в раз- |
нительно, для точного измерения длины в пределах аорты и из- |
||
витии и клиническом применении эндоваскулярного лечения |
гиба подвздошных артерий применяется компьютерная обработ- |
||
АБА. Эффективным звеном скринингового исследования АБА |
ка с реконструкцией изображения, что важно для определения |
||
остается ультразвуковое исследование абдоминального отдела, |
размера протеза и успеха эндоваскулярной процедуры. Другая |
||
но КТ становится первичным звеном в оценке параметров АБА, |
новая технология создает «виртуальный протез» Fillinger: ком- |
||
протяженности аневризмы и планирования как открытого, так |
пьютерное изображение, напоминающее трехмерный эндопро- |
||
и эндоваскулярного вмешательств. В крупных медицинских цен- |
тез, помещенный в пределы трехмерной реконструкции аорты |
||
трах КТ является исключительным методом визуализации при |
пациента, что помогает планировать вмешательство и предпола- |
||
неосложненной АБА, а аортография представляет собой ре- |
гать возможные осложнения (рис. 6.11) [57]. |
|
|
зерв для исследования подгруппы пациентов с аномалиями ана- |
|
|
|
томии, интраренальной, надчревной и комплексной аневризма- |
|
|
|
ми. АБА характеризуется дилатацией с кальцинозом стенки аорты и наличием тромба различной степени выраженности [54]. КТ очень важна для выявления характеристик АБА, требующих более срочного вмешательства. Случаи разрушения кальцинатов с проникновением в окружающие мягкие ткани могут свидетельствовать о разрыве аневризмы [55]. Кроме того, КТ мо-
|
Рис. 6.10. С помощью мультипланарной реконструкции воз- |
|
можно измерение длины аорты. Трансаксиальное изображение |
Рис. 6.9. Поздняя стадия воспалительной аневризмы брюшной |
используется для определения диаметра аорты при установке |
аорты. Контраст улучшает визуализацию стенки аорты. |
эндопротеза. |

104 Раздел I. Техника визуализации
А |
|
Б |
|
|
|
Рис. 6.11. Виртуальная реконструкция аорты (А) с предложенным расположением протеза (Б). (Реконструкции представили Mark Fillinger, M.D. и Medical Media Services.)
Помимо того что КТ является жизненно важной методикой для отбора пациентов и планирования эндоваскулярной помощи при АБА, она незаменима для послеоперационной оценки эндопротеза. Несмотря на точность в планировании установки эндопротеза, возникает значительное количество опасных для жизни осложнений: аневризматическое расширение, «подтекание», деформация стента и его миграция. Спиральная КТ в комбинации с рентгенографией и допплеровским ультразвуком в общем считаются золотым стандартом оценки отдаленных результатов эндоваскулярного протезирования АБА, выявления поздних осложнений [58, 59].
Подвздошные артерии
Аневризмы подвздошных артерий нередки и встречаются приблизительно в 2% случаев всех абдоминальных аневризм [60]. Аневризмы подвздошных артерий имеют широкий круг клинических проявлений, с затруднительной постановкой диагноза, но с развитием КТ диагностика аневризм подвздошных артерий совершенствуется [61]. Учитывая высокую частоту разрыва и связанную с этим летальность, для диагностики аневризм размером более 4 см необходима быстрая и точная визуализация. Традиционно диагностика аневризм подвздошных артерий осуществляется одним из двух методов — артериографией или дуплексным ультразвуковым исследованием. Использование КТ в диагностике и планировании хирургического лечения аневризм подвздошных артерий широко распространено. Исследования демонстрируют, что существует прекрасная корреляция между ультразвуком и спиральной КТ в определении размера аневризм подвздошных ар-
терий с недооценкой ультразвуком размеров 0,03 см [62]. Учитывая развитие эндоваскулярных протезов, большие и симптоматические аневризмы подвздошных артерий требовали применения открытого вмешательства. Имеется значительный опыт лечения изолированных аневризм подвздошных артерий с использованием эндоваскулярных протезов, и ранние результаты были убедительны при среднем уменьшении аневризмы в 0,516 см за год после эндоваскулярного протезирования [63]. Подобно развитию КТ-визуализации с дооперационной и послеоперационной оценкой эндоваскулярного лечения АБА, теперь КТ оказывает такую же роль в диагностике, планировании операции, а также послеоперационной оценке как открытых, так и эндоваскулярных вмешательств при аневризмах подвздошных артерий.
Периферические артерии
Сосудистаяпатологиябедренныхиподколенныхартерий можетбыть точно визуализирована с помощью КТ. В прошлом при исследовании использовали КТ-ангиографию для оценки окклюзии артерий нижних конечностей. В одной из работ КТ-ангиография была оценена как высокоточный метод диагностики окклюзии бедренной артерии, подколенной артерии, тибиальной артерии с чувствительностью 100%, 100% и 94% соответственно. В общем, было показано, что КТ-ангиография не такой точный метод, как обычная ангиография
воценке сосудистого поражения артерий нижних конечностей, но
вбудущем может стать надежной неинвазивной техникой для определения сосудистой патологии нижних конечностей [64, 65].
Спиральная КТ стала широко рассматриваться как ценная техника диагностики синдрома сдавления подколенной артерии
