
3 курс / Общая хирургия и оперативная хирургия / Избранные_лекции_по_факультетской_хирургии_Леванович_
.pdfно и других органов грудной клетки. И затем последовало предложение Ф. Торека (1913), определившее путь развития хирургии пищевода на многие десятилетия вперед. Суть его заключалась в удалении опухоли пеищевода с формированием пищеводного и желудочного свищей, а на втором этапе – пластикой пищевода. Операцию стали называть Добромыслова-Торека. Ее раньше применяли для удаления рака среднегрудного отдела пищевода. Из правостороннего чресплеврального доступа удаляли грудной отдел пищевода. Через абдоминальный разрез накладывали гастростому. В последующем (спустя 3–6 мес) создавали искусственный пищевод из толстой и тонкой кишки.
Первоначально внимание хирургов было сосредоточено на создании искусственного пищевода из кожного лоскута передней грудной стенки.
Более перспективным направлением в развитии реконструктивной хирургии пищевода оказался метод тонкокишечной предгрудинной эзофагопластики, полностью лишенный всех недостатков, свойственных кожному пищеводу. Идея такой пластики принадлежала Ц. Ру (1906), но в полном объеме осуществил ее в собственной модификации спустя 9 месяцев в клинике наш соотечественник, выдающийся хирург П. А. Герцен (1907). Вследствие этого антеторакальная пластика пищевода тонкой кишкой вошла в историю хирургии, как операция Ру-Герцена.
Исключительная значимость в разработке этой проблемы принадлежит выдающемуся хирургу, нашему соотечественнику С. С. Юдину. За 20 лет (1928–1948) лично им было произведено 318 операций создания антеторакального пищевода из тонкой кишки. Благодаря внесению целого ряда оригинальных методик, ему удалось снизить летальность при данном вмешательстве до 9 %.
Предел совершенства методики предгрудинной пластики тонкой кишкой был достигнут А. А. Русановым (1974). Используя опыт многих своих предшественников, обладая незаурядными хирургическими способностями и внеся в производство операции ряд оригинальных решений, он сумел достигнуть отличных результатов. Из 200 оперированных больных у 192 течение было гладким и произошло полное приживление трансплантата под кожей. Некроз кишечного трансплантата наступил только у 7 человек (3,5 %).
Параллельно с тонкокишечной пластикой происходило внедрение в практику восстановительной хирургии пищевода толстокишечного трансплантата. Идея толстокишечной эзофагопластики принадлежит Kelling (1911) и Vulliet (1911). В толстой кишке привлекала к себе внимание достаточная длина, хорошее кровоснабжение и сравнительно простая техника ее мобилизации. А. А. Русанов (1974) по этому поводу писал: «Здесь не требуется тонкой скрупулезной аккуратности и такого исключительно острого внимания и точного расчета, как при мобилизации тощей кишки. Для хирурга мобилизовать толстую кишку несравненно легче. Однако, несомненно, что для больного создание пищевода из толстой кишки – операция более тяжелая и более опасная, чем создание пищевода из тонкой кишки». С этим положением трудно не согласиться.
Наибольший расцвет толстокишечной эзофагопластики приходится на 1950–1970-е годы. К 1970 году самым большим опытом пластики пищевода толстой кишкой обладали сотрудники института им. Н. В. Склифосовского. Их опыт составил почти 250 наблюдений с общей летальностью 6,8 %.
К настоящему времени можно констатировать, что толстая кишка как пластический материал для эзофагопластики выдержала испытание временем и заняла свое место в современной реконструктивной хирургии пищевода.
Использование желудка в качестве пластического материала для замещения резецированного пищевода всегда привлекало к себе пристальное внимание специалистов, занимавшихся этим разделом хирургии. К этому располагают его хорошие пластические свойства, обильное экстра– и интраорганное кровоснабжение, большие размеры и непосредственное расположение вблизи пищевода. По мнению многих авторов, использование желудка для пластики является наиболее физиологичным, а техническое выполнение операции представляется менее громоздким вмешательством, нежели любой
вариант кишечной пластики пищевода.
История развития желудочной эзофагопластики на протяжении всего своего периода происходила и продолжает развиваться параллельно по двум принципиально различным направлениям. Сторонники одного из них придерживаются принципа использования целого желудка, второго – части его с моделированием трубкоподобной формы трансплантата с расположением его в изо– или антиперистальтическом направлении.
Впервые указания на возможность использования желудочного трансплантата, сформированного из большой его кривизны в антиперистальтическом направлении, для эзофагопластики содержатся в трудах Beck и Carrel (1905).
Независимо друг от друга румынский хирург Jianu (1912) и русский хирург Я. О. Гальперн (1912) описали технику идентичной операции: из большой кривизны желудка выкраивался трубчатый лоскут с основанием в области его дна и питанием за счет желудочно-сальниковой артерии. Блестящие результаты Gavriliu послужили основанием к признанию данного вида хирургического вмешательства в качестве перспективного варианта пластики пищевода как у нас в стране, так и за рубежом.
Однако с накоплением клинического опыта было установлено, что наряду с положительными моментами операция Жиану-Гальперна-Гаврилиу имеет существенные недостатки. Несмотря на значительное усовершенствование техники операции, она по-прежнему оставалась чрезвычайно громоздкой и опасной, особенно из-за недостаточного кровоснабжения дна желудка. Фистула в зоне анастомоза наблюдалась практически у каждого второго больного. Кроме того, удаление не пораженной заболеванием селезенки с целью удлинения трансплантата может рассматриваться как не оптимальный вариант, а как вынужденный при отсутствии альтернативного способа. Далее, сохранение кардиального отдела желудка влечет за собой оставление соответствующего лимфатического коллектора, что при раке пищевода является нарушением принципа онкологического радикализма.
Все изложенное дало основание хирургам в начале 1970-х годов вновь вернуться к вопросу о методике формирования желудочного трансплантата для эзофагопластики в изоперистальтическом его варианте.
Принципиально новый способ пластики пищевода в виде желудочной трубки, сформированной из большой кривизны желудка в изоперистальтическом направлении, разработан в 1923 г. Rutkowski. Выкраивание трубчатого стебля начиналось им со стороны кардиального отдела желудка с основанием в области привратника. По мнению автора, такое расположение трансплантата обеспечивает лучшее его кровоснабжение, поскольку правая желудочно-сальниковая артерия крупнее одноименной левой. В клинике эта методика была успешно применена Lortat-Jacob (1949).
Дальнейшие научные изыскания, направленные на изучение экстраорганной ангиоархитектоники желудка доказали целесообразность эзофагопластики изоперистальтической желудочной трубкой.
В то же время ведущим осложнением после внутриплевральной пластики пищевода по-прежнему продолжала оставаться несостоятельность пищеводно-желудочного анастомоза (до 42 %), возникающая вследствие ишемии и некроза проксимального отдела трансплантата.
Стремясь уменьшить летальность вследствие этого грозного осложнения, некоторые хирурги перешли к заднемедиастинальной эзофагопластике с анастомозом на шее. Ключевым моментом методики является вынесение пищеводно-желудочного анастомоза за пределы плевральной полости, на шею, при любой локализации рака пищевода, вплоть до рака кардии. Предложенная методика позволила значительно улучшить непосредственные результаты одномоментной эзофагопластики, снизив послеоперационную летальность в специализированных стационарах до 3–5 %. В то же время частота развития несостоятельности такого пищеводно-желудочного анастомоза в некоторых учреждениях достигает 75 %, что не может удовлетворить хирургов.
При этом имеется прямая зависимость частоты развития несостоятельности
пищеводно-желудочного анастомоза от экстраорганной ангиоархитектоники сосудов большой кривизны желудка.
Наряду с пластикой пищевода с помощью желудочной трубки разрабатывались методики его замещения целым желудком. Первую попытку антеторакальной пластики пищевода желудком предпринял Fink (1913), однако операция закончилась летальным исходом.
Следующим заметным событием в хирургии пищевода являются работы Lewis (1946). Он предложил использовать для мобилизации и резекции пищевода правосторонний торакотомический доступ. При этом он разделил операцию на два этапа. Первоначально производилась лапаротомия, мобилизация желудка с тщательным сохранением сосудистых аркад вдоль малой и большой кривизны и формированием гастростомы. Затем спустя 1–2 недели выполнялся второй этап, во время которого перевязывалась непарная вена, выделялся пищевод вместе с окружающей клетчаткой, расширялось пищеводное отверстие диафрагмы, и через него выводился в плевральную полость ранее мобилизованный желудок. Пищевод с опухолью резецировался и накладывался эзофагогастроанастомоз конец в бок.
Операция Lewis в 1950-е годы приобрела довольно широкое распространение, особенно после того, как McManus (1948) доказал целесообразность ее осуществления в один этап.
Основным недостатком антеторакальной и внутригрудной пластики пищевода желудком оказалось частое развитие свищей анастомоза и желудочных свищей в связи с некрозом перемещенного желудка. Главной причиной наблюдавшихся некрозов являлось прямое нарушение кровоснабжения дна желудка.
Вцелях снижения частоты развития несостоятельности анастомоза многие хирурги стали прибегать к резекции кардии и дна, как отделов с ущербным кровоснабжением в условиях мобилизованного желудка.
Вто же время резекция проксимального отдела желудка влечет за собой уменьшение размеров формируемого трансплантата. Отсюда понятен повышенный интерес хирургов к таким методам эзофагопластики, когда в качестве трансплантата используется «трубка» из большой кривизны.
Лечение больных раком пищевода – одна из самых сложных задач клинической онкологии. Радикальное лечение больных раком пищевода сегодня – это комбинированное (удаление опухоли и лучевая терапия и ЛТ) или комплексное лечение (радикальная операция, химиотерапия, или еще и ЛТ), в которое, помимо хирургического удаления опухоли, включают адъювантные (после операции) или неоадъювантные (до операции) воздействия.
Современные операции при раке пищевода можно разделить на два типа: резекция пищевода и субтотальная эзофагэктомия. При резекции линия пересечения пищевода находится на определенном удалении (обычно 4–6 см) от верхнего края опухоли. Субтотальная эзофагэктомия предусматривает почти полное (за исключением небольшого участка шейного отдела) удаление пищевода, независимо от локализации опухоли.
Взависимости от выбора оперативных доступов выделяются следующие основные виды вмешательств: 1) чрезплевральные (право– или левосторонняя торакотомия) в сочетании с диафрагмо-или лапаротомией; 2) комбинированные торакоабдоминальные; 3) трехдоступные (торакотомия, лапаротомия и цервикотомия) и 4) трансхиатальные (так называемые операции «без торакотомии»). На современном этапе активно разрабатываются внутрипросветные эндоскопические операции и тораколапароскопические.
Внастоящее время общепризнанным является выполнение при раке пищевода одномоментных операций. В качестве пластического материала для эзофагопластики предпочтение отдают использованию желудка, при этом применяется как целый желудок, так и выкроенный лоскут из большой его кривизны. В случаях невозможности осуществить пластику пищевода желудочным трансплантатом в пластических целях используют ободочную или тонкую кишку. Оптимальным и наиболее физиологичным путем проведения
трансплантата признано заднее средостение (ложе пищевода). Ретростернальный и антеторакальный пути проведения трансплантата также имеют право на существование, но чаще их используют при невозможности проведения трансплантата через заднее средостение. При резекции пищевода пищеводный анастомоз, как правило, располагается внутриплеврально, а при субтотальной эзофагэктомии – только внеплеврально (на шее). Новой тенденцией стали пластические пересадки свободных трансплантатов с использованием микрососудистых анастомозов. При резекции шейного отдела пищевода, сопровождающейся удалением гипоглотки и ларингэктомией, прибегают к свободной трансплантации двух кишечных сегментов: толстокишечного и толстокишечно-подвздошного – для восстановления глоточно-пищеводного дефекта и для возобновления голосовой функции.
Выбор метода лечения зависит от локализации опухоли и ее распространенности. Неоперабельными больные бывают по двум причинам: 1) прорастание опухолью соседних органов и структур – аорты, трахеи, легкого, метастазирование в лимфатические узлы второго, третьего порядка и другие органы (печень, легкие), поэтому возможность удаления опухоли (резектабельность) у большинства больных становится окончательно ясной только во время операции; 2) наличие сопутствующих заболеваний сердца, легких, почек, печени и других органов в стадии декомпенсации.
При раке шейного и верхнегрудного отделов пищевода опухоль быстро прорастает окружающие органы и рано дает метастазы. Рак этой локализации более успешно лечат при помощи лучевой терапии.
При раке грудного отдела пищевода выполняют одномоментную субтотальную резекцию пищевода с пластикой его желудком с внутриплевральным пищеводным соустьем (операция Льюиса). При раке нижнего отдела пищевода производят резекцию нижней трети пищевода, проксимального отдела желудка и малого сальника из левостороннего торакоабдоминального доступа (операция Гарлока).
С целью улучшения результатов лечения, как уже отмечалось, радикальное оперативное вмешательство дополняют лучевой терапией, нередко фармакомодулированной (с одновременным введением противоопухолевых химиопрепаратов).
При неоперабельных опухолях производят паллиативные вмешательства с целью восстановления проходимости пищевода, улучшения питания больного. К ним относят гастростомию (чаще по Кадеру), обходной анастомоз, паллиативные резекции.
Из неоперативных паллиативных методов лечения рака пищевода, направленных на восстановление возможности приема пищи, сегодня широко разрабатываются и используются эндоскопические методы реканализации опухоли. К ним относятся: бужирование, электрокоагуляция, реканализация просвета пищевода высокоэнергетическим лазером, фотодинамическая реканализация низкоэнергетическим лазером, интубация опухоли жесткими протезами, интубация опухоли саморасширяющимися стентами, интратуморальное введение цитостатиков. Выбор того или иного метода определяется возможностями и опытом персонала конкретного лечебного учреждения.
Бужирование опухолевой стриктуры является одним из самых традиционных и доступных методов лечения. Однако его возможности очень ограничены, а риск осложнений слишком высок. Уровень осложнений может достигать 30 %, в том числе перфораций –
10 %.
Аргоно-плазменная коагуляция или биполярная электрокоагуляция подразумевают прямое разрушение опухоли под эндоскопическим контролем. Лечение бывает эффективным более чем в 80 % случаев при частоте осложнений около 8 % (в основном за счет перфораций).
В последние 10–15 лет широкое распространение получила методика реканализации пищевода посредством лазерной коагуляции опухоли. Главный недостаток лазерной терапии
– необходимость частых повторных процедур. Процент перфораций при этом также достаточно высок (8 %).
Некоторое время назад интенсивно развивалась фотодинамическая терапия (ФДТ), которая заключается во внутривенном введении в организм пациента фотосенсибилизаторов, которые накапливаются в ткани опухоли, с последующим воздействием на опухоль низкоэнергетическим лазерным лучом. И хотя при раке пищевода метод применяется в основном для лечения ранних опухолей, появились данные по использованию его также в целях борьбы с дисфагией. Уменьшается и частота перфораций, т. к. не требуется предварительная дилатация. Ограничениями ФДТ являются высокая стоимость оборудования и поверхностная глубина проникновения лучей в опухоль, что часто требует повторных сеансов лечения. После введения фоточувствительных агентов пациенты должны избегать воздействия прямых солнечных лучей.
Главным недостатком всех перечисленных симптоматических методик является кратковременность достигаемого эффекта. Наиболее перспективным направлением сегодня представляется интубация (стентирование) опухоли. Однако эффективность использовавшихся ранее жестких внутрипищеводных протезов с неизбежно малым внутренним диаметром (деревянных, серебряных, стальных, пластиковых) была крайне низка из-за их частых смещений и закупорки пищей. Нередкими были и такие осложнения, как кровотечение и перфорация вследствие некроза опухоли от давления. В 1990 году был изобретен проволочный саморасширяющийся стент с внутренним диаметром до 20–25 мм. К недостаткам стентов относится возможность их смещения в момент установки, обтурация опухолевыми разрастаниями по краям, способность скольжения в дистальном направлении по мере обрастания коллагеном, трудность удаления или передислокации, высокая стоимость.
Лучевая терапия Лучевую терапию применяют в комплексе с оперативным лечением до и после
операции, а при неоперабельном раке в качестве самостоятельного вида лечения или в сочетании с химиотерапией. При применении сочетанной лучевой терапии при раке пищевода уровень пятилетней выживаемости повышается до 36–38 %, что соответствует показателям при радикальных операциях, выполненных на ранних стадиях.
Наиболее благоприятные результаты получены при использовании источников высоких энергий (гамма-терапии, тормозного излучения и быстрых электронов), обеспечивающих подведение к опухоли пищевода высокой дозы излучения. В настоящее время наиболее эффективной методикой внешнего облучения при раке пищевода признано облучение на линейных ускорителях с энергией излучения 10 Мэв.
При аденокарциноме пищевода лучевая терапия неэффективна. Противопоказана лучевая терапия при тяжелых заболеваниях сердечно-сосудистой и дыхательной систем, паренхиматозных органов, центральной нервной системы, распаде опухоли, кровотечении.
При невозможности выполнения хирургического или лучевого лечения при раке пищевода может быть применена в качестве паллиативного средства химиотерапия (комбинация антиметаболитов пиримидинового ряда (5-фторурацил или фторафур) с метатрексатом и колхамином). Химиотерапия рака пищевода до настоящего времени малоэффективна в связи с низкой чувствительностью опухоли к известным противоопухолевым препаратам и плохим кровоснабжением органа. Однако полностью игнорировать роль химиотерапии в лечении больных раком пищевода нельзя.
Методика формирования желудочного трансплантата с учетом взаимосвязи экстра– и интраорганного межсосудистого анастомозирования
В нашей клинике было выявлено, что на фоне существующего внеорганного коллатерального сосудистого русла желудка, в наибольшей степени выраженного по большой кривизне, но носящего непостоянный характер, имеется строго топографоанатомически очерченная внутриорганная сосудистая магистраль между тремя основными сосудистыми коллекторами желудка (a.gastroepiploica dextra, a.gastrica sinistra, a.gastroepiploica sinistra) через систему сосудов первой и второй ветвей нисходящего отдела
левой желудочной артерии. При этом, ramus transversus (А1) через свои ветви Al-а и А1-6 является связующим интраорганным межсосудистым анастомозирующим стволом между системами a.gastrica sinistra и a.gastroepiploica sinistra, а вторая ветвь нисходящего отдела левой желудочной артерии (А2) – между a.gastrica sinistra и a.gastroepiploica dextra.
Конечным звеном данной магистрали являются две сосудистые веточки, отходящие от проксимальной ветви a.gastroepiploica sinistra к апикальной части дна желудка (рис. 44).
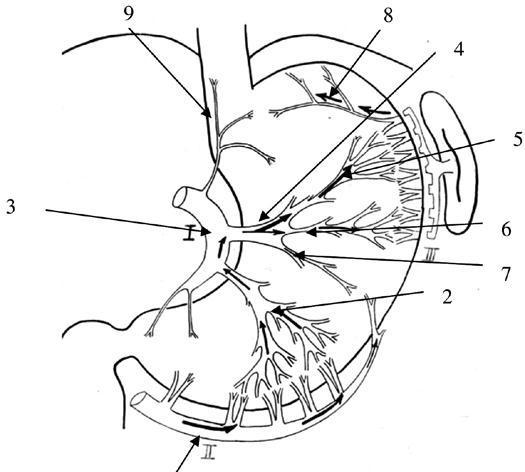
Рис. 44. Схематическое изображение движения контрастного вещества, введенного
вправую желудочно-сальниковую артерию, по сосудам желудка. 1. Ветви правой желудочно-сальниковой артерии. 2. Вторая ветвь (А2) нисходящего отдела левой
желудочной артерии в типичном варианте отходит на расстоянии 5-10 мм от А1. Длина ее внеорганной части колеблется от 5 до 10 мм, а диаметр – от 1,5 до 2 мм. Вступив в ткань желудка, она сохраняет основной ствол на расстоянии 20–30 мм, а затем делится на 2–4 ветви, которые идут в направлении большой кривизны и своими конечными стволиками входят в тесную взаимосвязь с сосудами a. gastroepiploica dextra. 3. Нисходящий отдел левой желудочной артерии. 4. Первый сосуд нисходящего отдела левой желудочной артерии (А1 – ramus transversus) является наиболее крупным из всех остальных ветвей a. gastrica sinistra и с небольшим числом вариантов остается наиболее стабильным в своем анатомическом расположении. Чаще всего эта ветвь отходит от основного ствола на границе между верхней
исредней третями малой кривизны желудка. 5.6.7. деление основного ствола А1 на три ветви
–верхнюю (5), среднюю (6) и нижнюю (7). Они обозначаются как А1 – а, А1-6 и А1-в. А1 – а
имеет строго восходящее направление в сторону верхнего полюса селезенки. А1-6 устремляется косо вверх в сторону ворот селезенки или ее нижнего полюса. Оба артериальных ствола своими конечными ветвями широко анастомозируют с сосудами системы левой желудочно-сальниковой и короткими желудочными артериями, а А1 – а, кроме того, с сосудами пищеводно-кардиально-фундальной артерии. А1 – в сохраняет поперечное направление, достигает большой кривизны и анастомозирует с ветвями
проксимальной части правой желудочно-сальниковой артерии. Сосудистый коллектор системы ramus transversus является одним из ведущих в обеспечении кровоснабжения проксимального отдела тела желудка. Своими двумя основными ветвями (А1-а и А1-6) он имеет четкую хорошую внутриорганную связь с сосудами левой желудочно-сальниковой артерии и короткими сосудами желудка, а через А1 – в – с a. gastroepiploica dextra. 8 . Ветви левой желудочно-сальниковой артерии. 9. Пищеводно-кардиально-фундальная артерия.
Описанная сосудистая магистраль является устойчивой и не подвержена влиянию анатомических различий ветвления сосудов желудка. При этом, имеются и другие
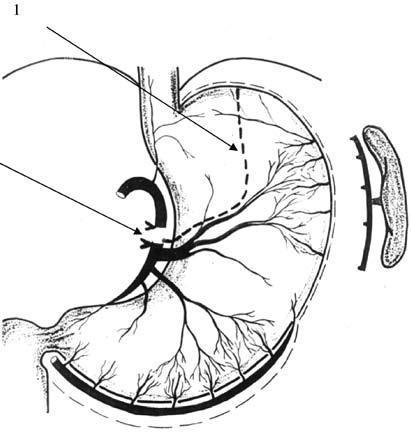
внутриорганные пути анастомо-зирования основных сосудов желудка, но они, по нашему мнению, могут рассматриваться как вторичные, не гарантирующие надежного кровоснабжения всех его отделов. На основании полученных данных в клинике разработана методика формирования желудочного трансплантата для эзофагопластики, основанная на полной сохранности магистрального внутриорганного сосудистого русла (авторское свидетельство № 4769328/14 от 24.05.91 г.). (рис 45, 46).
Основу хирургического вмешательства при карциноме грудного отдела составляет резекция грудного отдела пищевода, части кардиального отдела желудка и расширенная
двухуровневая лимфодиссекция с перевязкой грудного лимфатического протока. Лимфодиссекция в пределах грудной полости включает в себя удаление в максимальном объеме клетчатки заднего средостения от купола плевральной полости до диафрагмы. При этом повышенное внимание уделяется лимфатическим узлам, наиболее подверженным раковому метастазированию. К ним относятся трахеобронхиальные и бифуркационные лимфатические коллекторы, лимфатические узлы зоны аортального окна. Лимфодиссекция считается адекватной, если происходит полное обнажение мембранозной и боковых поверхностей трахеи, ее бифуркации вместе с обоими главными бронхами на всем их протяжении, дуги аорты и ее грудного отдела, медиастинальной плевры противоположной стороны.
Рис. 45. Схема формирования желудочного трансплантата. 1 – линия резекции
кардиального отдела желудка; 2 – место перевязки нисходящей ветви левой желудочной артерии выше отхождения ее поперечной ветви (ramus transversus)
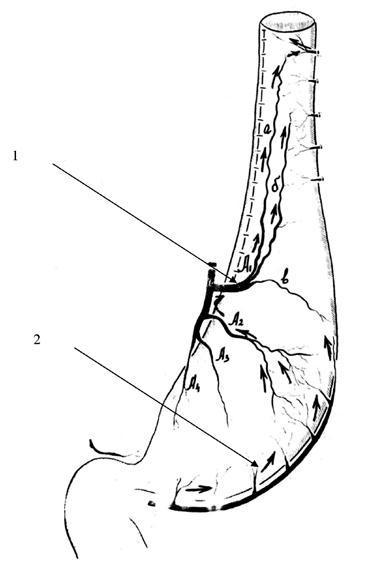
Рис. 46. Схема конечного вида сформированного желудочного трансплантата. 1 –
кровоснабжение верхней части трансплантата; 2 – кровоснабжение нижней части трансплантата
Чрезвычайно важное значение придается адекватности операции в брюшной полости за счет выполнения лимфодиссекции. Японское Общество по изучению рака в соответствии с
рекомендациями UICC в 1995 году приняло решение об обозначении лимфоаденэктомии символом D (от слова dissection). Лимфодиссекция в объеме D1 предусматривает удаление перигастральных лимфоколлекторов, расположенных в связочном аппарате желудка – правые и левые паракардиальные лимфоузлы, лимфоузлы малой и большой кривизны (лимфоузлы вдоль правой и левой желудочно-сальниковой артерии и коротких желудочных сосудов), над– и подпривратниковые лимфоузлы (N1-6). Лимфодиссекция D2 означает удаление, кроме N1-6, лимфоузлов чревного ствола (N9) и его ветвей – левой желудочной (N7), общей печеночной артерии (N8), селезеночной (N11), лимфоузлов ворот селезенки (N10). Лимфодиссекция D3 предполагает в дополнение к вышеперечисленным удаление лимфоузлов гепатодуоденальной связки (N12), ретропанкреато-дуоденальных (N13), лимфоузлов по ходу верхней брыжеечной артерии (N14), корня брыжейки поперечноободочной кишки, средней ободочной артерии (N15), парааортальных лимфоузлов, расположенных на уровне брюшной аорты (N16). При раке среднегрудного
отдела пищевода лимфодиссекцию в брюшной полости выполняют в объеме типа D2 или D2-3. В результате ее производства полностью скелетируют ножки диафрагмы, абдоминальный отдел аорты вместе с чревным стволом, общую печеночную и селезеночную артерии на всем протяжении и верхний край селезеночной вены за счет удаления ретропан-креатических лимфатических узлов. Кроме того, в целях соблюдения максимальной абластичности операции последнюю всегда начинают с брюшного этапа. Грудной этап вмешательства начинают с мобилизации и пересечения пищевода выше опухоли, лигирования грудного лимфатического протока над диафрагмой и на уровне непарной вены. Только после этого приступают к мобилизации пищевода, начиная с этапа отделения его от аорты. Завершающей стадией операции является формирование инвагинационного пищеводно-желудочного анастомоза с погружением его в средостение, в ложе удаленного пищевода и восстановление целостности париетальной плевры от купола плевральной полости до пересеченной непарной вены.
В послеоперационном ведении пациентов акцент делают на следующих моментах: профилактике развития дыхательной недостаточности, поддержании водно-электролитного
баланса, коррекции кислотно-щелочного равновесия, показателей центральной гемодинамики, антибактериальной терапии, адекватном обезболивании, профилактике тромбоэмболии легочной артерии, при необходимости проводится парентеральное питание. В конце операции дренируют плевральную полость и дренажи удаляют на 3–4 сутки, когда они перестают функционировать. Обязательно проводят рентгенологический контроль: выполняют рентгеноскопию грудной клетки, чтобы уточнить расправлены ли легкие и нет ли жидкости в плевральных полостях (дренажи могут функционировать недостаточно адекватно и может появиться выпот с противоположной стороны), для оценки герметизма пищеводножелудочного анастомоза и эвакуаторной функции желудочного трансплантата на 4–5 сутки больному дают выпить жидкую бариевую взвесь.
Благодаря разработанной методике формирования желудочного трансплантата с учетом интраорганного межсо суд истого анастомозирования нам удалось практически
полностью избежать такого грозного осложнения, как несостоятельность пищеводно-желудочного анастомоза.
Наиболее частыми явились плевролегочные (пневмония) – 7,2 % и сердечно-сосудистые (острая сердечно-сосудистая недостаточность) – 2,0 % осложнения.
Летальность составила 5 %.
Прогноз. Пятилетняя выживаемость при опухолях T3N1M0 и T4N1M0 остается низкой, но повышается при выполнении расширенной двухуровневой лимфодиссекция по сравнению
с избирательной.
Онкологические результаты хирургического лечения рака грудного отдела пищевода преимущественно определяются степенью инвазии опухоли, наличием регионарных
метастазов, методикой и объемом хирургического вмешательства. Расширенная двухуровневая лимфодиссекция в сочетании с перевязкой грудного
лимфатического протока при опухолях Т1 – Т2 и отсутствии метастазов в регионарные лимфатические узлы является достаточно эффективным пособием, обеспечивающим пятилетнюю выживаемость в пределах 50 %.
При отсутствии возможности радикального лечения прогноз всегда безнадежен и средняя продолжительность жизни составляет 5-10 месяцев.
Тестовые задания для самоконтроля
Выберите один или несколько правильных ответов.
1. При раке пищевода встречаются следующие анатомические типы роста опухоли:
1)язвенный;
2)узловой (бородавчато-папилломатозный);
3)инфильтративный (скиррозный);
4)субклинический;
5)рак in situ.
2. Наиболее характерным клиническим симптомом рака пищевода является:
1)повышенное слюноотделение;
2)тошнота;
3)дисфагия;
4)рвота;
5)боль за грудиной.
3. Дисфагия при раке пищевода может иметь: 1) рефлекторный характер;
2)стойкий характер, обусловленный обтурацией пищевода опухолью;
3)смешанный – рефлекторный и механический характер;
4)свойство усиливаться при глотании жидкости и уменьшаться при приеме твердой
пищи;
5)свойство усиливаться при приеме молочной пищи.
4.Боли при раке средней трети пищевода могут локализироваться в области: 1) шеи; 2) грудной клетки; 3) эпигастрия;
4) правого подреберья;
5) левого подреберья.
5.Клиническими проявлениями запущенного рака пищевода могут быть: 1) осиплость
голоса; 2) кашель;
3) эмпиема плевры;
4) медиастинит;
5) асцит.
6.К рентгенологическим признакам рака пищевода относятся: 1) нарушение акта глотания;
2) изменение эластичности стенки пищевода;
3) неровность контура пищевода;
4) деформации рельефа слизистой;
5) исчезновение газового пузыря желудка.
7.С целью уточнения распространенности опухолевого процесса при раке пищевода могут применяться: 1) КТ грудной клетки;
2) эндосонография пищевода;
3) лапароскопия;
4) бронхоскопия;
5) позитронно-эмиссионная томография.
8.Дифференциальный диагноз рака пищевода в ряде случаев приходится проводить:
1)с кардиоспазмом;
2)с пептическими язвами пищевода;
3)с рубцовой стриктурой пищевода;
4)с доброкачественными опухолями пищевода;
5)с дивертикулами пищевода.
9.Хирургический метод лечения применяется в основном при лечении рака следующих отделов пищевода: 1) шейного;
2) верхнегрудного;
3) нижнегрудного;
4) среднегрудного;
5) абдоминального.
10.С целью эзофагопластики после операции Добромыслова-Торека можно применять трансплантат из: 1) тонкой кишки;
2) правой половины толстой кишки;
